武汉大学ACS Nano:新型光驱动双层聚多巴胺包覆柔性MOF材料:平衡抗菌与组织再生功能
时间:2025-09-10 12:17:32 热度:37.1℃ 作者:网络
烧伤伤口若合并抗生素耐药菌感染,将面临病原体定植、慢性炎症反应及过量活性氧(ROS)积累等多重病理挑战,成为临床治疗中的一大难题。光催化金属有机框架(MOFs)虽展现出对抗耐药菌感染的潜力,但其产生的ROS往往不足以有效杀菌,而过量ROS又可能损伤健康组织。因此,如何精确调控ROS水平,在抗菌效力与生物安全性之间取得平衡,成为该领域的关键挑战。
近日,武汉大学张玉峰教授、柴纪华博士合作,提出了一种创新解决方案:研究人员成功开发出一种双层聚多巴胺(PDA)涂覆的柔性MOF纳米材料。该材料将光响应范围扩展至近红外区(808 nm),显著提升光催化效率,并利用PDA的抗氧化特性清除多余ROS,协同释放锌离子与二甲双胍(Met),调控氧化还原平衡、减轻炎症反应并促进组织再生。在耐药菌感染的烧伤动物模型中,该材料表现出97.7%的抗菌率与98.4%的伤口愈合率,展现出优异的综合性能。
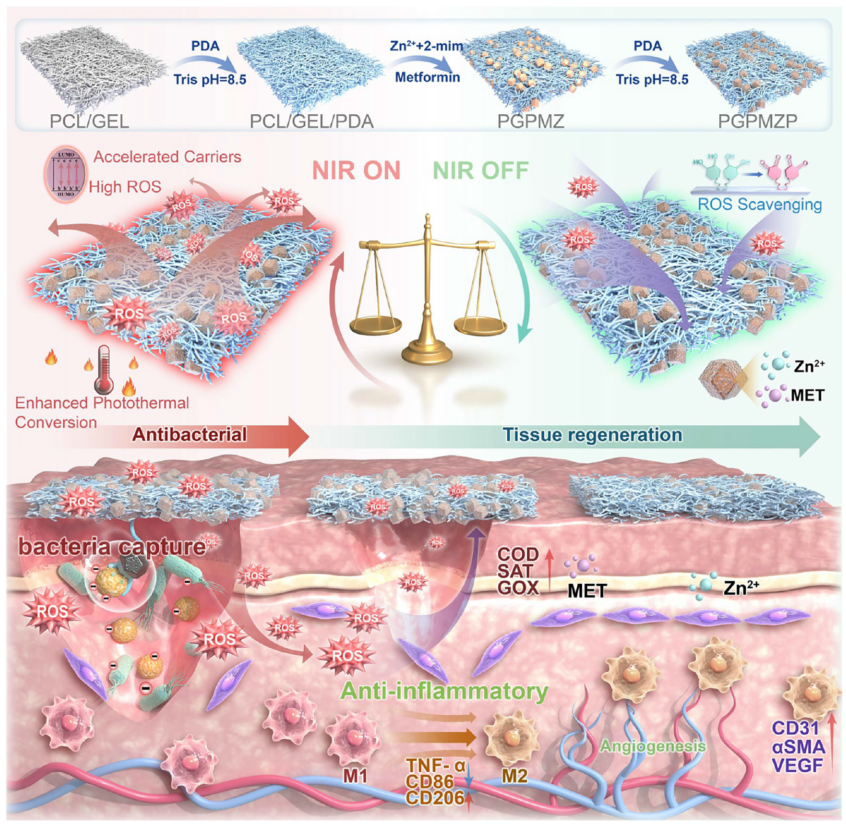
示意图1: 材料的合成、功能属性及生物效应示意图 通过PDA涂层、锌离子、2-甲基咪唑与二甲双胍的逐步修饰,构建具有增强光热转换、细菌捕获、抗菌、抗炎及组织再生功能的PGPMZP材料。
研究人员首先通过电纺技术制备了PCL/明胶(GEL)基纳米纤维(PG),并在其表面通过多巴胺自聚合形成PDA涂层(PGP)。随后利用PDA的儿茶酚胺基团螯合锌离子,原位生长ZIF-8结构并负载Met,形成PGPMZ材料。最后再次进行PDA涂层处理,得到具有双层PDA结构的PGPMZP材料(图1a)。SEM图像显示(图1b–g),PGPMZP表面ZIF-8颗粒分布均匀,粒径较大且表面粗糙,元素 mapping 证实锌元素的存在。XPS、TGA、XRD与FTIR等表征手段进一步验证了PDA的成功包覆与Met的有效负载(图1h–m)。
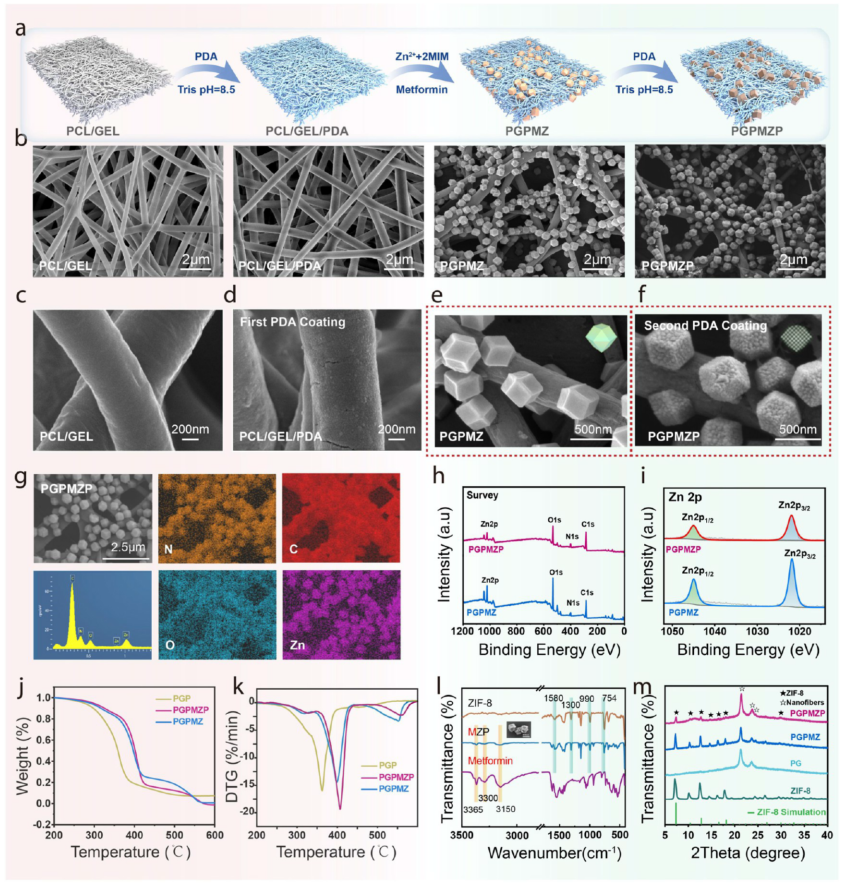
图1. 材料的合成与表征
图2展示了不同PDA浸泡时间对材料光催化性能的影响。PGPMZP2(浸泡60分钟)表现出最优的ROS生成能力,其带隙仅为1.26 eV,显著增强近红外光响应(图2e,f)。该材料在光照下高效产生活性氧(图2b–d),而在无光条件下则表现出强烈的ROS清除能力(图2h,i),实现了ROS的动态平衡调控。此外,在酸性环境中,ZIF-8结构逐渐降解(图2j),为后续抗菌与释放行为提供基础。
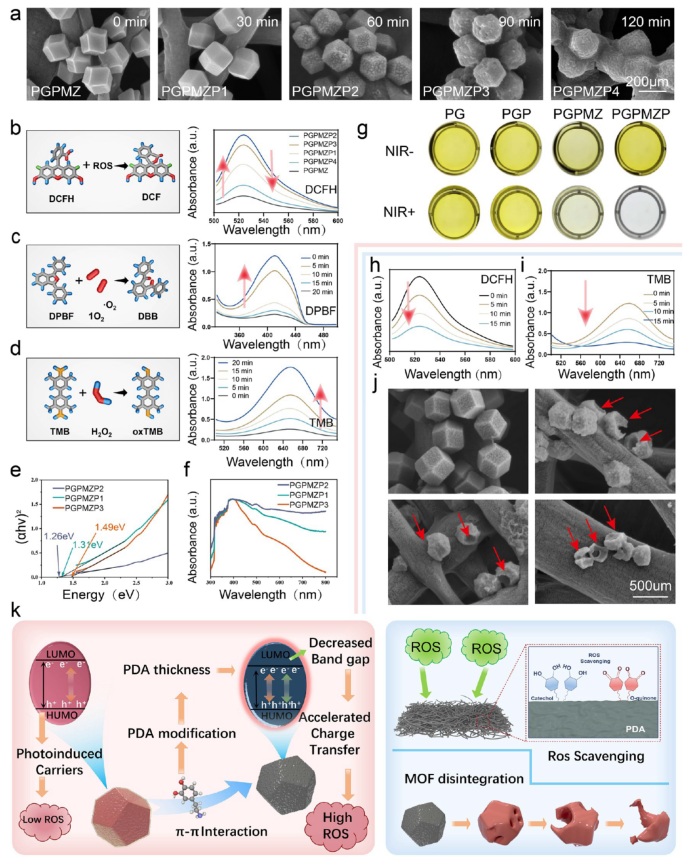
图2. 材料的光学与化学性质表征
图3全面评估了PGPMZP作为伤口敷料的物理性能。该材料具备良好的机械强度、亲水性、水蒸气透过率与保湿能力(图3a–f),并能持续释放锌离子与Met(图3j)。其光热转换效率达29.9%,在1 W/cm²光照下温度可达50°C(图3l,m),具备显著的光热抗菌潜力。
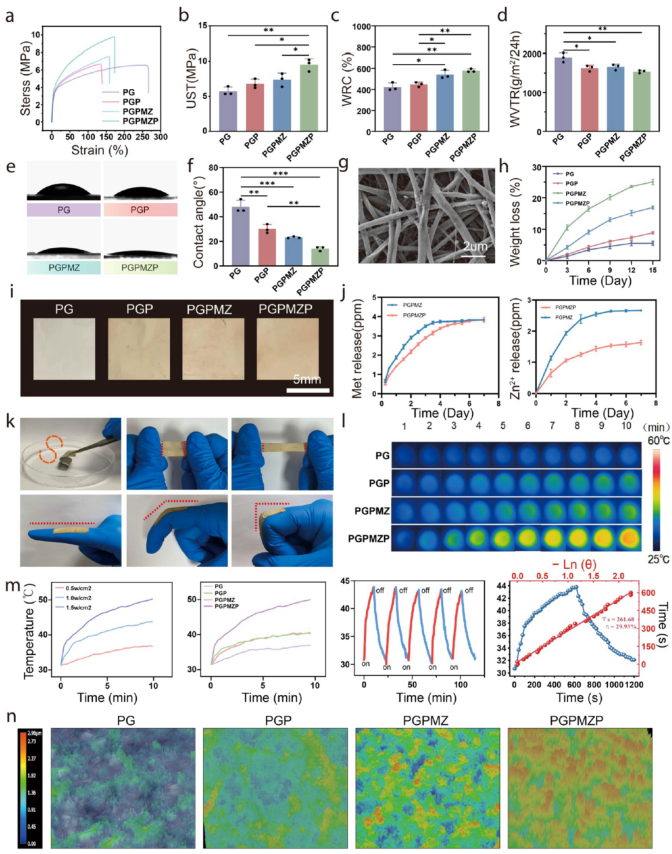
图3. 材料的性能表征
生物学评价显示(图4),PGPMZP材料显著促进L929和RAW264.7细胞增殖,减少细胞凋亡,增强细胞粘附与扩展(图4b–k)。流式细胞术与Live/Dead染色进一步证实其优异的生物相容性。
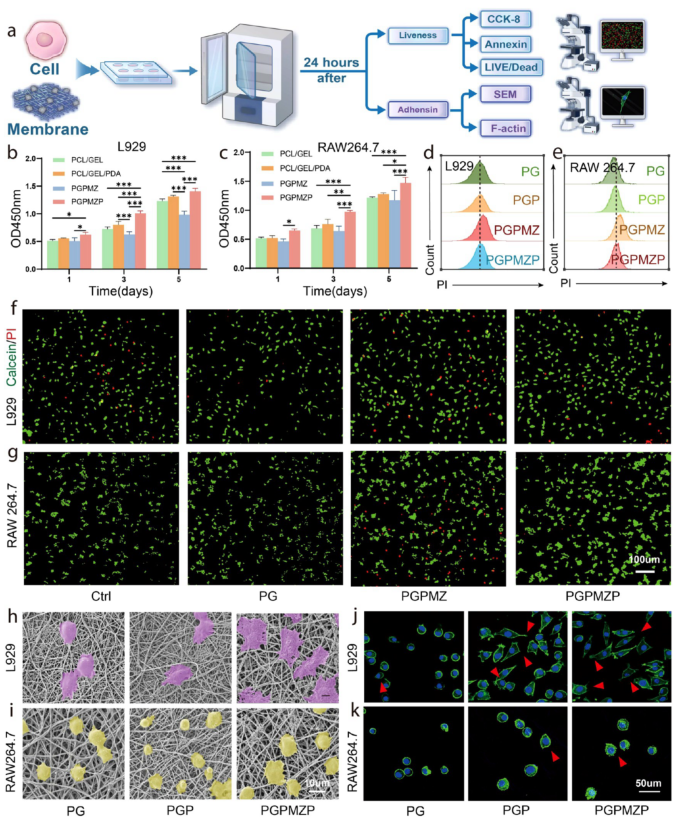
图4. 实验设计与细胞生物学性能表征
在抗菌性能方面(图5–6),PGPMZP在近光照下能有效破坏生物膜、捕获并杀灭细菌(包括MRSA与E. coli),其机制包括光热效应、ROS生成与表面电荷反转增强的细菌捕获能力(图5a–m、图6a–m)。此外,该材料还能调控巨噬细胞极化向抗炎M2型转化,促进血管生成与细胞迁移(图7a–i)。
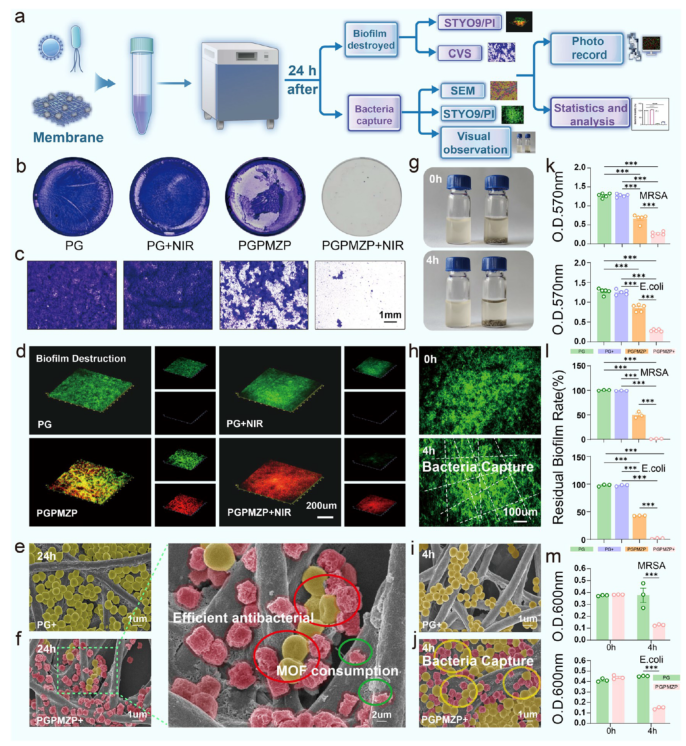
图5. 材料的抗菌与ROS生成性能
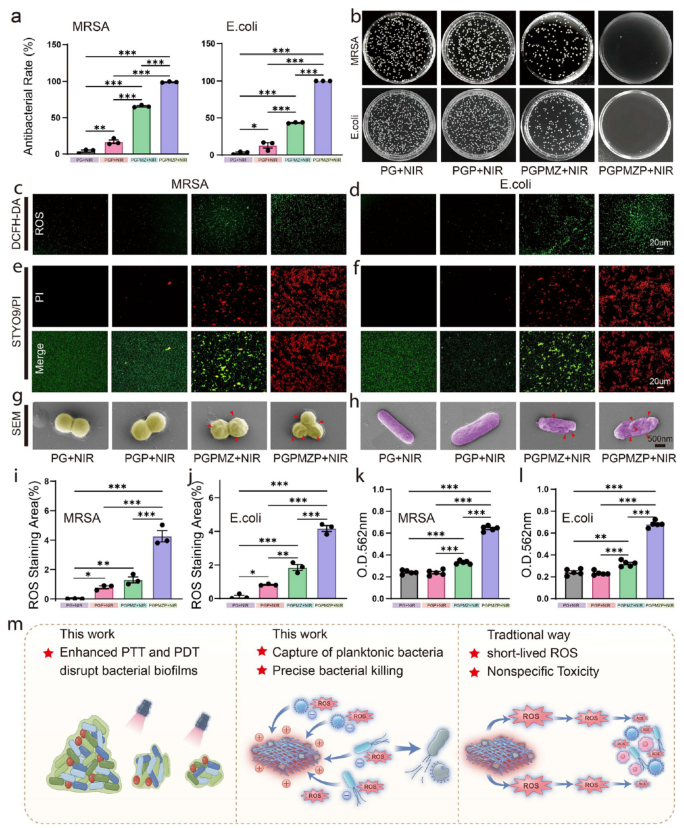
图6. 材料的抗氧化、抗炎与促愈合性能
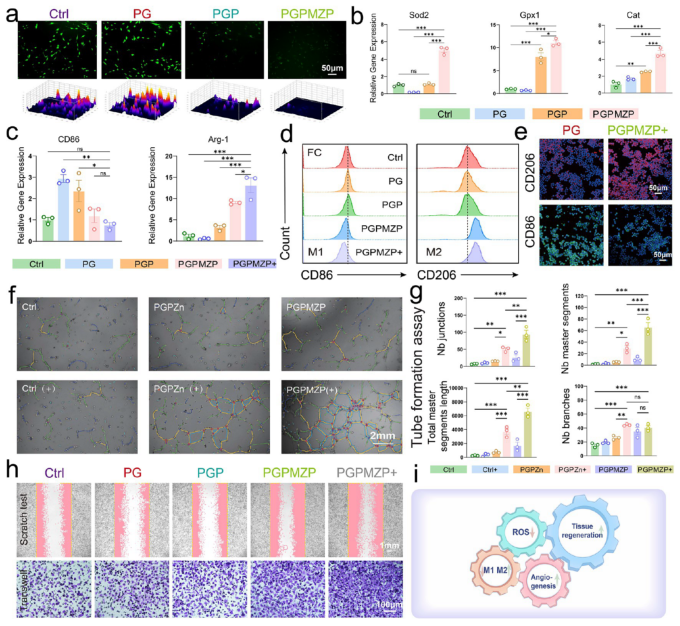
图7. 材料在感染模型中的生物学表现
体内实验进一步验证了其卓越的抗菌与促愈合能力(图8)。在MRSA感染烧伤模型中,PGPMZP+NIR组表现出最快的伤口愈合速度、最少的细菌残留与最显著的血管生成(图8b–h)。免疫荧光显示其能有效抑制M1型巨噬细胞,促进M2型极化,优化免疫微环境(图8i,j)。
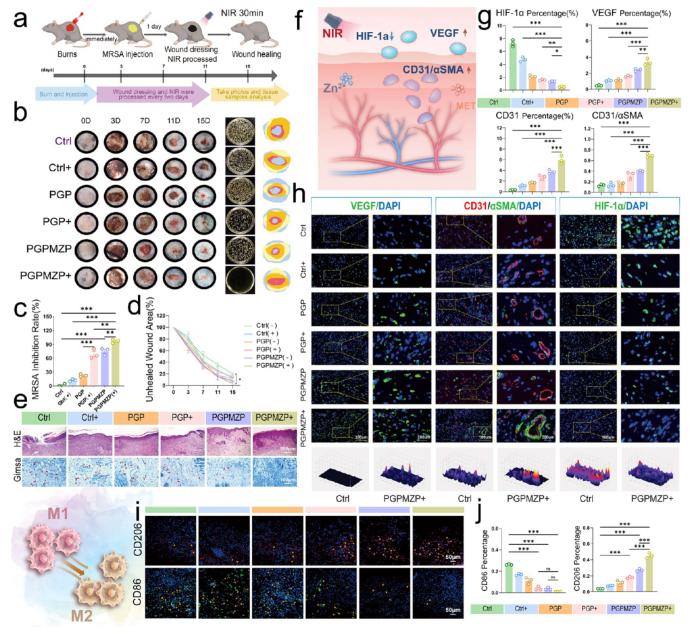
图8. 材料促进伤口愈合的表现
图9进一步探讨了材料在非感染条件下的组织再生能力。即使MOF结构降解后,残留的锌离子仍能促进上皮形成、胶原沉积与血管新生(图9a–k)。体内生物毒性评估显示PGPMZP对主要器官无显著毒副作用(图9l),具备良好的生物安全性。
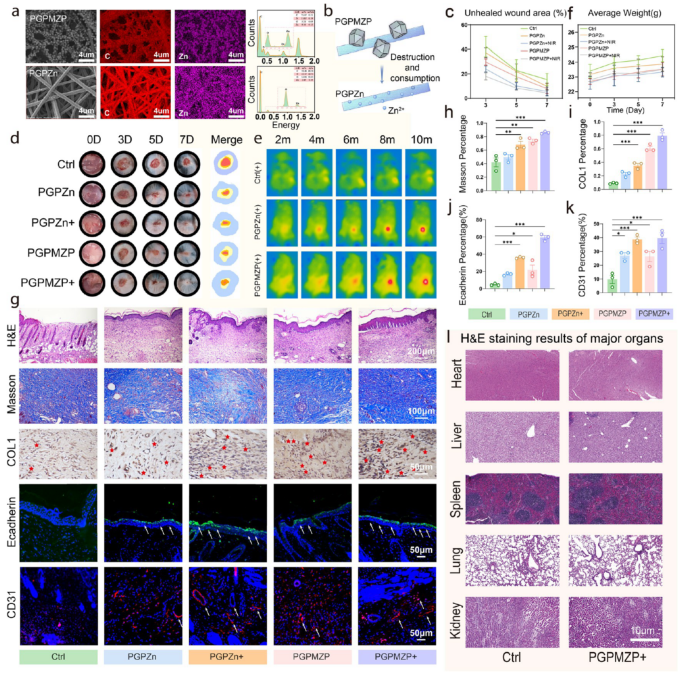
图9. 材料在非感染条件下的组织再生能力
总结而言,该研究通过创新性地设计双层PDA涂层的柔性MOF材料,成功实现了光催化抗菌与组织再生的平衡,为耐药菌感染伤口的治疗提供了新策略。未来研究将聚焦于大规模生产、稳定性提升、集成实时监测功能及个性化治疗等方向,推动其临床转化应用。


