CCR:晚期卵巢癌一线治疗完全缓解后,近一半二次腹腔镜MRD阳性,同时检出血浆ctDNA预后最差
时间:2025-09-18 12:11:43 热度:37.1℃ 作者:网络

晚期卵巢癌一线治疗后的微小残留病(MRD)仍是实现治愈的长期障碍。本研究旨在探讨一线治疗结束时,通过二次腹腔镜探查术(SLL)和循环肿瘤DNA(ctDNA)检测MRD的预后价值与转化价值。研究纳入对一线治疗达到完全临床缓解、接受二次腹腔镜探查术(SLL)并采集血浆用于循环肿瘤DNA(ctDNA)检测的高级别上皮性卵巢癌患者。根据MRD状态及临床病理特征,对患者的无进展生存期(PFS)和总生存期(OS)进行评估。同时,对部分患者的系列样本进行空间转录组学(GeoMx和Visium)及蛋白质组学(CODEX)分析。
95例患者中,40例(42.1%)经手术检测发现MRD,此类患者的PFS和OS均更差[中位PFS:7.4个月 vs. 23.8个月,P<0.001;中位OS:33.9个月 vs. 未达到,P<0.001]。多变量分析显示,SLL阳性是OS的独立不良预后因素[HR=4.40,95%CI:1.37-14.21,P=0.013]。在44例同时接受SLL和ctDNA检测的患者中,34%(15/44)的ctDNA检测结果为阳性,这类患者同样具有更差的PFS和OS[中位PFS:6.4个月 vs. 28.1个月,P<0.001;中位OS:32.4个月 vs. 未达到,P=0.008]。本研究证实,空间多组学技术在MRD研究中具有可行性,且能够产生具有假说生成意义的研究结果,提示MRD病灶中存在缺氧信号通路上调、多种可成药靶点(CDK6、GLS、MSLN、ERBB2)表达及免疫排斥现象。
一线治疗后处于临床缓解状态的患者中,约半数存在可检测的MRD,这些MRD信息可为预后评估、治疗靶点发现及临床试验设计提供参考。
研究背景
微小残留病灶(MRD)指患者接受治疗后体内仍残留的少量癌细胞,这些癌细胞在临床上无法被检测到。在晚期卵巢癌中,绝大多数患者经过一线手术和化疗后,其疾病负荷会降至临床检测下限以下(通过CT和CA-125肿瘤标志物检测);然而,由于存在隐匿性、耐化疗的残留病灶,仅有不到20%的患者能够治愈。尽管目前在此阶段会采用PARP抑制剂、贝伐珠单抗等维持治疗手段以延缓疾病进展,但绝大多数女性患者最终仍会出现临床可检测到的疾病进展,进而发展为不可治愈的疾病。当前维持治疗方案的应用并未考虑到MRD所具有的生物学特征及耐化疗机制,这在很大程度上是因为目前缺乏对MRD进行检测及详细生物学分析的能力。这一重大知识空白是研发个性化新型疗法的重大技术障碍,而此类疗法旨在清除MRD,最终提高卵巢癌的治愈率。
在许多实体瘤中,MRD的检测等同于对循环肿瘤细胞(CTCs)或循环肿瘤DNA(ctDNA)的检测。然而,卵巢癌在这方面具有特殊性,因为在历史上,临床上一直采用“二次探查术”来检测手术微小残留病灶(sMRD)。该手术最初用于确定辅助治疗的持续时间,在20世纪70至90年代,其用途扩展到疾病预后评估。当时,二次探查术需通过较大的腹部切口(剖腹术)进行,尽管有研究表明二次探查术的结果对PFS具有预后价值,但由于该手术并发症发生率较高,且当时延长有限化疗方案的疗程似乎并不能改善患者生存期,因此这种手术逐渐不再用于临床。然而,随着新型靶向治疗药物和生物治疗药物的日益普及,以及微创手术的常规应用,SLL已成为一种并发症显著减少的手术残留病灶评估方法。此外,由于SLL需获取多个腹膜活检样本,这为研究卵巢癌此前难以触及的sMRD阶段的肿瘤微环境(TME)和癌细胞表型状态提供了途径。
如上所述,在过去十年中,评估实体瘤残留病灶的其他方法逐渐涌现,其中最受关注的是ctDNA检测技术。通过基于聚合酶链式反应(PCR)或下一代测序(NGS)的检测方法,针对肿瘤特异性突变、结构变异、拷贝数变异及表观遗传特征,可实现对ctDNA的检测。基于肿瘤信息的ctDNA评估可用于一线治疗后分子微小残留病灶(molMRD)的检测、治疗反应的监测,以及癌细胞随时间推移的克隆进化评估。这种基于血液的微创生物标志物已被证实是多种实体瘤复发的预后标志物,且具有较高的敏感性。然而,关于ctDNA在卵巢癌中作用的研究数据十分有限。有一项研究发现,术后ctDNA阳性与较短的无复发生存期相关;但该研究中ctDNA阳性的患者数量有限,且近一半的研究队列为早期疾病患者,这使得该研究结果难以广泛推广。
本研究的目的是评估晚期卵巢癌患者在一线治疗结束时,通过SLL检测sMRD和通过ctDNA检测molMRD的检出率及预后价值。此外,本研究还试图验证将前沿的空间转录组学和蛋白质组学检测技术应用于SLL获取的sMRD活检样本的可行性,并为阐明sMRD阶段疾病持续存在的机制提供生物学见解。
研究方法
SLL 是一种门诊腹腔镜手术,通常在辅助化疗最后一个周期结束后 6-8 周进行。对于需要进行回肠造口术或结肠造口术还纳术的患者,主刀医生可根据实际情况决定是否同时进行 SLL 或二次探查剖腹术。若任何活检样本的组织病理学检查确诊存在肿瘤,或腹腔冲洗液细胞学检查呈阳性,则判定为“SLL 阳性”,即存在手术微小残留病灶(sMRD)。ctDNA 分析仅纳入在肿瘤减灭术期间采集到足量肿瘤组织、可用于全外显子测序的患者。在患者接受 SLL 时采集血浆样本并储存。采用经临床验证的个性化tumor-informed 16重多重聚合酶链式反应-下一代测序(mPCR-NGS)检测方法(Signatera,Natera 公司)对 ctDNA 进行回顾性检测和定量分析。对每位患者的存档福尔马林固定石蜡包埋(FFPE)组织提取的 DNA,以及匹配的正常血液样本提取的 DNA 进行全外显子测序。在每位患者的血浆游离 DNA 中,选择最多 16 个患者特异性体细胞单核苷酸变异(SNV)进行 mPCR-NGS 检测。若检测到 2 个及以上 SNV 的信号强度超过预设统计算法置信阈值,则判定为 ctDNA 阳性。
研究结果
患者/临床特征及与残留病灶的关联:
SLL队列共纳入95例高级别上皮性卵巢癌患者(图1A)。整个SLL队列的人口统计学和临床特征,以及按SLL结果分层的数据均列于表1。队列中绝大多数患者为白人(82.1%)、非西班牙裔(90.5%),且组织学类型为高级别浆液性癌(87.4%)。约92%的患者确诊为晚期疾病(III期或IV期),8例患者(8.4%)分期不完整或为早期疾病。从一线治疗方式来看,队列分布较为均衡(56.8%接受新辅助化疗(NACT),43.2%接受初始手术)。几乎所有患者(95.8%)均接受了理想的肿瘤减灭术[无肉眼残留病灶(R0切除)或肉眼残留病灶<1cm(R1切除)]。多数患者肿瘤为同源重组缺陷(HRD)阴性(58.9%),且无胚系或体细胞BRCA突变(BRCA1/2野生型,80.0%)。大部分患者(n=61,64.2%)在一线治疗后接受了维持治疗,其中40例SLL阳性患者中有27例(67.5%)入组临床试验:多数患者(n=25)接受贝伐珠单抗单药治疗直至疾病进展(临床试验编号NCT02884648),2例患者接受帕博利珠单抗、口服环磷酰胺联合贝伐珠单抗治疗(临床试验编号NCT06083844)。
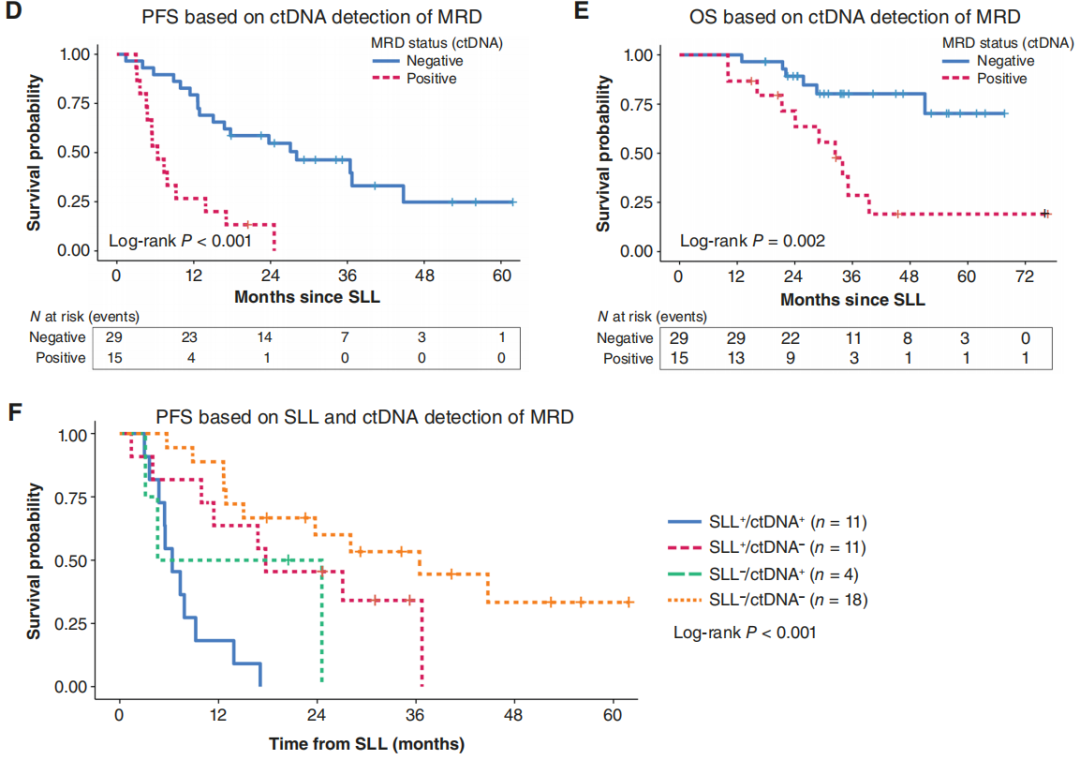

图1
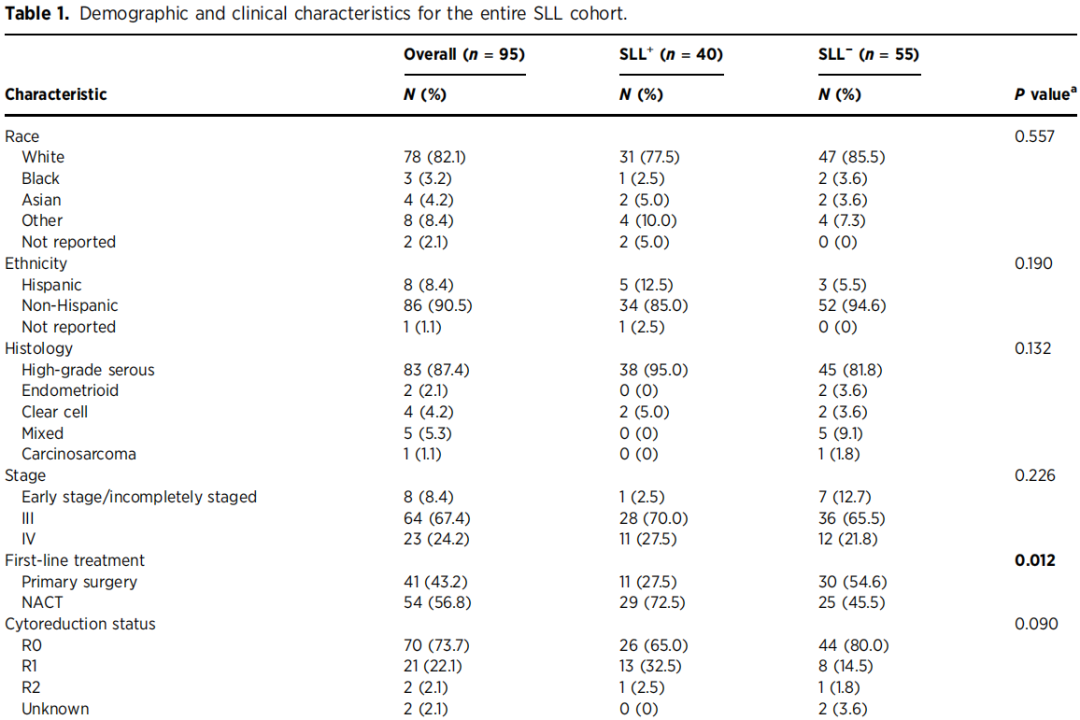
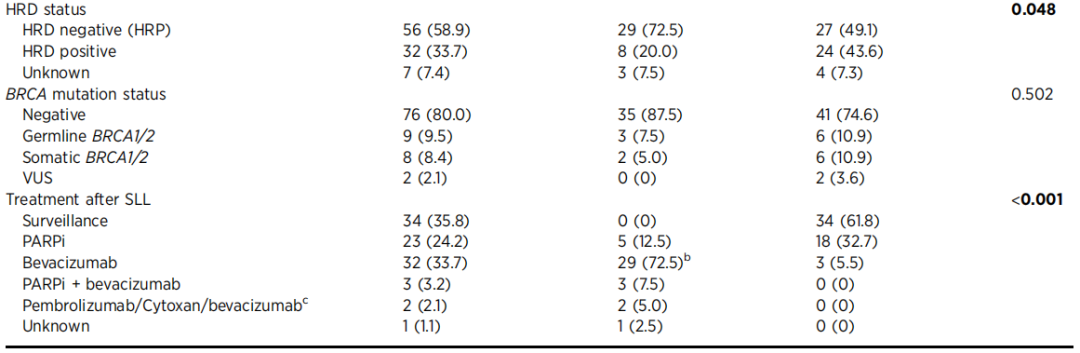
表1
SLL评估时,42.1%的患者(40/95)存在sMRD,每例患者中位活检数为9.0个(范围:3-18个),活检阳性率中位数为0.24。单因素分析显示,SLL阳性与SLL阴性患者在以下方面存在显著差异:一线治疗方式(27.5%的SLL阳性患者接受初始手术,54.6%的SLL阴性患者接受初始手术;P=0.012);HRD状态(72.5%的SLL阳性患者肿瘤为HRD阴性,49.1%的SLL阴性患者肿瘤为HRD阴性;P=0.048);SLL后的治疗(P<0.001,所有SLL阳性患者均接受维持治疗,而SLL阴性患者中仅38.2%接受维持治疗,且后者中近85.7%(18/21)为HRD阳性或BRCA突变型肿瘤,按标准治疗方案接受PARP抑制剂治疗)。两组患者在种族、民族、组织学类型、分期、肿瘤减灭术切除状态及BRCA突变状态方面无显著差异(表1)。多因素logistic回归分析显示:与接受初始肿瘤减灭术的患者相比,接受NACT的患者SLL阳性的可能性更高(OR=4.53,95%CI=1.65-12.44,P=0.003);HRD阴性肿瘤患者SLL阳性的可能性也更高(OR=3.55,95%CI=1.23-10.24,P=0.019)。相反,初始肿瘤减灭术切除状态并非sMRD的独立预测因素(表2),但需注意的是,整个队列中多数患者(73.7%)实现了R0切除。
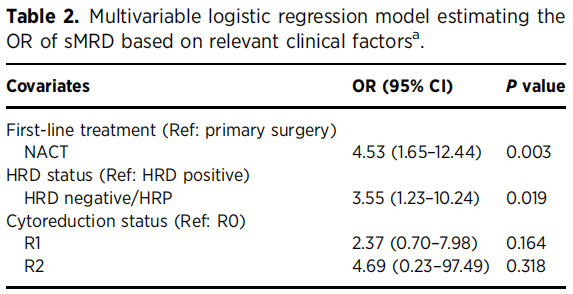
表2
在同时接受SLL和ctDNA检测的44例患者亚组中,90.9%的患者为高级别浆液性癌,90.9%确诊为晚期疾病。44例患者中,50%(22/44)存在sMRD,34%(15/44)为ctDNA阳性。手术残留病灶状态与基于ctDNA的残留病灶状态之间存在显著关联(P=0.026):22例SLL阳性患者中,11例(50%)同时为ctDNA阳性;22例SLL阴性患者中,4例(18%)为ctDNA阳性。单因素分析显示,ctDNA阳性与ctDNA阴性患者在以下方面存在显著差异:一线治疗方式(26.7% vs. 65.6%接受初始手术;P=0.025)、BRCA突变状态(0% vs. 34.4%存在胚系或体细胞BRCA突变;P=0.031)及SLL后的治疗(P=0.034)。
残留病灶与患者结局的关联:
在整个SLL队列(n=95)中,可检测到的sMRD与更差的PFS(HR=2.9,95%CI=1.7-4.9;中位PFS:7.4个月 vs. 23.8个月;P<0.001)和OS(HR=7.7,95%CI=2.8-20.9;中位OS:33.9个月 vs. 未达到;P<0.001)相关(图1B、C)。需重点强调的是,尽管100%的MRD阳性患者和仅38%的MRD阴性患者接受了额外维持治疗,MRD阳性仍显示出显著的不良预后价值。PFS预后因素的多因素分析显示,HRD阳性是有利预后因素(HR=0.27,95%CI=0.13-0.56,P<0.001),而接受NACT是不良预后因素(HR=2.62,95%CI=1.34-5.13,P=0.005)。HRD阳性同样与OS改善相关(HR=0.11,95%CI=0.03-0.47,P=0.002)。值得注意的是,SLL阳性也是OS的独立预后因素(HR=4.40,95%CI=1.37-14.21,P=0.013),表明SLL时检测到残留病灶的患者死亡风险增加4.4倍(表3)。所有患者的中位随访时间为23.7个月(范围:0.1-76.7个月)。
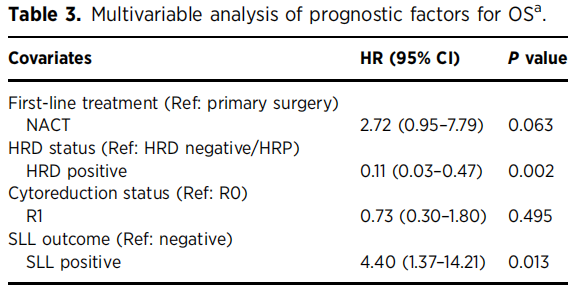
表3
在同时接受SLL和ctDNA检测的较小亚组(n=44)中,sMRD与更差的PFS(HR=3.1,95%CI=1.4-6.9;中位PFS:9.2个月 vs. 28.1个月;P=0.003)和OS(HR=9.9,95%CI=2.2-44.7;中位OS:29.0个月 vs. 未达到;P<0.001)相关。此外,该亚组中基于ctDNA的molMRD阳性同样与更差的PFS(HR=5.3,95%CI=2.3-12.4;中位PFS:6.4个月 vs. 28.1个月;P<0.001)和OS(HR=3.6,95%CI=1.3-10.0;中位OS:32.4个月 vs. 未达到;P=0.008)相关(图1D、E)。对手术与ctDNA检测结果的四种可能组合进行分析(尽管样本量有限)发现:SLL阴性且ctDNA阴性的患者中位PFS最长(36.4个月),而两种检测均为阳性的患者中位PFS最短(仅6.4个月)(图1F)。
可行性与安全性:
从辅助化疗结束到SLL的中位时间为43天(范围:23-118天)。患者在SLL术中中位活检数为9.0个(范围:3-18个)。95例手术中发生2例术中并发症(2.1%),均为肠损伤,需中转开腹。第1例为热损伤导致的肠浆膜损伤(SLL术中发现),需行部分横结肠切除并吻合。第2例为致密粘连患者腹腔镜进入时发生横结肠3mm穿孔,术中直接缝合修补。另有1例患者因腹腔镜下发现肉眼可见病灶,需中转开腹行小肠切除以清除病灶。
SLL样本可用于分析MRD病灶的肿瘤微环境与细胞状态:
在对SLL临床队列进行回顾性分析的同时,研究还对卵巢肿瘤进行了高参数空间分析,以阐明可能导致sMRD形成的一线治疗适应性机制。研究收集了7例患者(3例sMRD阴性、4例sMRD阳性)在三个不同时间点的样本:NACT前活检样本、间歇性肿瘤减灭术(IDS)样本和SLL活检样本。通过相邻组织切片,分别采用GeoMx数字空间profiling(DSP)、Visium空间转录组学和CODEX空间蛋白质组学对这些样本进行分析(图2A)。本可行性探索试验采用了复杂的研究流程:需收集7例患者在三个时间点的肿瘤样本,每例患者4个连续切片,共84个独立组织切片用于分析;同时还需进行(多步骤)病理评估、质量控制,并成功实施三个空间分析平台的实验方案(包括测序/成像、数据分析、平台间比较及数据整合)。最终,84个组织切片中有81个(96.4%)可用于评估,表明对SLL获取的珍贵且通常体积较小的样本进行空间分辨多组学分析具有整体可行性。
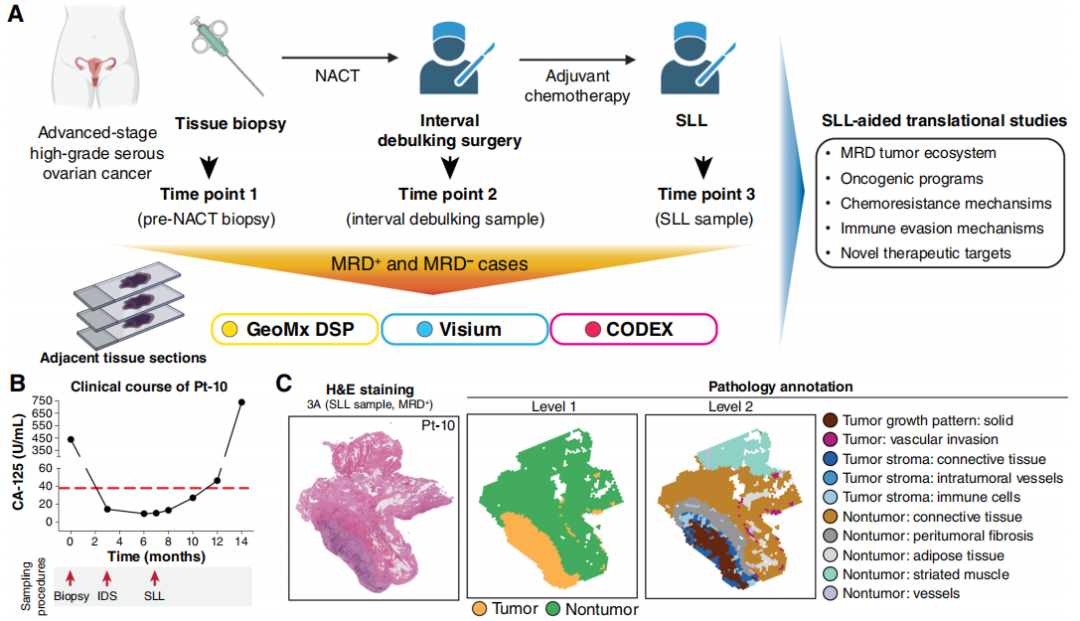
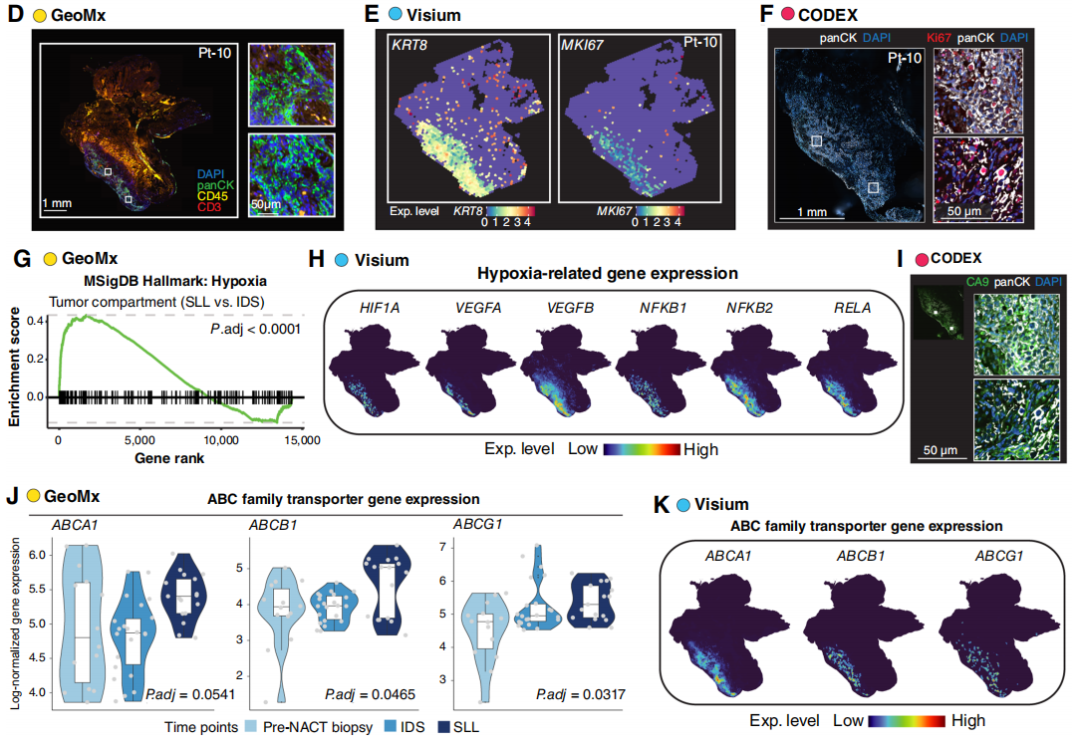

图2
首先,研究分析了4例SLL活检样本的癌细胞表型状态。以10号患者(Pt-10)为例,其SLL在IDS后4个月、末次化疗后6周进行(图2B)。通过以下手段,可实现相邻切片的高保真对齐:苏木精-伊红(H&E)染色图像的病理注释(确定肿瘤和间质区域;图2C)、GeoMx前免疫荧光(图2D)、Visium检测的肿瘤标志物KRT8基因表达(图2E)及CODEX检测的panCK蛋白表达(图2F)。此外,H&E切片显示肿瘤周围存在反应性纤维化,且周围正常结缔组织中可见散在血管侵犯(图2C);Visium和CODEX均检测到Ki67表达,提示癌细胞增殖活性高(图2E、F)。
为评估治疗过程中癌细胞表型状态的变化,研究通过GeoMx比较了sMRD阳性患者SLL样本与IDS样本中肿瘤区域的转录组特征。值得注意的是,SLL样本中缺氧信号通路显著富集(图2G),这一发现得到以下结果的进一步支持:仅在SLL样本的肿瘤区域检测到缺氧相关基因和转录因子(如HIF1A、VEGFA/B、NFKB1/2、RELA;图2H),且在相邻CODEX切片中检测到CA9蛋白表达(图2I)。此外,研究还通过GeoMx数据分析了sMRD阳性患者肿瘤区域中三个时间点呈渐进性变化的基因。已知ATP结合盒(ABC)家族蛋白是多种癌症(包括卵巢癌)多药耐药的介导因子,因此研究重点分析了其在治疗过程中的表达变化。与假设一致,多个ABC家族基因(包括ABCA1、ABCB1、ABCG1)在治疗过程中呈渐进性上调,且在sMRD病灶中高表达(图2J),提示这可能是高级别上皮性卵巢癌疾病持续存在及sMRD形成的机制之一。Visium空间分析结果进一步证实了这一发现(图2K)。此外,研究还在MRD肿瘤细胞中发现了多个其他可用药靶点的表达,包括参与表观遗传修饰(DNMT1/3A、HDAC1/6)、细胞周期进展(CDK6)、细胞生长(ERBB2、FGFR1、MYC)、细胞间黏附(MSLN)及代谢重编程(GLS、GPX4)的分子。综上,这些分析表明:对SLL获取的肿瘤样本进行复杂空间检测,以识别耐化疗机制和潜在治疗靶点具有可行性。
肿瘤免疫排斥与免疫抑制:MRD病灶中疾病持续存在的潜在机制:
接下来,研究者探究了sMRD中恶性细胞与免疫细胞之间的相互作用。以另一例代表性患者(Pt-19)为例,其SLL在IDS后约4个月进行。通过GeoMx、Visium和CODEX对腹膜活检样本的分析发现,肿瘤内部存在显著异质性(图3A)。CODEX分析显示,在区域1和区域2中,CD8+T细胞均被排除在肿瘤岛之外;而在区域2中,更高比例的CD8+T细胞表达PD-1,这与细胞活化或耗竭状态一致(图3A,第II-III列)。此外,区域1的肿瘤周围间质中,成纤维细胞活化蛋白(FAP)及干扰素(IFN)刺激基因HLA-ABC、ISG15的表达水平较低(图3A,第IV-V列)。最后,区域1中的癌细胞E-钙黏蛋白表达水平较低,而N-钙黏蛋白和SLUG表达水平较高,提示这些细胞正在发生上皮-间质转化(EMT;图3A,第VI列)。事实上,已有研究表明,IFN信号通路可抑制EMT过程,但近期研究也发现其与T细胞耗竭相关。
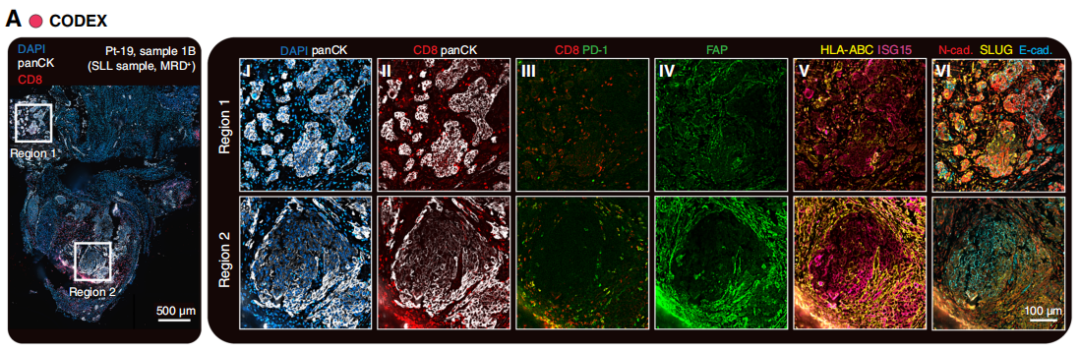
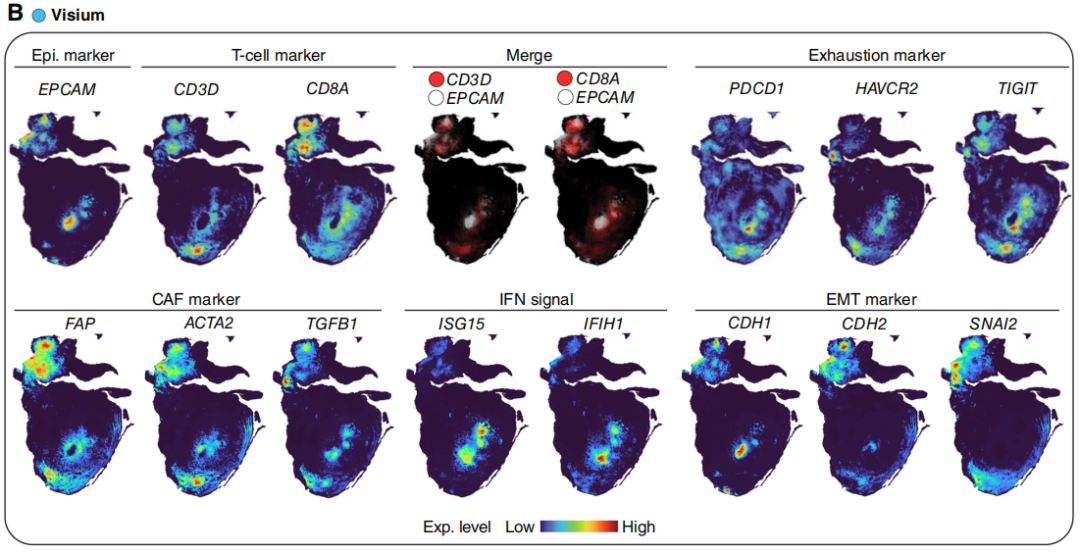
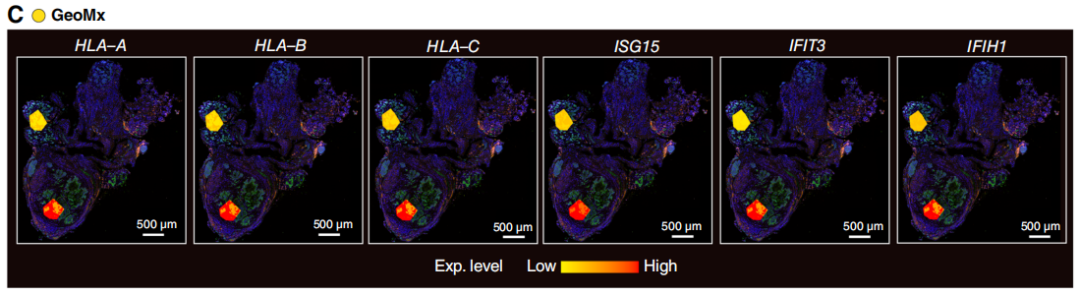

图3
其他空间分析平台的结果验证了上述发现。在相邻的Visium切片中,CD3D和CD8A信号在EPCAM+肿瘤区域周围富集,但未浸润到肿瘤内部;且这些信号与多个免疫检查点基因(如PDCD1(PD-1)、HAVCR2(TIM-3)、TIGIT)的表达重叠(图3B)。尽管在Visium切片的区域1中,T细胞相关基因与EPCAM存在共定位,但更高分辨率的CODEX数据显示,该区域的肿瘤面积较小,T细胞仅分布在肿瘤周围,并未浸润到肿瘤内部(图3A,第II列)。此外,通过成纤维细胞活化蛋白、ACTA2和TGFB1的表达特征鉴定出的癌相关成纤维细胞(CAF),与区域2的肿瘤区域显著重叠,且紧密围绕在肿瘤核心周围(图3B)。已有研究证实,CAF可促进免疫排斥;具体而言,在所有CAF来源的因子中,转化生长因子-β(TGF-β)在此过程中发挥关键作用,且临床前研究表明,抑制TGF-β可有效重塑肿瘤微环境(TME)并增强抗肿瘤免疫应答。进一步观察发现,区域2中存在强烈的IFN信号,且该信号与CDH1(编码E-钙黏蛋白)的表达重叠,但与CDH2(编码N-钙黏蛋白)和SNAI2(编码SLUG)的表达互斥(图3B)。GeoMx的分析结果也证实了这一观察:研究者对与CODEX中鉴定区域位置相近的两个区域进行分析,发现区域2中IFN刺激基因的表达水平显著高于区域1(图3C)。综上,MRD病灶中的肿瘤内异质性表明,免疫排斥、EMT和IFN信号通路可能是疾病持续存在的共同作用机制。
在另一例患者(Pt-67)中,研究者对SLL期间采集的小肠转移灶样本进行了分析。CODEX结果显示,肿瘤边缘(区域1)存在大量CD8+T细胞,但肿瘤实质(区域2)中CD8+T细胞数量稀少。与19号患者类似,区域1中的CD8+T细胞也高表达PD-1和IFN刺激基因。Visium的分析结果同样证实,CD8+T细胞被排除在肿瘤实质之外,且肿瘤边缘的T细胞处于耗竭状态。总而言之,探索性队列中MRD病灶的微环境具有显著的免疫排斥和免疫抑制特征。肿瘤细胞与多种非恶性细胞亚群之间的这些相互作用,可能是癌细胞得以存活的关键决定因素。然而,要充分阐明sMRD阶段驱动这些相互作用的分子机制,以及癌细胞与TME细胞的共同进化过程,仍需更大规模的队列研究和进一步的机制研究。
讨 论
在治疗结束时评估患者残留病灶状态的能力具有诸多重要临床意义。研究发现,约半数高级别上皮性卵巢癌患者在初始治疗后,虽通过影像学检查和CA-125检测可被归类为临床缓解,但实际存在sMRD,且sMRD是OS的独立预测因素。对于HRD阴性或接受NACT的患者,这一比例更高。因此,目前针对晚期卵巢癌患者一线治疗结束后临床缓解的咨询服务,因现有临床评估标准敏感性较低而存在显著局限性。手术或分子MRD状态可与其他重要临床标志物(如BRCA/HRD状态、是否接受NACT——NACT在很大程度上可作为诊断时疾病负荷较重的替代指标)结合,用于为患者提供预后咨询,并指导后续治疗方案(包括是否参与MRD指导的临床试验)。
既往研究已探讨过二次探查剖腹术的临床意义。一项针对接受辅助化疗试验(GOG 158)的晚期卵巢癌最优切除患者的研究,比较了接受二次探查手术(剖腹术)与未接受该手术患者的结局,结果显示二次探查手术并未改善患者生存期。而本研究是首个在卵巢癌现代治疗背景(当前有更多且不断新增的新型治疗方案)下,采用微创外科手段(SLL)重新评估SLL临床价值的研究。此前也有研究旨在明确ctDNA阳性在卵巢癌中的临床意义。其中一项研究发现,术后ctDNA阳性与无复发生存期缩短显著相关,但该研究存在局限性:纳入了早期疾病患者,且ctDNA阳性患者数量较少(n=5)。另一项近期研究表明,对卵巢癌患者每3个月进行一次连续ctDNA评估,可比CT或CA-125检测等传统监测手段更早发现疾病进展,但该研究的中位随访时间仅为12个月,限制了ctDNA与长期结局相关性的分析。
此外,针对卵巢癌MRD阶段设计的临床试验具有独特优势:此类试验中的患者仅存在微小病灶或分子水平病灶,且仅接受过一线治疗;理论上,通过清除残留病灶提高治愈率具有可行性。本研究团队率先采用这一思路开展了两项临床试验:第一项试验(NCT02884648)探究贝伐珠单抗单药治疗(持续给药至疾病进展,而非固定周期的维持治疗)的疗效;第二项试验是研究者发起的后续试验(NCT06083844),基于贝伐珠单抗、帕博利珠单抗联合低剂量节拍式环磷酰胺在复发性铂耐药卵巢癌中显示出的良好疗效,进一步探究该联合方案的作用。
尽管本研究未直接探讨,但一线治疗结束时的MRD状态还可作为早期替代疗效终点,用于降低一线临床试验风险并加快试验进程。目前,卵巢癌一线临床试验将PFS作为唯一主要终点,导致试验规模大、耗时长且成本极高,进而限制了一线治疗领域的创新。为验证sMRD状态作为替代终点的可行性,一项比较NACT联合或不联合腹腔注射IMNN001的随机试验(NCT05739981)正在招募患者,该试验是首个以SLL阳性率作为主要临床终点的研究。
除将手术和分子MRD作为预后标志物以优化患者咨询和后续治疗风险分层外,通过SLL获取sMRD活检样本还为研究这些持续存在的耐化疗细胞的生物学特征提供了独特机会,有助于深入理解如何通过治疗靶向并清除此类残留病灶。本研究观察到,sMRD病灶中缺氧信号通路上调,且在多例患者的MRD肿瘤中检测到VEGF表达。这些发现提示,尽管贝伐珠单抗等抗VEGF药物可能是sMRD阶段维持治疗的有效基础方案,但联合其他药物或优化治疗持续时间可能进一步提升患者获益。在此基础上,研究还在sMRD肿瘤区域中发现了多个其他可用药靶点的表达,如CDK6、GLS、MSLN和ERBB2。尽管目前已针对这些靶点开发了多种靶向药物和嵌合抗原受体T细胞(CAR-T)疗法,但其在卵巢癌中的应用仍需通过MRD阶段的临床试验进一步探索。此外,探索性队列的研究结果还提示,sMRD样本中观察到的免疫排斥现象(图3)可能是疾病持续存在的原因之一。因此,在sMRD阶段调控TME或可成为疾病控制的新途径。为实现上述目标,本研究证实:SLL为获取sMRD组织提供了独特机会——在癌细胞负荷极低的关键窗口期,这些组织样本可助力开发个性化、生物标志物指导的靶向治疗。最后,研究数据显示,50%的sMRD阳性患者molMRD呈阴性,提示肿瘤固有特征可能影响ctDNA的释放。未来,基于更大规模队列比较molMRD阳性与阴性患者MRD病灶中的癌细胞表型状态,或可进一步深化对MRD生物学特征的理解。
这项研究在相邻的组织切片上应用了三种不同但技术上互补的空间平台,包括GeoMx DSP、Visium和CODEX,以便一种数据模式的关键发现可以被其他数据模式验证。例如,GeoMx DSP数据可用于纵向或横向直接比较肿瘤或间质区域的基因表达特征;Visium数据在可视化特征空间分布、研究细胞区域间空间相互作用方面具有独特优势;而CODEX数据具有最高的空间分辨率,可用于在蛋白质水平验证关键标志物。研究结果证实,在卵巢癌MRD研究中应用空间多组学方法具有可行性,但要深入解析机制,仍需更大规模的队列研究。
尽管SLL和ctDNA均能识别低负荷残留病灶患者,并提供高价值的预后信息,但二者各有优势与局限性:SLL可识别更多残留病灶患者,并在这一关键且此前无法检测的时间点(此时最易识别与治疗适应性耐药相关的变化)获取组织样本;但SLL属于有创手术,不适用于MRD的连续评估,且治疗决策受SLL结果指导,可能影响其预后价值。相比之下,ctDNA检测为molMRD提供了微创检测手段,且对PFS的预后价值更高;但在sMRD阳性患者中,仅50%检测到ctDNA阳性,这提示ctDNA阴性结果需谨慎解读,不能作为晚期卵巢癌患者降低治疗强度的依据。ctDNA检测的另一优势是可纵向定量评估疾病负荷(bioRxiv 2024.08.21.609031),这为针对高风险患者(尚未出现可测量病灶但ctDNA可检测)设计新型临床试验开辟了道路。近期发表的AMPLIFY-201研究便是此类设计的实例:该研究纳入KRAS突变型胰腺癌和结直肠癌患者,这些患者已完成一线局部区域治疗,但molMRD阳性或肿瘤标志物升高。尽管该试验初始发表时疗效结局的随访数据有限,但其证实了在临床试验中利用ctDNA水平和清除率监测患者的可行性与应用价值——目前这一方法已应用于肌层浸润性膀胱癌(NCT04660344)和高风险乳腺癌(NCT04567420)的临床试验。
本研究临床部分存在一定局限性:ctDNA分析仅为单时间点检测、样本量较小、患者群体同质性较高(以白人、非西班牙裔及有医保患者为主)。此外,转化研究数据也受限于不同时间点采样部位不同及患者个体异质性的影响。尽管存在这些局限,本研究仍具有高度创新性,是首个在卵巢癌现代治疗时代探索sMRD的研究。研究首次报道了sMRD和molMRD状态在卵巢癌中的预后价值,以及sMRD病灶中独特的癌细胞表型状态和TME特征。
这些发现尚需进一步验证,但其有望指导未来卵巢癌的临床试验和转化研究。研究者期望未来不仅能检测MRD,还能以个性化方式靶向MRD,最终通过清除MRD提高晚期卵巢癌患者的生存率。
参考文献:
Knisely, Anne et al. “Surgical and blood-based minimal residual disease in patients with ovarian cancer after frontline therapy: Clinical outcomes and translational opportunities.” Clinical cancer research : an official journal of the American Association for Cancer Research, 10.1158/1078-0432.CCR-25-0512. 1 Aug. 2025, doi:10.1158/1078-0432.CCR-25-0512


