结核性毁损肺单侧全肺切除术后严重并发症影响因素及临床治疗
时间:2025-09-04 12:11:47 热度:37.1℃ 作者:网络
摘 要
目的 评价单侧全肺切除术治疗结核性毁损肺的手术疗效及分析发生术后严重并发症的原因,并探讨临床治疗方法。方法 回顾性分析成都市公共卫生临床医疗中心2017—2023年接受单侧全肺切除的结核性毁损肺患者的临床资料。对术后严重并发症进行统计,将患者分为无严重并发症组及严重并发症组,并分析并发症的原因、治疗与结局。结果 共纳入134例患者,其中男69例、女65例,平均年龄17~73(40.43±12.69)岁。左侧手术93例,右侧手术41例。术前痰菌阳性35例术后全部转阴,术前58例合并咯血术后均未再咯血。术后切口感染8例(5.97%)、肺部感染26例(19.40%)。术后严重并发症17例(12.69%),其中胸腔感染9例(6.72%)、支气管胸膜瘘合并胸腔感染1例(0.75%),重症肺炎3例(2.24%)、全肺切除术后综合征1例(0.75%)、乳糜胸1例(0.75%)、酮症酸中毒1例(0.75%)、心力衰竭合并重症肺炎1例(0.75%)。围手术期死亡2例(1.49%),均为右全肺切除。多因素logistic回归分析结果显示,合并既往同侧胸腔手术史、合并曲霉菌感染、术中出血量较多为结核性毁损肺行单侧全肺切除术后出现严重并发症的独立危险因素(P<0.05)。结论 结核性毁损肺患者行单侧全肺切除手术能够极大提高患者临床治愈率、痰菌转阴率及咯血停止率,但存在一定围手术期严重并发症及死亡风险,需充分做好围手术期管理及术后并发症的合理治疗。
正 文
结核性毁损肺是由于结核分枝杆菌反复感染引起单侧肺叶或全肺单发或多发结核纤维空洞或干酪性空洞、大量纤维干酪病灶、广泛支气管扩张和/或支气管狭窄所致的肺不张、肺纤维化、肺萎陷、肺组织严重破坏和肺功能丧失的综合征,是重症结核的严重后遗症[1]。对单侧结核性毁损肺患者实施全肺切除术可有效清除坏死组织潜在性病灶,改善患者临床症状并提高临床治愈率[2],但具有较高的围手术期并发症发生率及死亡率[3]。本研究通过回顾性分析成都市公共卫生临床医疗中心单侧全肺切除的结核性毁损肺患者的临床资料,旨在评价其手术安全性及有效性,分析发生术后严重并发症的原因,并探讨临床处理方法。
1 资料与方法
1.1 临床资料和分组
回顾性分析2017—2023年于成都市公共卫生临床医疗中心接受单侧全肺切除的结核性毁损肺患者的相关临床资料。结核性毁损肺的诊断标准:初治肺结核失败或久治未愈并且反复复发,一侧肺内结核病变广泛,肺组织严重破坏,不可逆性病理改变,肺功能丧失的肺结核[4-5]。根据患者是否出现严重并发症,分为无严重并发症组及严重并发症组,将两组临床资料进行对比分析。
1.2 手术适应证与禁忌证
结核性毁损肺患者手术分为急诊手术和择期手术[6]。急诊手术适应证主要为经内科及介入治疗难以控制、危及生命的大咯血。择期手术适应证主要包括持续的肺结核症状(如持续痰菌阳性、咳嗽、咳痰、咯血、胸痛、呼吸困难、合并真菌感染等)、影像学上显示的严重肺部破坏(胸部 CT检查提示气管、纵隔向患侧移位,患侧膈肌上抬,患肺内大部分多发纤维条索影、空洞、实变、支气管扩张或肺萎缩、不张等致全部或绝大部分肺毁损)、反复发作肺部感染、合并脓胸或支气管胸膜瘘(bronchopleural fistula,BPF)以及药物治疗无效的情况。需要强调的是,通过抗结核化疗使病情基本稳定是外科治疗的前提。
手术禁忌证包括双肺广泛病变、心功能Ⅲ~Ⅳ级、严重合并症(糖尿病失代偿期,肝、肾功能损害)、活动性支气管结核。
1.3 筛选标准
纳入标准:(1)术前确诊或临床诊断为结核性毁损肺;(2)行单侧全肺切除手术治疗;(3)对侧无病灶或病灶局限且稳定。
排除标准:(1)合并人类免疫缺陷病毒(HIV);(2)合并恶性肿瘤;(3)长期服用免疫抑制剂的患者(如系统性红斑狼疮、类风湿性关节炎、器官移植术后);(4)术后细菌学、分子生物学、病理检查排除结核的患者。
1.4 术前准备
术前完善血常规、电解质、肝肾功能、血气分析、凝血功能、红细胞沉降率等生化检查。痰涂片、胸部 CT、心脏彩色超声(彩超)、腹部彩超、纤维支气管镜、肺功能。咯血患者经内科及介入治疗控制欠佳者免做纤维支气管镜及肺功能。参照国家感染性疾病临床医学研究中心发布的肺结核活动性判断规范及临床应用专家共识[7]及本单位结核内科专家评估患者术前肺内病灶情况。低肺功能患者术前均进行呼吸功能训练≥1周。术前纠正电解质紊乱、低蛋白血症、贫血等。
1.5 手术方法
双腔气管插管全身麻醉,健肺单肺通气,经胸后外侧切口第5肋间进胸。钝、锐交替分离肺与周围组织的粘连,渗血较多时可用烫盐水纱布压迫止血。若胸膜增厚严重,可于增厚胸膜外分离,将增厚胸膜与肺一同自胸壁游离。合并结核性脓胸者,打开脓腔清理脓液及坏死物后反复双氧水及温生理盐水冲洗干净后再进行肺的游离。若胸顶胸膜增厚广泛,为避免损伤胸顶重要血管神经,可旷置部分增厚胸膜,刮除表面坏死组织。解剖肺门,分别游离出病肺肺动脉、肺静脉及主支气管,依次分别使用一次性直线切割缝合器闭合离断。夹闭肺动脉干时观察3~5 min,观察患者心率、血压有无变化。使用奈维NEOVEIL(规格型号:NV-M-O15G,国械注进20163131267)包埋支气管残端。若术前有充血水肿、术前未行纤维支气管镜检查、术中考虑张力较大或吻合器成钉效果欠佳者使用3-0 Prolene线连续缝合加固支气管残端。间断缝合纵隔胸膜,将支气管残端密闭于纵隔内。于下胸腔放置1根胸腔引流管后关胸。所有患者均未行胸廓成形手术。
1.6 术后治疗
患者术后抗结核治疗参照世界卫生组织欧洲办事处发布的《手术在治疗肺结核、耐多药和广泛耐药肺结核中的作用》[6]:(1)手术时培养阳性的患者:药物敏感肺结核,培养转阴后4~6个月;耐多药结核病(multidrug-resistant tuberculosis,MDR-TB),培养转阴后至少18个月;广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB),培养转阴后至少24个月。(2)手术时培养阴性的患者:药物敏感性肺结核,手术后至少4个月;M/XDR-TB,手术后6~8个月(根据术后恢复情况)。
1.7 观察指标
观察指标包括:手术时间及术中出血量;术后胸腔引流液颜色、性状、每日引流量及细菌培养情况;术后相关血液指标、痰涂片、术后咯血情况、术后严重并发症发生情况(胸腔感染、BPF、重症肺炎、心力衰竭、结核播散、乳糜胸等)及死亡率等。严重并发症判断标准依据Clavien-Dindo[8-8]分级≥Ⅱ级,排除简单的切口脂肪液化和一过性的心律失常。
1.8 统计学分析
应用 SPSS 27.0统计学软件进行数据分析。符合正态分布的计量资料采用均数±标准差(x±s)描述,组间比较采用独立样本t检验。非正态分布的计量资料采用中位数(上下四分位数)[M(P25,P75)]描述,组间比较采用Wilcoxon秩和检验。分类变量采用率和构成比描述,组间比较采用χ2检验。采用logistic回归模型分析单侧全肺切除术后严重并发症发生的危险因素。双侧检验水准α=0.05。
1.9 伦理审查
本研究经成都市公共卫生临床医疗中心伦理委员会批准(YJ-K2024-02-01)并征得所有患者知情同意。
2 结果
2.1 术后严重并发症的影响因素分析
共纳入134例患者,其中12例患者因术前咯血内科控制欠佳未行肺功能检查。择期手术133例,1例患者因大咯血内科治疗及介入治疗效果不佳,急诊行右侧余肺切除术。术前痰抗酸杆菌涂片或纤维支气管镜冲洗液(纤冲液)抗酸杆菌涂片阳性35例,合并曲霉菌感染30例,合并结核性脓胸57例,合并BPF 9例,术前耐药患者22例,利福平耐药结核病(Rifampicin-resistant tuberculosis,RR-TB)5例、MDR-TB 10例、准广泛耐药结核病(Pre-XDR-TB)3例、XDR-TB 4例。术前合并基础疾病46例(糖尿病、高血压、慢性阻塞性肺疾病、胸腔感染、BPF、矽肺、心律失常、乙肝等);其余基线资料见表1。
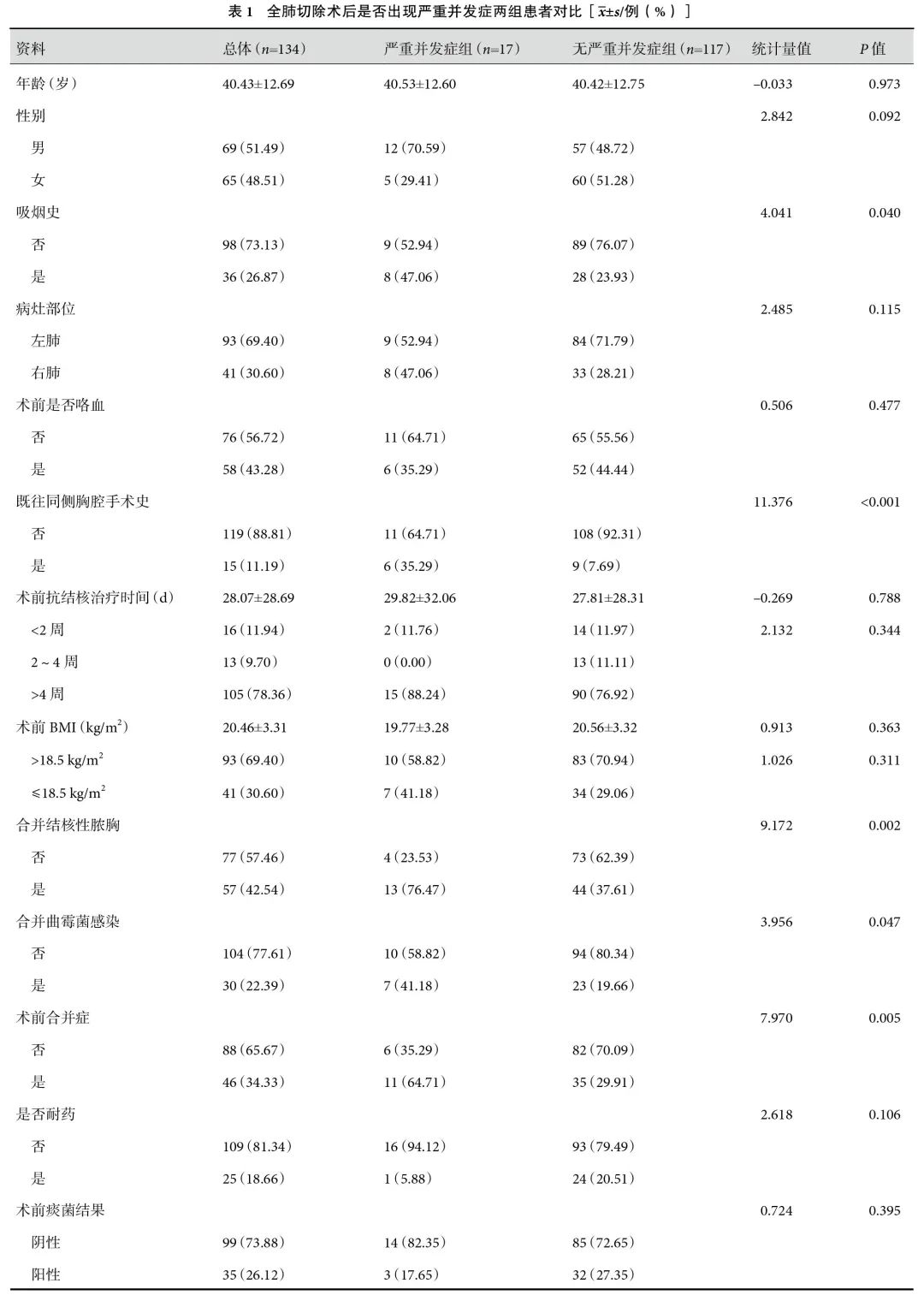
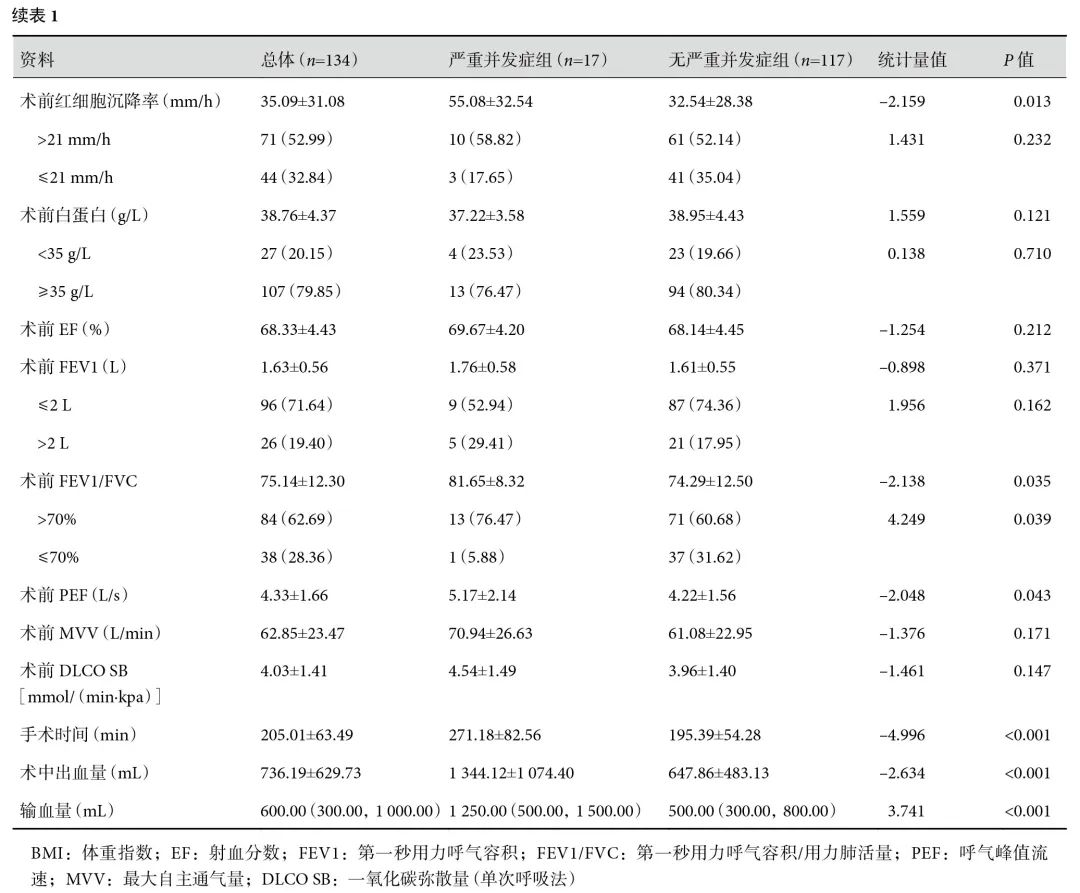
经评估,全部患者术前肺内病灶均处于非活动期,133例术前行规范抗结核治疗,抗结核治疗时间54(28,78)周。1例患者经结核内科会诊评估后未找到结核复发依据,未行抗结核治疗,该患者术前反复发作患侧肺部感染,伴咳嗽、咳痰、咯血等临床症状,符合手术指征。平均手术时间95~440(205.01±63.49)min,平均术中出血量100~5 000(736.19±629.73)mL,术后总引流量2 771(1 030,4 775)mL,平均术后带管时间3~104(15.71±13.21)d。术前合并咯血患者术后均未再咯血。术前痰抗酸杆菌涂片或纤冲液抗酸杆菌涂片阳性患者术后全部转阴。合并曲霉菌感染患者术后均行伏立康唑200 mg,1次/12 h,口服抗真菌治疗6~8周。术后通过病理标本送检新发现耐药患者3例,其中单耐药结核病(MR-TB)1例,RR-TB 1例、MDR-TB 1例。术后切口感染8例(5.97%),肺部感染26例(19.40%)。严重并发症17例(12.69%)。术前1例未行抗结核治疗患者,术后出现胸腔感染,经抗生素治疗、胸腔冲洗、持续引流后成功拔管。
单因素分析结果显示:与非严重并发症组相比,严重并发症组合并吸烟史、合并既往同侧胸腔手术史、合并结核性脓胸、合并曲霉菌感染、合并基础疾病、术前红细胞沉降率升高、术前第一秒用力呼气容积(FEV1)/用力肺活量(FVC)>70%、术前呼气峰值流速(peak expiratory flow,PEF)偏高、手术时间较长、术中出血量较多、输血量较多,术后发生严重并发症的概率显著增加(P<0.05);见表1。
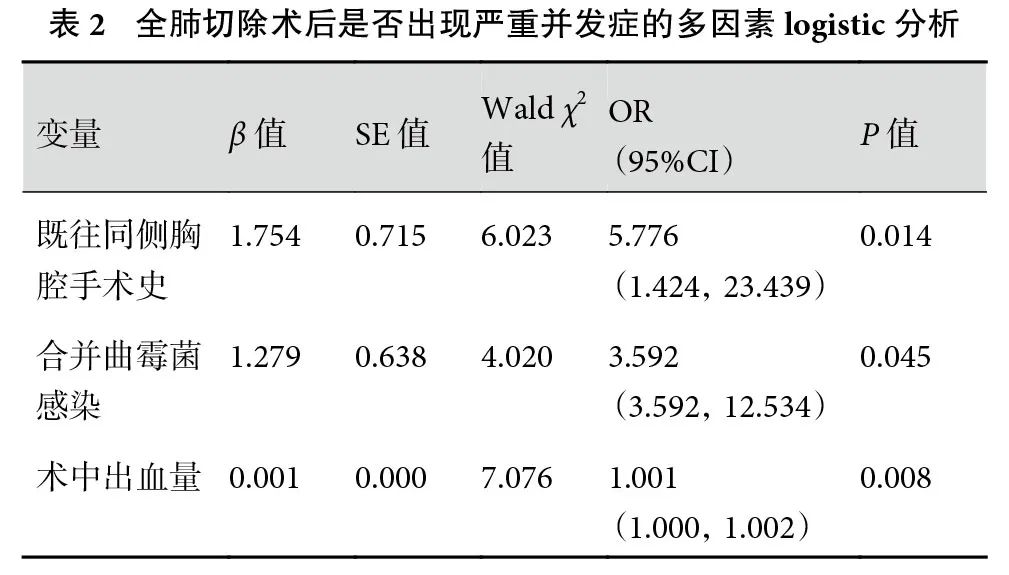
2.2 严重并发症的多因素分析
将单因素分析中差异具有统计学意义的指标和有临床意义的指标(性别、年龄)纳入多因素分析。多因素logistic回归分析结果显示,既往同侧胸腔手术史、合并曲霉菌感染、术中出血量为全肺切除术后出现严重并发症的独立危险因素;见表2。
2.3 单侧全肺切除患者临床严重并发症分析及处理
17例患者发生严重并发症,并发症情况见表3。围手术期死亡2例,其中1例术后出现重症肺炎、呼吸衰竭,术后第10天死亡;1例术后出现心力衰竭合并重症肺炎,术后2个月死亡。2例死亡病例均为右全肺切除,术前体重指数均<18.5 kg/m2,围手术期死亡率1.49%。术后失访10例,其余患者术后随访11~36个月,1例术前未行抗结核治疗患者,术后病理标本均未查到结核活跃依据,经结核内科会诊评估后未行抗结核治疗。其余122例患者术后抗结核治疗参照《手术在治疗肺结核、耐多药和广泛耐药肺结核中的作用》[6]。其中完成术后抗结核治疗疗程117例,4例仍在抗结核治疗中,术后平均抗结核治疗(70±32)周。其中1例患者术后合并胸腔感染、严重营养不良,无法耐受足量抗结核治疗,术后新发脊柱结核,抗结核治疗失败,术后14个月死亡。其余随访患者中无结核复发病例。对于以上并发症所产生的时间、原因分析及治疗结局等见表3。
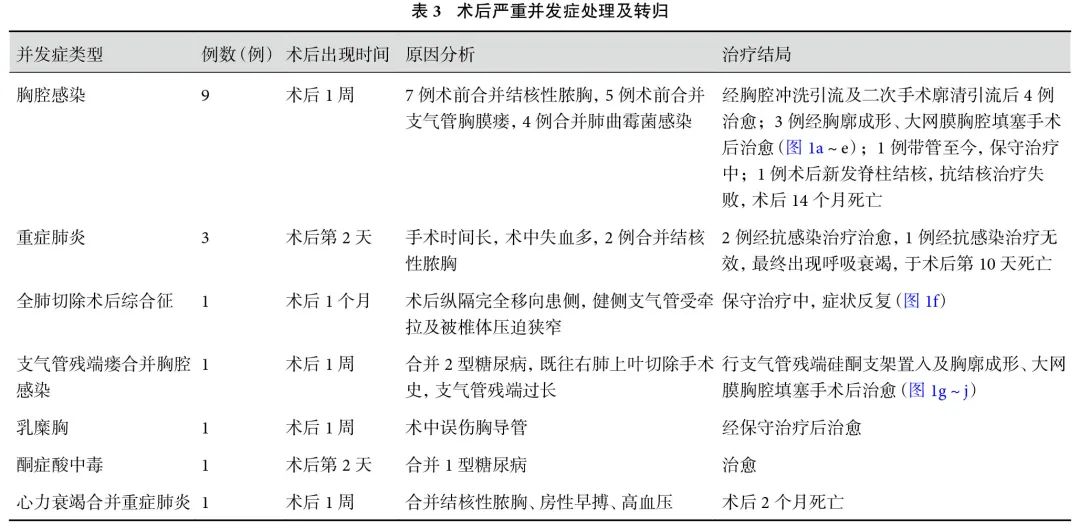
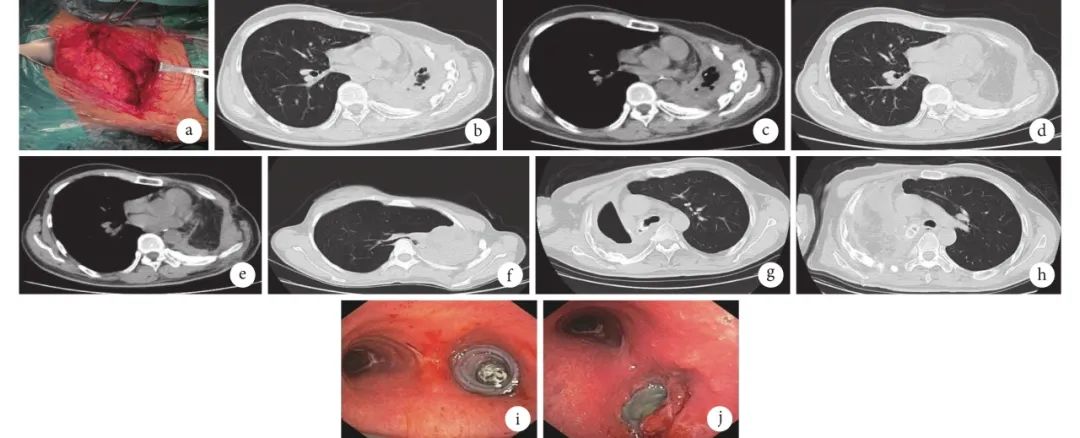
图1 术前及术中图片
a:大网膜胸腔填塞;b:大网膜胸腔填塞术前肺窗;c:大网膜胸腔填塞术前纵隔窗;d:大网膜胸腔填塞术后 2 个月肺窗;e:大网膜胸腔填塞术后 2 个月纵隔窗;f:全肺切除术后综合征;g:硅酮支架植入术后-大网膜胸腔填塞术前 CT;h:硅酮支架联合大网膜胸腔填塞术后 CT;i:右侧主支气管残端硅酮支架置入;j:右侧主支气管残端硅酮支架置入术后 3 个月
3 讨论
目前,外科仍然是一种不能被替代的、和化疗相辅相成的结核病治疗手段[9]。随着耐药结核患者逐渐增加,2016版世界卫生组织耐药结核病治疗指南[10]将外科作为一个积极的治疗手段。《耐多药和利福平耐药肺结核外科治疗中国专家共识(2022年版)》[11]中提出MDR/RR-PTB治愈率约60%,外科的及时干预可将治愈率提高至85%以上。对于单侧结核性毁损肺患者,行全肺切除可显著提高长期治疗无效肺结核及耐药肺结核的治愈率,并且可显著改善其临床症状,如降低咯血率及改善呼吸状态等。但结核性毁损肺患者具有病史长、病情重、手术难度大等特点,具有较高的围手术期并发症发生率及死亡率。随着手术技术的不断改进,结核性毁损肺行单侧全肺切除手术的并发症、死亡率均下降,安全性提高。本研究中134例患者术后出现肺部感染26例(19.40%)。出现严重并发症17例(12.69%),围手术期死亡2例(1.49%),术前痰菌阳性35例患者术后全部转阴,术前合并咯血58例患者术后均未再咯血。此外,在单侧全肺切除手术中,具有较高的急性呼吸窘迫综合征发生率及围手术期死亡率[12-13],本研究中134例患者中围手术期死亡2例,死亡率仅为1.49%,均为右全肺切除。有研究[14]显示右全肺切除术后死亡率是左全肺切除术后的3倍,右侧全肺切除死亡风险较高,与本研究观察到的结果基本一致。整体来讲,本研究数据显示单侧全肺切除治疗结核性毁损肺手术疗效明确,安全性高。
目前普遍认为结核性毁损肺术前经正规抗结核治疗≥6个月未见明显好转,健侧肺无结核病灶或有局限性病灶但处于稳定期可行全肺切除手术[14]。本组研究中134例患者,术前评估肺内病灶均处于稳定期,术前抗结核时间<2周、2~4周及>4周3组患者术后严重并发症发生率差异无统计学意义。我们认为,行单侧全肺切除的结核性毁损肺患者,若既往有抗结核治疗史,肺内病灶处于稳定期且经评估抗结核治疗无法缓解肺毁损,术前抗结核时间长短不是完全手术禁忌,给予抗结核治疗后1~2周实施手术安全可行。尽早手术切除毁损肺,可避免反复肺部感染及造成耐药,并减少传染源,提高患者生活质量。
肺功能检测是目前肺部手术前的常规检查项目,既能预测围手术期患者的并发症风险和远期生活质量,也能为手术决策提供客观依据。国内外多个指南[15-16]普遍认为耐受单侧全肺切除术肺功能需满足FEV1>2 L。但这些指南大多针对肺部肿瘤等非毁损肺疾病,对于毁损肺全肺切除的肺功能要求目前国际上尚缺乏权威依据。有研究[3]显示,对毁损肺患者实施手术,FEV1≤2 L与FEV1>2 L的患者在手术安全性及近远期生存方面均一致。该结论在本研究中也得到了印证。在本研究中,术前肺功能指标更高者(FEV1/FVC>70%、FEV1>2 L),术后出现严重并发症的概率反而更高。我们认为其原因可能为术前肺功能指标更高者,患侧肺组织残存的肺功能更多,术后丢失的肺功能所占比例更大。单侧肺组织全部毁损或大部分毁损,毁损肺组织无法正常完成血-气交换,属于无功能区,手术切除可以改善通气血流比例,对于此类患者与肺癌患者不同,术前的肺功能评估的阈值应适当放宽[16]。
BPF是肺切除手术后较为严重的并发症,处理难度较大,死亡率高,尤其对于全肺切除术后患者[3, 17-18]。在本研究中,仅有1例(0.75%)患者出现BPF,其原因考虑:该患者既往于外院行右肺上叶切除,本次因大咯血于我院急诊行右侧余肺切除手术,术前未行纤维支气管镜检查评估支气管情况,且合并2型糖尿病及支气管残端保留过长有关。最终给予支气管残端硅酮支架置入及胸廓成形、大网膜胸腔填塞手术后治愈。根据术者经验,游离暴露主支气管时不能把支气管残端周围组织过度裸化,支气管残端不宜过长或过短,通常距离隆突开口0.5~1 cm。对于存在支气管残端瘘风险的患者,残端使用3-0 Prolene线连续缝合及奈维补片加固,并缝合纵隔胸膜,使其密闭于纵隔内,可显著降低BPF的发生风险。BPF 瘘口<0.5 cm的患者,可于纤维支气管镜下利用生物胶、纤维蛋白等材料封堵的方法,封堵满意后继续加强胸腔冲洗、抗感染治疗,基本可以治愈[19]。BPF的介入治疗还包括金属支架封堵、单向活瓣(EBV)治疗、自体脂肪移植等[18]。
在本研究中,有9例患者出现术后胸腔感染,术前7例合并结核性脓胸,5例合并BPF,4例合并曲霉菌感染。对于合并BPF、结核性脓胸及曲霉菌感染的患者,术中操作可能会污染胸腔,导致术后胸腔感染风险增高。对于这类患者,术中需更加注重无菌观念。关胸前予以生理盐水、双氧水、碳酸氢钠、碘伏水反复多次冲洗胸腔。术后胸腔积液连续3次培养阴性(每次间隔24 h)可拔除胸腔引流管。尽管经过仔细的术中处理与术后观察,仍有一部分患者会出现术后胸腔感染。对于这部分患者,通过二次胸腔镜下廓清引流手术及间断冲洗,部分可以治愈。但仍有一些患者病情反复,长期带管。采用大网膜脓胸填塞及局部胸廓成形可治愈,成功拔管。大网膜具有炎性物质包裹及液体吸收的作用,是作为全肺切除术后胸腔感染后填充残腔的理想自体器官[20]。
此外,在单因素分析中,合并吸烟史、合并既往同侧胸腔手术史、合并结核性脓胸、合并曲霉菌感染、合并基础疾病、术前红细胞沉降率升高、术前FEV1/FVC>70%、术前PEF偏高、手术时间较长、术中出血量较多、输血量较多的病例,术后发生严重并发症的概率显著增加。Logistic回归分析显示,既往同侧胸腔手术史、合并曲霉菌感染、出血量较多为全肺切除术后出现严重并发症的独立危险因素(P<0.05)。本研究结果与相关研究[2]基本一致。因此,对于结核性毁损肺患者围手术期间,我们更加需要关注术前及戒烟指导,进行感染控制及基础疾病稳定,以降低手术风险。根据患者的具体情况,制定个性化的手术方案,包括手术方式、麻醉选择、手术时间预估等,尤其加强右肺毁损患者的手术风险评估,尽可能缩短手术时间和减少术中出血量,对于预计手术时间较长或出血风险较高的患者,应提前准备充足的血液制品,术前密切监测患者的生命体征和实验室指标(如红细胞沉降率)、肺功能等,及时发现并处理潜在的异常。密切观察患者的病情变化,及时发现并处理可能的并发症,如感染、出血、呼吸功能不全等。
综上所述,结核性毁损肺患者行单侧全肺切除手术能提高患者临床治愈率、痰菌转阴率及咯血停止率,但该类患者因长期营养消耗、肺功能下降、合并多重感染、胸腔致密粘连等,导致手术难度大、时间长、出血多,存在围手术期严重并发症及死亡风险,需充分做好围手术期管理及术后并发症的合理处理,以提高治愈率,降低并发症及死亡风险。
利益冲突:无。
作者贡献:李霄负责研究设计、数据统计、文章撰写;王宁负责数据分析、文章撰写;包蕾负责数据支持及整理;伍治强负责研究支持与指导;李刚、蔡聪、宋毅杰、李丹、吴邦贵负责资料整理与收集;蒋良双负责研究技术指导与支持;姚晓军负责研究设计、论文修改、审阅、经费支持。


