山东大学/济南大学合作ACS Nano:纳米颗粒调控细胞内三价铁离子浓度促进运动神经元分化及脊髓损伤修复
时间:2025-09-05 12:10:05 热度:37.1℃ 作者:网络
脊髓损伤(SCI)是由各种原因引起的脊髓结构和功能损害,作为最严重的中枢神经系统(CNS)疾病之一,通常会导致不可逆的感觉和运动功能障碍,并伴随着反射活动异常及自主神经功能紊乱,同时会引发的一系列并发症,导致患者生活质量显著下降。全球现有患者超过2000万,中国现存脊髓损伤患者374万,每年新增脊髓损伤患者约9万人,脊髓损伤患者数量激增,已经成为越来越严重的社会和医疗问题。干细胞疗法被认为是SCI修复的有前景的策略,但神经干细胞(NSCs)自发分化为运动神经元的比例不足,难以形成功能性神经网络,导致SCI修复效果不佳。因此,通过调控移植的NSCs定向分化为运动神经元以实现运动功能的改善对于SCI的治疗具有重要的意义。

近期,山东大学仇吉川教授、刘宏教授、周恒星教授,济南大学董宝利教授等人报道了一种利用三氧化二铁(Fe₂O₃)纳米颗粒调节细胞内三价铁离子(Fe3+)浓度调控NSCs定向分化为运动神经元的方法。Fe₂O₃纳米颗粒被NSCs内吞后在溶酶体酸性环境中溶解可以提高细胞内Fe3+浓度,诱导29.38%的NSCs定向分化为运动神经元,并使其提前5天发育成熟。动物实验证实,将预先摄取Fe₂O₃纳米颗粒的NSCs移植到损伤部位后,能够促进SCI小鼠的运动与感觉功能恢复。该研究为优化NSCs治疗脊髓损伤的效果带来了重要前景。相关工作以“Nanoparticle-Mediated Regulation of Intracellular Ferric Ions to Induce Motor Neuron Differentiation for Spinal Cord Injury Repair”为题发表在ACS Nano期刊上。
文章要点
在这项研究中,作者首先通过透射电子显微镜(TEM)和X射线衍射(XRD)等技术表征了Fe₂O₃纳米颗粒的尺寸和晶体结构。结果表明Fe₂O₃纳米颗粒分散性良好,平均直径约10 nm,呈γ相立方晶格结构且仅含Fe³⁺不存在Fe²⁺,可以避免由Fe²⁺引起的铁死亡风险。荧光染色和扫描电子显微镜(SEM)图像结果表明Fe₂O₃纳米颗粒被NSCs内吞后在溶酶体中滞留长达14天,并在溶酶体的酸性环境下Fe₂O₃纳米颗粒逐渐分解并持续释放Fe³⁺,提高了细胞内Fe³⁺浓度。
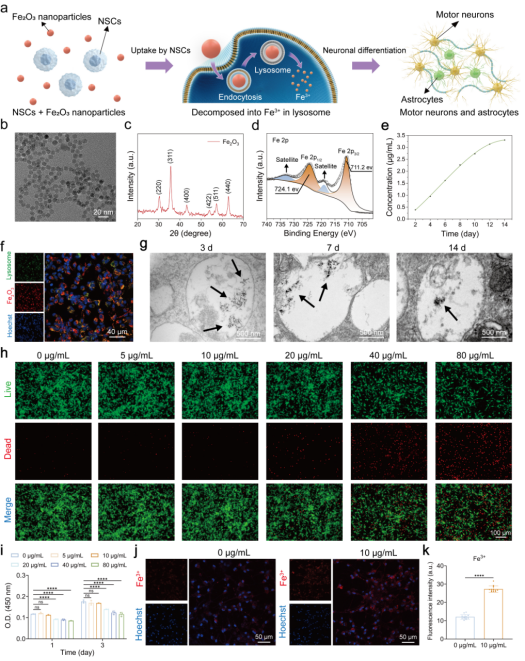
图1.Fe₂O₃纳米颗粒的表征及其在NSCs中的细胞相容性
接下来,作者通过基因(RT-qPCR)和蛋白水平(免疫荧光染色)的结果发现Fe₂O₃纳米颗粒显著提高了神经元特异性标记物Tuj1和MAP2的表达,而对胶质细胞标记物GFAP无显著影响,这表明Fe₂O₃纳米颗粒促进了NSCs向神经元的分化。作者又通过蛋白免疫印迹(Western blot)分析,观察到与自发分化的NSCs相比,通过Fe₂O₃纳米颗粒处理的NSCs提前5天分化为成熟神经元。
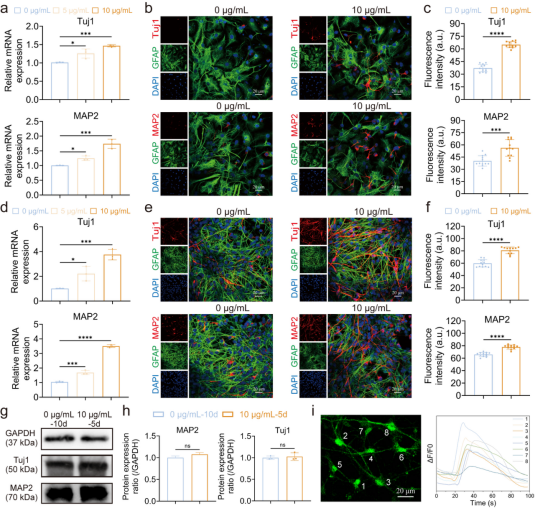
图2. Fe2O3纳米颗粒分解释放的Fe3+促进NSCs分化的作用
作者进一步通过RT-qPCR、免疫荧光染色以及Western blot的结果发现Fe₂O₃纳米颗粒显著提高了运动神经元标记物Ngn2、HB9和ChAT的表达,并且有29.38%的NSCs定向分化为运动神经元,表明Fe₂O₃纳米颗粒能够定向诱导NSCs分化为运动神经元。随后通过mRNA测序结果对其中的潜在机制进行研究,其中Fzd9的上调激活了Wnt信号通路,进而增强靶基因Ccnd1的表达,调控运动神经元的分化。
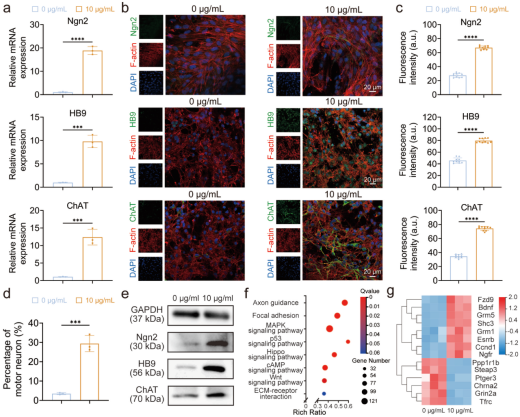
图3. Fe₂O₃纳米颗粒对NSCs分化为特定类型神经元的影响
随后作者建立了完全横断SCI模型,将预摄取Fe₂O₃纳米颗粒的NSCs移植到损伤部位,免疫荧光染色结果显示Tuj1和HB9阳性细胞增多,表明预摄取Fe₂O₃纳米颗粒的NSCs在体内成功存活并进一步分化为运动神经元。此外,作者通过膀胱组织的苏木精-伊红(HE)染色发现SCI小鼠的膀胱壁厚度明显增加,表明摄取Fe₂O₃纳米颗粒的NSCs移植可促进SCI小鼠自主神经恢复。
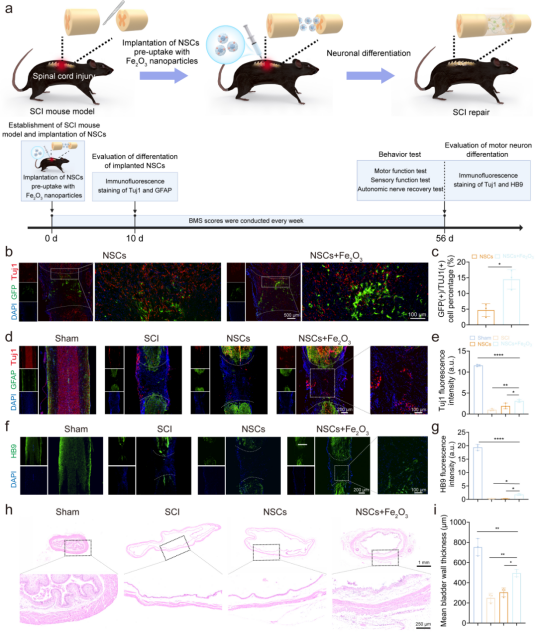
图4.移植预摄取Fe2O3纳米颗粒的NSCs对SCI小鼠的组织修复
作者通过行为学测试发现移植预摄取Fe2O3纳米颗粒的NSCs有效提高SCI小鼠的BMS评分,并通过电生理测试发现运动诱发电位(MEP)和体感诱发电位(SEP)的明显升高。上述研究结果表明移植预摄取Fe₂O₃纳米颗粒的NSCs显著提高了SCI小鼠的运动和感觉功能恢复。此外,关于心、肺、肝、肾、脾的HE染色显示Fe₂O₃纳米颗粒在体内具有良好的生物相容性。
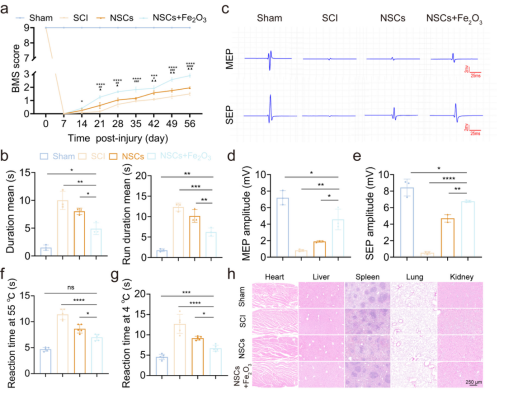
图5.移植预摄取Fe2O3纳米颗粒的NSCs对SCI小鼠运动和感觉功能的影响
【结论与展望】
本研究通过Fe₂O₃纳米颗粒调控细胞内Fe³⁺浓度,成功实现了神经干细胞(NSCs)向运动神经元的定向分化,为脊髓损伤(SCI)的治疗开辟了新途径。当Fe₂O₃纳米颗粒被NSCs内吞后,会在酸性溶酶体环境中分解并释放 Fe³⁺,显著提升了神经元分化效率,定向诱导29.38%的NSCs分化为运动神经元。在SCI小鼠模型中,经Fe₂O₃纳米颗粒预处理的NSCs能显著促进运动与感觉功能恢复。这一策略的临床转化潜力值得期待——Fe₂O₃纳米颗粒已获FDA批准,其优异的生物相容性为SCI及其他神经退行性疾病的治疗提供了安全有效的手段。不过,当前研究中新生神经元的数量仍需提升。未来研究可聚焦于优化NSCs的存活率及与宿主神经网络的整合能力,以进一步增强SCI修复效果。总体而言,Fe₂O₃纳米颗粒介导的细胞内Fe³⁺传递为NSCs治疗SCI提供了一种创新且前景广阔的策略,有望在临床领域得到广泛应用。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c10725


