【论肿道麻】癌症治疗相关心脏毒性的细胞间通路及其治疗意义:以放射性治疗为范例
时间:2025-09-06 12:14:42 热度:37.1℃ 作者:网络
癌症突破性治疗减少了癌症死亡人数,并将以前致命的癌症类型转变为慢性疾病。然而,幸存者可能面临急性、长期后遗症,影响他们的生活质量。与癌症治疗相关的心脏毒性是一种主要且可能危及生命的不良事件。大量临床证据支持癌症治疗可以改变肿瘤患者发生心血管疾病的风险。其中放射疗法通常靶向肿瘤区域以诱导癌细胞死亡,也已被证明可引起广泛的心脏疾病,2024年8月《Pharmacology and Therapeutics》杂志上发表了一篇名为《Intercellular pathways of cancer treatment-related cardiotoxicity and their therapeutic implications: the paradigm of radiotherapy》的综述,作者着重阐述了放射性治疗后肿瘤对心脏的影响,揭示了其复杂的细胞间通信机制和潜在的治疗意义,强调了多学科合作的重要性,通过结合计算生物学、实验生物学和临床数据,可以更全面地理解癌症治疗相关的心脏毒性机制,并开发出更有效的治疗策略。
目前,已经报道了癌症治疗诱导的CVD:蒽环类药物引起的心肌病;放疗患者出现各种CVD后遗症;靶向治疗和免疫治疗也会促进CVD并发症。免疫检查点抑制剂(ICI)是一个典型的例子:由于其成功的治疗特征,ICI被快速推进到一线治疗。然而,它们与心血管并发症相关。这反映了癌症治疗对心血管系统的脱靶效应。然而,癌症治疗后CVD并发症的多样性指出,癌症、癌症治疗和心脏病之间的关联的谜题中的重要部分仍然缺失。
众所周知,肿瘤具有与各种宿主细胞和组织进行短距和长距通信的能力。肿瘤不仅与其周围细胞相互作用,而且与携带肿瘤的器官和整个身体相互作用。因此,我们合理假设:经治疗的肿瘤具有通过远程、间接和长距离机制影响心脏组织的潜力。据我们所知,生长或治疗的肿瘤如何远程影响心脏组织在很大程度上仍不清楚。需要对治疗肿瘤如何影响心脏的分子和细胞水平进行系统水平的理解。考虑到已知放射疗法影响非靶向的、偏远的区域,它提供了探索癌症治疗对心脏的全身效应的一个相当合适的背景。我们探索:正在治疗的肿瘤和心脏组织的远距离作用。我们总结了目前的研究和荟萃分析表明,放射治疗后的肿瘤分泌的因子损害了心脏组织的稳态,从而使其易患CVD。最后,我们提出了最先进的方法,以生成可行的多学科工作流程,进行概念验证临床前研究,在生物体水平上解释治疗相关的心脏毒性的细胞间机制。
肿瘤和心血管疾病(CVD)的密切内在联系
据报道,与普通人相比,癌症患者的心血管疾病发病率和死亡率的风险增加了两倍以上。泌尿生殖系统、胃肠道、胸部、神经系统和血液系统恶性肿瘤患者的CVD风险最高。此外对于癌症患者,CVD死亡风险随时间增加,而老年男性、非裔美国人和未婚癌症患者的风险最大。与治疗相关的心脏毒性被确定为癌症患者中CVD发病率和死亡率的主要因素。癌症治疗相关CVD的发作范围从治疗时直至数十年后。儿童癌症幸存者提供了一个突出的例子,他们在癌症诊断后40年表现出10.6%的累积治疗相关心力衰竭发生率。相反,CVD患者与一般人群相比显示出显著更高的癌症风险。在心脏病患者中,患有动脉粥样硬化的患者具有显著的癌症风险。这些临床观察结果证明了“逆向心血管肿瘤学”领域的诞生。
放疗vs.其他治疗导致的心脏毒性
大量临床证据支持癌症治疗可以改变肿瘤患者发生心血管疾病的风险,放射疗法通常靶向肿瘤区域以诱导癌细胞死亡,放射疗法已被证明可引起广泛的心脏疾病,称为放射诱导的心血管疾病(RICVD),包括冠状动脉疾病、瓣膜疾病、心肌病、心包疾病、心律失常和肺动脉高压。在20世纪70年代之前接受过早期放疗的患者,CVD风险跃升至7.2倍。RICVD通常在治疗后10-30年出现。即使是低辐射剂量也会增加CVD并发症的风险。有趣的是,RICVD不仅表现在与心脏相邻的放射治疗肿瘤部位,也表现在与心脏距离较远的部位,如宫颈癌、前列腺癌、直肠癌和睾丸癌。常规化疗、靶向剂和免疫疗法也表现出心血管副作用。
CVD、癌症和癌症治疗之间互相作用的多因素性质
癌症和心血管疾病在同一患者中的共存对治疗提出了挑战,因为两者中一种的存在阻碍了另一种的最佳管理,限制了手术选择和/或需要减少或中断药物剂量。CVD、癌症和癌症治疗之间的相互作用是复杂、多因素的(图1)。它取决于患者的遗传特征、流行病学、生活方式、共有风险因素和病理生理过程,甚至非医学因素,如经济稳定性或获得教育和医疗保健的机会。
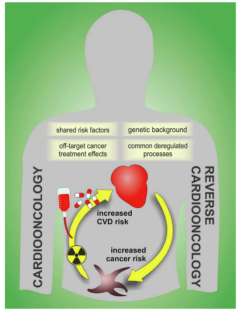
Figure1. 癌症和心血管疾病之间存在着复杂的联系
首先,癌症和CVD共有诱发因素和机制,风险因素包括高血压、肥胖、糖尿病、血脂异常、炎症、吸烟、酒精中毒、体力活动和决定健康的社会因素。CVD风险因素(CVRF)在接受放疗治疗的某些肿瘤中更为常见。CVRF的特征也可能有所不同,具体取决于癌症类型。这一点最近在房颤中得到了证实,多发性骨髓瘤和食管癌患者的房颤风险较高,但胃癌患者的房颤风险较低。第二,遗传背景共同决定患者是否可能表现出心脏对癌症治疗过度敏感。个体多态性或与药物代谢有关的基因改变可能导致患者特异性心脏毒性和药物药代动力学和药效学的变化。第三,在两种病理改变中普遍失调的生物学过程可能进一步解释了它们的关联,并为同时靶向两种疾病提供了前景。炎症是CVD和癌症中的一个关键共同过程;微生物的生态失调(即肠道微生物组及其代谢物的改变)被认为是CVD和癌症的驱动因素。
肿瘤和心脏之间远距离相互作用:心脏对肿瘤,肿瘤对心脏、还是两者兼而有之?
最近有人提出,癌症和CVD之间的临床相关性是由肿瘤和心脏之间远距离相互作用导致的,主要由循环因子介导。这些因子的分泌似乎是相互的,具有从心脏到肿瘤以及从肿瘤到心脏的双向作用。具体来说,心脏-肿瘤通信:心脏具有通过细胞外小泡、脂质和其它旁分泌分子与其它器官和组织进行长距离通信和信息交换的能力。有趣的是,心脏损伤似乎会增强远端部位的肿瘤形成。这种作用是由心脏分泌的因子介导的,这些因子在心力衰竭时升高,并能增加癌细胞增殖。肿瘤-心脏通信:肿瘤释放因子进入循环、到达远离肿瘤器官的组织并影响其体内平衡的能力。肿瘤分泌物组不仅在近端,而且在远端介导肿瘤与宿主细胞的相互作用。局部分泌的因子在肿瘤微环境(TME)中建立了癌细胞与多种受体细胞类型的相互作用,包括免疫细胞,内皮细胞,成纤维细胞、脂肪细胞,神经元。在肿瘤微环境TME之外,肿瘤衍生物到达远端组织并与它们相互作用:比如,骨骼肌干细胞系暴露于来自乳腺癌细胞的条件培养基加速了干细胞-肌管分化和伤口愈合,并减少了代谢和存活途径,这总体上与骨骼肌功能障碍一致。
放射治疗后的肿瘤分泌组是心脏毒性的新兴贡献因素
1. 放射治疗诱导肿瘤分泌组的蛋白免疫原性和毒性作用
放射治疗的肿瘤释放炎性和免疫原性因子进行细胞间通讯。这些通信信号由免疫系统传播并且对患者既有益又有害。免疫原性细胞死亡(ICD)和损伤相关分子模式(DAMPs)是相关通路的关键参与者。辐射激活DNA损伤反应和修复(DDR/R)机制以诱导细胞周期停滞和凋亡性死亡。应激、垂死的癌细胞释放广泛的生物活性分子以触发免疫原性细胞死亡(ICD),其参与肿瘤靶向免疫应答。这些免疫原性因子包括但不限于损伤相关分子模式(DAMP)。DAMP是正常情况下封闭在细胞膜内的功能性分子,但一旦它们暴露于细胞外环境,它们就变成免疫原性的。一旦先天性免疫系统通过模式识别受体(PRRs),感应到DAMP,它就会以基序特异性方式应答,并促进促炎环境和无菌炎症。
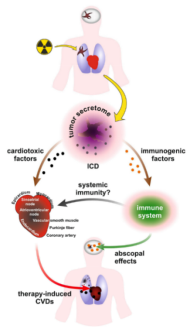
图2放射肿瘤的分泌物组对免疫系统和心脏组织的双面效应。
2.损伤相关分子模式(DAMPs)及其相应的模式识别受体(PRRs)影响心脏组织的稳态
循环DAMP水平的升高在临床上与CVD相关,DAMP激活不同的PRRs,包括但不限于Toll样受体(TLR),其触发免疫应答级联。有趣的是,PRRs在CVD中是慢性激活的。这些研究证明了CVD与单个DAMP释放之间的因果关系。一般而言,在啮齿类动物中进行DAMP的实验性给药对心血管参数具有有害影响,相反地,抑制DAMP或其各自的PRR可改善心血管疾病的表型和结局。基于这些数据,可以合理地设想,放疗诱导免疫原性细胞死亡(ICD)后癌症患者循环中DAMP的增加可能最终通过心脏组织稳态失调为CVD的发展创造了肥沃的土壤。
3. 肿瘤对放射产生和分泌的因子可以调节多种心脏组织细胞
辐射如何激活肿瘤和心脏组织之间的细胞间通讯仍然是一个未知领域。传统的啮齿动物模型来研究放射治疗肿瘤和心脏之间的细胞间通路可能特别具有挑战性。为了研究在癌症患者中观察到的临床情况,必须对携带肿瘤的小鼠进行手术切除和/或照射,并使它们存活至CVD发展。此外,动物可能需要在CVD发展之前实施安乐死,意味着研究终点不会达到。为了绕过这些局限性并预测受辐射肿瘤细胞分泌的因子是否可能触发影响心脏的细胞间通路,我们进行了一个系统的计算机模拟(in silico)元分析,利用所有公开的资源来研究人类癌细胞在受到低线性能量转移(low-LET)和高线性能量转移(high-LET)辐射时所经历的高通量变化。。我们最近开发了RadBioBase,一种以全面和系统的方式提供正常和肿瘤哺乳动物细胞中辐射诱导的转录组变化的数据库。通过RadBioBase,我们检索到482个基因,其转录物在不同癌症类型的肿瘤细胞中响应于辐射而上调。我们进一步将该列表与Uniprot数据库中的数据重叠,以筛选功能性注释为分泌途径的基因。这一方法使我们能够推断出受辐射的癌细胞分泌物组的蛋白质组分。
最后,我们定义了34个编码跨膜蛋白和/或分泌蛋白的基因,其在计算机模拟中被预测为参与辐射后肿瘤细胞的细胞间相互作用。34个因子的STRING表示显示它们高度相互关联,IL 6、ILB、INFG、CSF 2、CSF 3和CCL 2占据了最中心的枢纽(图3A)。这些因子中的大多数与各种CVD的发生呈正相关(图3A,带红线圆圈的结节)。基因集富集分析(GSEA)分析表明,这34种因子在IL 10、IL 6和IL 4/IL 13信号传导以及JAK/STAT途径中过量表达(图3B)。CANTOS和RESCUE临床试验显示分别针对ILB和IL 6的单克隆抗体可降低CVD患者的心血管事件发生率。关于细胞功能,分泌的因子作用于心脏组织中发现的几种细胞类型,包括肌细胞、内皮细胞、免疫细胞、脂肪细胞、心脏祖细胞和成纤维细胞(表3和图3C)。每个因素影响一种以上的细胞类型,相反,每种细胞类型受到许多这些因素的影响(图3C)。
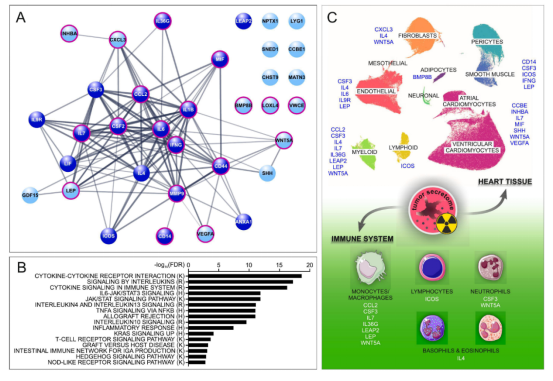
Figure 3:计算机模拟参与辐射后肿瘤细胞的细胞间相互作用
上述计算数据提供了系统性证据,表明肿瘤可能具有通过其分泌组中响应于辐射上调的蛋白质与心脏细胞通信的潜力。从CVD病理生理学的观点来看,每种分泌因子作用于异质性心脏组织的不同细胞,这是因为心脏是一种高度异质性的组织,不仅包含各种功能和生理上不同的心肌细胞亚型,而且还包含成纤维细胞、内皮细胞、免疫细胞和脂肪细胞。每种分泌的因子可通过靶向特定的心脏细胞亚群而易患不同的CVD。因此,我们需要表征哪些亚群被哪些分泌因子靶向,这种方法将使我们能够将分泌蛋白与特定细胞亚群的功能障碍联系起来,而这些功能障碍与特定的心血管疾病(CVDs)有因果关系。
多学科通道用于放射诱发的心血管疾病(RICVD)细胞间机制的概念验证临床前研究
1. 在临床前心脏肿瘤学研究中,需要将体内和体外实验与计算方法相结合
基于动物的实验计划带来了实际挑战。因此我们可以使用适当湿/干实验方法在临床前环境中再现和研究该现象。在图4中,我们提出了一个多学科的工作流程,以解决细胞间的途径,通过该途径,放射治疗的肿瘤分泌组随着时间的推移损害心脏组织的稳态。首先,人类癌细胞模型用具有不同物理性质的辐射类型照射。然后,将2D和3D培养的哺乳动物心脏模型用经处理的癌细胞的分泌组调节并进行电生理学测定和超分辨率显微镜来估计心脏传导性和细胞变化。使用蛋白质组学平台。自然语言处理(NLP)可以促进挖掘治疗诱导的CVD人类患者中的临床相关分泌因子。这种方法筛选出易感的候选分子排名。随后指导选择适当的遗传工程小鼠模型(GEMM)作为体内环境,以验证体外研究结果。临床前发现可以转化为心脏肿瘤学临床试验,并转化为CVD风险的生物标志物和肿瘤患者的个性化心脏保护药物(图4A)。
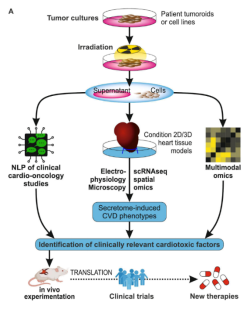
Figure 4A:多学科的工作流程
经辐照的肿瘤细胞可以进行基因组学、转录组学、表观基因组学和蛋白质组学分析。可以对用来自肿瘤的预处理培养基处理的心脏组织进行单细胞RNA测序和空间组学,以捕获组织异质性和结构的变化。通过机器学习和数学方法,产生几条组学数据线,然后将其与临床病理学和体外数据整合,使我们能够以高效推断介导肿瘤-心脏干扰的细胞内和细胞间通路网络。用于基于其分子特征个性化预测接受放疗的癌症患者的CVD风险(图4 B)。
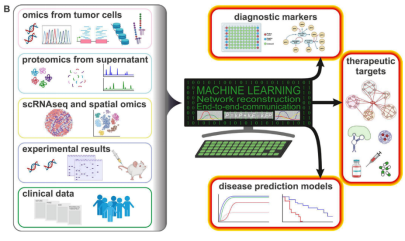
Figure 4A:个性化预测接受放疗的癌症患者的CVD风险
2. 用于研究放射治疗后肿瘤分泌组对异质心脏组织作用的心脏病学工具包
组织工程学的最新进展已经建立了丰富多样的心脏细胞生物学工具,这些工具不受动物实验的伦理限制,并且能够在体内复制癌症、心脏生理学和病理学的几个方面。常规用于鉴定药物毒性的基线模型是人诱导的多能干细胞衍生的心肌细胞(hiPSC-CM)。它们用于预测人特异性应答,允许高通量筛选,没有种间差异,没有与培养动物原代心脏细胞相关的技术困难和获得人心脏组织的挑战。这些研究通过在动物心脏组织上的scRNAseq方法来改善,单独或与空间转录组学组合。
3. 放射治疗后的肿瘤分泌蛋白组的高通量鉴定。
蛋白质组学和分泌组学适用于以高通量方式鉴定和功能表征放射治疗后的肿瘤分泌组及其对心脏组织的影响。新的高灵敏度质谱仪和数据独立采集(DIA)方法的引入将使得能够对复杂的分泌组进行深入分析。很可能在接下来的5年内,来自不同分泌组样品的完整蛋白质集合将被表征。
4. 机器学习用于优先识别放射治疗后肿瘤与心脏相互作用中具有临床相关性的成分。
数据解释是蛋白质组学分析的一个组成部分,有几个软件和数据库可用于对极其复杂的质谱数据进行跟踪、分析和功能注释的报告。这一任务可能特别具有挑战性,因为用经照射的癌细胞的上清液调理心脏组织需要富含生长和分化因子的专门培养基,所述生长和分化因子可能总体上模糊或偏向功能相关候选分子的鉴定。
5. 多组学分析和整合用于预测癌症放射治疗诱导的心功能不全的生物标志物和靶点
组学技术已经能够以多维和系统的方式对治疗和不良反应途径进行详细的重建和概述。这种表现法的目的是针对病人的病理情况,同时将治疗的副作用减至最小。多维、非线性组学数据在现代高通量平台中产生。通过使用有效的机器学习技术整合几条组学路线,可以发现有意义的机制见解和生物标志物。在表征药物对心脏组织的副作用方面,生物信息学工作流程已被证明是成功的。
6. 数学模型捕捉放射治疗后肿瘤-心脏串扰的动力学
暴露于辐射后的肿瘤-心脏互作是一个高度动态的过程。这些重要的环境和时间依赖性动态可以使用细胞间通信的多尺度计算机模型来捕获。端对端分子通讯模型是用于精确模拟细胞间通信的示例性计算工具。生物体是一个高度复杂的系统,受到许多因素的影响,这使得它们的预测具有挑战性。然而,数值模型可以在可接受的范围内提供其行为的合理近似。这些模型有助于研究肿瘤对包括放疗在内的特定应激源的反应。各种数学方法可以模拟由放射治疗产生的调制响应。当肿瘤细胞受到辐射时,它们启动生化反应,影响细胞周期、细胞运动性和辐射诱导的损伤修复。统计模型可用于描述细胞阶段或寿命。细胞损伤可由直接辐射暴露或由化学信号传导过程诱导的DNA损伤引起。可以采用不同的统计模型来使用实验数据模拟辐射损伤。这些计算模型可以估计细胞存活分数以及生物分子和囊泡(包括外来体)的动力学从经照射的肿瘤细胞中释放。
心脏肿瘤学研究和定制治疗的前景和局限性
放射治疗后的肿瘤的分泌物组引起炎性和免疫原性级联反应,具有增强抗肿瘤免疫监视和损害心脏稳态的潜力。因此,它的分子和功能特征将使我们能够开发治疗策略,特异性地抑制心脏毒性成分,同时保留真正的免疫原性因子,支持癌症患者放疗的全身效应。因此,值得在将来研究的是,受辐射的肿瘤是否会分泌循环分子,这些循环分子可能通过直接作用于心脏组织,或作用于免疫系统进而“攻击”心脏,或同时作用于这两种组织而易患CVD。解决这一额外的机制方面将需要在多学科管道中引入专门的心脏免疫学工具,包括互惠骨髓嵌合体、专门的基因工程小鼠模型(GEMM)和来自小鼠和人的心脏免疫细胞的公开可用数据集。在广泛的基础、转化和临床研究范围内建立大规模的协作性心脏肿瘤学项目需要集中规划、新的指导方针和政府举措。为此,国家和国际心脏肿瘤学会最近制定的路线图显示了前进的道路。在实施大规模的多学科倡议过程中,一个不可避免的挑战是,不同领域的专家“讲不同的语言”,这一事实对最终建造科学“巴别塔”构成了风险。在过去十年中,系统医学的出现为科学家和相关方提供了跨学科研究、敏捷工作、巨大网络以及在基础和转化研究、临床实践和政策制定之间建立强大相互联系的先决条件。这些因素为研究相关机制以及将研究结果应用于心脏肿瘤患者的预防措施和系统管理提供了肥沃的土壤。
述评
这篇文章深入探讨了癌症治疗相关的心脏毒性(cardiotoxicity),特别是放射治疗(radiotherapy)对心脏的影响,揭示了其复杂的细胞间通信机制和潜在的治疗意义。文章通过系统综述和多学科方法,分析了癌症治疗与心血管疾病(CVD)之间的复杂联系,强调了放射治疗不仅直接损伤心脏组织,还通过激活免疫系统和释放炎症因子间接影响心脏功能。文章指出,癌症患者的心血管疾病风险显著高于普通人群,且这种风险可能在癌症治疗后数十年内持续存在。放射治疗作为一种常用的癌症治疗手段,虽然能有效杀死癌细胞,但其诱导的心脏毒性问题不容忽视。研究发现,放射治疗后的肿瘤细胞会释放多种生物活性分子,这些分子可能通过影响免疫系统和心脏组织的稳态来促进心血管疾病的发展。此外,文章还提出了肿瘤与心脏之间可能存在远程通信的概念,这种通信可能通过循环中的因子实现,这些因子可能促进心血管疾病的发展。
文章强调了多学科合作的重要性,通过结合计算生物学、实验生物学和临床数据,可以更全面地理解癌症治疗相关的心脏毒性机制,并开发出更有效的治疗策略。研究提出了利用多组学技术(如蛋白质组学、转录组学、脂质组学等)来全面分析放射治疗后肿瘤细胞分泌组的变化,并探索其对心脏组织的影响。这种方法不仅有助于揭示潜在的机制,还为未来的研究和治疗提供了新的方向。文章的研究结果对于理解癌症治疗相关的心脏毒性具有重要意义,有助于开发新的治疗策略,以减少癌症治疗对心脏的不良影响。同时,文章也指出了现有研究的局限性,包括动物模型和体外模型在模拟人类癌症治疗相关的心脏毒性方面的不足,以及多组学数据整合和分析的挑战。这些挑战需要更先进的计算工具和方法来处理和解释复杂的数据。总体而言,这篇文章提供了一个全面的视角来理解癌症治疗相关的心脏毒性,特别是在放射治疗的背景下。通过结合多学科的方法,文章不仅揭示了潜在的机制,还为未来的研究和治疗提供了新的方向,有望改善癌症患者的长期预后和生活质量。
参考文献
Logotheti S, Pavlopoulou A, Rudsari HK, Galow AM. Intercellular pathways of cancer treatment-related cardiotoxicity and their therapeutic implications: the paradigm of radiotherapy. Pharmacol Ther. 2024 Aug:260:108670. doi:10.1016/j.pharmthera.2024.108670


