山大仇吉川/刘宏团队AM:生物正交活性微卫星工程化神经干细胞促进脑修复
时间:2025-09-11 12:14:49 热度:37.1℃ 作者:网络
创伤性脑损伤是导致长期神经功能缺陷和残疾的主要原因,常引发不可逆的神经元丢失与突触回路退化。现有常规治疗多侧重症状管理和康复,无法再生受损神经元或恢复神经功能。基于神经干细胞的疗法是潜在方案,植入的神经干细胞可分化为功能性神经元,替代受损细胞、重建神经网络,实现脑组织修复与功能恢复。但该疗法存在局限:神经干细胞向神经元分化效率低,且干细胞的迁移特性,使其难以接受需7-14天精确诱导的长期靶向调控。针对以上问题,山东大学晶体材料国家重点实验室仇吉川教授和刘宏教授团队与福建省立医院任美霞主任合作,提出将含有神经元分化调节剂GM1的透明质酸微球通过生物正交反应共价结合在神经干细胞膜表面,并通过共价作用和微球尺寸调控微球-细胞相互作用,实现其在细胞膜表面的长期稳定锚定,这些透明质酸微球像微卫星一样随神经干细胞运动迁移,在细胞周围持续释放GM1,主动调控干细胞向神经元分化,促进创伤性脑损伤修复。相关工作以“Bio-orthogonal Engineering of Neural Stem Cells with Membrane-bound Microsatellites for Enhanced Brain Repair”为题发表在Advanced Materials。

文章要点
在这篇文章中,作者提出将含神经元分化调节剂GM1的透明质酸微球作为微卫星载体,经DBCO修饰后,通过应变促进的炔烃-叠氮环加成反应,与叠氮标记的神经干细胞膜共价结合;通过调控透明质酸微球尺寸避免被干细胞内吞,实现长期稳定锚定。这些生物相容性、可降解的透明质酸微球像微卫星一样能随神经干细胞一同迁移,在细胞周围持续释放GM1,主动调控其向神经元分化,用于脑损伤修复。(图1)
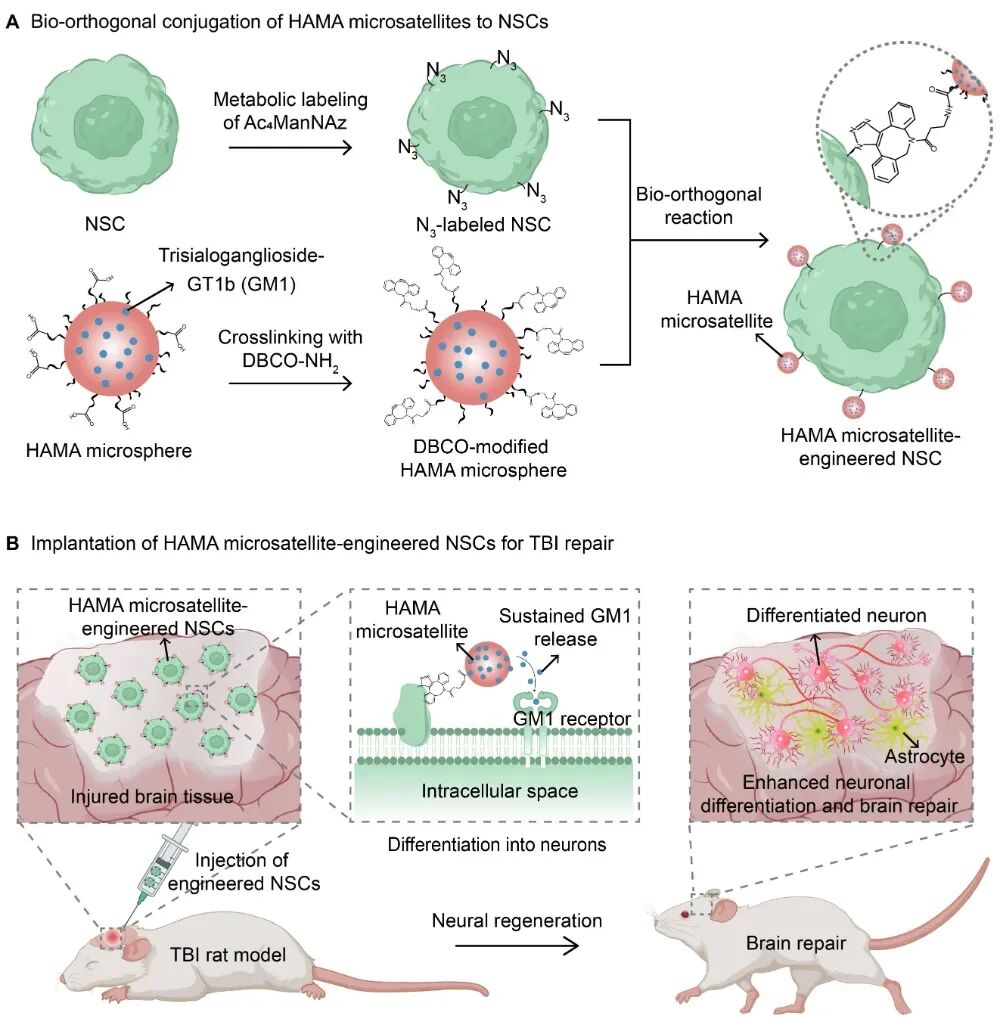
图1| HAMA微球与NSCs膜的生物正交共价结合,并调节其神经元分化和促进脑组织修复示意图
作者通过采用乳化法制备了不同尺寸的HAMA微球并通过DBCO对HAMA微球进行修饰。DBCO修饰的HAMA微球与N3标记的NSCs通过生物正交反应,显著提升结合效率,得到HAMA微卫星工程化NSCs。10.6μm的HAMA微球无法与细胞有效结合,206nm的HAMA微球会被细胞内吞,通过将微球尺寸调控到1.31μm实现了HAMA微球在细胞膜上的长期稳定锚定。(图2)细胞实验证明,这些微卫星工程化NSCs后可以随NSCs一起迁移,并在细胞周围释放调节剂GM1以促进NSCs向神经元的快速分化,微卫星工程化的NSCs在10天内向神经元分化的比例为45.1%,而未工程化微卫星的NSCs向神经元分化的比例仅有18.8%。
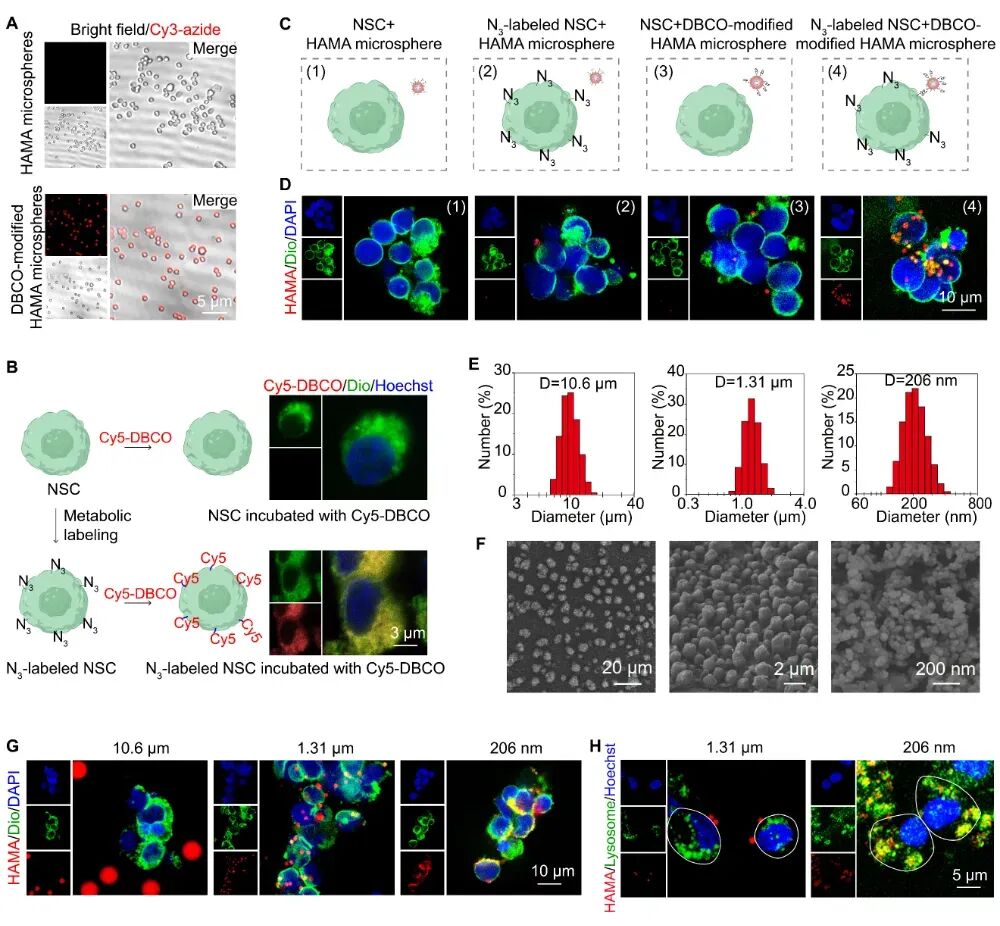
图2| HAMA微球的制备与修饰及其生物正交工程化NSCs
HAMA微卫星工程化的NSCs移植到脑损伤区域后,微卫星在细胞周围持续释放GM1,主动调控其向神经元分化,28天后TBI大鼠的脑组织明显修复,行为和认知能力也明显得到了改善。(图3)
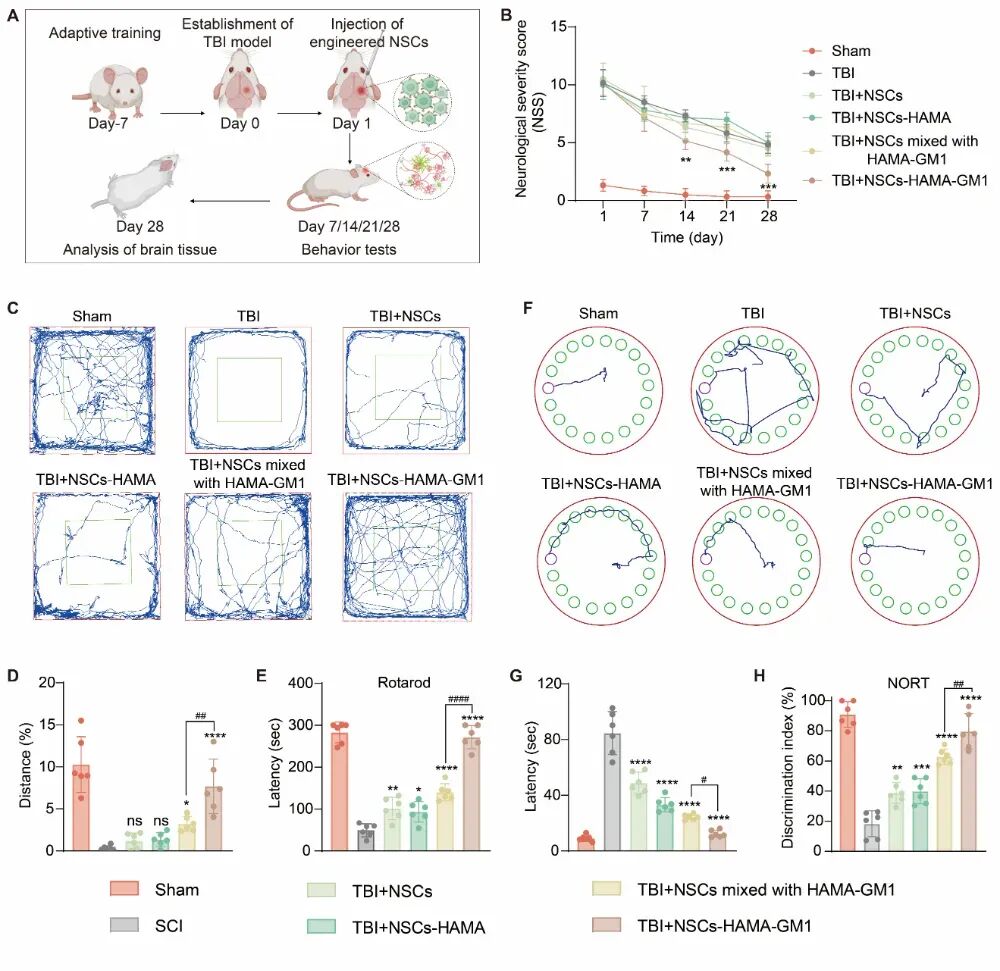
图3| HAMA微卫星工程化的神经干细胞移植后实现脑损伤修复
【结论与展望】
综上所述,作者提出了一种微载体工程化神经干细胞以促进神经元分化用于脑损伤治疗的新方法。通过生物正交反应将HAMA微球与神经干细胞膜共价结合,通过调控微球尺寸避免被干细胞内吞,实现HAMA微球长期稳定地锚定在神经干细胞表面。这些生物相容性、可降解的微卫星载体能随神经干细胞一同迁移,在细胞周围持续释放GM1,主动调控其向神经元分化。微卫星工程化的神经干细胞可以注射到损伤区域,高效地分化为神经元,用于脑损伤修复。
原文链接:
https://doi.org/10.1002/adma.202511104


