7例皮肤肌纤维瘤中6例检出PDGFRB突变 ,酪氨酸激酶驱动肿瘤家族又添新成员
时间:2025-09-13 12:12:45 热度:37.1℃ 作者:网络
PDGFRB是受体酪氨酸激酶蛋白家族众多成员之一。已知其发生变异时,是多种间叶性肿瘤的驱动突变,如血管周细胞瘤、炎性肌纤维母细胞瘤以及具有肌源性分化的肉瘤。研究者对7例皮肤肌纤维瘤进行了PDGFRB突变检测。患者包括6名女性和1名男性,年龄在2至59岁之间。肿瘤位于肩部(2例)、颈部(2例)、上臂(1例)、膝盖(1例)和小腿(1例)。临床上,这些肿瘤表现为边界不清的斑块。4例患者接受了完整切除,3例仅进行了活检。组织形态学上,这些真皮内边界不清的肿瘤由纤细的肌成纤维细胞束组成,这些细胞束常与表皮平行排列。细胞的细胞核形态单一且细长,细胞质不明显。4例可见累及表浅皮下组织。免疫组织化学显示,肿瘤表达SMA(5/7)、局灶性desmin(1/5)和CD34(4/6),而不表达S100(0/7)。通过DNA或RNA测序,在6/7例肿瘤中发现了PDGFRB激活突变。4例肿瘤在编码近膜区的第12外显子存在突变,2例在编码酪氨酸激酶区的第14外显子存在突变。测序分析结果表明,这些良性皮肤肿瘤属于酪氨酸激酶驱动的肿瘤这一广泛范畴。
研究背景
蛋白激酶相关间叶性肿瘤大多由受体酪氨酸激酶的激活改变所驱动,是一个新兴且迅速发展的肿瘤群体,包括良性、局部侵袭性和恶性肿瘤。
这类肿瘤可位于表浅部位(皮肤和皮下组织)、深部软组织和骨骼,或内脏器官,解剖部位是重要的治疗管理参数之一。受影响患者的年龄范围广泛,但年轻患者似乎更为常见。
其形态学、免疫组织化学和基因学特征范围广泛,且存在相当程度的重叠,形成了一些诊断特征:细胞类型常为(肌)成纤维细胞,细胞核形态单一。细胞包埋于纤维黏液样/玻璃样基质中,常伴有明显的中等大小(鹿角样)血管。免疫组织化学表型以CD34和S100的表达为主,但并不稳定,标记物表型极具异质性,可能造成诊断困惑。从基因学角度而言,已知许多过度激活的蛋白激酶是此类肿瘤的驱动突变。
PDGFRB及其同源物α是受体酪氨酸激酶(RTK)蛋白家族的众多成员中的两种。它们与c-KIT、集落刺激因子1受体(CSF1R)和Fms样酪氨酸激酶3受体(FLT3)同属III类家族。PDGFRA和PDGFRB发生变异时,在多种疾病中发挥作用,包括软组织肿瘤。已有报道称,在炎性肌纤维母细胞瘤中存在涉及PDGFRB的基因融合,而在脂肪纤维瘤病和肌纤维瘤病中,PDGFRA则发生替代性变异。在血管周细胞瘤中已发现PDGFRB功能获得性突变,这些肿瘤中还存在NOTCH3突变(替代性存在,或罕见同时存在),且二者具有相似的生物学效应。
基于1例索引病例,研究者在一组皮肤肌纤维瘤中发现反复出现的PDGFRB功能获得性突变作为致癌驱动因素,从而将这类肿瘤归入蛋白激酶相关肿瘤范畴。
研究结果
临床、免疫组织化学及分子检测结果见表1。共收集到7例肿瘤样本,来自6名女性和1名男性患者。患者年龄范围为2至59岁(中位数22岁,平均值23岁)。肿瘤发生部位包括肩部(2例)、颈部(2例)、上臂(1例)、腘窝(1例)和小腿(1例)。临床上,肿瘤表现为边界不清、轻度红斑样及色素沉着的斑块。4例患者接受了肿瘤切除术,3例仅行活检。经切除的肿瘤均未复发。仅行活检的肿瘤中,2例病情稳定,1例患者失访。
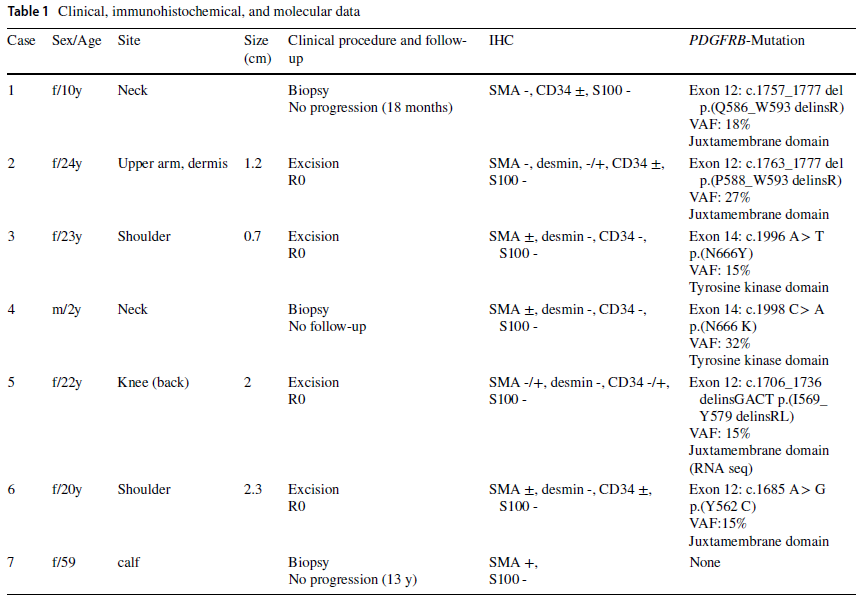
表1
组织学上,肿瘤局限于真皮内或浅表浸润至皮下组织(4例)。肿瘤由形态单一的纤细肌成纤维细胞组成,这些细胞主要呈束状排列,与皮肤表面平行。细胞核细长,染色质疏松。细胞质不明显。皮肤附属器未受累及(图1A、B,图2)。经切除的肿瘤均被完整移除。进行弹力纤维染色时,可见病变内遍布明显增粗的弹力纤维(图1C)。
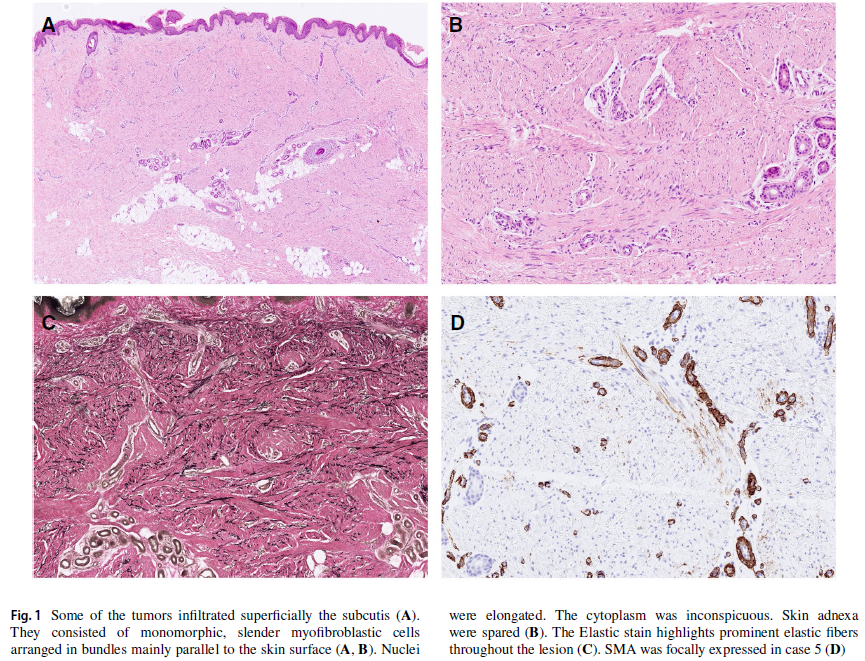
图1
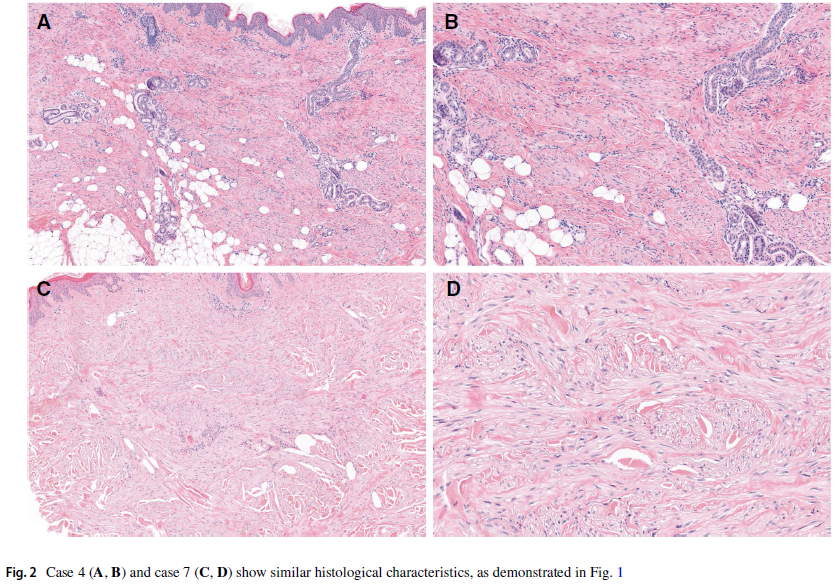
图2
免疫组织化学检测显示,5例肿瘤SMA部分阳性(图1D),2例阴性。5例肿瘤进行了结蛋白检测,其中1例局灶阳性。6例肿瘤进行了CD34染色,4例局灶阳性,2例阴性。7例肿瘤S100均为阴性。
DNA或RNA测序显示,7例中有6例存在PDGFRB点突变或框内缺失插入突变。4例突变发生在编码近膜区的第12外显子(p.(Q586_W593delinsR)、p.(P588_W593delinsR)、p.(I569_Y579delinsRL)、p.(Y562C))。2例在编码激酶区的第14外显子存在热点突变(p.(N666Y)、p.(N666K))(图2、3、4)。1例未发现PDGFRB突变。
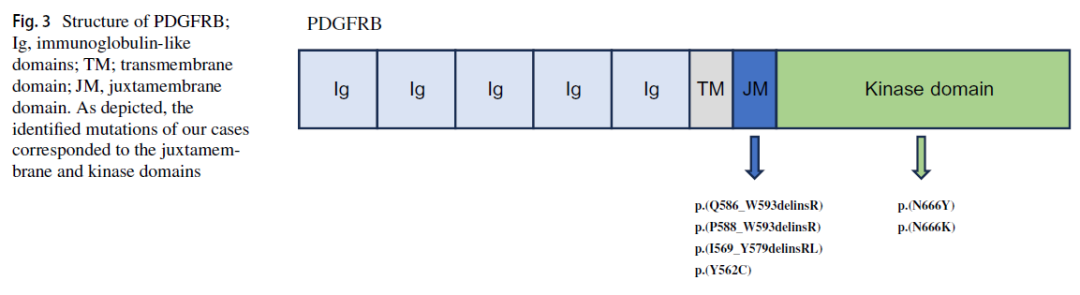
图3
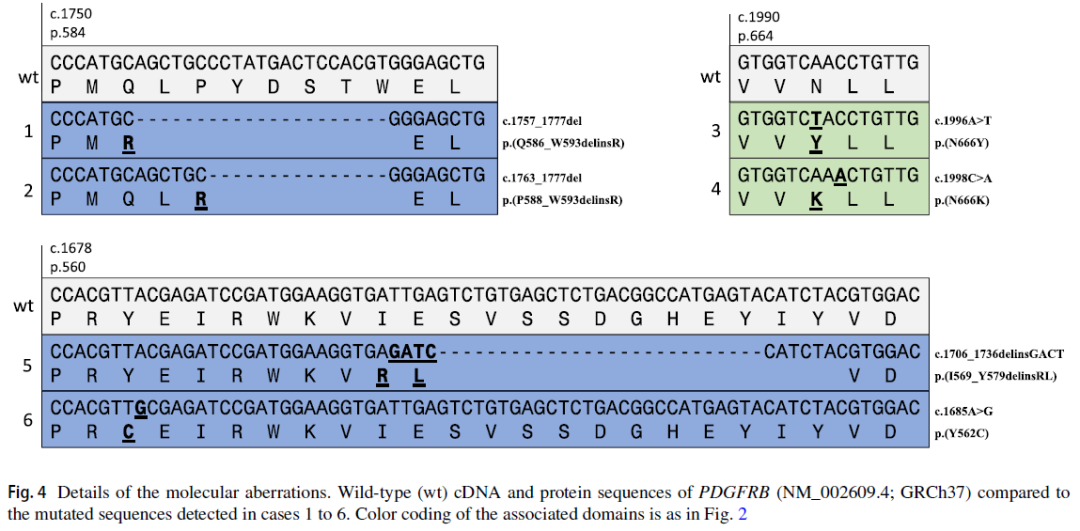
图4
讨 论
皮肤肌纤维瘤最早于1991年由Huegel报道,1992年Kamino等人也对其进行了描述,认为它是一种皮肤斑块状的成纤维细胞和肌成纤维细胞增生性病变,好发于年轻女性,尤其多见于肩带区域。不过,其发病年龄范围较广,涵盖儿童群体,甚至存在先天性肿瘤病例。有少数病例报告显示其存在多灶性。
组织学上,肿瘤边界不清,由形态一致的纤细梭形(肌)成纤维细胞组成,这些细胞排列成界限分明的细长且相互交叉的束状,主要与皮肤表面平行。细胞具有尖细或细长的正常染色质细胞核,细胞质不明显。弹力纤维得以保留,且可能比正常情况下更粗,这可作为一个诊断线索,尤其是在进行弹力纤维染色时。当肿瘤浸润至皮下组织时,可观察到与脂肪纤维瘤病或脂肪纤维瘤病样神经病变相重叠的特征,包括神经样细胞形态。皮肤附属器不受累也是皮肤肌纤维瘤及其他蛋白激酶(PK)相关肿瘤(包括隆突性皮肤纤维肉瘤)的典型特征。由于在组织形态学上与其他肌成纤维细胞病变(如斑块状肌成纤维细胞瘤)存在重叠,关于皮肤肌纤维瘤是否实际上为一个独立的病变实体一直存在争议。
免疫组织化学方面,(肌)成纤维细胞表型可通过SMA和钙调蛋白的不同表达来体现,而结蛋白和h-钙调蛋白通常为阴性。可能会观察到CD34的局灶性表达。
PDGFRB位于5q32,编码血小板衍生生长因子受体β,这是一种细胞表面酪氨酸激酶,作用于血小板衍生生长因子家族成员(包括PDGF A、B、C、D),而这些因子具有有丝分裂原的作用。PDGF结合后,受体二聚化导致酪氨酸残基自身磷酸化,并激活下游信号传导,影响细胞的增殖、分化、存活和迁移。与其他受体酪氨酸激酶一样,PDGFRB的持续激活会导致PI3K-AKT-mTOR通路的信号转导增强。功能获得性突变和融合基因会引起受体构象改变和自主激活,这在具有肌成纤维细胞/血管周细胞表型的肿瘤中已有报道。这包括多种血管周细胞瘤(遗传性和散发性)、具有恶性行为的炎性肌纤维母细胞瘤(炎性肌纤维母细胞肉瘤)、脂肪纤维瘤病以及具有肌源性分化的高级别肉瘤。
在本研究的皮肤肌纤维瘤队列中,7例肿瘤中有6例存在PDGFR第12外显子或第14外显子突变,这似乎是这种(肌)成纤维细胞肿瘤的驱动因素。所涉及的外显子分别编码近膜区和激酶区,从而影响激酶功能。本研究中检测到的所有框内缺失插入突变均发生在第12外显子,这可能会破坏近膜区的激酶抑制功能,进而导致不依赖配体的激活。相反,第14外显子的热点突变被认为通过将酪氨酸激酶区自身改变为活性构象而导致持续激活。类似的突变在多种血管周细胞瘤(包括肌纤维瘤)以及具有肌源性分化的高级别肉瘤中也有发现。肌纤维瘤也是一种形态学鉴别诊断对象。与皮肤肌纤维瘤不同,肌纤维瘤呈(多)结节状外观,具有双相模式,即存在较原始的细胞,伴有血管外皮细胞瘤样血管,以及位于典型淡蓝色基质中的成熟肌成纤维细胞。考虑到所有这些病变都属于蛋白激酶相关肿瘤群体,皮肤肌纤维瘤与脂肪纤维瘤病、脂肪纤维瘤病样神经肿瘤以及婴儿纤维性错构瘤在形态学特征上存在重叠并不奇怪。它们的共同特征是形态一致的肌成纤维细胞束,浸润皮下脂肪,而婴儿纤维性错构瘤根据定义还存在原始细胞巢。鉴别诊断中的其他蛋白激酶相关肿瘤包括隆突性皮肤纤维肉瘤的斑块期以及ALK重排的CD34阳性梭形细胞肿瘤/奖章样树突细胞错构瘤/斑块状CD34阳性真皮纤维瘤。它们也以水平排列的束状或弥漫分布的形态一致的(肌)成纤维细胞为特征,但后者因存在ALK重排而表现出强烈的CD34染色模式并伴有ALK共表达,以此可进行区分。而隆突性皮肤纤维肉瘤通常存在PDGF融合基因,但不涉及受体。与皮肤肌纤维瘤不同,鉴别诊断中的瘢痕和皮肤纤维瘤会累及皮肤附属器,且不含弹力纤维。瘢痕组织的排列更杂乱无章,而由纤维组织细胞构成的皮肤纤维瘤主要表现为放射状结构,边缘包含宽阔的真皮胶原。
其他鉴别诊断包括神经纤维瘤(CD34、SOX10和S100阳性)、神经束膜瘤(EMA、CD34和GLUT1阳性)、结缔组织痣(更硬化,CD34阳性,SMA弱阳性或阴性)、蓝痣(黑素细胞标志物阳性)、丛状纤维组织细胞瘤/丛状肌成纤维细胞瘤的成纤维细胞亚型(SMA阳性,CD34和结蛋白弱阳性或阴性)、毛平滑肌瘤和平滑肌错构瘤(平滑肌标志物阳性)以及斑块状肌成纤维细胞瘤(短束状肌成纤维细胞,坚韧的胶原束,SMA阳性,XIIIA因子阳性)。
皮肤肌纤维瘤本身并不一定需要切除,因为它们可能会自发消退,且不完全切除也不会导致病情进展或复发。在本研究患者中,有2例未进行肿瘤切除,病情也处于稳定状态。
总之,皮肤肌纤维瘤是一种良性肌成纤维细胞肿瘤,存在PDGFRB基因反复出现的功能获得性突变。这会导致受体酪氨酸激酶处于活性构象并引发肿瘤发生。因此,皮肤肌纤维瘤是蛋白激酶相关肿瘤的一个例证。
“骨与软组织肿瘤1308基因检测”项目,覆盖PDGFRB等基因的CDS区;“骨与软组织肿瘤272基因检测”项目,覆盖PDGFRB基因的部分区域(其中包括文中检出变异的第12号外显子和第14号外显子)。
参考文献:
Flucke, Uta et al. “Dermatomyofibromas harbor PDGFRB mutations - another tyrosine kinase-driven neoplasm.” Virchows Archiv : an international journal of pathology, 10.1007/s00428-025-04128-z. 19 May. 2025, doi:10.1007/s00428-025-04128-z


