人工智能影像量化参数预测≤2 cm肺结节良恶性及复发风险的临床价值
时间:2025-09-13 12:13:20 热度:37.1℃ 作者:网络
摘 要
目的 评估人工智能(artificial intelligence,AI)辅助诊断系统中影像量化参数在≤2 cm肺结节临床诊疗决策中的价值以及AI的诊断效能。方法 纳入2020—2023年大连大学附属中山医院收治的肺结节患者,利用AI辅助诊断系统提取肺结节影像参数,多因素分析筛选出鉴别良恶性、浸润性腺癌复发高风险的预测因子,建立诊断模型并评估其性能。根据病理结果,判断AI系统的诊断效能。结果 共纳入594例肺结节患者,其中男202例、女392例,平均年龄(58.75±11.55)岁。非实性结节的体积、平均CT值、3D长径是恶性结节的独立预测因子,阈值分别为287.4 mm3、−491 HU、12.0 mm。诊断效能的曲线下面积(area under the curve,AUC)由高到低分别为联合模型(0.802)、体积(0.783)、平均CT值(0.749)、3D最大径(0.714)。实性结节的平均CT值和3D长径是恶性结节的独立预测因子,阈值分别为−81 HU和17.5 mm,AUC分别为0.874和0.686,联合模型的AUC为0.957。囊腔样结节的质量是恶性结节的独立预测因子,当质量>180.7 mg时,结节更倾向恶性。非实性结节浸润性腺癌高复发风险的独立预测因子为肿瘤实性成分占比(consolidation-tumor ratio,CTR)、平均CT值、3D长径、体积,阈值分别为0.14、−386 HU、15.6 mm、1018.9 mm3,诊断效能由高到低分别为联合模型(0.788)、3D长径(0.735)、体积(0.725)、平均CT值(0.720)、CTR(0.697)。AI预测靶结节良恶性准确率为87.4%、阳性预测值96.6%、阴性预测值58.9%。结论 在≤2 cm肺结节的临床诊疗决策中,AI辅助诊断系统具有较高的应用价值。
正 文
肺癌是我国乃至全球癌症死亡的首要原因。腺癌是最常见的病理亚型,其组织学分型包括腺体前驱病变、微浸润性腺癌(minimally invasive adenocarcinoma,MIA)、浸润性腺癌(invasive adenocarcinoma,IAC),腺体前驱病变包括非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位癌(adenocarcinoma in situ,AIS)[1-4]。肺癌的病理性质与患者的预后相关,并对手术切除范围具有指导意义。对于长径≤2 cm的AAH、AIS或MIA,亚肺叶切除即可,其10年生存率接近100%;而对于含有磨玻璃成分的直径<2 cm的IAC,Ⅰ期完全切除后的5年复发率高达10%~30%[5-6];存在高级别结构(微乳头或实体成分)和病理高危因素的IAC,亚肺叶切除是其局部复发的独立预测因子[7]。因此术前病理学亚型精准判断对于制定术式及后续治疗非常关键。
随着影像技术的发展和肺癌筛查的普及,直径≤2 cm、无症状肺结节在临床中大量涌现。指南[8-9]指出,直径>2 cm的结节恶性概率显著升高(>65%),建议手术,而≤2 cm的结节不确定性大,处于临床决策的“灰色地带”,其诊疗决策仍需依赖多模态评估。但传统影像存在测量和主观偏差,故对早期肺癌预测价值受限[10];病理活检诊断准确率更高,但也有一定局限性。一项Meta分析[11]显示,超声引导下内镜穿刺技术对直径≤2 cm病灶的诊断率仅为61%。术前诊断性穿刺活检对直径<1 cm肺结节的准确率为72.5%[12]。术中冰冻活检对AIS和MIA的准确率分别为59%和46%[13],对微乳头型和实体型的敏感性仅为37%和69%[14],给术前和术中诊断以及合理临床决策带来了挑战。
综上,术前如何可靠地判断肺结节的病理性质,继而指导临床决策缺乏标准,尚未达成共识。近年来,AI可提取结节微观形态和纹理特征进行三维(three dimension,3D)量化分析,客观、准确反映其影像学特点,可重复性高,从而进一步提高术前对肺结节的评估准确性[15]。本研究旨在探讨利用基于AI的3D量化参数预测≤2 cm肺结节良恶性和高复发风险类型的临床价值以及AI诊断肺结节的准确性,进而探讨指导手术规划的可能性。
1 资料与方法
1.1 临床资料和分组
纳入2020—2023年在大连大学附属中山医院胸外科接受肺结节(≤2 cm)切除术的患者。所有结节具有明确病理结果,部分患者表现为多发结节,仅纳入危险性最高的主病灶进行分析。纳入标准:(1)具有完整的肺部医学数字成像和通信(DICOM)影像数据;(2)具有完整人口学、病理等临床资料;(3)术前CT扫描至手术时间间隔不超过1个月。排除标准:(1)既往接受过肺部手术或合并肺部疾病,且影响分析者;(2)术前有化疗或胸部放疗史者;(3)既往有其他部位恶性肿瘤病史且不能排除转移者;(4)图像有影响结节观察的运动伪影或金属伪影,结节边缘难以勾画者。
病理诊断参照2021年世界卫生组织(World Health Organization,WHO)肺腺癌病理分类标准和国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)分级系统[3-4]。根据预后和既往研究[7,16],将良性结节、AAH和AIS归为良性组,MIA和IAC归为恶性组;再按主要病理亚型和复发风险,将恶性结节分为低危组(中高分化腺癌)和高危组(包括低分化腺癌、含有气腔播散、脉管侵犯、胸膜侵犯、淋巴结转移者)。
1.2 影像评价
1.2.1 检查方法和图像分析
术前接受胸部薄层高清CT扫描,读片前对数据脱敏处理。为减少误差,图像分析由2名影像科和1名胸外科医师共同诊断、分析和记录,计量资料由3名医师测量后取平均值。结节直径:影像中最大横截面积的长径;实性结节:在CT影像中仅含有实性成分。非实性结节:含有或仅有磨玻璃成分。
1.2.2 图像处理
DICOM数据传输到AI系统(InferRead CT Lung-LA,4.0版本,推想医疗科技股份有限公司)。自动识别标记结节,勾画结节3D边界,提取结节的CT纹理组学定量参数,包括结节体积、表面积、质量、3D长径、平均CT值、肿瘤实性成分占比(consolidation-tumor ratio,CTR),根据深度学习模型,计算恶性概率预测值,当恶性概率预测值≥70%时判断为高危结节(图1)。
1.3 统计学分析
采用SPSS 23.0和R 4.3.0统计软件分析。符合正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数(上下四分位数)[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验;计数资料以例(%)表示,组间比较用χ2检验或Fisher确切概率法。
将单因素分析中P≤0.05的参数纳入多因素二元logistic回归分析,采用非条件双向逐步逻辑方法,逐步去除自变量,以消除多重共线性,避免过度拟合,确定最佳独立预测因子,并绘制定量资料的受试者工作特征(receiver operating characteristic,ROC)曲线,计算最佳阈值,建立联合诊断模型,以曲线下面积(area under the curve,AUC)评定各变量诊断效能。双侧检验α=0.05。
1.4 伦理审查
本研究经大连大学附属中山医院医学伦理委员会批准,批准号:KY2023-216-1。
2 结果
2.1 患者一般资料
2020—2023年,806例患者接受肺结节手术,共切除结节1017个。根据纳入和排除标准,594例患者纳入研究,共切除751个肺结节。其中男202例、女392例,平均年龄24~82(58.75±11.55)岁。
594个靶结节中,纯磨玻璃结节(pure ground-glass nodule,pGGN)208个,占比35.0%;混合磨玻璃结节(mixed ground-glass nodule,mGGN)204个,占比34.3%;实性结节141个,占比23.7%;囊腔样结节41个,占比6.9%。恶性结节占比76.1%,其中腺癌447例、鳞状细胞癌(鳞癌)2例、小细胞癌3例。良性结节占比23.9%,分别为前驱病变53例,炎性病变、错构瘤、肺结核等89例。
2.2 非实性结节良恶性分析
除外囊腔灶的412例非实性结节中,良性组(n=71,17.2%)和恶性组(n=341,82.8%)患者在年龄、性质、体积、质量、表面积、3D长径、平均CT值、CTR方面,差异均有统计学意义(表1)。多因素分析显示,体积、平均CT值和3D长径是恶性结节的独立预测因子(表2)。
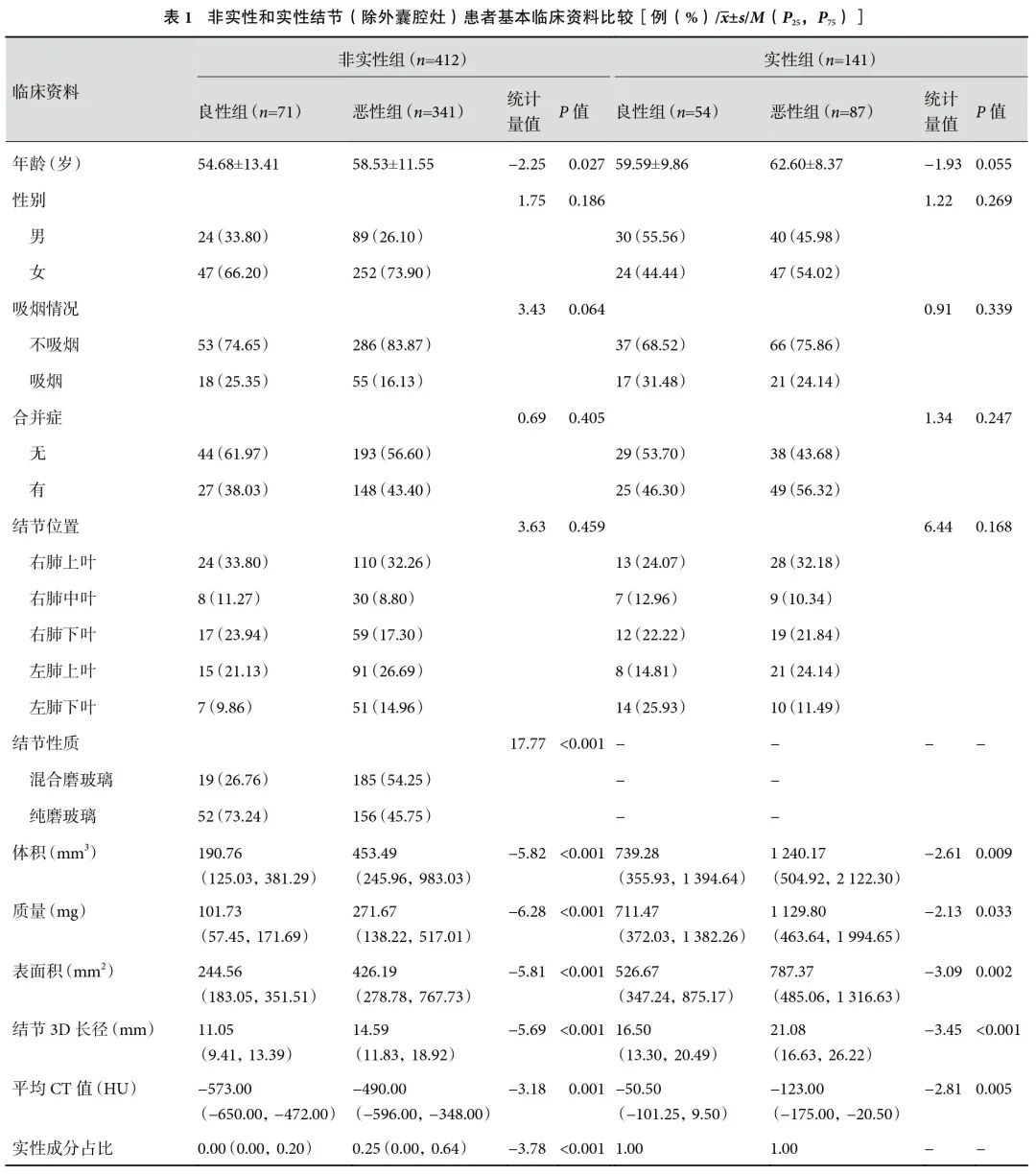
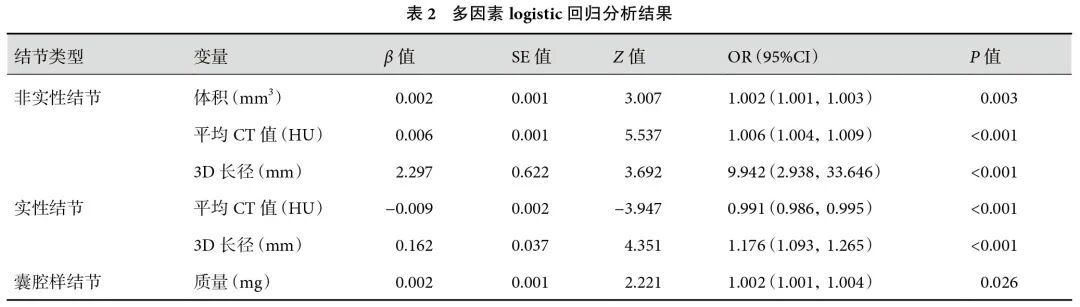
将独立预测因子纳入ROC曲线,计算其阈值,结节体积为287.4 mm3、平均CT值为−491 HU、3D长径为12.0 mm。根据AUC值,诊断效能依次为:结节体积(0.783)>平均CT值(0.749)>3D最大径(0.714)。联合模型的AUC=0.802,敏感性为85.9%,特异度为65.7%,预测效能最优(表3,图1)。
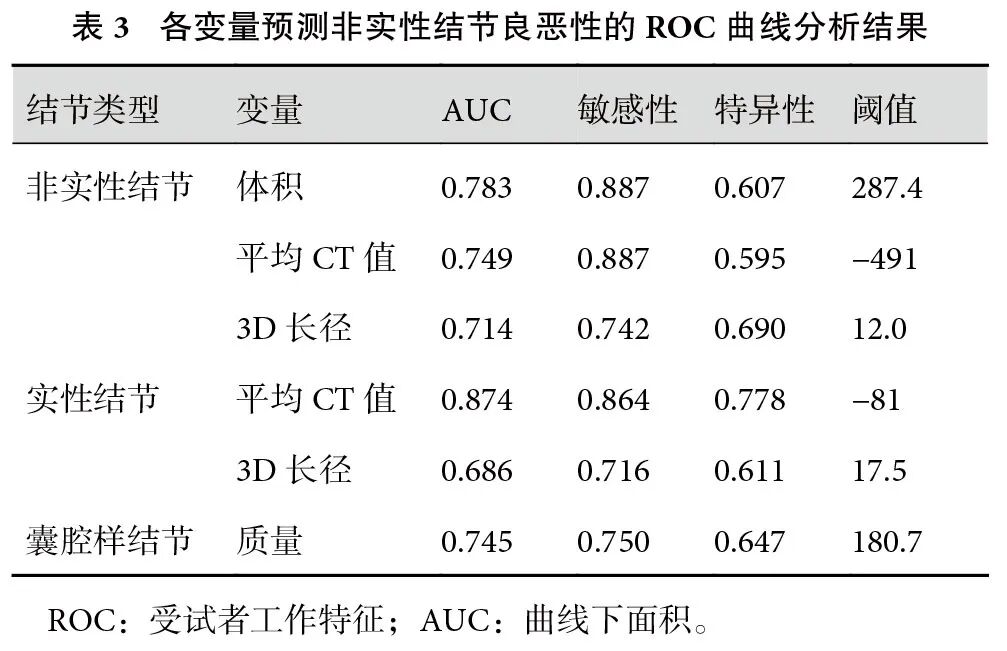
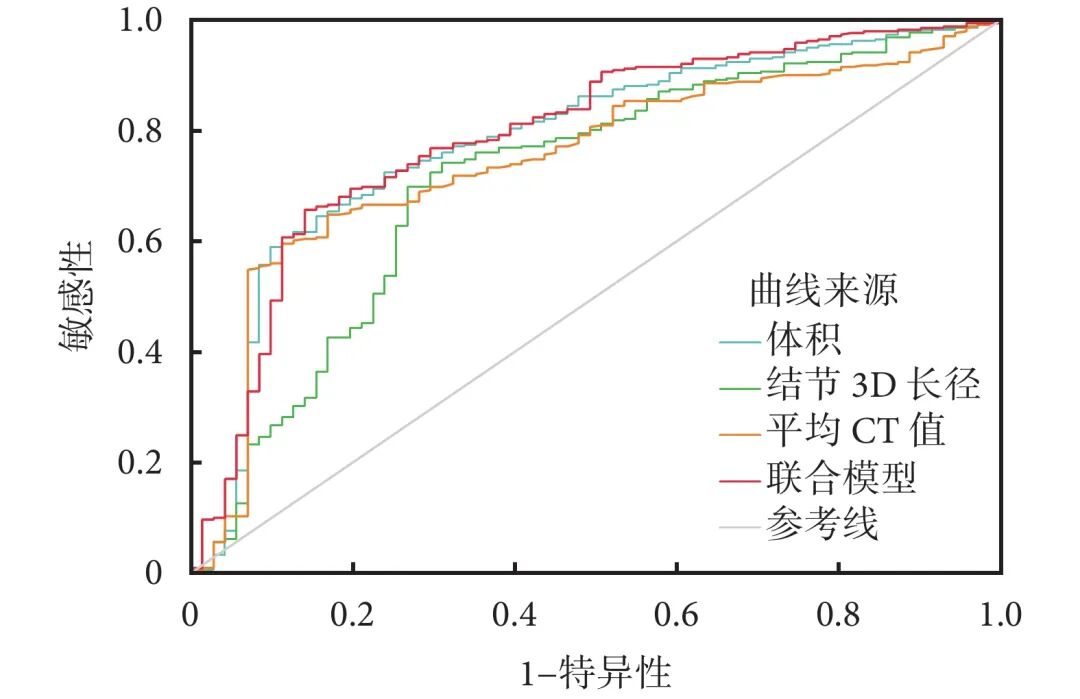
图1 各变量及联合模型预测非实性结节良恶性的受试者工作特征曲线
2.3 实性结节良恶性预测
在实性结节患者中,良性组(n=54,38.3%)和恶性组(n=87,61.7%)患者结节体积、质量、表面积、3D长径、平均CT值差异均有统计学意义(P<0.05),除平均CT值外,恶性结节的量化参数均显著大于良性结节(P<0.05,表1)。多因素分析显示,3D长径和平均CT值是恶性结节的独立预测因子(表2)。
ROC曲线分析显示,当结节3D长径>17.5 mm、平均CT值<−81 HU时,恶性可能性大,其平均CT值(AUC=0.874)的诊断效能优于3D长径(AUC=0.686,表3)。联合模型的AUC=0.957,敏感性为94.4%,特异度为87.5%,预测效能最优(图2)。
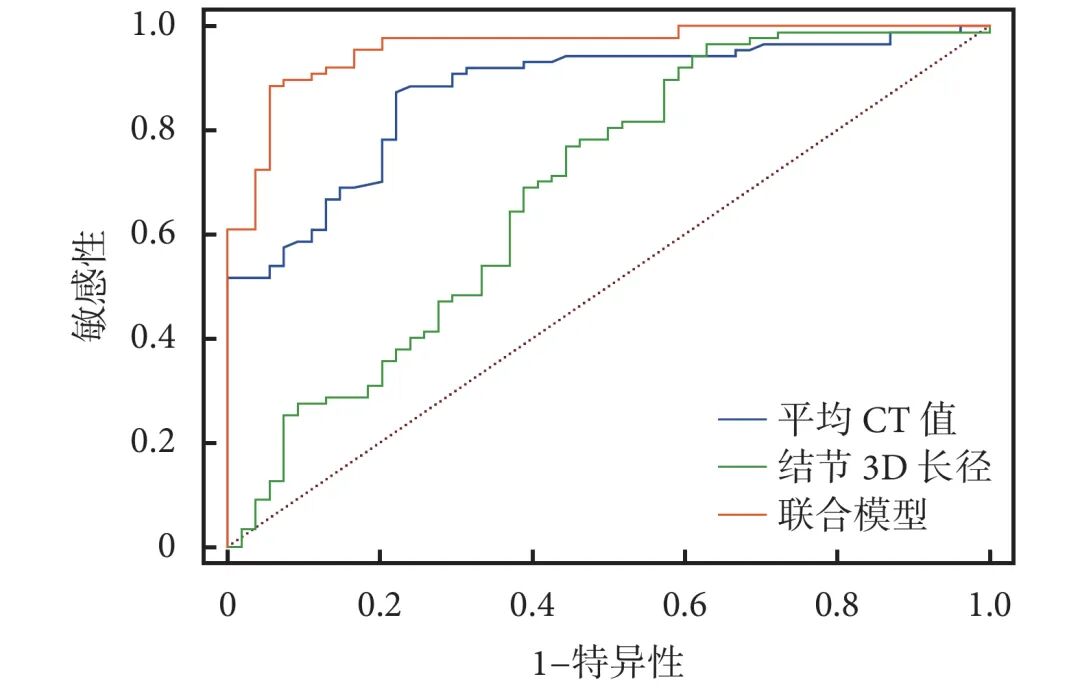
图2 各变量及联合模型预测实性结节良恶性的受试者工作特征曲线
2.4 囊腔样结节良恶性预测
在囊腔样结节患者中,良性组(n=17,41.5%)和恶性组(n=24,58.5%)患者在结节体积、质量、表面积、3D长径方面差异有统计学意义,恶性结节的AI量化参数均大于良性结节(P<0.05,表4)。
多因素分析显示,质量是囊腔样恶性结节的独立预测因子(表2)。ROC曲线分析显示,当结节质量>180.7 mg时,恶性可能性越大(表3)。
2.5 浸润性腺癌复发风险预测
由于鳞癌和小细胞癌病例数仅5例,且在术中病理表现上同腺癌区分较大,故未纳入讨论。表现为非实性结节的IAC患者中,低危组(n=315,92.4%),高危组(n=26,7.6%)。在主要病理亚型中,贴壁型为主202例,腺泡/乳头型为主124例,实体/微乳头型为主6例,粘液腺癌8例,复杂样腺体1例。同时,胸膜侵犯5例,气腔播散10例,脉管侵犯1例。
非实性IAC患者中,低危组和高危组结节性质、体积、质量、表面积、3D长径、平均CT值、CTR差异均有统计学意义(表5)。多因素回归分析显示,CTR、平均CT值、3D长径和体积是复发的独立危险因素(表6)。ROC曲线分析显示,当CTR>0.14、平均CT值>−386 HU、3D长径>15.6 mm、体积>1018.9 mm3时,具有高危病理学因素的可能性更高。根据AUC值,诊断效能依次为结节3D长径(0.735)>体积(0.725)>平均CT值(0.720)>CTR(0.697)。联合模型的AUC=0.788,敏感性为88.5%,特异度为63.2%,预测效能最优(图3)。
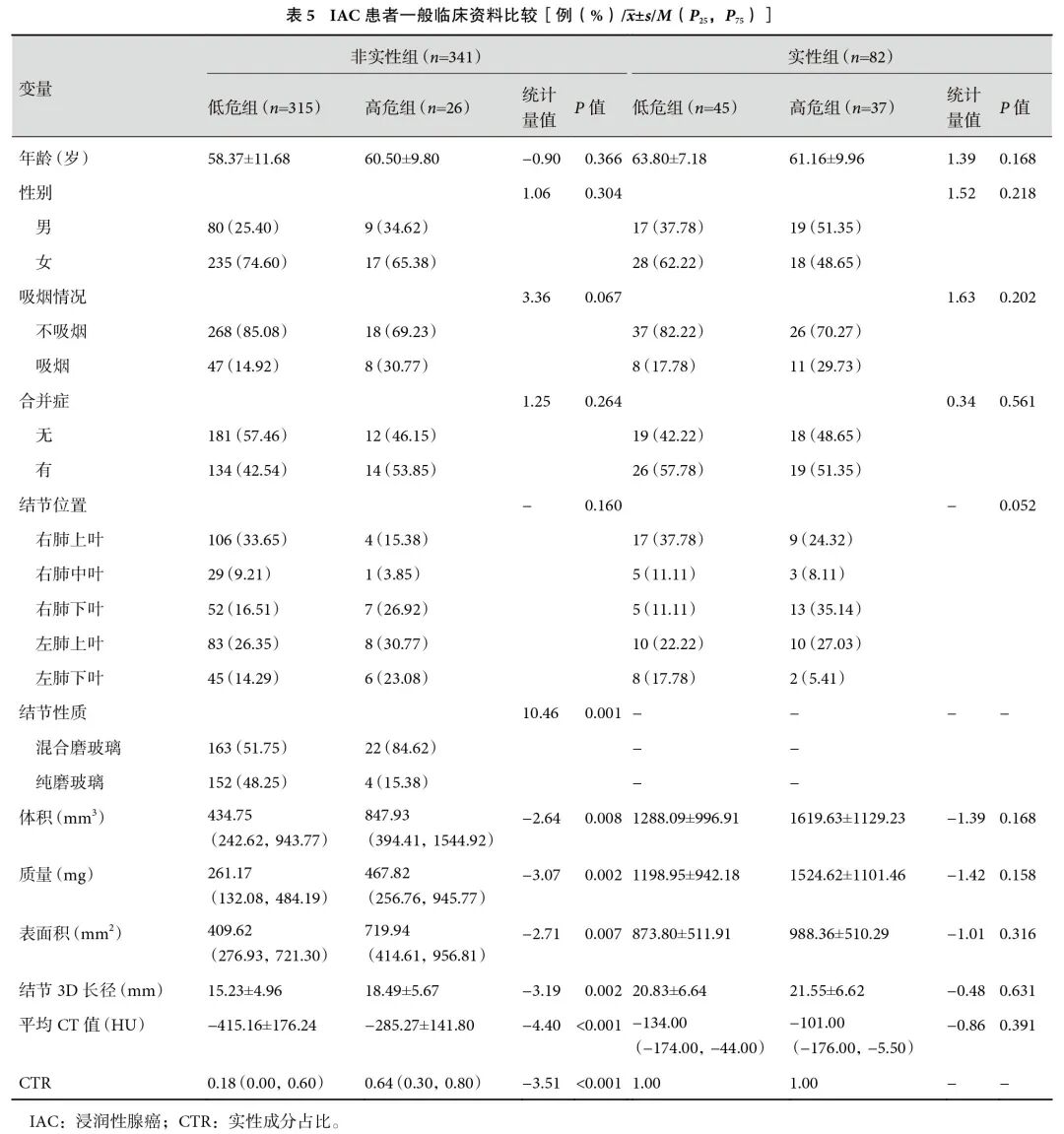
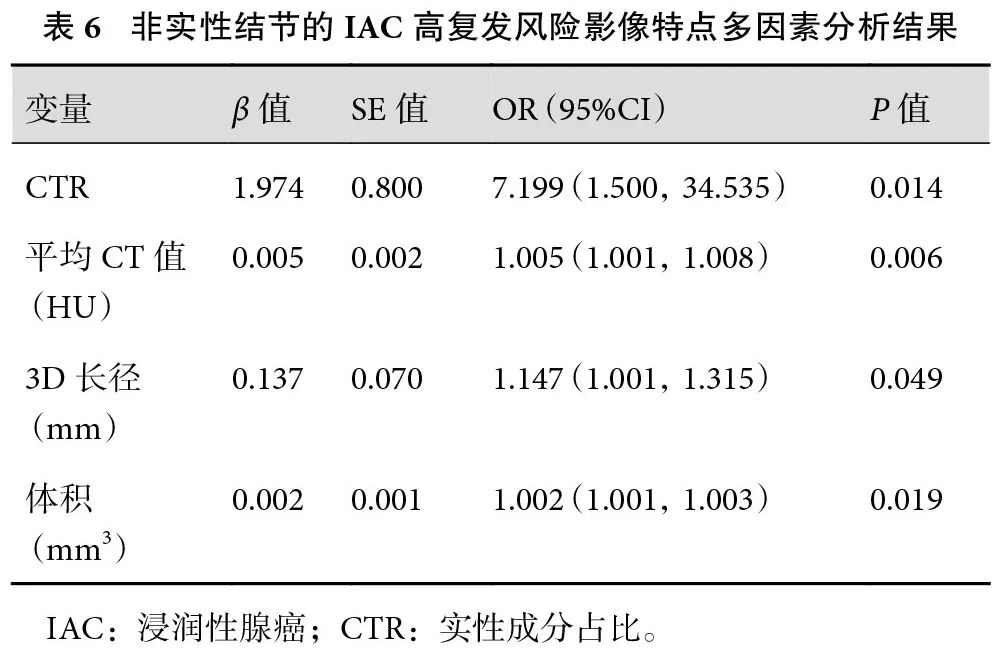
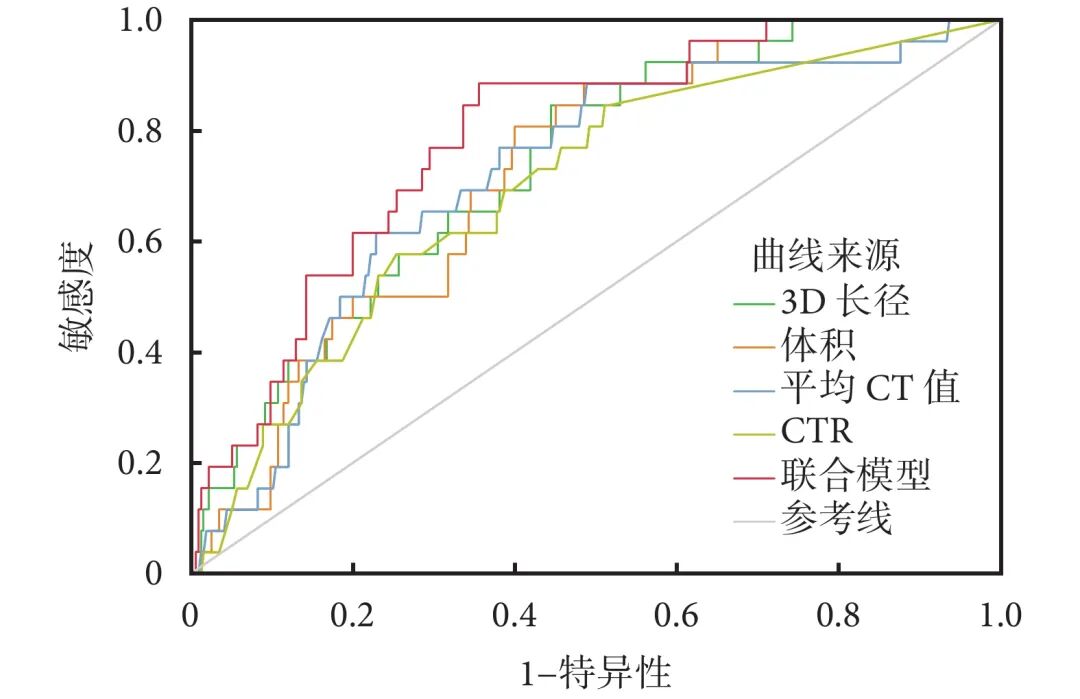
图3 各单一预测因子和联合模型预测复发高风险肺腺癌的ROC曲线
ROC:受试者工作特征;CTR:实性成分占比。
2.6 人工智能辅助诊断系统的诊断效能
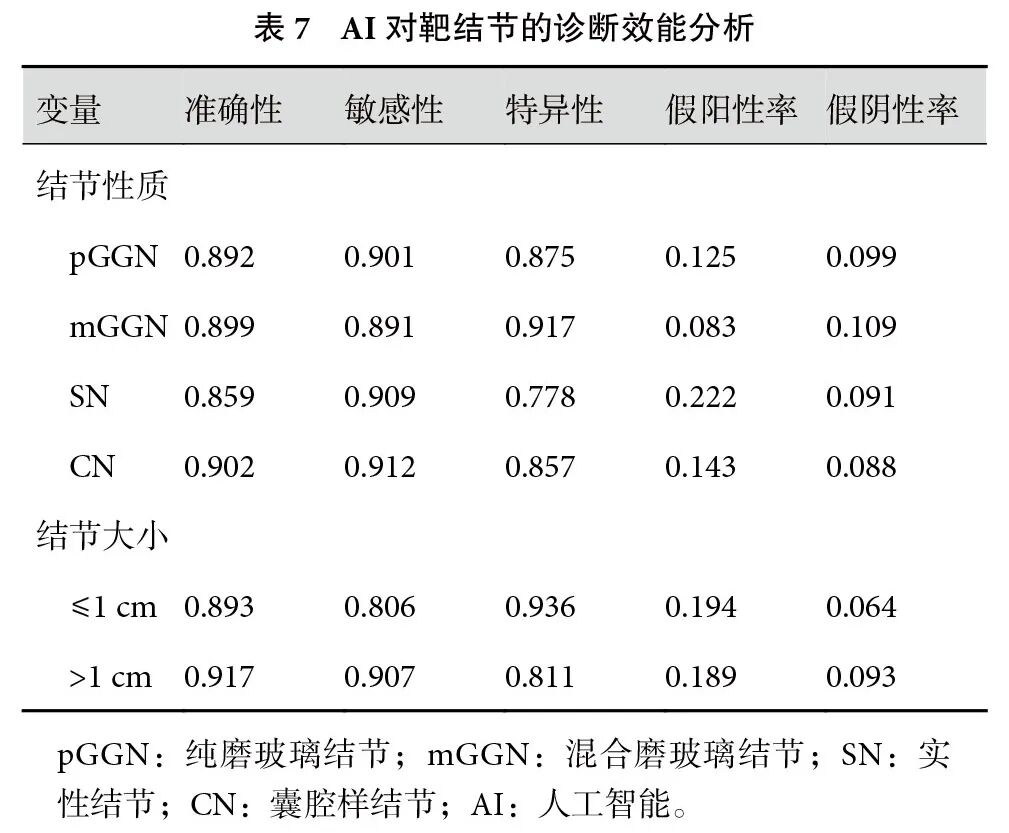
针对结节良恶性判断,AI诊断的准确率为87.4%,假阳性率为14.6%,假阴性率为12.3%,阳性预测值为96.6%,阴性预测值为58.9%。
针对结节的不同性质,AI诊断囊腔样结节的准确率最高,为90.2%,亚实性结节次之;根据结节不同大小,AI诊断>1 cm的结节准确率为91.7%,≤1 cm结节为89.3%。总体上,AI对小结节的诊断效能较好(表7)。
3 讨论
早诊早治可显著提升肺癌患者的预后[5-6]。对于良性结节及前驱病变,定期随访即可;对于MIA及部分中高分化早期腺癌,亚肺叶切除可取得较好预后,同时有利于保护肺功能和减少并发症;而对于含有微乳头/实体亚型、气腔播散、胸膜或脉管侵犯等高危因素肺腺癌患者而言,亚肺叶切除是局部复发的独立预测因子,故推荐肺叶切除[16-18]。因此,有必要在术前准确判断结节的性质,制定个体化方案,避免过度诊疗或切缘不够导致复发风险增加。胸部CT特征可初步区分肺结节[19-21],但因缺乏明显的临床特征和影像标志,肺结节诊断仍具挑战。AI诊断系统为这一难题提供了有力辅助。
研究[22-23]表明,pGGN多为良性病变或AAH、AIS,而mGGN更倾向浸润性生长,而发展为MIA或IAC。本研究发现pGGN多为非浸润性病变(73%),mGGN半数以上为浸润性病变(54%)。Hattori等[24]纳入432例GGN和239例实性结节,中位随访时间为10.1年,发现不论磨玻璃成分多少,其预后均优于实性结节组。本组数据显示,表现为实性结节的IAC中,具有高复发风险因素的占比为45.1%,而非实性结节IAC中,高复发风险占7.6%,其中,以mGGN(185例)和pGGN(156例)为表现的IAC中,高复发风险占比分别为11.9%和2.6%,说明实性成分越多的IAC,复发风险越高,但即使在总体预后较好的pGGN中,也存在预后较差的病理因素,此时,亚肺叶切除将不适合,应扩大切除范围。
有研究[25-26]显示,结节最大径是浸润性癌的独立预测因子。在鉴别IAC的长径阈值方面,Ding等[27]的研究表明,pGGN和mGGN中AIS、MIA与IAC直径的阈值分别为12.0 mm和15.4 mm。在本研究中,无论在亚实性、实性还是囊腔样结节中,恶性结节的直径均显著大于良性结节,且高危组IAC的直径也大于低危组。当非实性结节3D长径>12.0 mm时,更倾向恶性结节,而15.6 mm是具有复发高风险因素IAC的阈值,原因可能是浸润性或低分化癌生长更快。
另有研究[28-29]显示,CT值是肺癌侵袭性的另一重要因素,其可量化结节内的实性成分。平均CT值与肿瘤细胞侵犯肺组织所导致的肌成纤维细胞基质厚度增加有关,肿瘤侵袭性越强,其平均CT值也越高,预示着预后较差。
本组数据显示,在非实性结节中,平均CT值、3D长径是鉴别良恶性的重要因素,且恶性结节的平均CT值、3D长径均大于良性结节,阈值分别为−491 HU、12.0 mm。有学者[30]认为,直径>10.5 mm、平均CT值>−452 HU是IAC的独立危险因素。在顾鑫蕾等[31]的研究中,当平均CT值≥−507 HU、肺窗最大径≥14.5 mm时,诊断IAC的可能性更大。结果间的不同可能是由于纳入的结节直径不同,且本研究把MIA归到IAC中。在实性结节中,平均CT值和3D长径同样是鉴别良恶性的重要因素,当结节3D长径>17.5 mm、平均CT值<−81 HU时,恶性可能性越大。而在低危组和高危组实性IAC中,AI量化参数差异无统计学意义,考虑样本量小所致。但高危组参数明显大于低危组,原因可能为表现为实性结节的IAC,大多为低分化癌,恶性程度高,常有多种病理高危因素。另有研究[32]表明,结节平均直径和平均CT值是低分化IAC的独立预测因子,其阈值分别为16.9 mm和−251.1 HU,结节直径与本研究结果相近,但平均CT值有一定出入,可这能与文献[32]排除了pGGN,而本研究排除了实性结节有关。
目前,CTR被广泛用于肺结节浸润性评估,并辅助选择手术方式。研究[33]表明,无论是肿瘤直径≤2 cm、CTR≤0.25的腺癌,还是肿瘤直径≤3 cm、CTR≤0.5的腺癌,行亚肺叶切除的5年总生存率分别为97.1%和96.7%。一项研究[31]显示,在除外囊腔灶的结节中,CTR≥70.5%、平均CT值>−106 HU时,更倾向微乳头/实性为主型IAC。张潇文等[34]发现,CTR≥25%、平均CT值>−283.95 HU时更倾向于中、低分化腺癌,其纳入的结节仅为mGGN。但是,本研究发现,在鉴别表现为非实性结节的IAC是否存在高复发风险时,AI量化指标平均CT值的预测价值较CTR更高(AUC,0.720 vs. 0.697)。
质量和体积也可视为鉴别肺腺癌病理性质的预测因子,质量融合了体积和密度两个维度,相较于直径,能更全面和客观地评估肺结节的特性,有助于辨别肺腺癌的浸润性和分化水平。本组数据显示,针对囊腔样肺结节,恶性结节的质量、体积、表面积、3D长径均高于良性结节,而质量是独立预测因子,当质量>180.7 mg时,结节更倾向恶性。在Chen等[35]研究中,体积和实性成分比例是鉴别腺癌浸润性的重要指标,其阈值分别为447.75 mm3、0.403。在本研究中,体积阈值为287.4 mm3,产生差异的原因是Chen等[35]纳入2~3 cm的结节,会拉大整体结节体积均值。本研究还发现,当体积>1018.9 mm3时,具有高危病理学因素的IAC可能性更高。
结合其他研究[36],我们发现AI 3D量化参数能全面捕捉结节的整体内部特性,3D指标受结节形态或实性成分分布的影响较小,且不受主观人为因素影响。目前已有研究[37-39]证实AI量化参数鉴别肺结节病理亚型的价值,但纳入病理高危因素预测肺腺癌复发风险的研究有限,其价值有待进一步验证。对于肺癌病理性质的判断,应综合临床、影像、血液等指标综合判断。AI软件对mGGN中实性成分的界定以及实性成分体积测量无统一标准,未来需要更多研究来指导标准的制定。
本研究的局限性:定量参数可受到CT仪器及AI系统参数的影响;高复发风险IAC亚型病例较少,两组样本不平衡;未纳入CT影像特征参数(如分叶征、毛刺征等)、纹理特征(如变异系数和熵等)进行评价;单中心研究,样本量略小。
本研究较为全面地分析了≤2 cm肺结节AI 3D量化参数与病理性质的关系,可在诊断中起到辅助作用。在病变较小、病理标本有限的情况下,AI辅助诊断系统的数据,同术中病理结果和其他因素一同能够指导手术规划。
利益冲突:无。
作者贡献:马钰杰负责查阅资料,收集、分析与解释数据,撰写论文初稿,对审稿意见进行解答,对论文进行修改;游雨禾、曹文军、薛洪省负责论文数据整理与分析;朴哲负责修改论文;赵志龙负责选题,论文设计、审阅及修改。


