临床研究|牙髓间充质干细胞治疗自身免疫性肝炎小鼠模型的效果及其免疫调控机制
时间:2025-08-28 12:10:51 热度:37.1℃ 作者:网络
自身免疫性肝炎(AIH)是一种由自身免疫异常导致的肝脏炎症性疾病,多发于女性,其临床表现通常为转氨酶升高、自身抗体如抗核抗体及平滑肌抗体等检测阳性、IgG水平升高,病理方面表现为巨噬细胞和浆细胞增多,肝组织中淋巴细胞浸润形成界面性肝炎。现有AIH的一线治疗为糖皮质激素(泼尼松/泼尼松龙)联合硫唑嘌呤。然而,有20%患者对标准治疗应答不佳,且长期使用可导致骨质疏松、代谢综合征等疾病发生;同时,基线碱性磷酸酶升高者停药后复发风险增加,需终身监测。
间充质干细胞(MSC)最早在成人骨髓中被发现,是一种黏附的成纤维细胞样群体。MSC具有与多种免疫系统细胞相互作用的免疫调节特性,包括对T细胞、B细胞、树突状细胞和自然杀伤细胞等的免疫抑制作用。当暴露于炎症环境中时,MSC可以通过释放多种介质(包括免疫抑制分子、生长因子、外泌体、趋化因子、补体成分和各种代谢产物)来协调局部及全身的先天性和适应性免疫反应。牙髓间充质干细胞(DPSC)作为一种独特的干细胞来源,正在被探索用于细胞医学、组织再生和各种疾病的组织工程。DPSC可通过分泌IL-10、转化生长因子(TGF)-β等抗炎因子抑制T细胞活化,并分化为肝细胞、成骨细胞等多种功能细胞。在治疗机制上,DPSC主要通过抑制增殖活化的淋巴细胞和促进调节性T细胞(Treg)的形成。体外研究表明,PHA-CD3+T细胞相关的旁分泌机制中的可溶性因子和细胞因子等具有免疫抑制效应。
刀豆蛋白A(ConA)诱导的小鼠肝炎是经典的T细胞依赖性肝炎模型。该模型在临床表现和组织病理学特征(如肝细胞坏死、炎症细胞浸润)方面与人类AIH高度相似。静脉注射ConA后,活化的T细胞和巨噬细胞会释放大量炎症因子[如肿瘤坏死因子(TNF)-α、干扰素(IFN)-γ、IL-6],导致肝损伤,表现为血清ALT和AST显著升高,这些指标变化同样是人类AIH的重要特征。已有研究表明在小鼠模型中DPSC在逆转肝脏炎症和逆转肝纤维化方面与脐带血来源的MSC有类似的治疗效果。另一项研究也揭示了DPSC在体内具有抗纤维化和抗炎作用以及促进肝源性相关肝再生的作用。本研究旨在通过体内外实验验证DPSC对自身免疫性肝损伤小鼠模型的疗效及其免疫调控作用机制。
1材料与方法
1.1 实验动物、材料和仪器
实验动物选用质量20~25 g的雄性8周龄BALB/C小鼠32只,均购自上海灵畅生物科技有限公司,实验动物生产许可证号:SCXK(沪)2023-0003,动物使用许可证号:SYXK(沪)2020-0034。牙髓来源于患者捐赠。药品生产质量管理规范(GMP)级MSC无血清培养基购自友康生物科技(北京)股份有限公司;GMP级MSC无血清培养基添加剂购自友康生物科技(北京)股份有限公司;外周血单核细胞(PBMC)购自浙江自贸区迈顺生物科技有限公司;羧基荧光素琥珀酰亚胺酯(CFSE)细胞增殖试剂盒购自美国Thermo Fisher;DxFLEX流式细胞仪购自美国贝克曼公司。anti-CD34、anti-HLA-DR、anti-CD45、anti-CD90、anti-CD105、anti-CD73、anti-CD8、anti-IFN-γ、anti-IL-17A、anti-CD25和anti-FoxP3均购自美国Biolegend公司。三系分化培养基及其添加物购自加拿大Stemcell公司。丝裂霉素C购自美国Sigma公司。
1.2 DPSC的分离与培养
取出患者捐赠牙齿中的牙髓后进行消化和培养,培养液为包含GMP级MSC无血清培养基添加剂的GMP级MSC无血清培养基。
1.3 细胞表型测试
将DPSC重悬于PBS溶液中,细胞密度调整为2×106个/mL,分成6管,每个待测管中加入200 μL细胞悬液,分别加入anti-CD34、anti-HLA-DR、anti-CD45、anti-CD90、anti-CD105和anti-CD73,室温孵育20 min。孵育结束后PBS洗2次,行流式细胞仪检测,以上实验均需避光操作。
1.4 三系分化检测
成骨分化:将DPSC按每孔5×104个细胞加入六孔板中,置于培养箱中直至细胞汇合度达到约70%,吸弃干细胞培养基,加入成骨分化培养基(4倍体积基础培养基+1倍体积的添加物),继续培养,每3天更换一次培养基,直至显微镜下观察到骨基质形成,使用茜素红进行染色观察。
成脂分化:将DPSC按每孔5×104个细胞加入六孔板中,置于培养箱中直至细胞汇合度达到约100%,吸弃干细胞培养基,加入成脂分化培养基(4倍体积基础培养基+ 1倍体积的添加物),继续培养,每3天更换一次培养基,直至显微镜下观察到油滴,继续培养6天,使用油红O染色。
成软骨分化:取消化后的DPSC约5×105个细胞离心并重悬于成软骨分化培养基(4倍体积基础培养基+1倍体积的添加物)中,将含细胞的离心管置于培养箱中培养,每3天进行一次半换液,直至细胞形成软骨球后切片,使用阿利新蓝染色。
1.5 辅助性T细胞(Th)1、Th17增殖抑制实验
空白刺激组在12孔细胞培养板中加入PBMC、PHA(总浓度2.5 μg/mL)、IL-2(终浓度50 U/mL),实验组将DPSC接种六孔板过夜孵育后加入终浓度5 μg/mL的丝裂霉素C处理2 h,与PBMC共孵育48~72 h,加入终浓度2.5 μg/mL的PHA作为刺激剂培养4~6 h后,收集细胞悬液离心后重悬,加入anti-CD3、anti-CD4、anti-CD8室温避光孵育20 min,PBS清洗2次,加入固定破膜液,2~8 ℃避光孵育20 min,破膜液清洗2次,加入anti-CD3、anti-CD4、anti-CD8、anti-IFN-γ和anti-IL-17A,2~8 ℃避光孵育30 min,孵育结束后使用破膜液清洗2次,PBS重悬,进行流式细胞仪检测。
1.6 Treg增殖促进实验
单培养组在12孔细胞培养板中加入PBMC,共培养组将DPSC接种六孔板过夜孵育后加入丝裂霉素C处理2 h,与PBMC共孵育48~72 h,收集细胞悬液离心后重悬,加入CD3、CD4、CD25室温避光孵育20 min,PBS清洗2次,加入固定破膜液,2~8 ℃避光孵育45 min,破膜液清洗2次,加入anti-CD3、anti-CD4、anti-CD25和anti-FoxP3,2~8 ℃避光孵育30 min,孵育结束后使用破膜液清洗2次,PBS重悬,进行流式细胞仪检测。
1.7 淋巴细胞增殖抑制实验
标记刺激组为PBMC+CFSE(终浓度5 μmol/L)+PHA+IL-2,实验组将DPSC接种六孔板过夜孵育后加入丝裂霉素C处理2 h,与用CFSE标记的PBMC共孵育48~72 h,收集细胞悬液离心后PBS重悬,进行流式细胞仪检测。
1.8 实验动物分组
32只小鼠在造模前1天,按照各组之间差异体质量最小的原则随机分成4组:健康对照组(G1组)、模型组(G2组)、阳性药物组(G3组)、干细胞治疗组(G4组),每组8只小鼠。
1.9 ConA诱导造模及给药
给予ConA造模的当天设定为第0天(0 h)。G2~G4组动物在第0天(0 h)通过尾静脉注射20 mg/kg ConA诱导小鼠免疫性肝损伤,建立AIH模型;G1组按照同样的方式和剂量注射PBS。G3组:在ConA造模前2 h给予150 mg/kg NAC(N-乙酰半胱氨酸);G4组:在ConA造模后1 h尾静脉给予干细胞注射液1×106个细胞/只小鼠。所有小鼠在ConA诱导造模8 h后,进行终点取材。收集动物血清和肝脏样品。血清样品在收集后快速冷冻并保存在-80 ℃冰箱中,用于体外血生化指标检测。肝组织样品分成2份,1份用液氮快速冷冻后保存在-80 ℃冰箱中用于体外检测使用;1份用福尔马林固定后用于病理分析。
1.10 血清生物标志物检测
按照试剂盒的说明检测ALT、AST、TBil、IL-6、TNF-α、IL-1β的水平。将所有试剂置于室温,用200 µL/孔的Wash Buffer洗涤3次。每孔加入50 µL制备好的样品,用黏接板密封,在摇床上室温孵育2 h。用200 µL/孔的Wash Buffer洗涤3次。每孔加入25 μL检测抗体溶液,用黏接板密封,在摇床上室温孵育2 h。用200 µL/孔的Wash Buffer洗涤3次。每孔加入150 μL 2×Read buffer T,在MSD仪器上进行分析。上述所有血清生物标志物检测均重复3次,取平均值。
1.11 组织病理学分析
所有肝脏样品均通过脱水仪器(Leica HistoCore Pearl-0348)脱水,然后使用石蜡包埋机进行包埋,再通过Lecia RM2245机器将嵌入的肝脏样品切片。切片HE染色后,由病理专家对样品进行慢性肝损伤单盲评分,包含门静脉周桥接坏死、小叶内肝细胞变性和局灶性坏死、汇管区炎症、纤维化四个维度,按严重程度进行综合评分。
2结果
2.1 DPSC的分离、培养与鉴定
本实验自牙髓组织中分离获得PBMC(图1a),在培养过程中呈梭形且螺旋生长的细胞形态(图1b)。流式细胞仪检测结果显示,DPSC的CD105、CD73和CD90表达阳性,阳性率分别为99.97%、100%和99.53%;而CD34、HLA-DR和CD45表达为阴性,阳性率分别为0.56%、0.17%和0(图2),符合MSC的特征。成骨诱导发现细胞形态发生明显变化,有明显的红色钙结节组织;成脂分化显示DPSC周围出现空泡状的脂滴,脂滴呈现橘红色;成软骨分化中,细胞内缩脱落呈现为软骨球,培养后切片染色,显示蓝色的软骨组织(图3)。
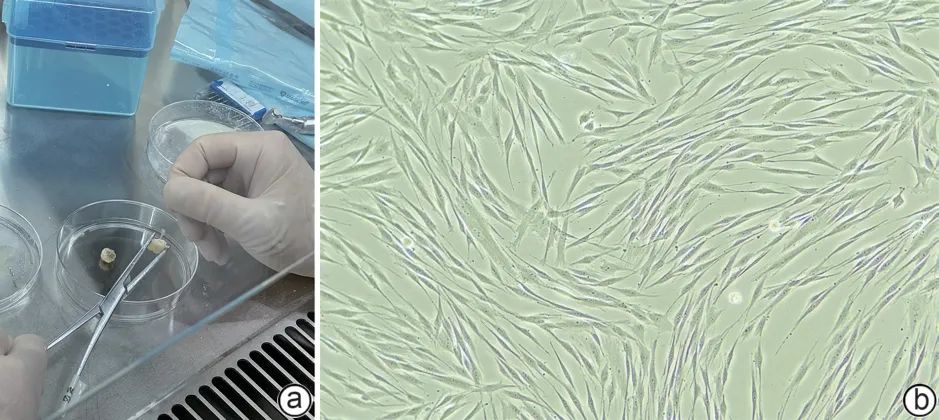
注: a,牙髓分离;b,DPSC细胞培养光镜照片(×10)。
图1 DPSC的培养与鉴定
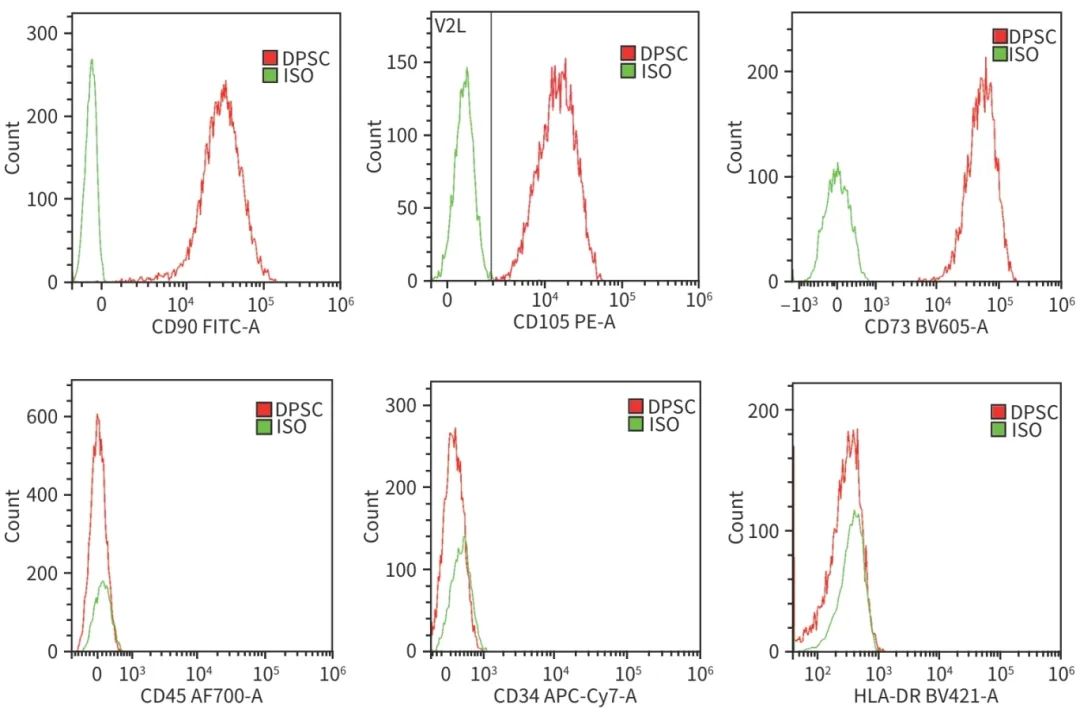
图2 DPSC鉴定的流式细胞仪结果
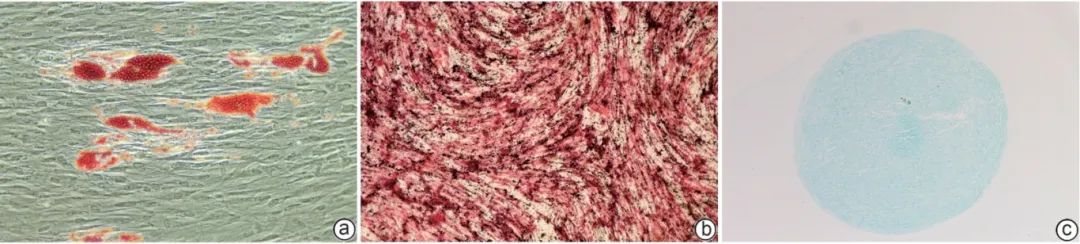
注: a,成脂分化(油红O染色,×20);b,成骨分化(茜素红染色,×4);c,成软骨分化(阿利新蓝染色,×10)。
图3 DPSC的三系分化能力
2.2 DPSC的体外免疫调节作用
流式细胞仪检测结果显示,与对应的空白刺激组相比,DPSC与PBMC共培养后Th1(CD4+IFNγ+)的增殖抑制率为31.32%(15.36% vs10.55%)(图4a),Th17(CD4+IL-17A+)的增殖抑制率为45.76%(1.18% vs 0.64%)(图4b)。与对应的单培养组相比,DPSC处理后Treg(CD4+CD25+FoxP3+)的增殖促进率为52.29%(1.09% vs 1.66%)(图4c),即干细胞可显著促进Treg细胞增殖。对应的,与刺激后的PBMC培养组相比,DPSC与刺激后PBMC共培养使PBMC出现明显增殖抑制(图4d),对淋巴细胞的增殖抑制率为93.70%(52.72%vs 3.32%)。
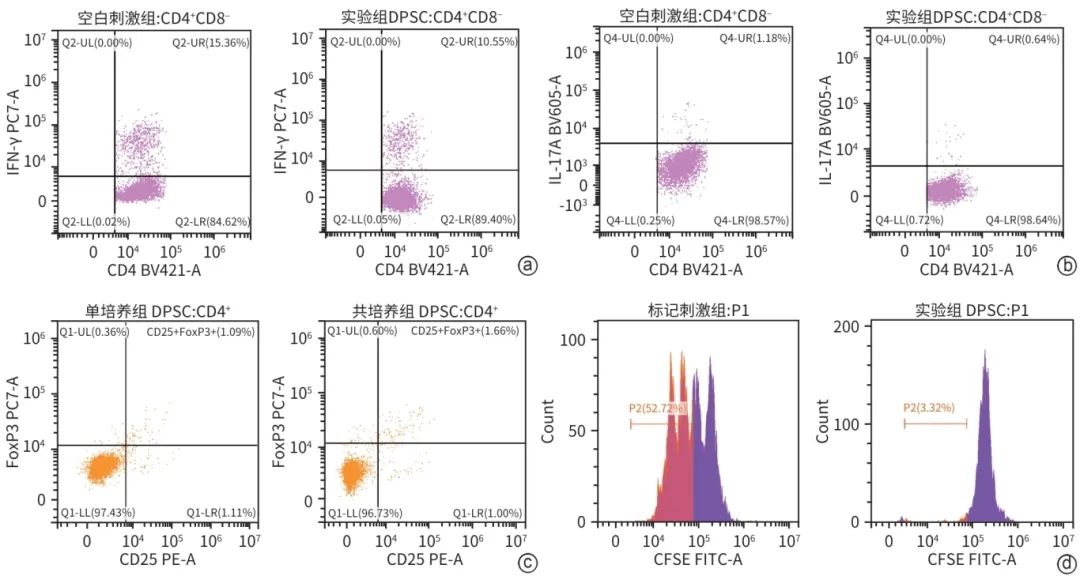
注: a,Th1流式细胞仪结果;b,Th17流式细胞仪结果;c,Treg流式细胞仪结果;d,经CFSE染色的PBMC扩增分析。
图4 DPSC在体外的免疫调节作用
2.3 DPSC在小鼠模型中对肝脏及外周免疫炎症的作用
实验流程图如图5所示。与G1组相比,ConA造模各组(G2~G4组)的体质量无明显变化(P=0.468)(图6a)。与G1组相比,各模型组(G2~G4组)的肝质量增加(P=0.047);与G2组相比,G4组小鼠肝质量显著降低(P<0.05),说明干细胞治疗可一定程度改善肝损伤(图6b)。如图7所示,与G1组相比,G2组的肝功能相关指标ALT和AST水平显著升高(P值均<0.001),同时炎症相关因子TNF-α和IL-1β也显著上升(P值均<0.001),提示ConA通过激活T细胞和NKT细胞,以及释放相应促炎因子,造成免疫性肝损伤。在ConA建模1 h后实施干细胞治疗,发现ALT和AST分别降低66.8%和60.0%(t值分别为3.321、2.907,P值分别为0.007 5、0.017 5),TNF-α和IL-1β分别下降57.5%和71.3%(t值分别为2.484、2.796,P值分别为0.039 8、0.020 6),该结果提示干细胞通过免疫调节作用降低促炎因子释放,减轻炎症反应,保护了小鼠的肝细胞功能。
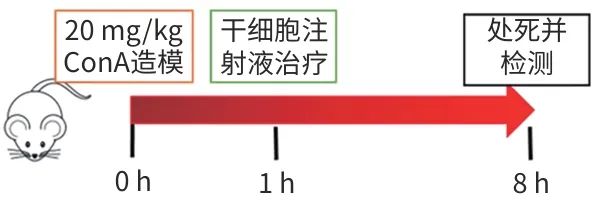
图5 干细胞治疗ConA诱导的自身免疫性肝损伤的动物实验流程图
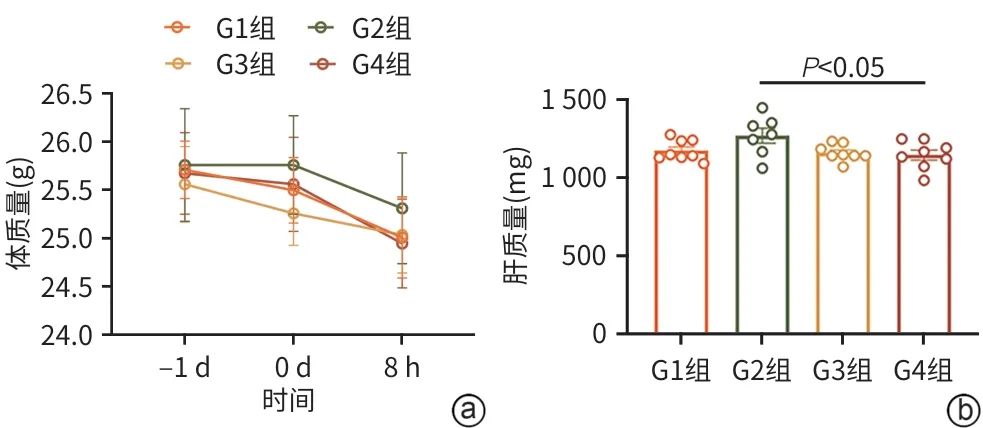
注: a,体质量变化;b,肝重量变化。
图6 干细胞治疗前后小鼠体质量和肝质量变化
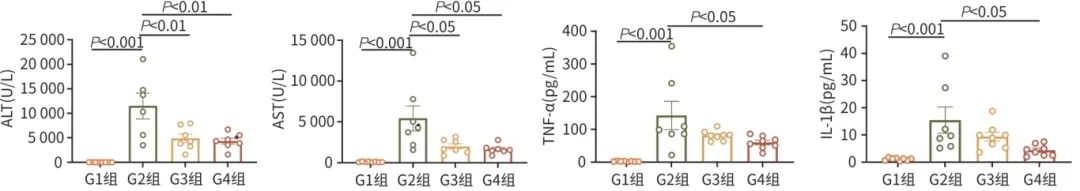
图7 DPSC改善ConA诱导免疫性肝损伤小鼠的转氨酶和炎症因子
2.4 DPSC在小鼠模型中对免疫病理损伤的作用
与G1组相比,G2组的门静脉周桥接出现广泛坏死。在ConA建模1 h后实施干细胞治疗,门静脉周桥接坏死无显著变化(t=1.969,P=0.098)(图8)。
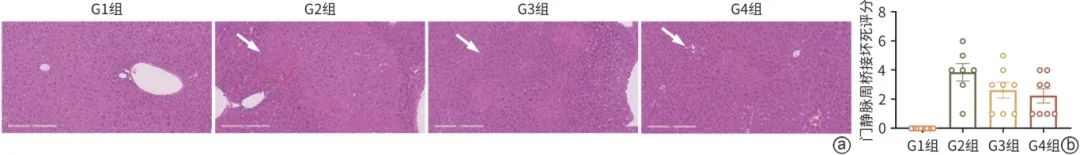
注: a,4组的组织病理学结果(HE染色,×10),白色箭头表示各组门静脉周桥接坏死情况;b,直方图展示病理结果。
图8 各组小鼠肝组织病理学结果
3讨论
MSC的来源广泛,在牙齿、脂肪、脐带、骨髓等多种组织中均可提取扩增,具有良好的自我增殖与多向分化潜能,在过继细胞疗法中,其免疫原性低,治疗风险小,副作用少,在临床中的应用日渐广泛。
课题组前期研究对比了DPSC与人骨髓MSC或人脐带MSC在免疫调节方面的差异,并通过转录组测序的方法发现DPSC具有较强的免疫调节能力,通过免疫细胞招募评分可知DPSC对各种免疫细胞的趋化性比脐带干细胞更强且更广泛,尤其表现在对Th17、Th22和Treg的影响。经过体外验证,研究者发现培养后的DPSC符合MSC的表型特征,与免疫细胞共培养过程中显示出对促炎相关群体如Th1、Th17的明显抑制,抑制率分别达到31.32%和45.76%,该调控作用同时体现在对Treg群体的增殖促进,促进率达52.29%。这种对不同类型T细胞亚群的精准调控作用充分显示DPSC精细的免疫调节能力。从免疫调节作用方面,Th1通过分泌IFN-γ等细胞因子参与细胞免疫反应,在AIH的发病过程中,其过度激活可导致肝细胞受损;Th17则在炎症反应和自身免疫性疾病的发生发展中扮演关键角色,其分泌的IL-17能够招募中性粒细胞至炎症部位,加剧肝脏炎症反应;而Treg作为维持免疫耐受的关键细胞群,能够通过多种机制抑制过度的免疫反应,其数量和功能的增强有助于恢复免疫平衡。DPSC对这些细胞亚群的调节作用,可能通过分泌多种细胞因子和趋化因子,以及与免疫细胞的直接接触等方式实现,从而在细胞水平上减轻肝脏炎症。
在ConA诱导的免疫性肝损伤小鼠模型中,DPSC干预组表现出显著的护肝效应,不仅显著降低血清ALT、AST水平,还有效抑制促炎因子(TNF-α、IL-1β)表达,并具有缓解门静脉周桥接坏死等组织损伤的趋势,进一步验证其抗炎和免疫调节作用。TNF-α和IL-1β作为促炎性细胞因子,在免疫性肝损伤中起着核心作用,其过度表达可激活肝内多种细胞,引发一系列炎症反应,加重肝细胞损伤。DPSC可能通过分泌抗炎因子如IL-10、TGF-β等,抑制炎症因子的产生和释放,阻断炎症信号通路的传导,从而减轻肝脏炎症反应。此外,DPSC还可能通过调节肝脏局部免疫微环境,促进肝脏组织自我修复和再生。
从组织病理学角度分析,经DPSC治疗后,门静脉周桥接坏死情况与造模组相比虽无统计学差异,但其病理损伤程度有好转的趋势。这表明DPSC不仅在分子和细胞水平上发挥作用,还能在组织层面有效缓解肝脏损伤,促进肝脏结构的修复和再生。肝脏损伤后的修复过程涉及多种细胞类型和复杂的细胞信号通路,DPSC可能通过分泌细胞外基质成分、生长因子等,促进肝细胞的增殖和分化,改善肝脏组织的结构和功能。
综上所述,DPSC在自身免疫领域已经取得部分进展,但临床应用治疗AIH仍需进一步探索,尤其是在激素治疗后效果较差或副反应较大的患者群体中疗效亟需评价。基于其较强的免疫调节功能,其抑制肝脏炎症反应的机制与调控淋巴细胞扩增,减少淋巴细胞浸润等有密不可分的关系。与传统治疗方法相比,DPSC治疗具有独特的优势。其来源便捷,可从拔除的智齿或脱落的乳牙中获取,避免了传统骨髓来源干细胞的有创采集过程,减少了患者的痛苦和风险。同时,DPSC具有更强的增殖能力和免疫调节活性,这在体内外实验中已经验证。此外,DPSC的免疫原性较低,不表达MHC-Ⅱ分子,这使其在异体移植时不太可能引发强烈的免疫排斥反应,拓宽了其临床应用的前景。
尽管本研究取得了积极的成果,但仍存在一些局限性和需要进一步探讨的问题。首先,动物模型与人类AIH在病理生理机制上存在差异,DPSC在人体内的疗效和安全性仍需通过临床试验进行验证。其次,本研究主要关注了DPSC对肝脏炎症的短期调节作用,但对于其在肝纤维化、肝细胞再生等方面的长期影响尚未深入探讨。此外,DPSC的最佳给药剂量、给药时间、治疗疗程等临床应用关键问题,也有待进一步研究明确。未来的研究应进一步优化实验设计,深入探索DPSC的作用机制和临床应用策略,以期为AIH患者带来更有效的治疗方案。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH250719



