巴雷特食管:食管癌风险增加30-50倍!
时间:2025-08-28 12:10:48 热度:37.1℃ 作者:网络
巴雷特食管(Barrett's Esophagus)是以英国外科医生诺曼·巴雷特(Norman Barrett)命名的疾病。
1950年,他在解剖学研究中首次描述了食管下段黏膜出现类似肠道柱状上皮的病理改变。
这种异常上皮化生并非先天存在,而是后天因长期胃食管反流导致食管黏膜损伤修复过程中发生的病理现象。
由于其与胃癌前病变的相似性,巴雷特食管被医学界视为食管腺癌的唯一公认癌前病变,其名称既是对发现者的致敬,也是对临床风险的警示。
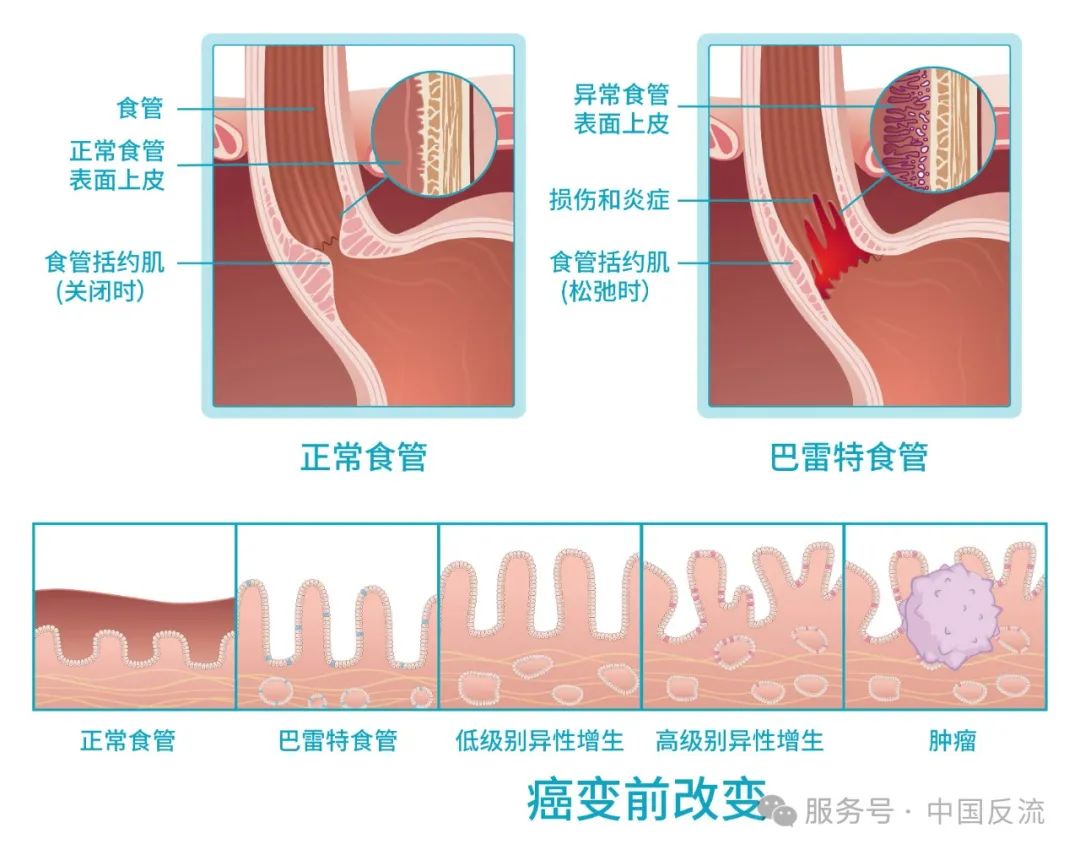
据2022年《美国胃肠病学会临床实践指南:巴雷特食管的管理》的数据,巴雷特食管患者食管腺癌风险较普通人群增加30-50倍。
一、癌变概率
研究表明,巴雷特食管患者患食管腺癌的风险较普通人群增加30-50倍,且约80%的食管腺癌源于此病变。
其癌变机制主要与以下因素相关:
1.上皮异型增生程度
- 无异型增生
癌变风险最低(约0.1%-0.6%/年)。
- 低级别异型增生(LGD)
风险升至0.5%-1%/年。
- 高级别异型增生(HGD)
风险高达7%-10%/年,需立即干预。
2.病变长度
累及食管全周的病变(长节段巴雷特食管)癌变风险显著高于短节段。
3.合并症
食管裂孔疝、慢性胃炎、肥胖等会加剧反流,加速病程进展。
二、临床表现
巴雷特食管(Barrett's Esophagus)的临床表现多样,部分患者可能无明显症状,而部分患者则以胃食管反流病(GERD)的典型症状为主。
以下是其常见的临床表现:
以下是巴雷特食管临床表现的表格总结(已删除检查与诊断要点):
反酸、烧心
胃酸反流至食管引起的灼热感,平卧或弯腰时加重。
长期反流易导致食管黏膜损伤,增加巴雷特食管癌变风险。
胸骨后疼痛
胸骨后隐痛或烧灼感,可能被误认为心绞痛。
需通过心电图等检查排除心脏疾病。
吞咽困难
食管狭窄导致固体/液体食物哽噎感,初期为固体食物,后期可能发展为液体困难。
黏膜反复炎症后瘢痕形成,需内镜或手术治疗。
呕血或黑便
食管黏膜糜烂或溃疡引发的消化道出血。
严重时可导致贫血或失血性休克。
异物感
进食后自觉食管内有堵塞感。
可能与食管痉挛或炎症相关。
隐匿进展
20%-40%患者无典型症状,仅通过内镜检查偶然发现。
癌变风险与有症状患者相当,需定期监测。
癌变风险
无症状患者仍存在癌变可能,需通过内镜随访发现早期病变。
高级别异型增生(HGD)患者年癌变率达7%-10%。
进行性吞咽困难
从固体到半流质再到流质饮食困难,提示食管梗阻。
需内镜或影像学评估病变范围。
持续性胸痛或背痛
可能提示肿瘤侵犯周围组织(如纵隔、脊柱)。
预后较差,需综合治疗。
声音嘶哑
喉返神经受侵导致声带麻痹。
提示肿瘤局部进展。
体重下降、恶病质
晚期肿瘤消耗性表现。
需紧急评估和治疗。
合并食管裂孔疝
反流症状更严重,巴雷特食管发生率显著升高。
手术治疗(如抗反流手术)需求增加。
肥胖或糖尿病
反流控制难度大,黏膜损伤风险增加。
需联合减重、控糖等综合管理。
三、如何检查和诊断?
1.X线检查
较难发现Barrett食管,有食管裂孔疝及反流性食管炎的表现,不是此症的特异性。发现食管有消化性狭窄或体部有溃疡者应疑有Barrett食管。
2.内镜检查
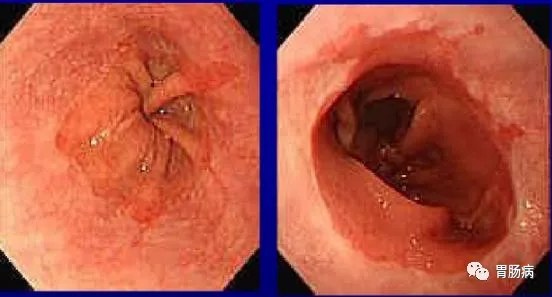
内镜下较易确认Barrett黏膜,正常食管黏膜为粉红带灰白,而柱状上皮似胃黏膜为橘红色,两者有显著差异。
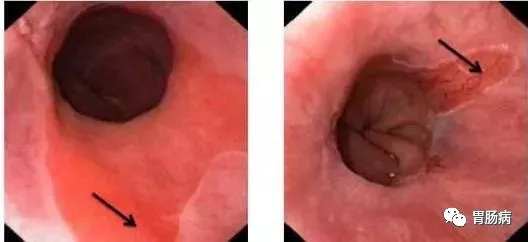
Barrett 食管镜下表现
3.食管测压及pH监测
Barrett食管的病人食管与酸、碱反流物接触时间长可见到胃食管反流的测压表现,其食管下端括约肌压力较一般的反流病人为低。
因为BE并无特异性的症状,多数病人是因为有反流性食管炎或慢性胃炎症状时行内镜检查被意外发现。
BE的诊断必须要有内镜和组织病理学依据,内镜发现鳞-柱状上皮线上移远离EGJ(以胃纵行皱襞口端或食管远端桔红色黏膜出现栅网状血管为标记),可先疑诊为BE,待组织活检进一步确认。
四、分类
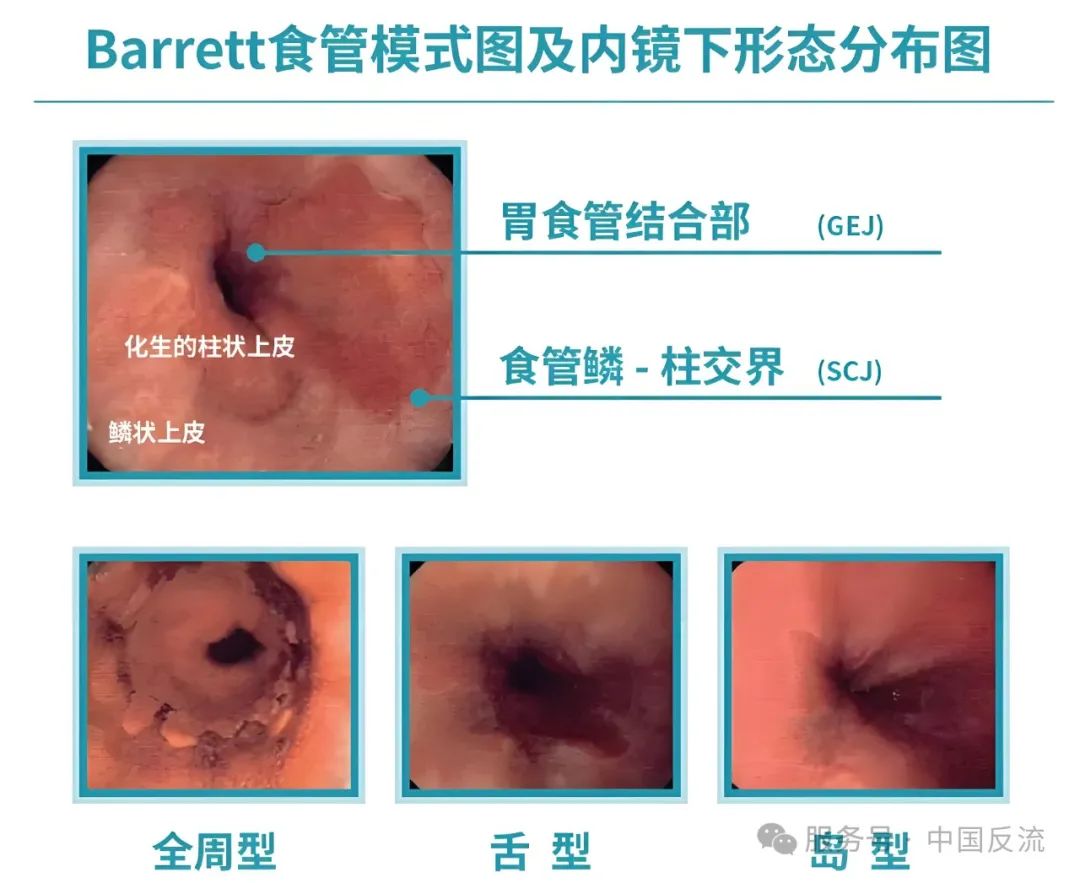
内镜下BE可分为三型:
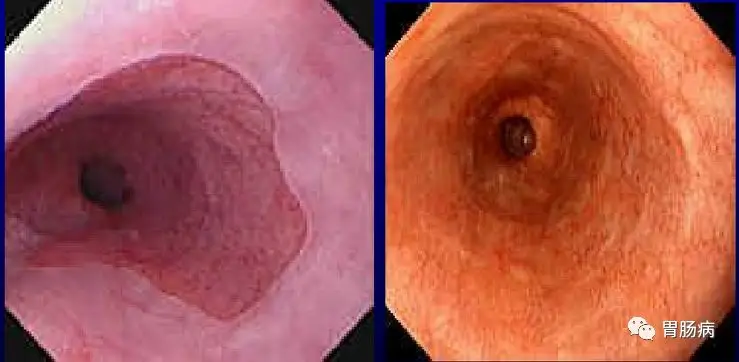
①全周型:红色黏膜向食管延伸累及全周,与胃黏膜无明显界限,其游离缘距食管下括约肌3cm以上。
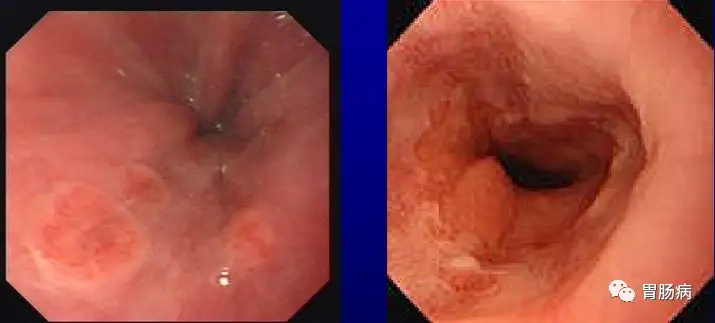
②岛型:齿状线1cm处以上出现斑片状红色黏膜。
③舌型:与齿状线相连,伸向食管呈半岛状。在Barrett上皮可以出现充血、水肿、糜烂或溃疡,反复不愈的溃疡可引起食管狭窄。
按化生柱状上皮的长度也分为三类:
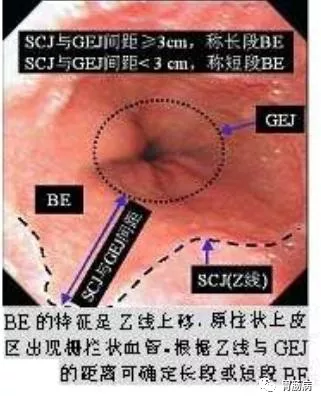
①.长节段BE(LSBE):化生的柱状上皮累及食管全周,且长度≥3 cm。
②.短节段BE(SSBE):化生的柱状上皮未累及食管全周,或虽累及全周但长度<3 cm。
③.超短节段BE(USSBE):指Barrett粘膜长度不满1cm的形态改变。
五、常见并发症
2%~54%
- 食管柱状上皮受胃酸腐蚀引发溃疡,症状类似胃溃疡(胸骨后疼痛,可放射至背部)。
- 可能进展为穿孔、出血、狭窄,甚至穿透主动脉导致致命性大出血。
- 病理分型:
① 鳞状上皮段浅表溃疡(常见,类似反流性食管炎);
② 柱状上皮段深大溃疡(罕见,类似消化性溃疡)。
15%~100%
- 多发生于食管中上段鳞-柱状上皮交界处,导致吞咽困难。
- 可单独累及柱状上皮,或同时累及鳞状和柱状上皮。
- 反流性食管炎基础上更易发生,可能需内镜扩张或手术治疗。
5%~10%(食管腺癌中占比)
- 机制:长期反流物刺激、异型增生(低度→高度→癌)。
- 高危因素:肠化生(BE的特殊型上皮)是明确癌前病变。
- 异型增生程度决定风险:
低级别:癌变率约0.5%/年;
高级别:癌变率7%~10%/年。
约45%
- 表现:呕血、黑便、缺铁性贫血。
- 来源:食管溃疡、炎症或糜烂。
- 出血量大时可危及生命,需紧急内镜止血或输血。
六、治疗
质子泵抑制剂(PPIs)
奥美拉唑(洛赛克)
20~40mg,每日2次口服
抑制胃酸分泌,缩小BE黏膜长度,促进鳞状上皮逆转,降低异型增生和癌变风险。
需长期治疗(≥半年),症状控制后减量维持;部分研究显示可部分逆转BE,但完全逆转困难。
兰索拉唑、泮托拉唑等
根据指南调整剂量
促动力药
多潘立酮(吗丁啉)
10~20mg,每日3~4次
增强胃肠动力,减少胃食管反流,常与PPIs联用提高疗效。
需长期使用,单独疗效有限;可能引起锥体外系反应(如震颤)。
西沙必利
5~10mg,每日3次
(因心脏副作用已较少使用)
黏膜保护剂
硫糖铝
1g,每日3~4次
在黏膜表面形成保护层,减轻胃酸和胆汁刺激。
与PPIs联用可增强黏膜修复效果;长期使用可能导致便秘。
蒙脱石散(思密达)
3g,每日3次
热消融治疗
射频消融(RFA)
根据病变范围定制能量参数
利用高温使异常黏膜凝固坏死,清除肠化生和异型增生组织。
安全性高,并发症少;对HGD和早期癌变治愈率可达80%~90%。
冷冻消融
液氮喷雾或探头冷冻
低温破坏异常细胞,保留正常组织。
适用于不耐受高温的患者;疗效与RFA相当。
化学消融
乙醇注射
局部注射无水乙醇
诱导黏膜坏死和脱落,需多次治疗。
适用于局限性病变;操作复杂度较高。
机械消融
内镜黏膜切除术(EMR)
切除深度达黏膜下层
直接切除异常黏膜,可获取完整病理标本。
适用于单发或多发息肉样病变;术后需预防出血和狭窄。
内镜黏膜下剥离术(ESD)
整块切除病变
适用于大面积或环周病变,整块切除率高。
技术难度大,但可降低复发风险。
食管扩张术
探条或球囊扩张
根据狭窄程度选择器械
机械扩张食管狭窄段,改善吞咽困难。
疗效短暂(3~6个月),需反复操作;可能并发穿孔或出血。
抗反流手术
Nissen胃底折叠术
腹腔镜或开腹手术
重建食管下括约肌功能,减少反流。
适用于内科治疗无效的严重反流、狭窄或溃疡;争议在于能否逆转BE或降低癌变风险。
食管切除术
食管切除+胃食管吻合
开胸或微创手术
根治重度异型增生或癌变,切除病变食管。
创伤大,并发症风险高(如吻合口瘘、肺部感染);仅用于癌变或癌前病变无法内镜治疗者。
生活方式干预
-
-
戒烟戒酒、抬高床头、避免高脂饮食、控制体重。
非药物干预的基础措施,可协同药物治疗降低反流频率。
补充说明
-
疗效差异
- PPIs
:可控制80%以上患者的反流症状,但仅少数患者(<10%)实现BE黏膜完全逆转。
- 内镜治疗
:对HGD和早期癌变的5年生存率>90%,但需终身随访以防复发。
- 手术争议
:抗反流手术短期改善症状,但长期随访(>5年)未能证实可降低癌变率。
-
监测与随访
-
无异型增生:每3~5年内镜随访。
-
低级别异型增生(LGD):每6~12个月随访。
-
高级别异型增生(HGD):每3个月随访或直接内镜治疗。
-
新兴技术
- 光动力疗法(PDT)
:利用光敏剂靶向杀灭异常细胞,适用于无法耐受手术者。
- 干细胞移植
:实验阶段,尝试修复受损食管黏膜。
总结
巴雷特食管的治疗需个体化,轻症以药物和生活方式干预为主,中重度异型增生或癌变优先选择内镜或手术治疗。早期干预可显著降低癌变风险,但需长期监测以防止复发。


