自身免疫性肝炎:免疫系统的“迷雾”与诊疗“破局”之路
时间:2025-09-04 17:07:21 热度:37.1℃ 作者:网络
自身免疫性肝炎(Autoimmune Hepatitis, AIH)是一种由异常自身免疫反应介导的慢性进行性肝脏炎症性疾病,以血清自身抗体阳性、高免疫球蛋白G血症和界面性肝炎为特征。
本文系统综述了AIH在遗传易感性、免疫失调机制、诊断技术、治疗策略及预后评估等方面的最新研究进展。研究表明,调节性T细胞(Treg)功能缺陷、Th17细胞过度活化、骨髓源性抑制细胞(MDSCs)动态变化以及新型炎症因子IL-26的参与共同构成了AIH的免疫发病基础。靶向Bcl-3/CXCR4通路、受体相互作用蛋白3(RIP3)以及工程化双特异性抗体等新型治疗策略在动物模型中展现出显著疗效。
基于孟德尔随机化研究发现的特定免疫细胞表型为风险预测提供了新指标。虽然传统免疫抑制剂可使80%以上患者获得生化缓解,但重建免疫耐受仍面临挑战。本综述还探讨了调节性T细胞过继移植、肠道菌群调控等前沿疗法的治愈潜力,为AIH的精准诊疗提供理论依据。
一 引言
自身免疫性肝炎(AIH)是一种病因未明的慢性进行性肝脏炎症性疾病,全球患病率呈上升趋势,据日本流行病学研究显示已达23.9/10万人口,男女患病比例约为1:3.3,但近年男性患者比例显著增加。根据血清自身抗体谱,AIH可分为两型:AIH-1型(抗核抗体ANA/抗平滑肌抗体SMA阳性)占90%以上,AIH-2型(抗肝肾微粒体抗体LKM-1阳性)则相对罕见。
该病病理特征为门管区淋巴-浆细胞浸润及界面性肝炎,临床表现为乏力、黄疸、肝酶升高,若不及时干预可进展为肝硬化、肝衰竭。尽管标准免疫抑制治疗(糖皮质激素联合硫唑嘌呤)可使80-90%患者获得缓解,但仍有约40%患者出现复发,10%发展为耐药性疾病。更严峻的是,诊断时已存在肝硬化的患者死亡或肝移植风险增加3.21倍。本文结合最新研究进展,从发病机制、诊疗策略及预后评估等多维度对AIH进行全面阐述,旨在为临床实践和科研方向提供参考。
二 发病机制
1. 遗传易感性与免疫启动
AIH具有显著的遗传易感性。全基因组关联研究(GWAS)证实,HLA-DR3和HLA-DR4等位基因是白种人群的主要风险基因,而亚洲人群则以HLA-DR4关联性更强。非HLA基因如CTLA-4(参与T细胞抑制信号)和SH2B3(调控淋巴细胞活化)的多态性也被证实与AIH发病相关。近年研究还发现,表观遗传调控异常如DNA甲基化、组蛋白修饰通过影响T细胞分化参与自身免疫应答。
肠道菌群失调是触发肝脏自身免疫的重要环境因素。AIH患者肠道菌群多样性显著降低,短链脂肪酸(SCFAs)产生菌减少,导致具有抗炎功能的调节性T细胞(Treg)分化受损。同时,肠道屏障损伤致使脂多糖(LPS) 易位入血,通过激活肝内Kupffer细胞的TLR4/NF-κB通路,促进IL-1β、TNF-α等促炎因子释放,放大肝脏炎症反应。
2. 免疫细胞失衡的核心作用
2.1 T细胞亚群紊乱
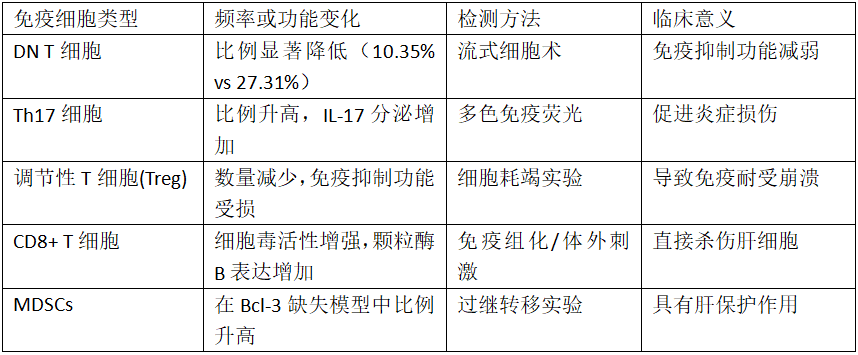
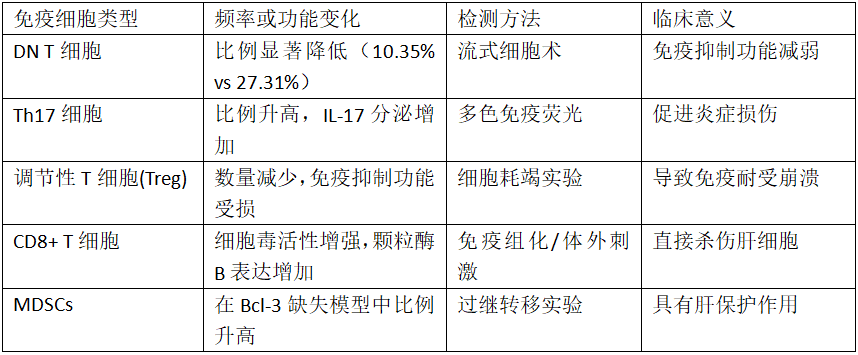
CD4+ T细胞:在AIH发病中处于核心地位。肝内浸润的自身抗原特异性CD4+ T细胞分化为促炎的Th1和Th17细胞,分泌IFN-γ、IL-17等细胞因子驱动肝细胞损伤。2025年研究发现,Th17/Treg比值与AIH组织学活动指数呈正相关(r=0.68, P<0.001)。
CD8+ T细胞:作为直接杀伤肝细胞的效应细胞,其活性受IL-26调控。2023年研究发现,AIH患者肝内IL-26水平显著高于慢性乙肝和脂肪肝患者(P<0.01),体外IL-26刺激可增强CD8+ T细胞的细胞毒活性。
双阴性T细胞(DN T cells):作为CD3+CD4-CD8-的独特T细胞亚群,在健康肝脏中具有免疫调节功能。然而,上海交通大学2025年研究发现,AIH患者肝内DN T细胞频率显著降低(10.35%±6.89% vs 健康对照27.31%±14.43%, P<0.05),且其表面活化标志物CD69及细胞毒介质颗粒酶B表达减少,提示免疫抑制功能受损。
自身免疫性肝炎患者肝内免疫细胞变化特征
2.2 固有免疫细胞与调节性细胞
骨髓源性抑制细胞(MDSCs):在免疫调节中发挥重要作用。2025年新乡医学院团队利用Bcl-3基因敲除(Bcl-3-/-)小鼠模型发现,Bcl-3缺失可促进粒细胞样MDSCs(G-MDSCs)向肝脏募集,抑制CD4+ T细胞和NK细胞的IFN-γ产生,从而减轻刀豆蛋白A(ConA)诱导的肝损伤。机制研究表明,这一保护作用依赖于CXCR4/CXCL12信号轴,阻断CXCR4受体可消除MDSCs的肝保护效应。
调节性T细胞(Treg)功能缺陷是AIH免疫耐受崩溃的关键。最新研究发现,AIH患者Treg细胞中FoxP3表达不稳定,且抑制效应T细胞增殖的能力显著下降。尤其值得注意的是,CD28-CD8+ Treg细胞绝对计数的增加与AIH风险呈正相关(OR=1.486, P<0.001)。
3. 细胞因子网络与信号通路
IL-26作为新型炎症介质在AIH中发挥重要作用。2023年发表于Journal of Digestive Diseases的研究显示,AIH患者肝组织IL-26水平显著升高,且与组织学严重程度呈正相关。免疫荧光证实,肝内浸润的CD4+ T细胞、CD8+ T细胞和CD68+巨噬细胞共同分泌IL-26,形成促炎微环境。
程序性坏死(Necroptosis)信号通路活化参与肝细胞损伤过程。2022年研究发现,AIH患者肝组织中磷酸化RIP3和MLKL(程序性坏死关键蛋白)表达显著高于对照组(P<0.01)。在ConA诱导的小鼠肝炎模型中,使用RIP3抑制剂GSK872可降低肝脏TNF-α、IL-6等促炎因子水平,减少Th17细胞比例,同时增加Treg和MDSCs,从而减轻肝损伤。
三 诊断进展
1. 临床诊断标准与生物标志物
目前AIH诊断主要依赖简化诊断标准(2008年Hennes标准),该标准综合性别、年龄、自身抗体、IgG水平及组织学特征,被引次数高达1247次,成为临床金标准。然而,传统自身抗体(如ANA、SMA)在疾病活动度评估中价值有限。
新型血清标志物研究取得进展:
① IL-26:作为疾病活动度的潜在标志物,其肝内表达水平与血清ALT、AST呈正相关;
② 可溶性CD163(sCD163):反映巨噬细胞活化程度,在急性加重期显著升高;
③ 细胞角蛋白-18(CK-18)片段:指示肝细胞死亡程度;
④ 遗传标记物方面,2025年一项孟德尔随机化研究通过分析731种免疫细胞表型,发现:分泌CD39+ Treg细胞上的CD28表达水平升高**(OR=1.194, P=0.001),单核髓源性抑制细胞上的CD45水平升高(OR=1.243, P<0.001)与AIH风险增加存在因果关系。
2. 无创诊断与评估技术
① 瞬时弹性成像(如FibroScan)和磁共振弹性成像(MRE)已广泛应用于肝纤维化评估。血清模型(如APRI、FIB-4)虽可初步筛查纤维化,但在炎症活动期准确性受限。
② 组织学评估仍是诊断金标准,界面性肝炎、浆细胞浸润及玫瑰花结样变是典型特征。近年来,人工智能辅助病理分析系统通过深度学习提高了界面性肝炎的识别准确率(达92%),并实现纤维化定量评估。
四 治疗策略
1. 传统免疫抑制治疗
一线方案仍为糖皮质激素联合硫唑嘌呤。2019年AASLD指南推荐泼尼松(初始0.5-1 mg/kg/天)诱导缓解,后联合硫唑嘌呤(1-1.5 mg/kg/天)维持。该方案可使80-90%患者获得生化缓解,但需警惕硫唑嘌呤肝毒性及骨髓抑制风险。
二线药物包括:
① 霉酚酸酯(MMF):适用于硫唑嘌呤不耐受者,但妊娠期禁用;
② 钙调磷酸酶抑制剂(他克莫司、环孢素):用于难治性AIH;
③ 利妥昔单抗(抗CD20单抗):用于传统治疗失败者。
然而,传统免疫抑制剂虽能控制炎症,却无法重建免疫耐受,40%患者停药后复发,且长期使用面临感染、代谢紊乱等风险。
AIH传统免疫抑制治疗方案及特点
2. 生物制剂及靶向治疗
① Bcl-3靶向干预:基于Bcl-3在调控CXCR4/CXCL12通路中的关键作用,新乡医学院团队提出靶向抑制Bcl-3可促进MDSCs向肝脏募集。Bcl-3-/-小鼠在ConA诱导后存活率显著提高,血清ALT、AST水平明显降低,为AIH治疗提供新思路。
② RIP3抑制剂:GSK872通过抑制受体相互作用蛋白3(RIP3)的活性,减轻ConA诱导的小鼠肝炎模型肝损伤。其机制包括:降低肝脏TNF-α、IL-6表达;减少Th17细胞比例;促进Treg和MDSCs积累。
③ 工程化双特异性抗体:2025年Cell杂志报道了一种创新疗法——LAG-3/TCR双特异性T细胞沉默器(BiTS)。该抗体通过同时结合T细胞受体(TCR)和LAG-3检查点,强制二者靠近,增强LAG-3的抑制信号。在自身免疫性肝炎小鼠模型中,BiTS显著减少肝内T细胞浸润和肝损伤。
3. 细胞治疗与免疫耐受重建
① 调节性T细胞(Treg)过继移植:被认为是实现免疫耐受的潜在治愈策略。最新临床试验采用体外扩增的自体Tregs(经肝源性抗原刺激)回输治疗难治性AIH。关键技术突破包括:清除效应记忆样Tregs亚群以提高细胞产品稳定性;使用CAR-Treg技术使Tregs特异性靶向肝脏抗原;门静脉输注增强肝内归巢。
② 低剂量IL-2疗法:选择性扩增Tregs。工程化IL-2突变体(如IL-2/抗IL-2复合物)可延长IL-2半衰期,优先激活高亲和力IL-2受体(CD25高表达的Tregs),已在早期临床试验中展示良好安全性。
4. 肝移植与术后管理
对于终末期AIH患者,肝移植是挽救生命的有效手段。然而,AIH肝移植后复发率高达36%-68%(5年内),需长期免疫抑制维持。术后管理要点包括:① 维持他克莫司或环孢素为基础免疫抑制;② 监测自身抗体及肝酶变化;③ 复发时强化免疫抑制(如增加激素或换用MMF)。
五 预后评估
2025年一项纳入33项研究的荟萃分析系统评价了AIH预后因素,采用GRADE评估证据质量。关键发现包括:
高危因素:
1. 诊断时存在肝硬化(HR=3.21, 95%CI 2.38-4.34);
2. 治疗反应不足(HR=4.35, 95%CI 2.5-7.58);
3. PSC重叠综合征;
4. 非白种人。
保护因素:
1. 基线ALT/AST升高(与传统认知相反);
2. 血清白蛋白水平升高。
预后模型方面,MELD评分、UKELD评分及ALP/AST比值对预测肝移植或死亡有重要价值。值得注意的是,该荟萃分析发现无症状起病和高复发率也是不良预后的隐匿风险因素。
六 挑战与展望
1. 当前研究局限性
AIH研究仍面临诸多挑战:动物模型局限性(如ConA诱导肝炎为急性模型,不能完全模拟慢性AIH);临床异质性导致治疗反应差异;长期免疫抑制的副作用;以及肝移植后高复发率问题。此外,东西方在AIH诊疗策略上存在差异:中国更关注肝硬化患者免疫抑制剂耐受性(如环孢素A替代硫唑嘌呤),而西方则强调妊娠期AIH管理。
2. 未来研究方向
精准分型与个体化治疗:整合基因组、转录组、蛋白质组数据建立AIH分子分型体系,指导靶向药物选择。如基于Bcl-3/CXCR4通路活性筛选适合MDSCs增强疗法的患者。
免疫耐受重建策略:优化Treg细胞治疗,包括↓↓↓
① 利用CRISPR-Cas9技术编辑Treg增强其功能稳定性;
② 开发肝靶向纳米载体递送Treg特异性激活剂;
③ 探索维生素D3、雷帕霉素等药物对Treg功能的保护作用。
肠道微生态调控:补充特定益生菌(如长双歧杆菌)或菌群移植(FMT)恢复SCFAs水平,纠正Treg/Th17失衡。
七 结论
自身免疫性肝炎作为一种复杂的免疫介导性肝病,其研究正经历从传统免疫抑制向靶向治疗和免疫耐受重建的转变。近年研究深入揭示了遗传背景、免疫细胞失衡(尤其Treg功能缺陷和MDSCs动态变化)、细胞因子网络及程序性坏死通路在AIH发病中的核心作用。
这些机制研发的Bcl-3抑制剂、RIP3抑制剂及双特异性抗体等新型疗法在实验模型中展现出良好前景。临床诊疗方面,简化诊断标准仍是基石,而新型生物标志物(如IL-26、特定免疫细胞表型)和人工智能辅助病理分析有望提升诊断精度。尽管传统免疫抑制剂疗效确切,但重建持久免疫耐受仍需依赖Treg细胞治疗、基因编辑等前沿技术。未来研究应着力于精准分型、个体化治疗及跨学科合作,最终实现AIH的深度缓解乃至治愈。
参考文献
[1] WANG X Q, ZHANG J, LI H, et al. IL-21 induces the secretion of different proinflammatory cytokines in healthy controls and patients with autoimmune hepatitis[J]. World Chinese Journal of Digestology, 2009, 17(20): 2096-2098.
[2] YAN M G, LIU X H, WANG X B. Study on the immunoregulatory mechanism of total glucosides of paeony on rats with autoimmune hepatitis[J]. Chinese Journal of Biomedical Engineering, 2018, 24(5): 385-390.
[3] LV T, LI W, HUANG J. Systematic review and meta-analysis on the incidence and prevalence of autoimmune hepatitis in Asian, European, and American populations[J]. Journal of Gastroenterology and Hepatology, 2019, 34(10): 1676-1684.
[4] LI Y L. Research progress of autoimmune hepatitis[J]. Advances in Clinical Medicine, 2023, 13(4): 5255-5261.
[5] Liu, Hui et al. “Bcl-3 depletion prevent autoimmune hepatitis of mice through CXCR4/CXCL12 pathway.” International immunopharmacology vol. 159 (2025): 114952. doi:10.1016/j.intimp.2025.114952
[6] 张华扬,李奕康,钱其炜,等.自身免疫性肝炎患者肝组织中CD3+CD4-CD8-双阴性T细胞的免疫学表型研究[J/OL]. 国际消化病杂志,1-6 [2025-08-21]. https://link.cnki.net/urlid/31.1953.R.20250310.1145.002.
[7] Slooter, Charlotte D et al. “Early prognostic factors for reduced survival in autoimmune hepatitis: a systematic review with meta-analysis.” Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, S1542-3565(25)00618-4. 23 Jul. 2025, doi:10.1016/j.cgh.2025.04.034
[8] Wei, Yiran et al. “Alterations of gut microbiome in autoimmune hepatitis.” Gut vol. 69,3 (2020): 569-577. doi:10.1136/gutjnl-2018-317836


