首个真实世界数据:不联合化疗,免疫治疗也对MSI/dMMR胆道肿瘤疗效显著且持久
时间:2025-08-28 12:11:00 热度:37.1℃ 作者:网络
免疫检查点抑制剂(ICIs)可显著改善错配修复缺陷型(dMMR)或微卫星高度不稳定型(MSI-H)肿瘤患者的生存期。2022年,ICIs获批准与化疗联合,用于晚期胆道肿瘤(BTCs)的一线治疗。MSI/dMMR BTC是一种罕见的亚型,目前其对ICIs的应答情况仍知之甚少。本项多中心真实世界研究旨在描述该类患者的临床特征与预后。本研究回顾性纳入了法国23个中心接受治疗的所有MSI/dMMR BTC患者。主要研究终点为患者从开始接受ICIs治疗起的中位总生存期(mOS)。
2012年至2023年期间,共纳入48例MSI/dMMR BTC患者,中位随访时间为25.1个月。其中37例(77%)患者接受了ICIs治疗:10例(27%)为一线联合化疗,4例(11%)为一线单药治疗,23例(62%)为后线治疗(20例为单药治疗,3例为双免疫治疗)。从开始接受ICIs治疗起,患者的mOS为40.9个月(95%CI:16.39-未达到),中位无进展生存期(mPFS)为11.24个月(95%CI:6.44-未达到)。总缓解率为36%,疾病控制率为75%。在未联合化疗和联合化疗接受ICIs治疗的患者中,分别有15%和50%发生了3-4级不良事件。在具备分子谱分析数据的患者(69%)中,16例(48%)被检测出共突变,最常见的突变基因包括TP53(12%)、CDKN2A/B(12%)、KRAS(12%)、GNAS(9%)、FGFR2/3(6%)、SMAD4(6%)和IDH1(6%)。
本研究是首个针对MSI/dMMR BTC患者的真实世界队列研究,结果表明,以ICIs为基础的治疗方案可为该亚型胆道肿瘤患者带来持久的治疗应答,并改善其生存期。
-
MSI/dMMR肿瘤是BTC中罕见的亚型;
-
MSI/dMMR BTC患者从开始接受ICIs治疗起的mOS为40.9个月;
-
本研究证实患者对ICIs的治疗应答具有持久性,mPFS达11.2个月;
-
ICIs在MSI/dMMR BTC中的疗效,对该类患者是否有必要联合化疗提出了疑问;
-
本多中心队列研究强调,针对MSI/dMMR BTC需制定个体化治疗策略。
研究背景
胆道肿瘤(BTCs)是一组异质性恶性肿瘤,起源于胆管细胞,根据发病部位可分为肝内胆管癌(iCCA)、肝门部胆管癌(pCCA)、远端胆管癌(dCCA)和胆囊癌(GBC),不同亚型具有独特的流行病学特征和病理生理机制。BTCs通常起病隐匿,导致诊断时已处于晚期,肿瘤负荷较高且存在化疗耐药性,因此预后较差。转移性BTC患者的mOS约为1年。
分子谱分析研究表明,胆管癌(CCA)中存在大量可靶向的基因变异,这为精准医疗方案的制定提供了依据。BTCs中存在一个罕见亚型,即表现为MSI表型的BTCs,其在BTCs中的发生率为2%-5%。MSI肿瘤的特征是存在一种名为dMMR的DNA修复通路异常,该异常可能由以下两种原因导致:一是MMR基因(MLH1、MSH2、MSH6或PMS2)发生胚系突变,与林奇综合征相关;二是MLH1基因启动子区域发生高甲基化,导致启动子沉默,该机制与衰老相关。在MSI/dMMR肿瘤中,移码突变会产生大量新抗原,这些新抗原可促进有效的免疫应答,这也解释了为何与错配修复功能正常(pMMR)的肿瘤相比,MSI/dMMR肿瘤对ICIs的应答率更高。
2022年和2023年,度伐利尤单抗(Durvalumab)和帕博利珠单抗(Pembrolizumab)先后获批与顺铂联合吉西他滨(CISGEM)方案联合,用于BTC的一线治疗。III期TOPAZ-1试验和KEYNOTE-966试验结果显示,度伐利尤单抗联合CISGEM组患者的mOS为12.8个月,帕博利珠单抗联合CISGEM组患者的mOS为12.7个月;而单纯CISGEM治疗组的mOS分别为11.5个月和10.9个月。上述试验中,仅不到1%的研究队列患者表现为MSI-H表型,且20%-50%的患者缺乏MSI/dMMR状态相关数据。研究未开展亚组分析,因此关于ICIs在MSI/dMMR BTC患者中疗效的数据仍存在空白。
无论肿瘤类型如何,ICIs已在MSI/dMMR癌症中显示出临床获益。II期KEYNOTE-158试验评估了帕博利珠单抗在晚期、经治非结直肠MSI/dMMR癌症患者中的疗效,结果显示在22例BTC患者中,ORR为40.9%。在所有入组患者中,mOS和mPFS分别为19.8个月和4.0个月;而在BTC亚组中,mOS和mPFS分别为24.3个月和4.2个月。另一项回顾性多中心研究对比了接受化疗与接受ICIs治疗的非结直肠MSI癌症患者,结果显示在所有肿瘤类型中,化疗组患者24个月PFS为7.9%,而ICIs组为71.2%。然而,该研究未对15例BTC患者亚组进行单独分析。
尽管ICIs在MSI/dMMR BTC中的疗效已被初步推测,但关于其在该类患者中实际应用的数据仍十分有限。因此,研究者开展了一项针对MSI/dMMR BTC的真实世界研究,旨在评估ICIs在这一罕见患者亚组中的疗效与安全性。
研究结果
患者特征:
本研究筛选了2012年至2024年期间在23个中心接受治疗的49例MSI/dMMR BTC患者。其中1例患者因数据严重缺失被排除,最终纳入并分析48例患者。
从初始诊断开始计算,中位随访时间为25.1个月(95%CI:16.3-48.3)。患者中位年龄为65.7岁,48%为女性(表1)。BTC发病部位分布如下:iCCA 16例(33%)、pCCA 14例(29%)、dCCA 7例(15%)、GBC 6例(13%)。诊断时,17例(36%)患者已存在同时性转移;在其余31例(64%)无同时性转移的患者中,22例(占总队列的46%)在疾病进展过程中出现异时性转移。在发生转移(包括同时性和异时性转移)的患者中(占总队列的81%,n=39),最常见的转移部位为淋巴结(51%)、肝脏(33%)、腹膜(18%)和肺部(15%)(表1)。
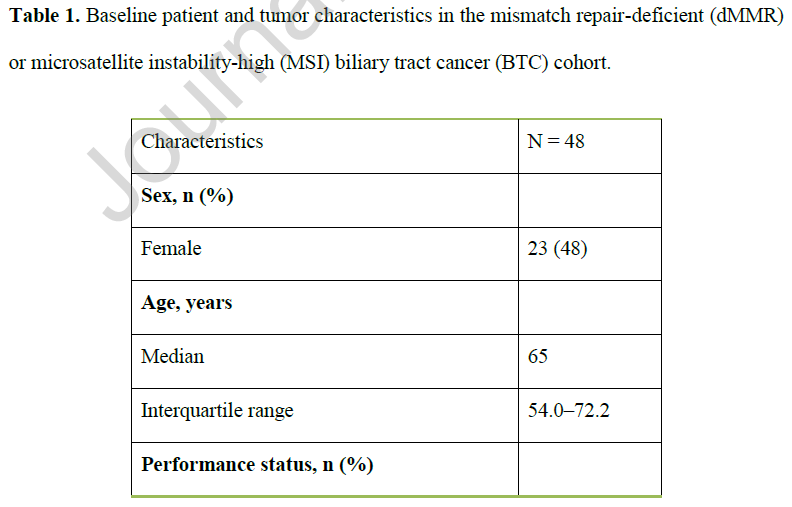
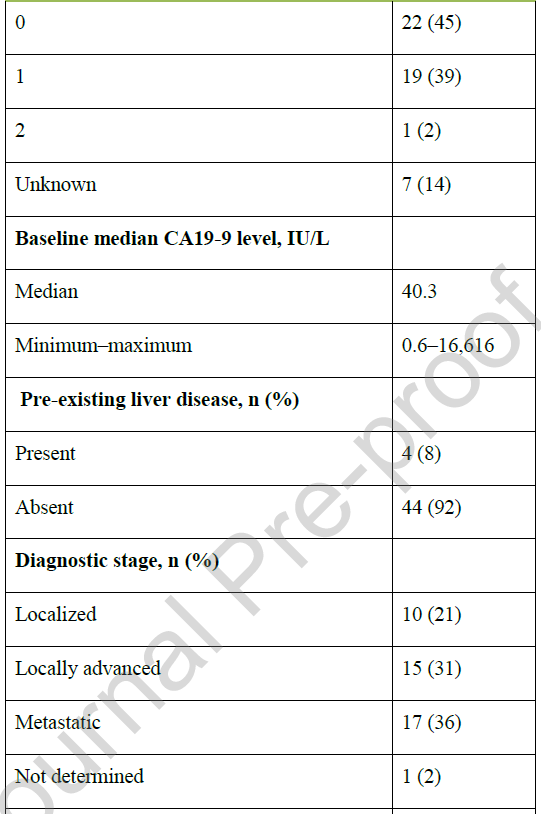
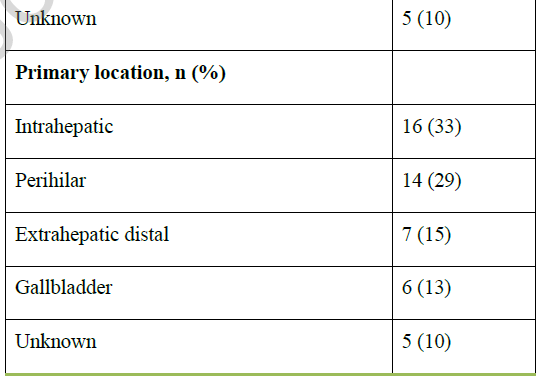
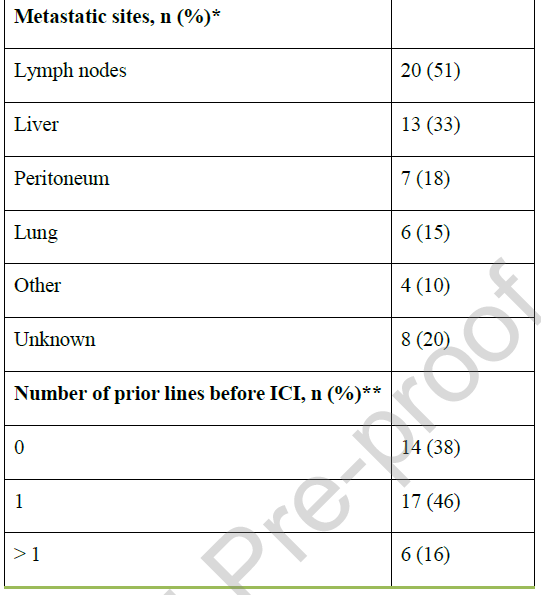
表1
MSI/dMMR状态检测:
2例(4%)患者仅通过PCR确认MSI/dMMR状态,7例(15%)仅通过IHC确认,3例(6%)仅通过NGS确认,36例(75%)通过两种或三种方法联合确认。33例(69%)患者拥有更全面的分子谱数据,其中16例(48%)除MSI/dMMR状态外,还存在其他分子变异。最常见的伴随分子变异涉及以下基因:TP53(12%)、CDKN2A/B(12%)、KRAS(12%)、GNAS(9%)和SMAD4(6%)。部分患者检测出可靶向分子变异,包括IDH1 R132C突变(6%)、FGFR2 Y375C突变(3%)、FGFR3扩增(3%)、BRAF V600E突变(3%)、HER2扩增(3%)、PIK3CA Q546K突变(3%)和EGFR G724S突变(3%)。
治疗方案:
局部治疗
25例(52%)患者接受了手术治疗,其中17例(68%)达到R0切除(肿瘤完全切除,切缘无肿瘤残留),5例(20%)为R1切除(切缘镜下可见肿瘤残留),1例(4%)为R2切除(切缘肉眼可见肿瘤残留),2例(8%)切除状态未知。在接受手术的患者中,74%接受了辅助化疗,其中59%的辅助化疗方案包含卡培他滨。20例(80%)患者术后出现复发,中位无复发生存期为6.5个月(95%CI:2.8-14)。
全身治疗
44例(92%)患者在疾病晚期接受了全身治疗,其中5例(11%)无转移,因疾病处于不可切除局部晚期而接受治疗(图1)。在一线治疗中,30例(68%)患者仅接受化疗,主要方案为吉西他滨联合顺铂或奥沙利铂;10例(23%)患者接受ICIs联合化疗(具体方案:度伐利尤单抗1500mg,联合吉西他滨1000mg/m²、顺铂25mg/m²,于治疗第1天、第8天、第21天给药);4例(9%)患者接受PD-1抑制剂单药治疗。
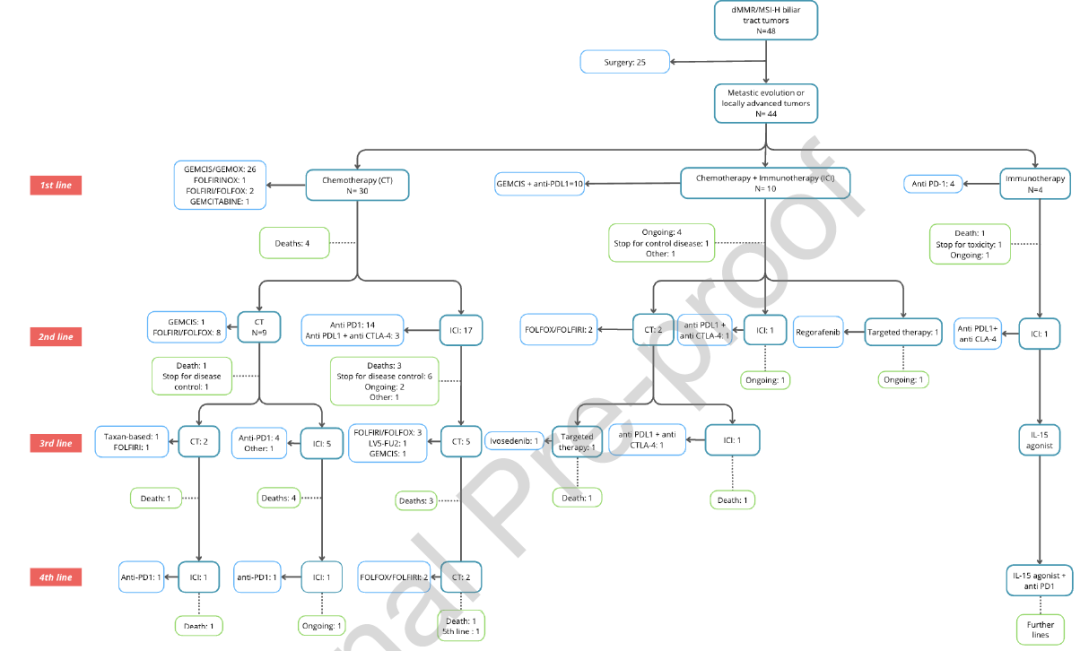

图1
总体而言,37例(77%)患者接受了ICIs治疗:10例(27%)为一线联合化疗,4例(11%)为一线单药治疗,23例(62%)为后线治疗(包括单药治疗或与另一种ICIs联合治疗)(图1)。在开始ICIs治疗前,患者平均接受过1.3线前期治疗(表1)。疾病进展过程中,10例患者参与了临床试验,其中多数在一线治疗后入组;6例患者接受PD-1抑制剂治疗,3例患者接受细胞毒性T淋巴细胞相关抗原4(CTLA-4)抑制剂联合PD-L1抑制剂治疗。
耐受性:
接受ICIs治疗患者的不良反应(AEs)总结于表2,按“ICIs单药或双ICIs联合治疗”与“ICIs联合化疗”两类情况分类统计。
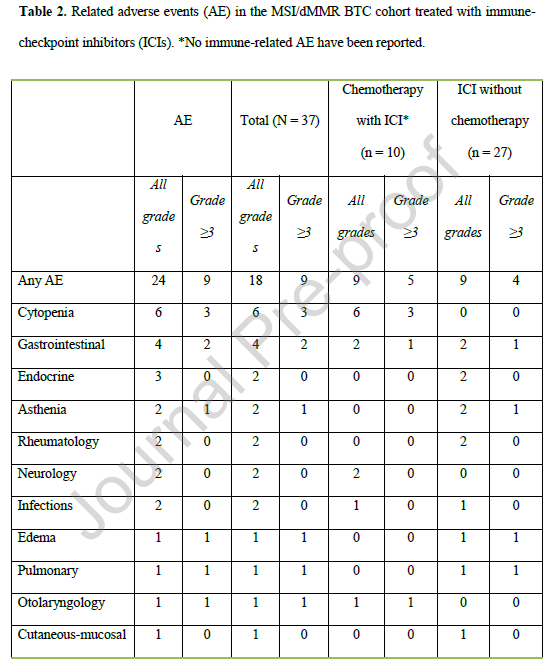
表2
无论是ICIs单药治疗、双ICIs联合治疗,还是ICIs联合化疗,总体耐受性良好。在37例接受ICIs治疗的患者中,4例(11%)出现3-4级免疫相关不良反应(irAEs),具体包括肺炎、重度水肿、乏力和结肠炎;最常见的irAEs为关节炎(5%)和垂体炎(5%),未报告5级irAEs。2例患者在接受帕博利珠单抗单药治疗6个周期后停用免疫治疗,1例因肺炎停药,1例因感染停药。
在10例接受ICIs联合化疗的患者中,5例(50%)出现3-4级不良反应,其中3例因此停用化疗。这些3-4级不良反应包括3例血液毒性、1例非免疫相关性消化道毒性,以及1例在接受8个周期顺铂治疗后出现的耳毒性。最常见的不良反应为血细胞减少(60%)、神经毒性(20%)和胃肠道毒性(20%)。
ICIs在晚期及转移性疾病阶段的疗效:
从开始接受ICIs治疗起,患者的OS为40.9个月(95%CI:16.39-未达到),3年总生存率为53.8%(图2A)。接受ICIs治疗患者的ORR为36%,其中6例(17%)达到CR,7例(19%)达到PR;疾病控制率(DCR)为75%,14例(39%)患者达到疾病稳定(SD),而无论治疗线数如何,25%的患者在ICIs治疗期间出现初始疾病进展(PD)。在一线治疗中使用ICIs时,ORR为50%;在后线治疗中使用时,ORR为27%。
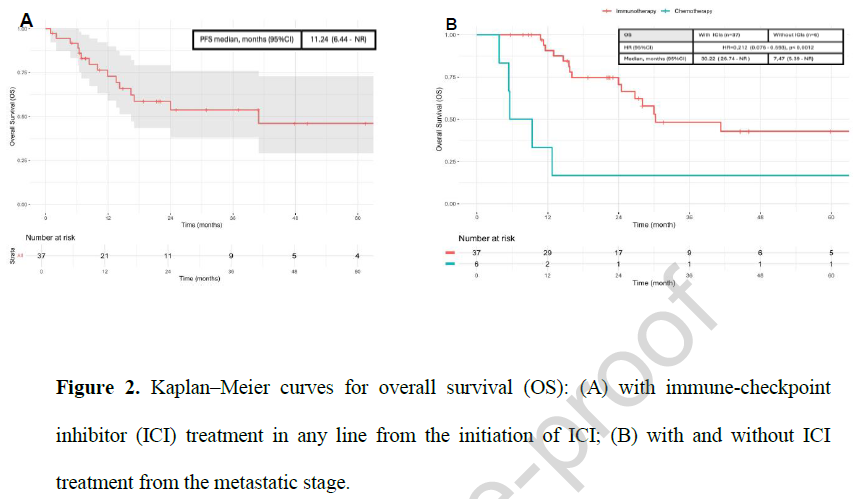
图2
从确诊晚期或转移性疾病时开始计算:接受过任意线ICIs为基础治疗方案的患者(n=37),其OS为30.2个月(95%CI:26.74-未获得);而未接受ICIs治疗的患者(n=6),其OS为7.5个月(95%CI:5.39-未达到),两组风险比(HR)为0.21(95%CI:0.08-0.59),差异具有统计学意义(P<0.001)(图2B)。当ICIs用于一线治疗时,患者的OS为41.3个月(95%CI:未达到-未达到),2年总生存率为76%。从开始接受ICIs治疗起,无论治疗线数如何,患者的PFS为11.2个月(95%CI:6.44-未达到),41.7%的患者在2年时未出现疾病进展(图3A)。当ICIs用于一线治疗时,PFS为30.9个月(n=14,95%CI:8.1-未获得);而当ICIs用于后线治疗时,PFS为7.9个月(n=22,95%CI:5.16-未达到),两组HR为1.27(95%CI:0.51-3.16),差异无统计学意义(P=0.61)(图3B)。
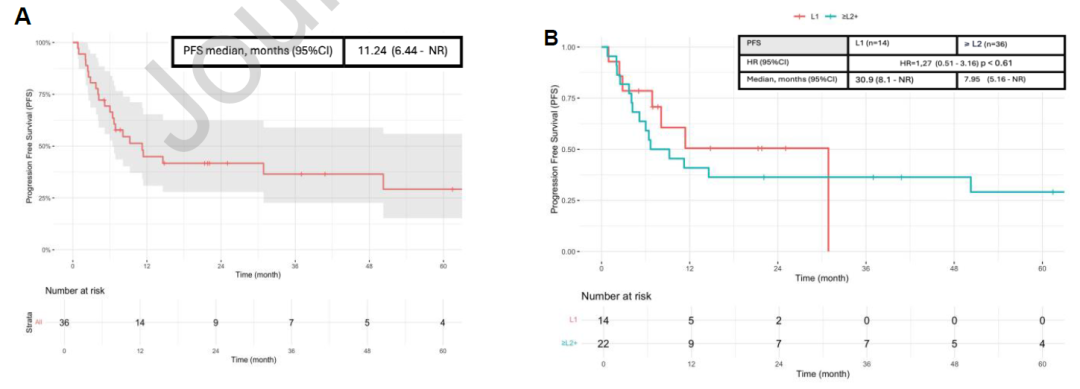

图3
在单变量分析中,诊断时疾病已处于晚期、治疗应答不佳(PD vs CR、PR、SD)与OS缩短相关,而接受ICIs治疗与OS改善相关。在多变量分析中,诊断时疾病处于晚期(HR:11.6,95%CI:2.2-61.1,P=0.0035)、实体瘤疗效评价标准(RECIST)应答情况(HR:5.8,95%CI:1.3-26.4,P=0.02)以及是否接受ICIs治疗(HR:0.02,95%CI:0.003-0.19,P=0.0005)仍与OS存在显著相关性。
ICIs治疗后的后续治疗:
3例患者在接受ICIs治疗后接受了手术:1例为一线ICIs联合化疗后手术,2例为后线ICIs单药治疗后手术。其中2例患者在完成辅助化疗后1-12个月内出现肺部转移复发,第3例患者目前仍处于缓解状态。
在一线或后线ICIs治疗进展后,4例患者接受了ICIs再挑战治疗(图1):1例患者在接受CLEVER-1抑制剂治疗后改用度伐利尤单抗,目前已治疗2年,疗效评估为SD;2例患者接受PD-1抑制剂联合CTLA-4抑制剂治疗,其中1例疗效评估为PD,另1例达到SD,目前仍在接受纳武利尤单抗治疗;最后1例患者在3年期间接受了7线不同治疗方案,包括多种ICIs方案(多塔利尤单抗,最佳疗效:PD;伊匹木单抗/纳武利尤单抗,疗效:SD;IL-15激动剂联合帕博利珠单抗)、4线化疗以及PRMT5抑制剂,但最终均出现疾病进展。
讨 论
相较于标准化疗,ICIs联合化疗已被证实可改善晚期BTC患者的生存结局,目前国际指南已推荐该方案作为晚期BTC的一线治疗方案。近年来,学界对实体瘤的分子机制认知取得显著进展,尤其是对MSI的研究——MSI是最早被报道的“不限瘤种”分子生物标志物之一。
据研究者所知,本研究是首个针对MSI/dMMR BTC患者的真实世界队列研究。研究结果显示,无论采用ICIs联合化疗还是ICIs单药治疗,与ICIs在整体BTC人群中的临床试验报道相比,ICIs治疗可显著改善MSI/dMMR BTC患者的OS。接受ICIs治疗的MSI/dMMR BTC患者,从确诊转移性疾病阶段起的中位OS为30.2个月,这一数据显著长于以下研究结果:KEYNOTE-966试验和TOPAZ试验中整体BTC人群的12.7个月与12.9个月、KEYNOTE-158试验中MSI/dMMR胆管癌亚组的24.3个月,以及KEYNOTE-158试验中所有MSI/dMMR非结直肠肿瘤的19.8个月。然而,本研究中的中位OS仍短于KEYNOTE-177试验中观察到的77.5个月——该试验确立了帕博利珠单抗单药治疗作为MSI/dMMR转移性结直肠癌一线治疗新标准的地位。在本研究队列中,患者对ICIs治疗表现出持久应答,41.7%的患者在治疗2年后未出现疾病进展,且这些患者均接受ICIs单药治疗。
BTC肿瘤的分子谱分析已受到广泛关注,约80%的BTC存在分子变异,40%-50%存在可靶向分子变异(如IDH1/2突变(19%)、FGFR1/2变异(16%)或ERBB2/ERBB3变异(16%))。在本研究中,具备分子谱数据的患者中,16例(48%)被检测出额外分子变异,这一比例低于其他针对整体BTC人群的研究。尽管如此,本研究仍检测到可靶向共突变,提示即使在这一罕见患者群体中,免疫治疗后采用精准肿瘤治疗策略仍具有潜在可能性。
本研究未发现新的安全性信号,尤其值得注意的是,ICIs治疗的安全性特征可控,AEs发生率较低。在本队列中,未联合化疗接受ICIs治疗的患者中,3-4级AEs发生率为15%;而接受ICIs联合化疗的患者中,3-4级AEs发生率为50%。现有文献显示,MSI/dMMR转移性肿瘤患者接受ICIs治疗时,3-4级AEs发生率为11.1%-56.0%;而在KEYNOTE-966试验和TOPAZ-1试验中,接受顺铂联合吉西他滨(CISGEM)分别联合帕博利珠单抗或度伐利尤单抗治疗的患者,3-4级AEs发生率为70%-75.7%。
本研究存在若干局限性:首先,纳入周期跨度较大,涵盖了ICIs尚未获批用于一线治疗的时期,导致治疗策略存在差异。仅14例患者接受ICIs一线治疗,其中2015-2022年期间有4例,2022年后有10例接受ICIs联合化疗,这使得该亚组患者的随访时长存在显著异质性。其次,样本量较小且治疗策略存在差异,限制了对后线治疗患者的分析;为缓解这一问题,研究者在分析OS时未限定治疗线数。此外,本研究中AEs发生率相对较低,部分原因可能是队列规模有限及回顾性研究设计的固有局限。
另一局限性在于,本队列缺乏胚系检测数据。尽管有报道称BTC中林奇综合征的发生率不足2%,但本队列中42%的患者表现出IHC检测下MSH2和/或MSH6蛋白缺失,或单纯PMS2蛋白缺失——这些结果高度提示林奇综合征可能。该结果强调,对于MSI/dMMR肿瘤患者,应常规推荐其接受基因筛查。最后,本研究中MSI/dMMR状态的判定未经过集中复核,可能存在分类错误风险;但这是所有真实世界研究均存在的固有局限性。
本研究是目前规模最大的MSI BTC患者回顾性队列研究,证实了ICIs对MSI/dMMR BTC患者具有显著治疗获益,表明ICIs在该亚组患者中具有长期疗效,同时支持对所有转移性肿瘤患者(无论肿瘤类型,包括BTC)常规开展MSI/MMR筛查。即使采用ICIs单药治疗,MSI/dMMR BTC患者仍能获得良好且持久的治疗应答,这提示对于该亚组患者,一线治疗中可能无需联合化疗,此举或可提高患者耐受性并改善生活质量。
参考文献:
Campo-Le-Brun, Iona et al. “Real-world efficacy of immune checkpoint inhibitors in microsatellite unstable/mismatch repair-deficient biliary tract cancer: An AGEO study.” European journal of cancer (Oxford, England : 1990) vol. 227 (2025): 115670. doi:10.1016/j.ejca.2025.115670


