Nat Commun 空军军医大学西京医院陶凌/闫文俊/赵会寿发现支链氨基酸代谢障碍是促进糖尿病向糖尿病肾病进展的关键危险因素
时间:2025-09-04 12:11:10 热度:37.1℃ 作者:网络
糖尿病肾病(DKD)作为糖尿病最常见的微血管并发症之一,困扰着全球30%-40%的糖尿病患者。DKD的进展速度和严重程度存在着异质性。有些患者肾功能下降相对较快,而另一些患者尽管患糖尿病数十年,肾功能仍然保持正常。只有15%-25%的1型糖尿病患者或30%-40%的2型糖尿病(T2DM)患者会发展为DKD。那些未发展为DKD的个体,尽管患糖尿病超过50年,但是仅表现出轻微的肾脏病理改变。这些证据表明,除了传统的危险因素(如高血糖、高血压)以外,可能存在新的决定DKD发生的“决定性关键环节”。
2025年8月25日,空军军医大学西京医院陶凌/闫文俊/赵会寿团队在Nature Communications杂志上发表题为“Branched Chain Amino Acids Contribute to Diabetic Kidney Disease Progression via PKM2 Mediated Podocyte Metabolic Reprogramming and Apoptosis”的研究论文。该研究揭示了一个隐藏在肾小球足细胞中的代谢奥秘—支链氨基酸(BCAA)代谢障碍,可能是触发DKD发生发展的关键“缺失环节”。该研究发现DKD患者和db/db小鼠肾小球足细胞出现显著的BCAA分解代谢障碍,是促进糖尿病向早期DKD进展的危险因素。团队构建足细胞特异性PP2Cm(一种BCAA分解代谢关键酶)敲除小鼠,或给予高脂饮食小鼠额外补充BCAA,结果均诱发明显DKD症状。机制上,BCAA会促使足细胞中PKM2蛋白解聚失活。失活的PKM2一方面抑制葡萄糖氧化磷酸化,使葡萄糖代谢转向丝氨酸合成与叶酸代谢,打乱足细胞能量平衡;另一方面与DDIT3蛋白结合进入细胞核,增强其转录活性,促进促凋亡基因Chac1和Trib3表达,直接导致足细胞凋亡。该研究揭示了足细胞中BCAA分解代谢障碍是决定DKD发生和进展的关键因素之一,通过靶向BCAA代谢或激活PKM2有望成为预防DKD进展的新策略。

首先,作者分析the Joslin Medalist Study研究中DKD患者和(糖尿病病史≥50年)非DKD患者肾小球蛋白质组学数据,发现DKD患者BCAA分解代谢酶有广泛下调趋势。通过对24小时尿液样本进行非靶向代谢组学分析,发现在早期DKD的男性和女性患者尿液中,支链氨基酸代谢产物的水平显著高于糖尿病病程为15年的非DKD患者。通过肾组织穿刺收集了非DKD患者和DKD患者的肾活检样本,并分别测定了肾小球切片和肾近端小管BCAA分解代谢酶水平。结果发现,DKD患者肾小球中P-BCKDE1α (Ser 293)(BCAA分解代谢限速酶)的水平显著高于非DKD患者,但在近端小管中无显著变化。为了明确P-BCKDE1α在肾小球不同细胞类型中的分布,作者进行了过碘酸-希夫(PAS)染色和P-BCKDE1α双重染色,发现高表达P-BCKDE1α (Ser 293)的细胞位于基底膜外侧。通过WT1与P-BCKDE1α的双重染色,证实P-BCKDE1α (Ser 293)定位于WT1(足细胞特异性标志物)阳性细胞。此外,作者发现DKD男性和女性患者足细胞中PP2Cm的表达显著低于非DKD患者。
接下来,作者在纯化的肾小球发现,与C57BL/6小鼠相比,雄性和雌性db/db小鼠肾小球中PP2Cm的表达显著降低,而P-BCKDE1α (Ser 293)与总BCKD的表达比值显著升高。作者还在db/db小鼠的肾切片中进行了WT1与P-BCKDE1α (Ser 293)或PP2Cm的双重染色。与DKD患者的结果一致,在db/db小鼠肾小球中,WT1阳性染色所示的足细胞中PP2Cm的表达显著降低,而P-BCKDE1α (Ser 293)的表达显著升高。随后作者检测了离体肾小球中支链氨基酸和支链α-酮酸的水平,发现db/db小鼠肾小球中BCAA和支链α-酮酸的水平也显著高于C57BL/6小鼠。此外,作者发现,高糖显著降低了原代足细胞PP2Cm的mRNA和蛋白水平,同时增加了P-BCKDE1α (Ser 293)与BCKD的表达比值,但对近端小管细胞无显著影响。分析人类DKD单细胞RNA测序和单细胞转座酶可及性染色质测序数据也显示,足细胞中PP2Cm的mRNA表达以及基因活性和可及性降低,而近端小管细胞中无明显变化。这些结果表明,在DKD条件下,足细胞易发生支链氨基酸分解代谢障碍。DKD患者以及小鼠的肾小球足细胞存在支链氨基酸分解代谢缺陷。
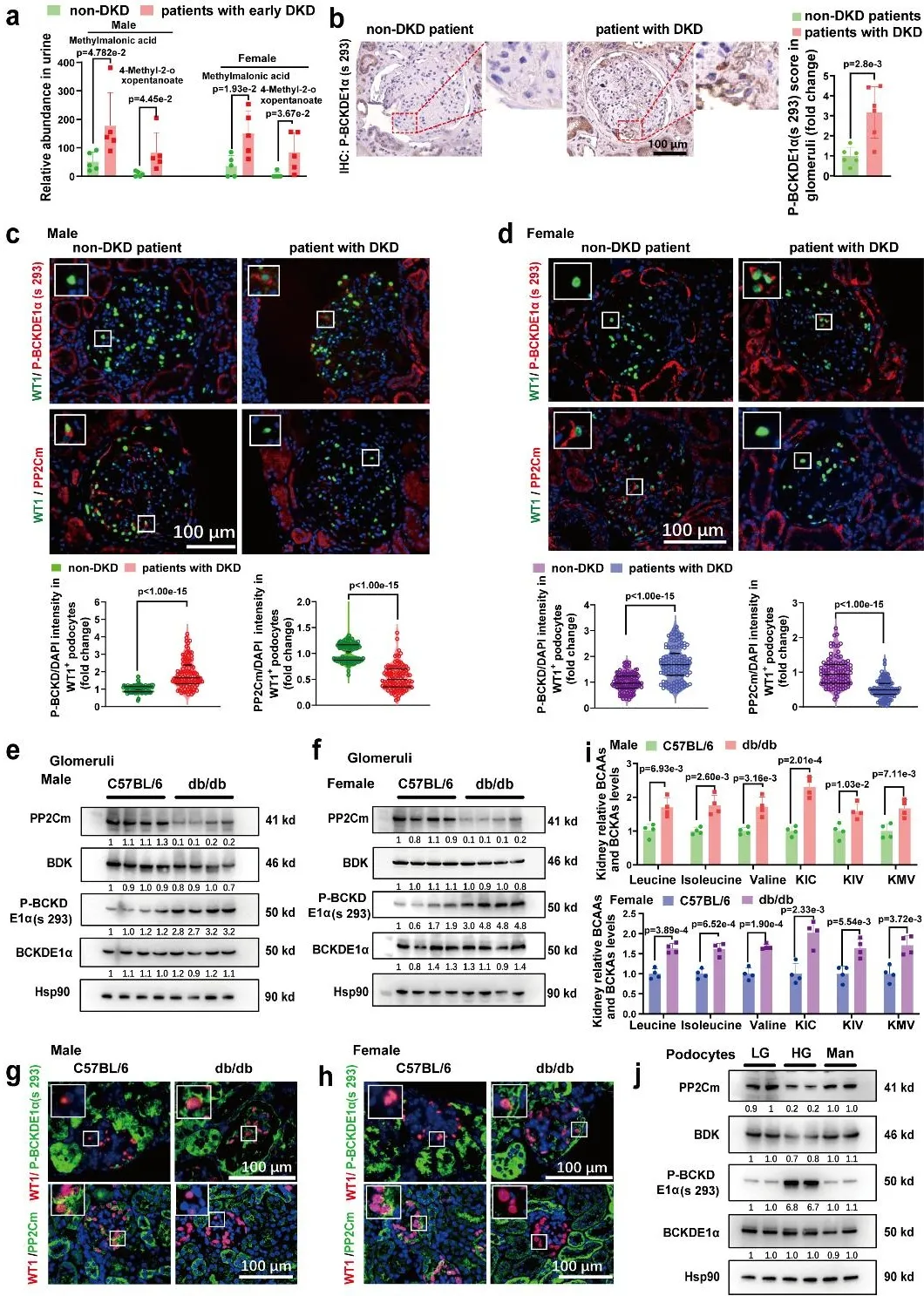
图1. 糖尿病肾病(DKD)患者和模型小鼠的肾小球足细胞存在支链氨基酸(BCAA)分解代谢缺陷
为阐明足细胞BCAA分解代谢缺陷与DKD进展之间的因果关系,作者利用Nphs2-Cre⁺小鼠与PP2Cmf/f小鼠杂交,构建了足细胞特异性PP2Cm敲除小鼠(PP2Cmf/f Cre⁺,一种支链氨基酸分解代谢缺陷小鼠模型)。随后,作者给予PP2Cmf/f Cre⁺小鼠及其野生型同窝对照小鼠喂食高脂饮食16周。作者发现,足细胞特异性PP2Cm敲除显著提高了小鼠肾重/体重比,加剧了系膜基质扩张,并通过甘油三酯(TG)检测和油红O染色证实肾脏脂滴蓄积增加。一致地,透射电子显微镜(TEM)分析显示,足细胞特异性PP2Cm敲除促进了足突融合,并显著增加了基底膜厚度。与高脂饮食喂养的PP2Cmf/f小鼠相比,高脂饮食喂养的PP2Cmf/f Cre⁺小鼠足细胞数量显著减少,而肾小球细胞凋亡显著增加,且足细胞特异性标志物(如Nephrin、Nphs2、P-钙粘蛋白和突触足蛋白(Synpo))的mRNA和蛋白表达显著降低。此外,作者发现高脂饮食喂养的PP2Cmf/f Cre⁺小鼠尿白蛋白/肌酐比值显著升高。体外实验中,BCAA可直接诱导原代足细胞中Synpo和Nphs2蛋白水平下调。这些结果表明,足细胞特异性BCAA分解代谢缺陷会导致足细胞损伤和凋亡,并引发高脂饮食喂养肥胖小鼠的肾损伤。
此外,作者还通过给予高脂饮食喂养小鼠外源性补充BCAA,构建了BCAA过载小鼠模型。BCAA补充显著提高了小鼠血浆BCAA水平,增加了肾重/体重比,并加剧了系膜基质扩张和管型形成。此外,BCAA饮食补充显著增加了肾脏脂滴蓄积。TEM分析显示,近端肾小管上皮细胞刷状缘中存在大量脂滴蓄积,这一现象证实血脂从肾滤过膜屏障渗漏到肾小管管腔,并被肾近端小管细胞重吸收。TEM还显示,BCAA补充显著加剧了高脂饮食诱导的肾小球基底膜增厚和足突融合。在高脂/BCAA组小鼠中,BCAA补充显著减少了足细胞数量,同时显著增加了足细胞凋亡。此外,BCAA蓄积显著降低了足细胞标志物的mRNA和蛋白表达水平。而且,作者发现与高脂配对喂养组相比,BCAA补充显著提高了小鼠尿白蛋白/肌酐水平。综上,作者证实BCAA分解代谢缺陷和过载会通过诱导足细胞损伤和丢失,促进DKD进展。
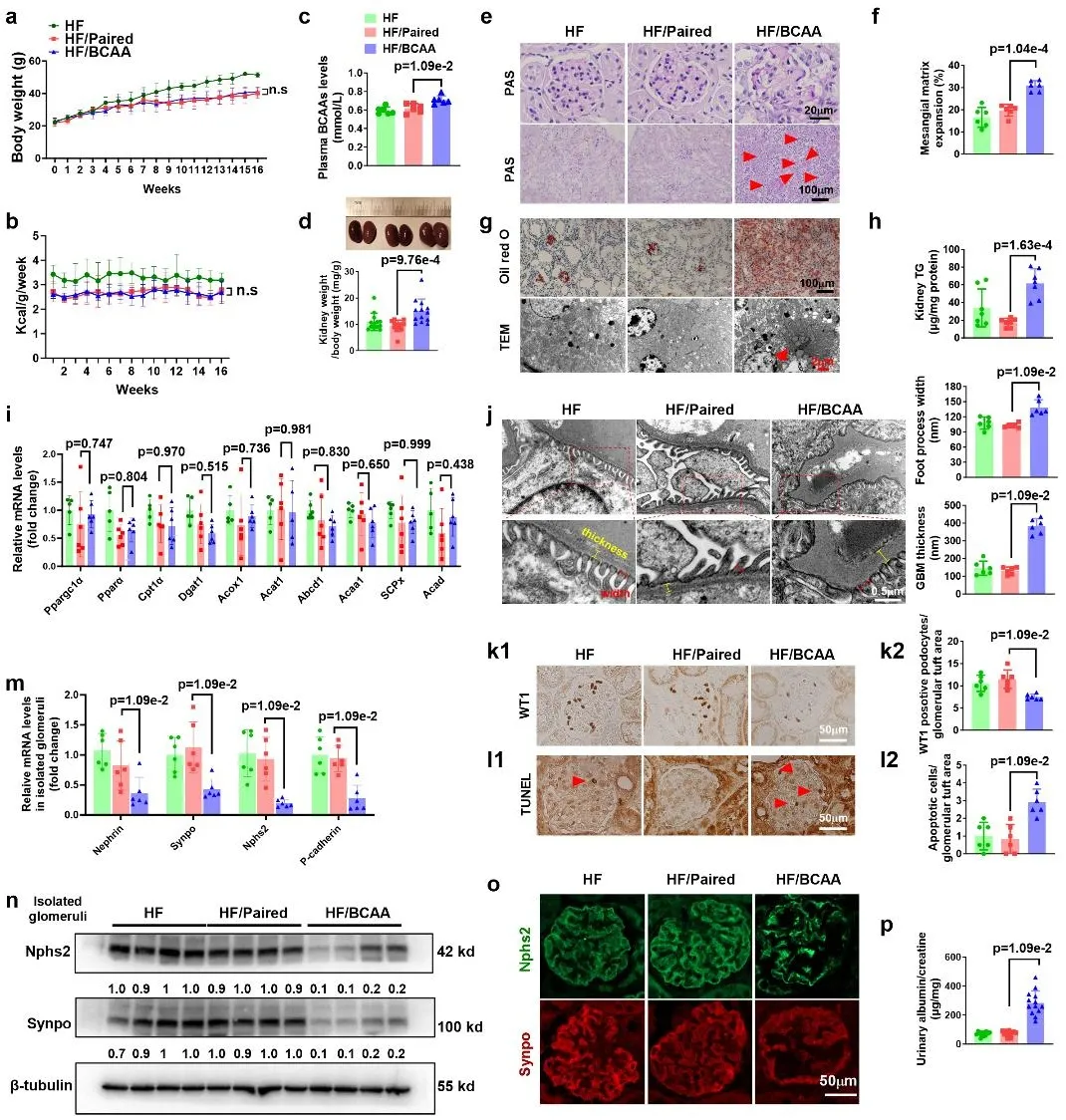
图2. 高脂饮食补充BCAA促进肥胖小鼠DKD相关肾损伤
为阐明BCAA诱导足细胞功能障碍与死亡的机制,作者对高糖(HG)或高糖+BCAA (HG/BCAA)处理的已分化MPC-5足细胞进行RNA-seq测序,分析其转录组特征。GO分析显示,HG/BCAA组中上调丝氨酸生物合成与叶酸代谢相关基因表达。Seahorse分析检测表明,BCAA抑制足细胞氧化磷酸化活性,但促进糖酵解来源酸性物质的生成。作者采用Uniformly碳-13标记葡萄糖([U-¹³C6]葡萄糖)进行葡萄糖代谢流碳追踪实验,发现BCAA显著提高原代足细胞中丝氨酸和甘氨酸的生物合成速率及池容量,同时显著降低葡萄糖来源的丙酮酸、乳酸及三羧酸循环中间代谢物(如琥珀酸、谷氨酸、柠檬酸)的生成。综上,这些数据表明,BCAA可抑制足细胞葡萄糖氧化磷酸化,同时促进葡萄糖代谢向丝氨酸生物合成与叶酸代谢转移。
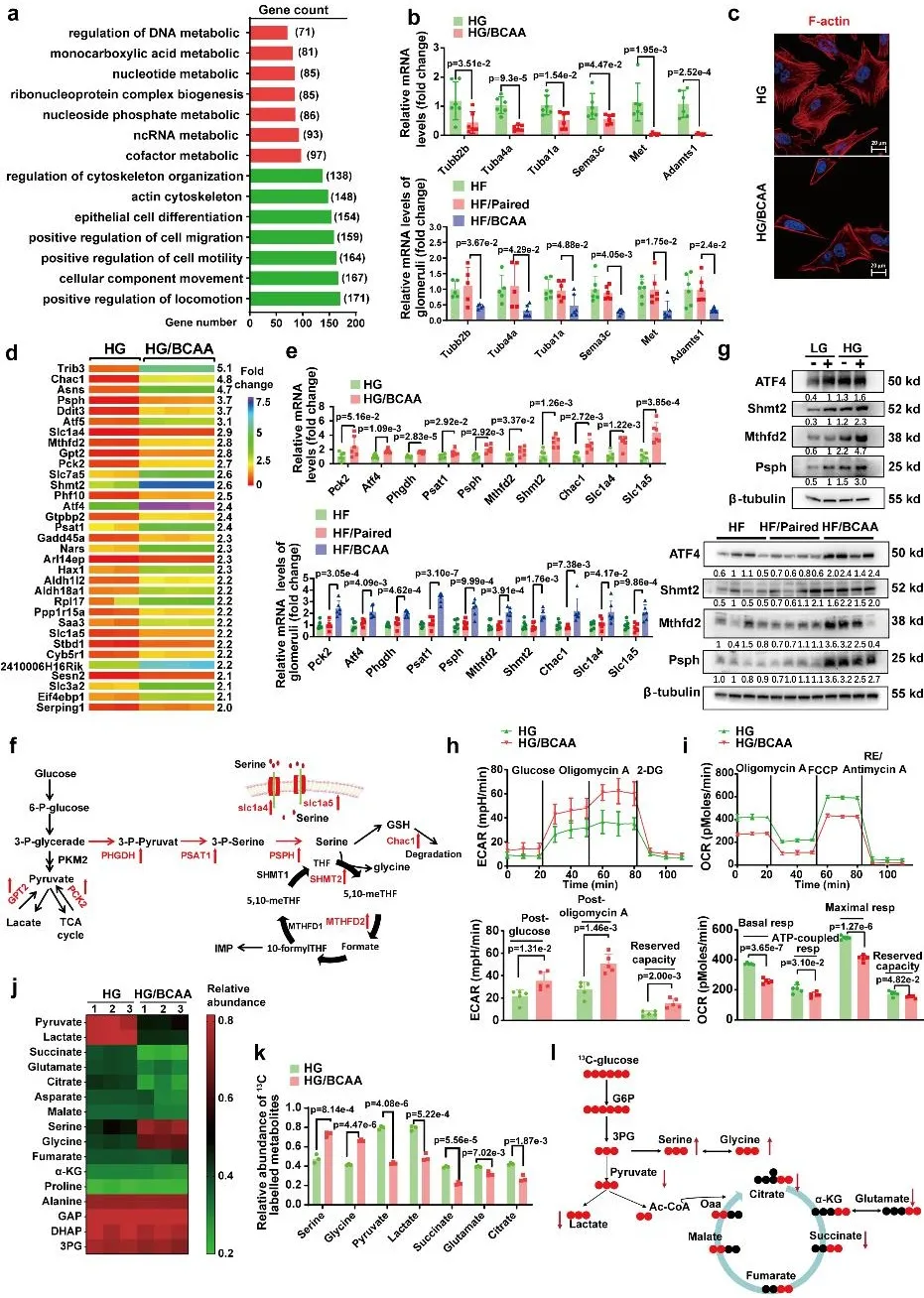
图3. BCAA诱导足细胞糖代谢向丝氨酸合成、叶酸代谢分流
为明确DKD患者肾脏中丝氨酸生物合成与叶酸代谢是否同样增强,作者分析了非DKD患者与DKD患者的尿液代谢谱。通过质谱检测,在尿液中共鉴定出4233种代谢物。热图显示非DKD组与DKD组之间存在430种差异表达的尿液代谢物。GO基因与KEGG通路富集分析表明,叶酸代谢通路以及甘氨酸、丝氨酸与苏氨酸代谢通路在DKD患者中显著富集。值得注意的是,叶酸代谢是富集程度最高的通路,包含7种丰度显著差异的中间代谢物。DKD组(包括男性和女性)中2种丝氨酸生物合成代谢物和6种叶酸代谢物的丰度均显著升高。
免疫荧光染色结果也显示,DKD患者肾小球中叶酸代谢关键酶(MTHFD2、SHMT2)以及丝氨酸生物合成关键酶(PSPH)的表达水平均显著升高。更重要的是,这些酶均定位于WT1阳性的足细胞中。DKD患者尿液和肾脏样本的数据,进一步验证了动物实验中“BCAA分解代谢缺陷促进足细胞丝氨酸生物合成与叶酸代谢”的研究结论。
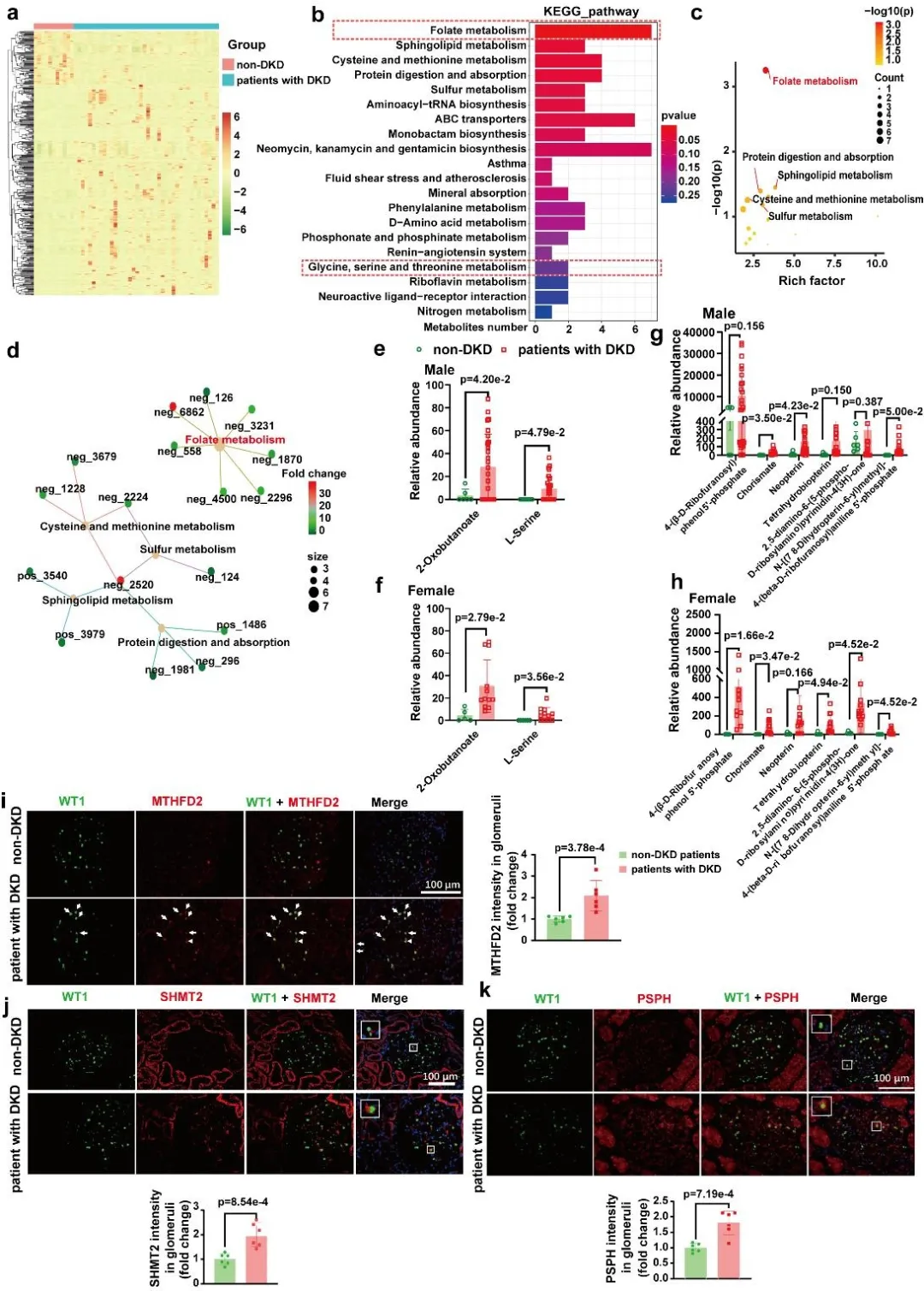
图4. DKD患者肾小球足细胞丝氨酸合成和叶酸代谢显著上调
深入研究发现,BCAA的异常堆积会引发一系列连锁反应,而丙酮酸激酶M2 (PKM2)正是这场代谢风暴的核心调控者。正常情况下,PKM2以四聚体形式存在,高效催化糖酵解最后一步反应。但在BCAA积累的环境中,BCAA显著增加PKM2在Ser 37和Tyr 105位点的磷酸化水平,促进PKM2解聚和失活,导致葡萄糖氧化磷酸化受抑,葡萄糖代谢被“强行分流”:原本进入三羧酸循环供能的葡萄糖,转而流向丝氨酸合成和叶酸代谢途径,介导了BCAA诱导的足细胞代谢重编程,细胞能量供应陷入困境。更为关键的是,失活的PKM2会"改道"进入细胞核,与转录因子DDIT3结合,PKM2发挥共转录因子的作用通过促进DDIT3转录激活Chac1和Trib,直接诱导足细胞死亡。
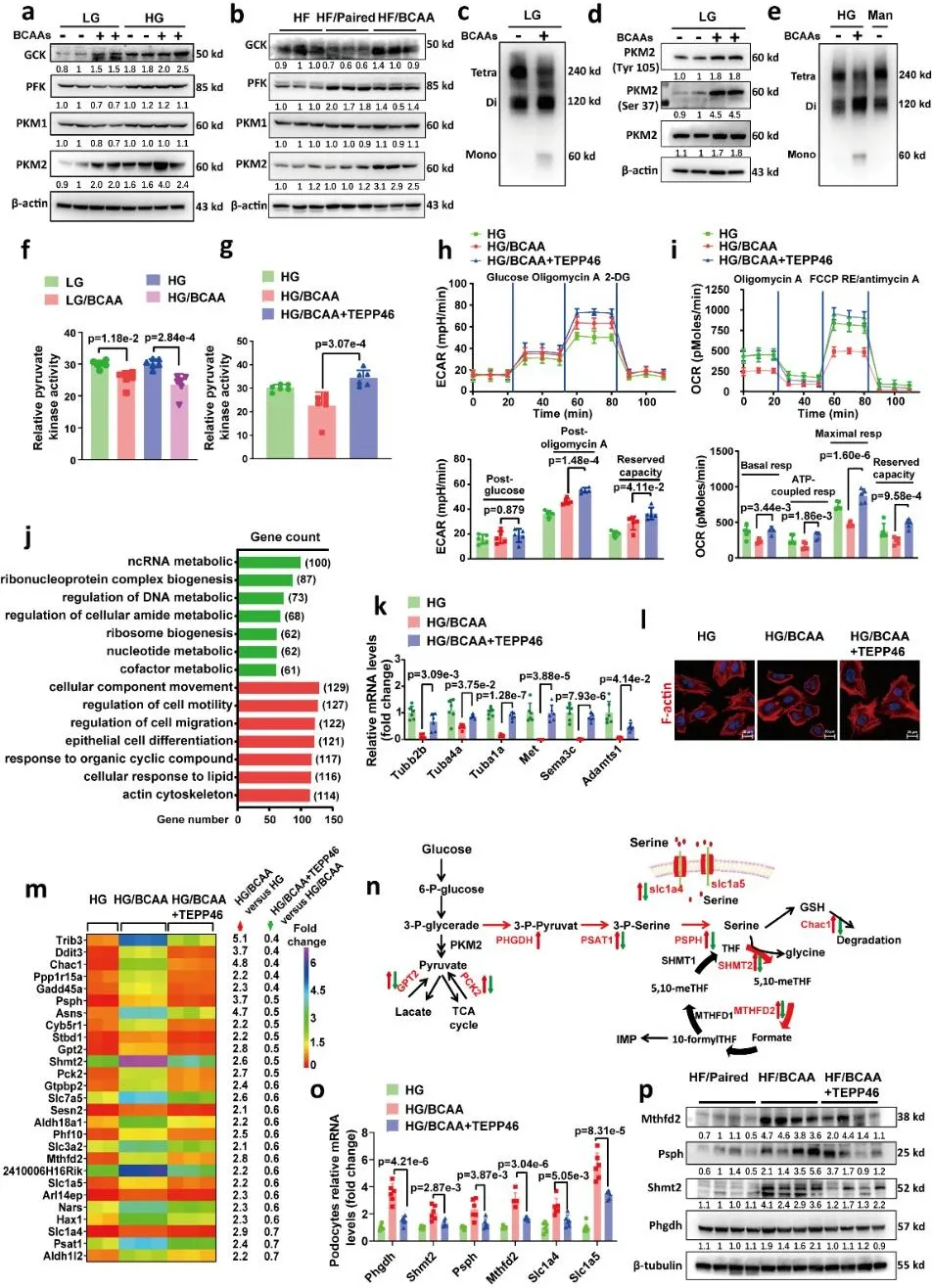
图5. PKM2解聚和失活介导BCAA代谢障碍诱导的足细胞代谢重编程
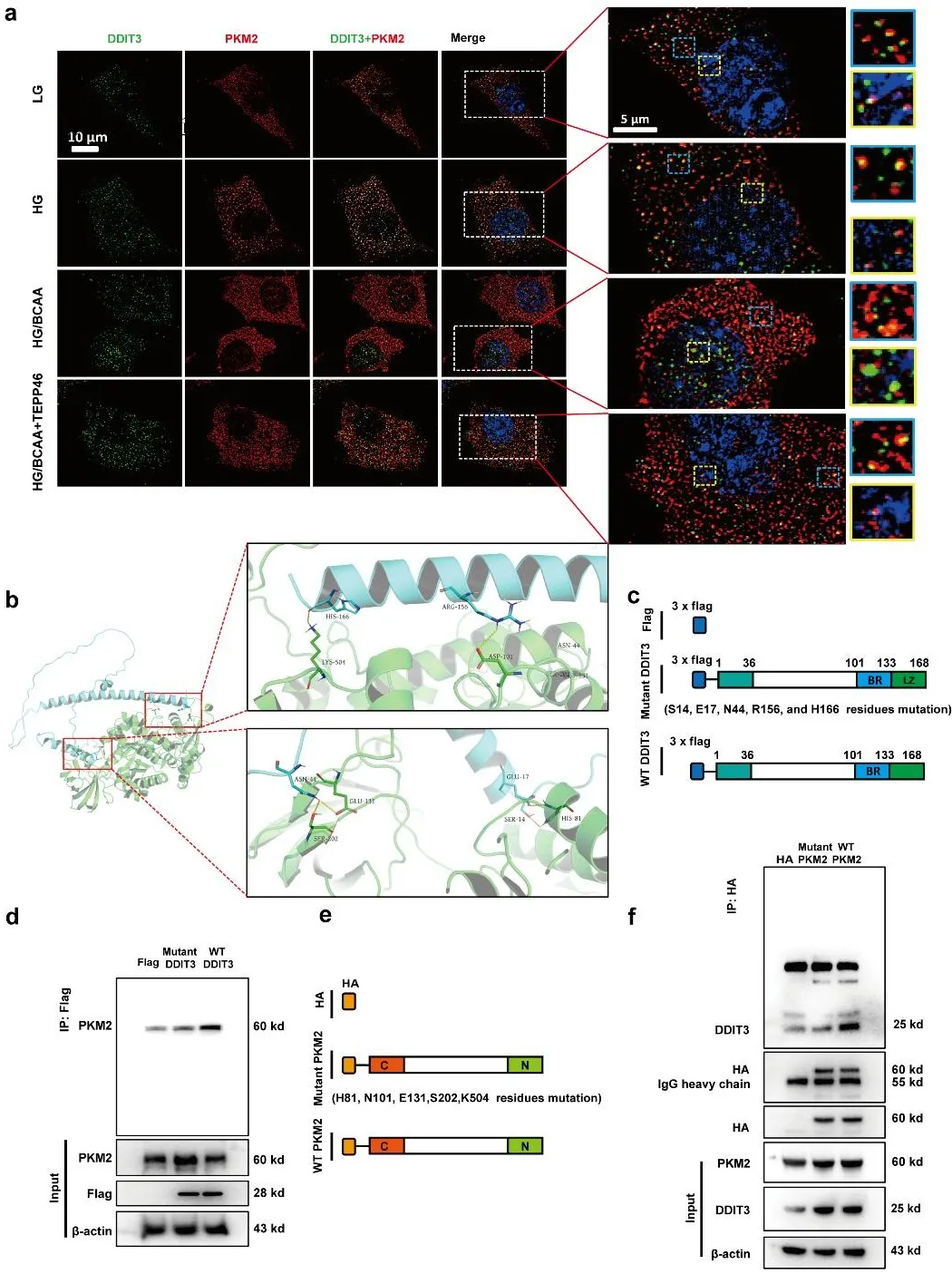
图6. BCAA促进高糖培养条件下足细胞PKM2入核并和DDIT3结合
最后,作者分别使用PKM2激动剂TEPP46激活PKM2或者BCAA分解代谢激动剂(BCKDK抑制剂)BT2,逆转BCAA代谢障碍诱导肥胖小鼠糖尿病相关肾损伤,阻断DKD进展。
图7. PKM2激动剂TEPP46逆转高脂饮食补充BCAA诱导的糖尿病肾损伤
综上,这项研究为DKD的防治提供了全新视角:(1) 早期预警:DKD患者尿液中BCAA代谢产物或可作为疾病早期诊断的生物标志物;(2) 治疗新靶标:激活BCAA代谢(如使用BDK抑制剂BT2)或恢复PKM2活性(如使用TEPP46),可能防治糖尿病向DKD进展(在动物模型中已显示出显著的肾脏保护作用);(3) 饮食干预:合理限制BCAA摄入可能成为辅助防治DKD的策略。值得注意的是,这项研究首次揭示了足细胞BCAA代谢异常在DKD发病中的核心作用,颠覆了传统认为DKD仅是“微血管病变”的认知。未来,针对足细胞BCAA代谢和代谢重编程的精准干预,有望为阻止DKD发生发展提供新的治疗方向。
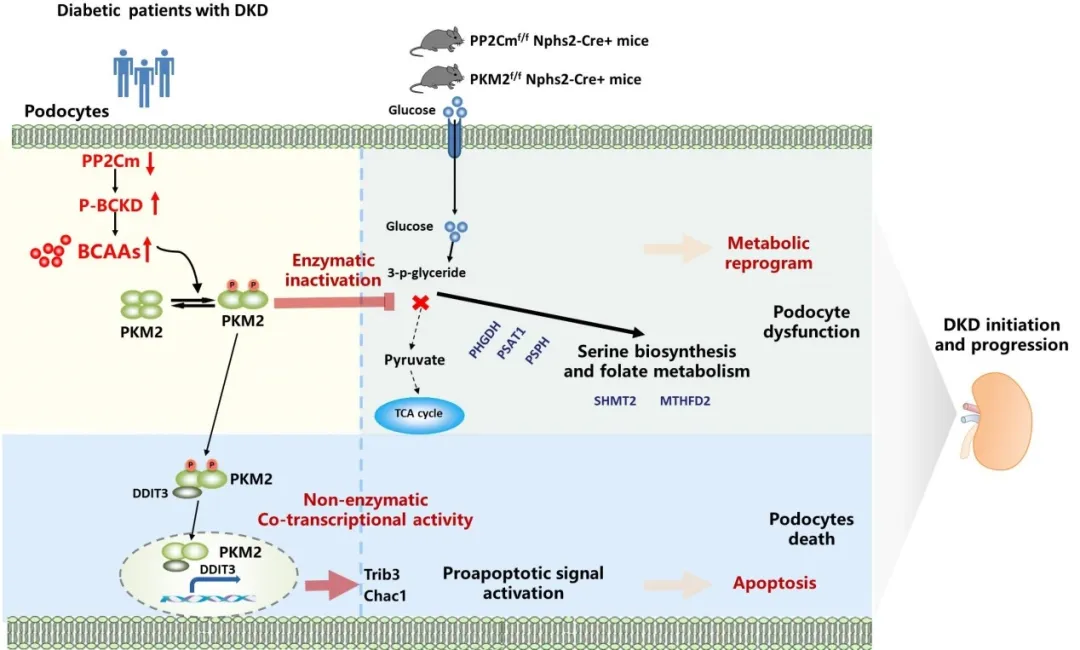
图8. BCAA代谢障碍诱导足细胞代障碍和凋亡,促进DKD发生发展
该项工作主要由空军军医大学西京医院心血管内科赵会寿讲师、唐都医院妇产科孙丹博士、西京医院王姗副研究员和刘毅副教授等人共同完成,空军军医大学西京医院心血管内科陶凌教授和闫文俊副教授为文章共同通讯作者。上述工作得到了美国Thomas Jefferson大学马新亮教授和天津医科大学孙海鹏教授的大力支持和无私帮助,受到西京医院肾内科孙世仁主任、西京医院内分泌科和唐都医院内分泌科等的大力支持,得到了国家自然科学基金委经费资助。陶凌教授团队长期致力于代谢性心血管疾病的基础与转化研究,并牵头多项大规模、多中心临床试验,研究成果在Lancet、BMJ、Circulation、European Heart Journal、Circulation Research、Nature Communications等杂志发表。陶凌课题组常年招收优秀的基础医学与临床医学硕士、博士和博士后,欢迎邮件联系:[email protected] (陶凌)或者[email protected] (闫文俊)或者[email protected] (赵会寿)。
本文基于空军军医大学西京医院陶凌教授团队发表的研究成果整理,原文参见Branched-Chain Amino Acids Contribute to Diabetic Kidney Disease Progression via PKM2-Mediated Podocyte Metabolic Reprogramming and Apoptosis, Nat Commun. 2025 Aug 25;16(1):7846. doi: 10.1038/s41467-025-62890-9.


