WES检出MSH6新发胚系致病变异,助力结直肠癌家族史患者优生优育
时间:2025-09-04 17:06:52 热度:37.1℃ 作者:网络
结直肠癌(CRC)是世界上第三大致命癌症,每年约占全球所有癌症诊断病例和癌症相关死亡病例的 10%。除了肥胖、缺乏运动和吸烟等公认的风险因素外,遗传易感性也显著增加CRC的发病风险。对一个确诊为CRC的中国家庭的先证者进行了全外显子测序(WES),以识别潜在的变异。通过Sanger测序证实了MSH6基因的一个胚系致病性变异。采用免疫组织化学(IHC)法验证肿瘤切片中MSH6的蛋白表达。化疗前,先证者的精液在生殖医学科进行了冷冻保存。随后采用单基因疾病植入前遗传学检测(PGT-M)以防止该致病性变异向下一代的垂直传递。研究人员通过WES和Sanger测序证实了MSH6基因的一个新发胚系致病性变异,即c.3438 + 245_4082delinsTGAGACTACATTG,并通过IHC分析验证了肿瘤切片中MSH6的蛋白表达。最终,通过PGT-M技术成功获得健康妊娠。本文研究揭示了CRC中一个新的MSH6胚系致病性变异,并扩大了与肿瘤发生相关的MSH6变异谱。本研究为MSH6胚系致病性变异引起的CRC提供了新的见解,并证明了PGT-M技术作为辅助生殖方法在防止遗传性肿瘤垂直传递方面的潜在应用价值。
背 景
结直肠癌(CRC)是世界上第三常见的恶性肿瘤,男性发病率高于女性,5年生存率为65%。CRC的主要临床症状包括排便习惯改变、腹痛、肠梗阻和贫血。CRC主要通过两种不同的生物学途径发生:传统腺瘤-癌途径和锯齿状癌途径。通过前一种途径发生的CRC占CRC病例的70%-90%,其典型病因包括APC基因变异、RAS通路激活或TP53功能丧失。这些肿瘤大多为微卫星稳定(MSS)。锯齿状致癌途径以RAS和RAF基因变异为特征,约占CRC病例的10%-20%。该途径还与CpG岛甲基化相关,可导致MSS和高微卫星不稳定性(MSI-H)癌症。值得注意的是,MSI-H状态与CpG岛甲基化表型(CIMP)和高突变密切相关,尤其是在右半结肠。
MSI由错配修复(MMR)系统缺陷引起。约15%的CRC病例因MLH1表观遗传沉默或MMR基因(MLH1、MSH2、MSH6或PMS2)之一的变异而表现出MSI。1993年,MSI被报道为CRC中常见的分子现象。此外,MSI在多种肿瘤类型中被发现,包括胃癌、子宫内膜癌、卵巢癌、皮脂腺腺癌、胶质母细胞瘤和淋巴瘤。DNA错配修复(MMR)是通过提高DNA复制和重组的整体保真度来维持基因组完整性的关键系统。其主要功能是识别并纠正单碱基错配、未配对核苷酸以及某些形式的DNA损伤[8]。在人类中,有五个基因与MutS蛋白同源(MSH2、MSH6、MSH3、MSH4和MSH5),四个基因与MutL蛋白同源(MLH1、PMS2、PMS1和MLH3)。其中,MSH6、MSH2、MSH3、MLH1和PMS2是经典MMR机制的核心组分。如果该机制中的某个核心基因发生致病性变异,错配的核苷酸将在下一轮复制中作为变异持续存在,从而导致高突变表型,这涉及MSI并增加特定组织的癌症发病风险。
MSH6基因位于2号染色体,包含 10 个外显子,翻译成 1360 个氨基酸的蛋白质。该蛋白具有五个功能结构域,即错配结合结构域、连接结构域、杠杆结构域、钳位结构域和ATP酶结构域。与大肠杆菌蛋白相比,人类MSH6蛋白的N端区域延长了400个氨基酸,该区域包含增殖细胞核抗原(PCNA)结合基序。MSH6与PCNA的相互作用将MMR机制与复制机制结合。MSH2和MSH6形成一种称为MutSα的异二聚体,负责识别错配。当MMR机制中的核心基因MSH6发生致病性变异时,可导致肿瘤发生。
在具有胚系致病性变异的CRC患者中,变异向后代的潜在传递以及随着孩子长大发生致命复发的可能性是重要的考虑因素。单基因疾病植入前遗传学检测(PGT-M)是一种选择性技术,可用于防止与临床严重疾病相关的致病性基因的垂直传递。
在本研究中,研究人员通过全外显子测序(WES)在一名中国CRC患者中发现了MSH6基因的一个新发胚系致病性变异,该变异导致第6至10外显子缺失,并经Sanger测序证实。该变异的特征为序列改变c.3438+245_4082delinsTGAGACTACATTG(NC_000002.11:g.48031068_48033999),并导致蛋白质改变(p.1146Q*)。接下来,进行体外分析以验证MSH6的致病性。最后,使用PGT-M技术阻断了该致病性变异的垂直传递。这些发现强调了MSH6基因在肿瘤发病机制中的关键作用,并突显了PGT-M在预防肿瘤遗传性传递方面的有效性。
研究方法
患者详情
患者被诊断患有结直肠癌(CRC),并在金陵医院外科、肿瘤科和生殖医学科接受治疗。
DNA提取和基因检测
研究人员使用血液DNA提取试剂盒从先证者及其父母的外周血中提取基因组DNA样本。对于全外显子测序(WES),先证者的基因组DNA经片段化、连接接头、扩增和纯化后构建DNA文库。通过杂交捕获富集约 180,000 个外显子区域及其侧翼 20 bp内含子区域。将测序数据与GRCh37/hg19参考基因组进行比对,发现新的罕见MSH6变异。根据国际变异命名指南对该变异进行命名。根据美国医学遗传学与基因组学学会(ACMG)指南评估该变异的致病性。该变异在外显子组聚合联盟(ExAC)浏览器、基因组聚合数据库(gnomAD)以及其他正常人群数据库中均未检出。为验证这些发现,从UCSC人类基因组数据库获取MSH6基因序列。通过Primer Premier v5.0软件设计高通量测序鉴定的候选变异的PCR引物。以先证者及其父母的基因组DNA为模板进行PCR扩增。PCR产物经琼脂糖凝胶电泳分离纯化后进行测序。通过SnapGene软件将测序结果与MSH6参考序列进行比对分析。此外,使用SWISS-MODEL同源建模程序对目标区域的变异进行模拟。
免疫组化染色及肿瘤特征
研究人员选择CKpan、CDX-2、CgA、CD56、Syn、Ki-67和MSH6用于石蜡包埋肿瘤切片的免疫组织化学染色,以验证肿瘤的组织学类型、分化程度、神经内分泌特征、增殖活性和微卫星稳定状态。该实验由金陵医院病理科完成。
用于胚胎筛选的SNP分析和单倍型连锁
研究人员对具有MSH6基因母系遗传变异的家庭,通过单基因疾病植入前遗传学检测(PGT-M)和基于下一代测序(NGS)的单倍型连锁分析进行了研究。从 5 个囊胚的滋养外胚层中提取DNA样本,首先进行多重置换扩增(MDA)以扩增整个基因组,然后对目标基因区域进行PCR扩增。使用NGS进行高通量分析,以检测与致病性变异密切相关的单核苷酸多态性位点,随后进行基因分型。此外,从致病性变异位点上下游 1 Mb区域中选择了 30 个信息性单核苷酸多态性(SNPs),并结合先证者父母及其家庭成员的遗传信息进行单倍型连锁分析,以推断每个胚胎是否携带致病性变异。此外,对所有胚胎进行基于NGS的非整倍体筛查,以降低妊娠丢失风险。研究人员还对SNP数据进行了全基因组拷贝数变异(CNV)分析,以识别胚胎中的染色体非整倍体或微缺失。根据该分析结果,选择未携带致病性变异且染色体正常的健康胚胎进行移植。
研究结果
CRC患者的临床及病理学表现
一名 35 岁患者因间歇性下腹部绞痛伴黑便和大便带鲜血就诊。结肠镜检查显示横结肠有一全周环形肿块,管腔狭窄,表面易出血。进一步的腹部和胸部CT检查(图1A)显示横结肠肝曲壁增厚,考虑为肠癌伴肠套叠、周围渗出及小淋巴结。肿瘤标志物检查显示CA19-9、CA24-2、CA72-4和CA50水平均高于正常范围(表1)。最终,患者被综合诊断为结直肠癌(CRC),并接受了结肠癌根治术。不幸的是,术后病理分析显示肿瘤组织已侵犯全肠壁(图1B)。对CKpan、CDX-2、CgA、CD56、Syn和Ki-67的免疫组织化学分析(图1C)表明,该肿瘤为上皮源性中低分化腺癌,具有高增殖活性。相关标志物检测显示为高度微卫星不稳定性(MSI-H),提示肿瘤细胞存在DNA错配修复缺陷。在肿瘤科接受手术干预和化疗前,考虑到对未来生育能力的潜在影响,患者在生殖医学中心进行了精子冷冻保存。
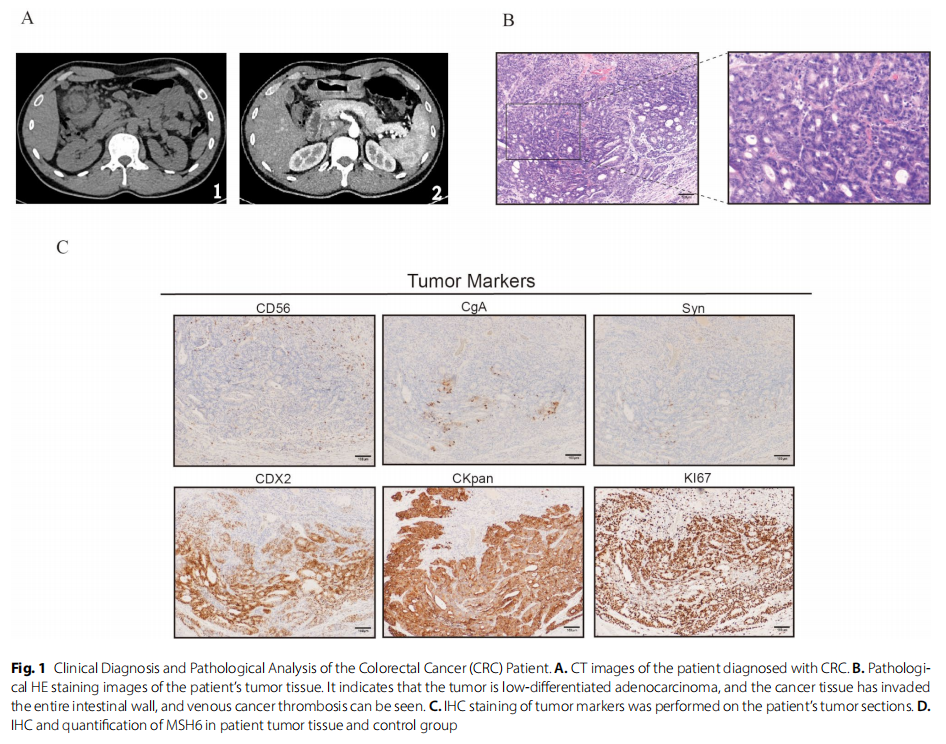
▲图1 结直肠癌(CRC)患者临床诊断及病理分析
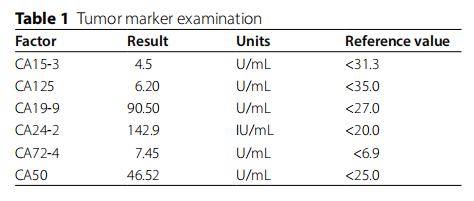
▲表1 肿瘤标志物检查
MSH6变异背景下的遗传特征和蛋白质表达分析
从先证者及其家庭成员中采集外周血样本,提取基因组DNA,并通过全外显子测序(WES)检测可能的致病性变异。筛查结果显示一个插入缺失变异,即c.3438 + 245_4082delinsTGAGACTACATTG(图2A),导致先证者MSH6基因第6至10外显子缺失。Sanger测序显示父亲基因型正常,而母亲为该变异的携带者(图2B)。根据ACMG/AMP指南的致病性分类标准,该变异被定义为可能致病性变异(PVS1 + PM2_supporting)。该变异在外显子组聚合联盟(ExAC)浏览器、基因组聚合数据库(gnomAD)以及其他正常人群数据库中均未检出。尽管先证者母亲携带致病性MSH6变异,但她尚未患癌。使用SWISS-MODEL构建MSH6野生型和突变型的三维蛋白质结构,并通过PyMOL软件进行可视化,如图2C所示。通过免疫组织化学分析,研究人员评估了MSH6蛋白在结直肠癌(CRC)组织和对照溃疡性结肠炎(UC)组织中的表达水平(图2D)。结果显示,CRC样本中MSH6蛋白的表达显著低于UC样本,提示该MSH6变异可能具有致病性。图2E显示了MSH6基因变异在基因组和蛋白质水平的位置示意图。
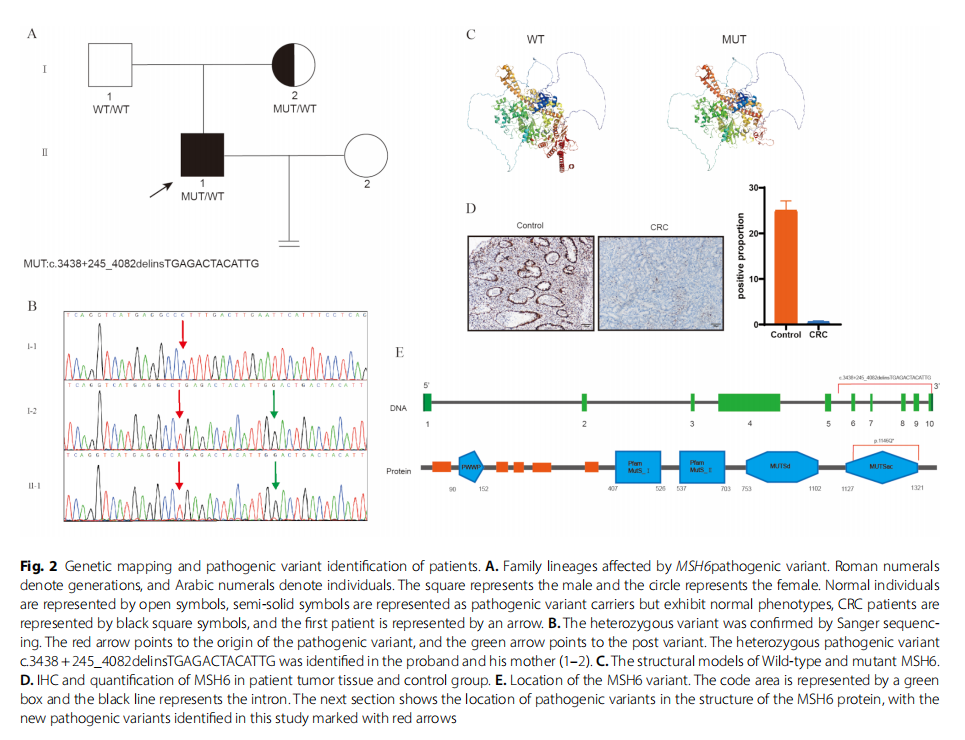
▲图2 患者基因图谱及致病变异鉴定
MSH6致病变异家族的PGT-M分析和胚胎移植
MSH6基因的胚系变异有 50% 的概率传递给后代,增加其患结直肠癌(CRC)的风险。在知情同意的情况下,患者选择通过植入前遗传学检测(PGT)辅助生殖,以防止该MSH6致病性变异的垂直传递。全面检查后,患者配偶接受了体外受精(IVF)周期治疗,并采用拮抗剂方案进行促排卵。注射促性腺激素释放激素拮抗剂 36 小时后获得 17 个卵母细胞(表2)。在第一个刺激周期中,12 个MII期卵母细胞受精,经标准胚胎培养后形成 8 个囊胚。通过对先证者夫妇及其父母进行测序,构建了变异位点上下游的单核苷酸多态性(SNP)单倍型。对该MSH6致病性变异(c.3438 + 245_4082delinsTGAGACTACATTG)家庭的5个胚胎进行了单基因疾病植入前遗传学检测(PGT-M)活检。基于先证者的参考数据,在致病性变异位点上下游1 Mb区域中选择了30个信息性单核苷酸多态性(SNPs)(表3)。使用全基因组扩增(WGA)对活检细胞进行扩增和测序。所有胚胎的单倍型连锁分析结果如图3A所示。E1、E3和E4胚胎遗传了男方的致病性等位基因和女方的非致病性等位基因,因此被视为不可移植胚胎。此外,研究人员使用原始SNP数据检测5个胚胎的胎儿非整倍体,结果显示所有胚胎(100%)均为整倍体,所有胚胎基因组的拷贝数变异(CNV)结果如图3B所示。E2和E5胚胎在CNV检测中显示为整倍体,且遗传了父母双方的非致病性等位基因,表明其具有利于进一步发育的良好遗传谱。E2和E5胚胎在CNV检测中显示为整倍体,且遗传了父母双方的非致病性等位基因,表明其具有利于进一步发育的良好遗传谱。为验证单倍型连锁分析结果的可靠性,对 5 个胚胎进行了Sanger测序,再次证实E1、E3和E4胚胎携带MSH6致病性变异,E2和E5胚胎为野生型(图3C)。最后,经临床指标评估后,将E2胚胎移植到母亲子宫内,并通过两次外周血人绒毛膜促性腺激素(hCG)检测确认妊娠。胚胎移植后 35 天,通过超声检查观察到妊娠囊和胎心搏动,确认临床妊娠。截至本文撰写时,患者配偶已妊娠。图3E显示了结直肠癌(CRC)的诊断、通过基因检测发现胚系变异以及通过PGT-M阻断致病性胚系变异向后代传递的过程。图3F显示对患者配偶羊水的Sanger测序结果,表明该家庭的致病性变异已成功阻止传递。

▲表2 接受卵胞浆内单精子注射治疗的伴侣的临床特征
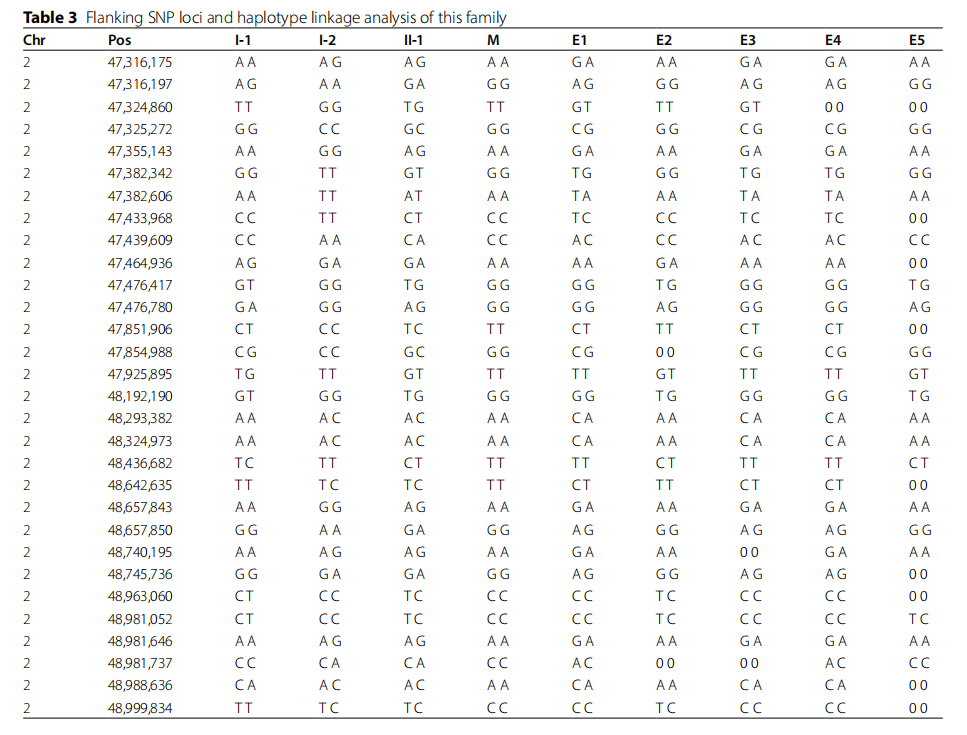
▲表3 该家族的SNP位点和单倍型连锁分析
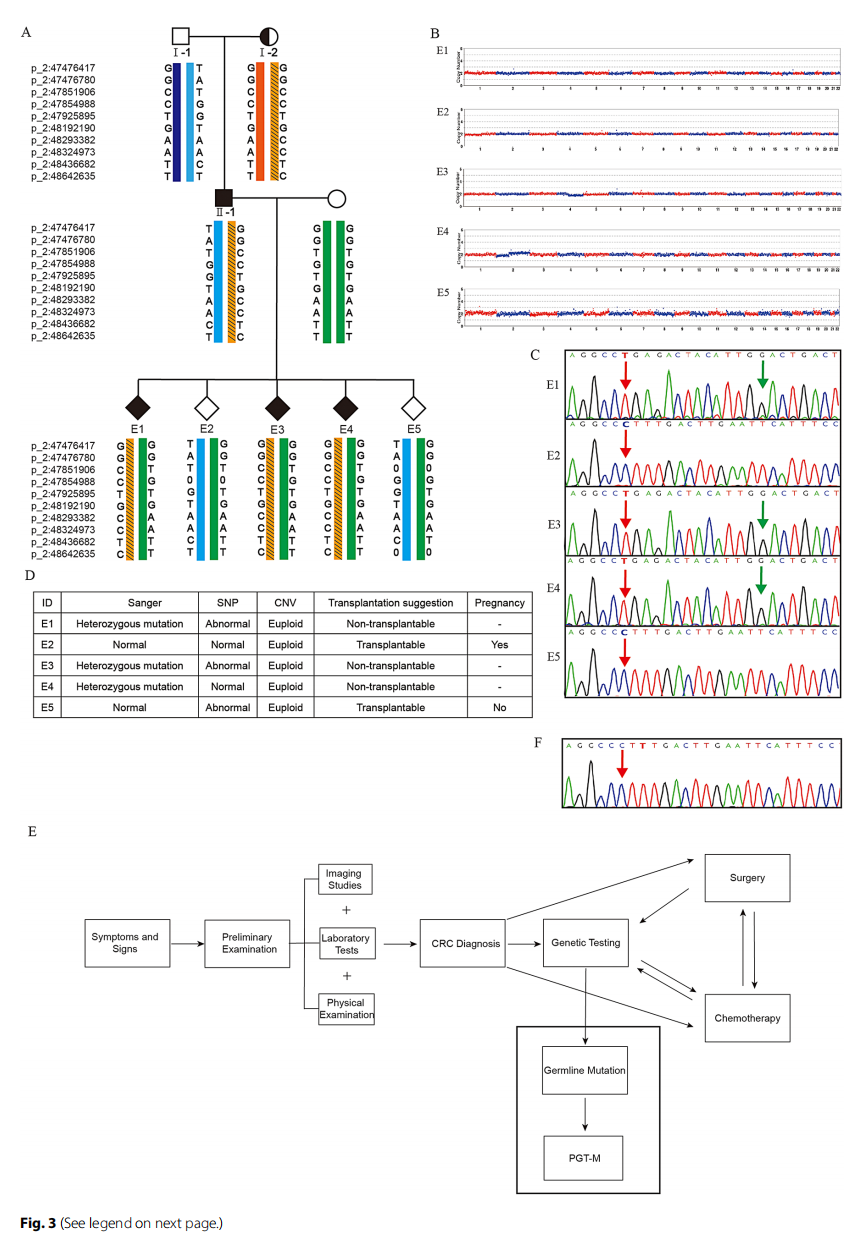

▲图3 PGT-M基因分析及胚胎筛查结果
讨 论
本研究通过在中国结肠癌患者家庭中检出新发MSH6基因插入缺失变异(c.3438 + 245_4082delinsTGAGACTACATTG),为结直肠癌(CRC)的遗传基础提供了重要见解。Sanger测序证实该变异为胚系致病性变异,免疫组织化学(IHC)证实该变异与肿瘤组织中MSH6蛋白表达降低相关。患者接受了右半横结肠根治术和化疗。化疗前进行了精子冷冻保存。卵胞浆内单精子注射(ICSI)和单基因疾病植入前遗传学检测(PGT-M)成功阻断了疾病的遗传传递,并实现了健康妊娠。这些发现表明MSH6胚系变异与CRC之间存在直接关系,扩展了CRC的遗传谱,并强调了MSH6在肿瘤发生中的关键作用。
结直肠癌死亡率高,病因复杂多样;约 2-5% 的结直肠癌病例由遗传变异导致,属于遗传性结直肠癌,包括林奇综合征(LS)、家族性腺瘤性息肉病(FAP)和Mutyh相关息肉病(MAP)。林奇综合征是一种由DNA错配修复(MMR)基因变异引起的常染色体显性遗传病。尽管MSH6基因变异罕见,但作为错配修复系统中的关键基因,仍被认为与林奇综合征相关。然而,微卫星不稳定性(MSI)并非林奇综合征特有,约 15% 的散发性结直肠癌也存在MSI。家族性腺瘤性息肉病由APC基因变异引起,Mutyh相关息肉病是由MUTYH基因变异引起的常染色体隐性遗传病。先前研究表明,76%的结直肠癌患者存在错配修复基因变异,11.2% 存在APC基因变异,7.9% 存在MUTYH基因变异,3.4% 存在POLE和POLD1基因变异。
错配修复系统对复制错误的修复主要包括三个步骤:错配识别、含错误链降解和无错修复链再合成。MutS和MutL蛋白在该修复过程的第一阶段发挥作用。如前所述,MSH6和MSH2相互作用形成异二聚体MutSα,其结构与DNA结合形式的MutS非常相似,在MSH6亚基中保守苯丙氨酸的帮助下识别碱基/碱基错配以及1-2个核苷酸的插入/缺失环。然而,MSH6发生致病性变异可能导致该复合物功能缺陷,影响错配修复系统的正常修复,从而促进结直肠癌的发生。在该家庭中,先证者母亲 56 岁,尽管携带MSH6致病性变异,但至今仍无症状。根据先前研究,MSH6胚系变异主要见于家族史较弱的非典型遗传性非息肉病性结直肠癌(HNPCC)家庭,这可能与该基因变异的外显率低有关。研究人员推测母亲无症状可能与该基因外显率不完全以及环境因素有关。此外,应为这些携带者提供个性化监测计划,包括每 1-2 年结肠镜检查和每年子宫内膜癌筛查,以降低其癌症风险。癌症的早期发现显著提高治疗成功的可能性。近年来,miRNA等生物标志物在结直肠癌早期检测中显示出高灵敏度和特异性,为结直肠癌的早期诊断提供了重要依据。通过对胚系变异携带者进行生物标志物检测,可更早识别遗传病风险,为及时干预和阻断疾病传递提供有力支持。
本研究存在一些局限性。首先,本研究仅纳入一例病例,MSH6致病性变异与结直肠癌的关联需在更多结直肠癌患者中验证。其次,尽管研究人员通过SWISS-MODEL预测了MSH6突变蛋白的结构变化,但未进行进一步的实验验证。最后,尽管本研究成功应用了PGT-M技术,但目前无法获取经该技术选择的胚胎发育儿童的长期健康和发育数据。
结 论
总之,本文研究强调了MSH6在结直肠癌(CRC)发病机制中的重要性,并展示了单基因疾病植入前遗传学检测(PGT-M)在防止遗传性肿瘤垂直传递方面的潜力。本研究为MSH6基因致病性变异引起的结直肠癌(CRC)的诊断和遗传阻断提供了新见解。
参考文献:
Wang W, Zhou Z, Cheng X, Chen L, Jing J, Chen C, Dong J, Chen H, Ma J, Yao B. Preimplantation genetic testing for monogenic disorders to prevent MSH6 germline pathogenic variant related colorectal cancer. BMC Cancer. 2025 Jul 1;25(1):1131. doi: 10.1186/s12885-025-14226-5. PMID: 40597796; PMCID: PMC12211955.


