J Clin Invest 哈佛大学Mark Feinberg团队揭示VSMC特异lncRNA CARMN调控血管新生的新机制
时间:2025-09-05 12:08:45 热度:37.1℃ 作者:网络
慢性肢体威胁性缺血(CLTI)作为外周动脉疾病(PAD)的严重阶段,以静息痛、伤口难愈、肢体坏疽为典型表现,最终常导致截肢,全球超2亿人受PAD困扰,其中CLTI患者1年死亡率约20%。长期以来,Therapeutic Angiogenesis (治疗性血管新生)被视为CLTI的潜在治疗方向,但针对血管内皮生长因子的临床研究屡屡受挫,核心在于对缺血状态下细胞间通讯及转录调控机制的认知不足。
2025年8月28日,美国哈佛大学医学院Brigham and Women’s Hospital的Mark W. Feinberg教授团队在血管疾病研究领域取得重要进展,在The Journal of Clinical Investigation发表题为“A smooth muscle cell lncRNA controls angiogenesis in chronic limb-threatening ischemia through miR-143-3p/HHIP signaling”的研究论文,该研究聚焦血管平滑肌细胞(VSMC)富集的长链非编码RNA (lncRNA) CARMN,首次揭示其通过调控miR-143-3p/HHIP信号轴影响血管新生,为CLTI治疗提供了全新靶点与思路。

研究团队首先通过RNA测序,对比缺氧刺激的SMC与CLTI患者腓肠肌组织中的lncRNA表达,发现CARMN是两者中共同显著下调的关键分子。临床样本验证显示,CLTI患者腓肠肌中CARMN表达较健康人群及间歇性跛行患者大幅降低;小鼠后肢缺血模型也证实,缺血后3天CARMN表达即显著下降,并持续低表达31天,且缺氧环境会直接抑制SMC中CARMN的表达。为明确CARMN的功能,研究构建了CARMN敲除(KO)小鼠。结果显示,CARMN缺失后,小鼠后肢缺血区域毛细血管密度下降80%,血流恢复严重受损,肢体坏死评分显著升高,同时伴随肌细胞坏死加剧、纤维化程度增加(图1)。更关键的是,CARMN主要表达于SMC而非内皮细胞(EC),其缺失会通过旁分泌机制影响EC功能—CARMN KO小鼠SMC的上清液会显著抑制EC增殖、球状体出芽及血管网络形成,还会破坏EC屏障功能,降低血管内皮一氧化氮合酶(eNOS)与AKT的活化水平,导致血管舒张功能受损(图2)。
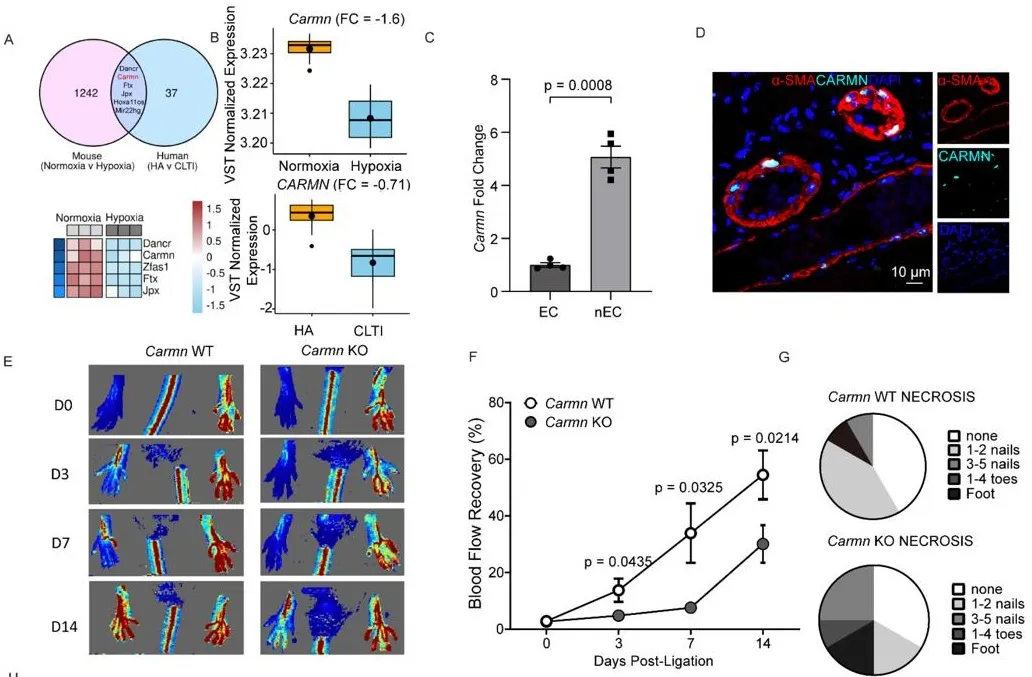
图1. CARMN在后肢缺血中表达降低,CARMN缺失导致小鼠后肢缺血后血流恢复受损。A. (上)低氧刺激SMC与PAD患者(健康成人HA或慢性肢体威胁性缺血CLTI)腓肠肌中差异表达lncRNA的交集分析(GSE120642);(下)常氧与低氧条件下原代SMC中差异表达lncRNA的热图(p值=0.00012)。B. 低氧处理原代SMC及CLTI与非CLTI患者腓肠肌中Carmn的表达(p值=1.44×10⁻⁸)。C. Carmn在内皮细胞(EC)与非EC中的相对表达量。D. Carmn WT小鼠腓肠肌中Carmn与α-SMA⁺ SMC细胞核共定位的代表性图像。E. 股动脉结扎(FAL)后不同时间点后肢激光多普勒血流成像(LDI)代表性图像。F. 两组间手术肢与对侧肢血流量的LDI定量分析(以非手术肢标准化,n=6)。
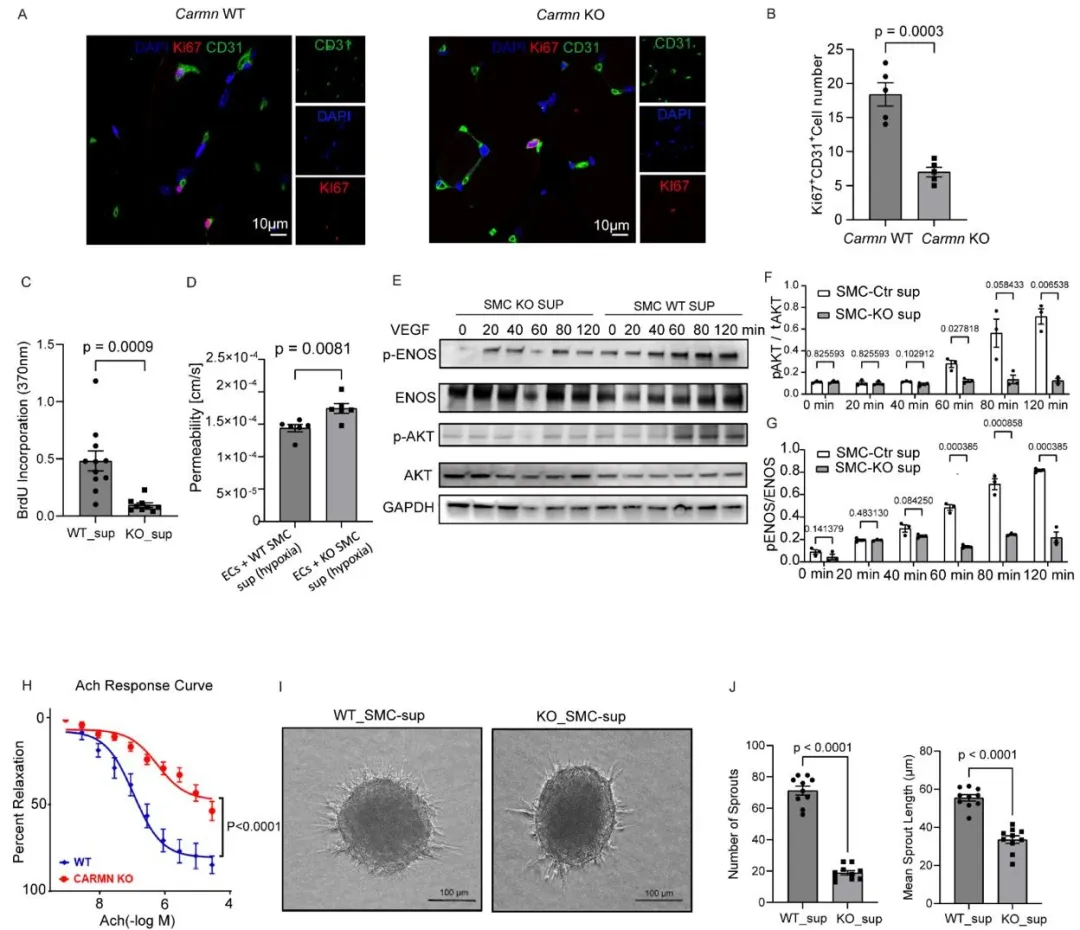
图2. 平滑肌来源的CARMN促进内皮细胞增殖和血管新生。A. WT与CARMN KO小鼠腓肠肌中CD31⁺与Ki67⁺染色的代表性图像。比例尺=20 μm。B. 各组Ki67⁺与CD31⁺细胞定量结果。C. 经WT或KO SMC上清液处理的mEC中BrdU掺入量的定量。D. 经WT或KO SMC上清处理的EC通透性实验定量。E. 经WT或KO SMC上清处理的mEC中指定AKT与eNOS蛋白的Western blot代表性图像。F、G. 相应蛋白相对表达量的定量。H. WT与Carmn KO小鼠中乙酰胆碱(Ach)介导的动脉血管反应性。I. 与WT或KO SMC上清共培养的EC球体代表性图像(上清添加至小鼠EC);J. 球体出芽长度与数量的相应定量;比例尺=100 μm。
通过对CARMN WT与KO两组小鼠的体外提取VSMC及缺血后腓肠肌组织进行RNA测序,研究团队发现Hedgehog信号通路在CARMN缺失后显著下调,且该通路的拮抗剂—HHIP表达异常升高。进一步实验证实,CARMN缺失会促使SMC分泌更多HHIP,而HHIP会通过抑制EC中的Hedgehog信号通路,削弱EC的血管新生能力(图3)。当使用siRNA敲低 HHIP后,EC的增殖、信号活化及血管形成能力均能有效恢复,小鼠缺血肢体的血流与毛细血管密度也得到显著改善。
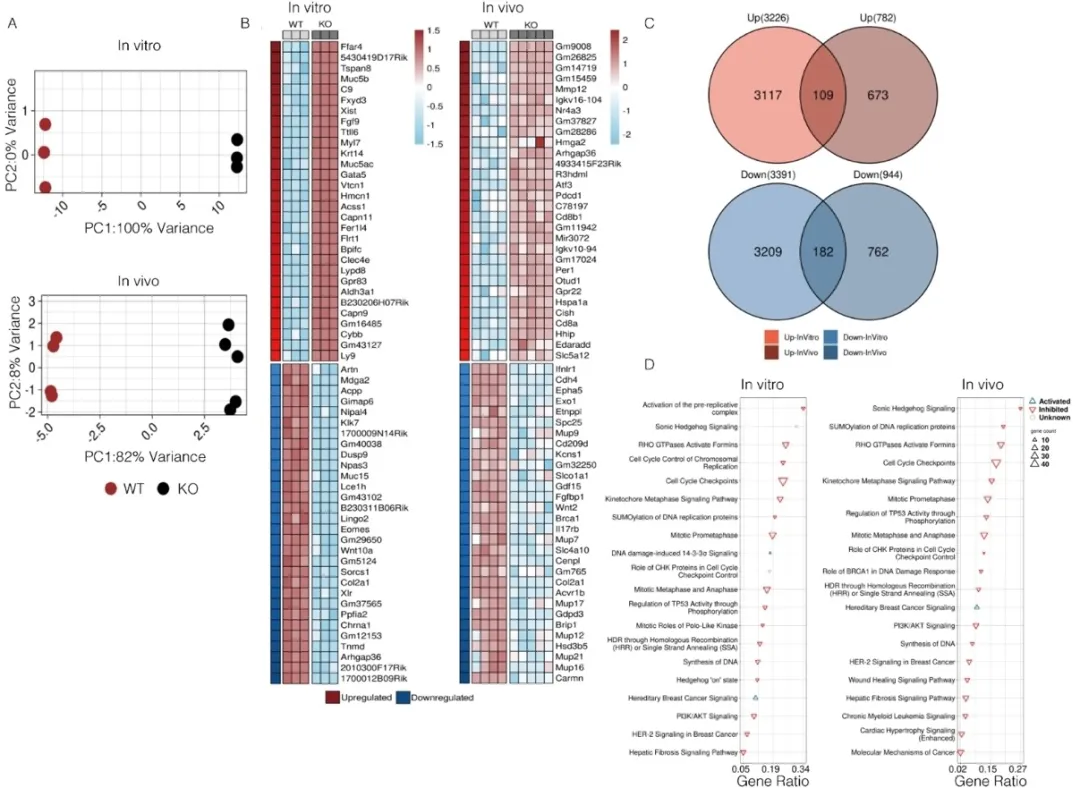
图3. CARMN通过激活Hedgehog信号通路促进血管新生。A. RNA-seq样本转换计数数据主成分分析(PCA)散点图。体外实验组为WT或Carmn KO SMCs;体内实验组为股动脉结扎14天后WT或Carmn KO小鼠腓肠肌。B. 表达上调(p<0.01且log2FC≥0.58)及下调(p<0.01且log2FC≤-0.58)的前30个转录本热图。转录本按Fold-change值排序,上、下面板分别代表上调和下调转录本。C. 体外与体内组共同上调和下调转录本的韦恩图。红色和蓝色分别代表上调和下调转录本。D. 前20条显著富集通路(p<0.05)图示。上三角表示激活(Z>0),下三角表示抑制(Z<0),圆形表示激活状态未知(Z=0)。
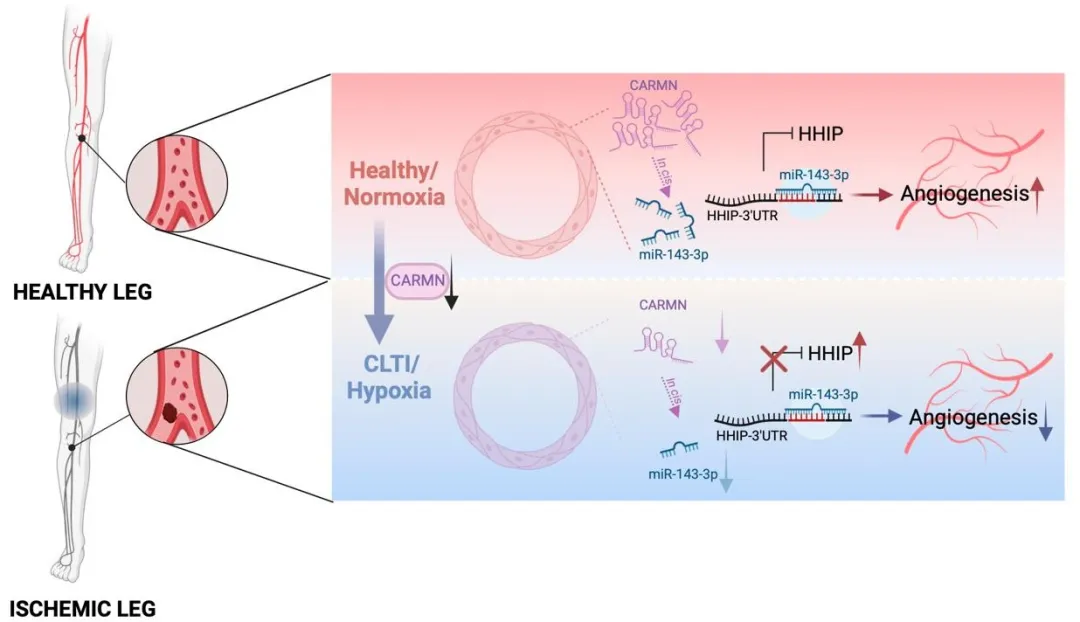
机制探索环节,研究团队发现CARMN作为miR-143/14的HOST基因,其缺失会导致 miR-143-3p表达下降。而miR-143-3p可直接结合HHIP的3'UTR区域抑制其表达,形成 “CARMN-miR-143-3p-HHIP” 调控轴(图4)。在CARMN KO小鼠SMC中过表达miR-143-3p,能显著降低HHIP水平,恢复Hedgehog信号通路活性,进而挽救EC的血管新生功能;体内实验也证实,肌肉注射miR-143-3p模拟物可使CARMN KO小鼠缺血后血流恢复率提升44.68%,有效减少肢体坏死(图5)。
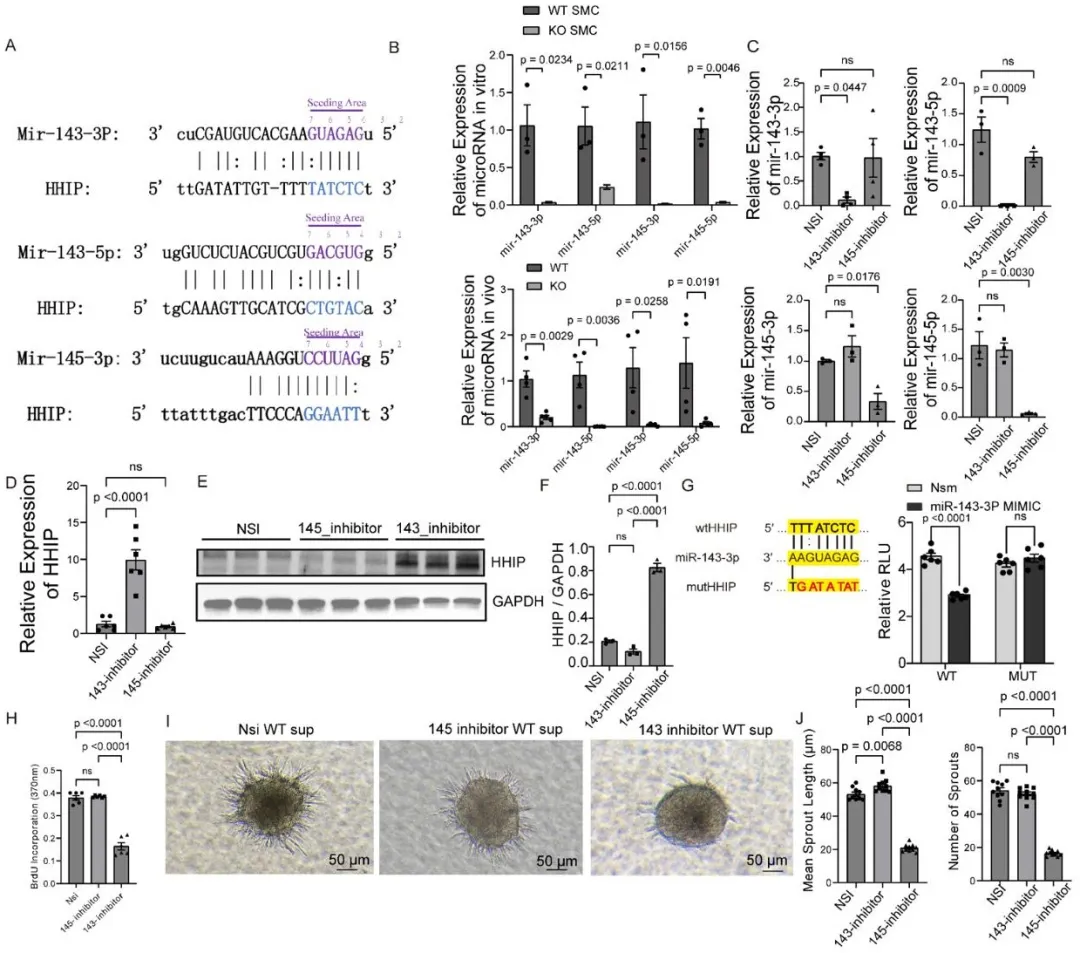
图4. CARMN通过miR-143-3p抑制HHIP表达。A. miR143和miR145在Hhip 3′UTR区结合位点及序列互补示意图。B. Carmn WT与KO SMCs在体内和体外模型中miR-143-3p、miR-143-5p、miR-145-3p和miR-145-5p的相对表达。C. 转染非特异性对照抑制剂(NSi)、miR143抑制剂和miR145抑制剂的WT SMC中miR-143-3p、miR-143-5p、miR-145-3p和miR-145-5p的相对表达。D. 转染NSi、miR143抑制剂和miR145抑制剂的WT SMC中Hhip mRNA的相对表达。E. 转染NSi、miR143抑制剂和miR145抑制剂的WT SMC中HHIP的蛋白表达。F. E图中三组HHIP相对表达量的定量结果。G. (左)miR-143-3p与Hhip 3′UTR结合位点示意图;(右)野生型(WT)和突变型(MUT) Hhip 3′UTR荧光素酶报告基因在NS模拟物或miR-143-3p模拟物处理下的相对荧光素酶活性(RLU)(n=6)。H. 经WT SMC (转染NSi、miR143抑制剂、miR145抑制剂)上清处理的mEC的BrdU增殖实验。I. 与WT SMC (转染NSi、miR143抑制剂、miR145抑制剂)上清共培养的mEC球体代表性图像。比例尺=100 μm。J. I图中球体出芽长度及分支数量的定量分析。
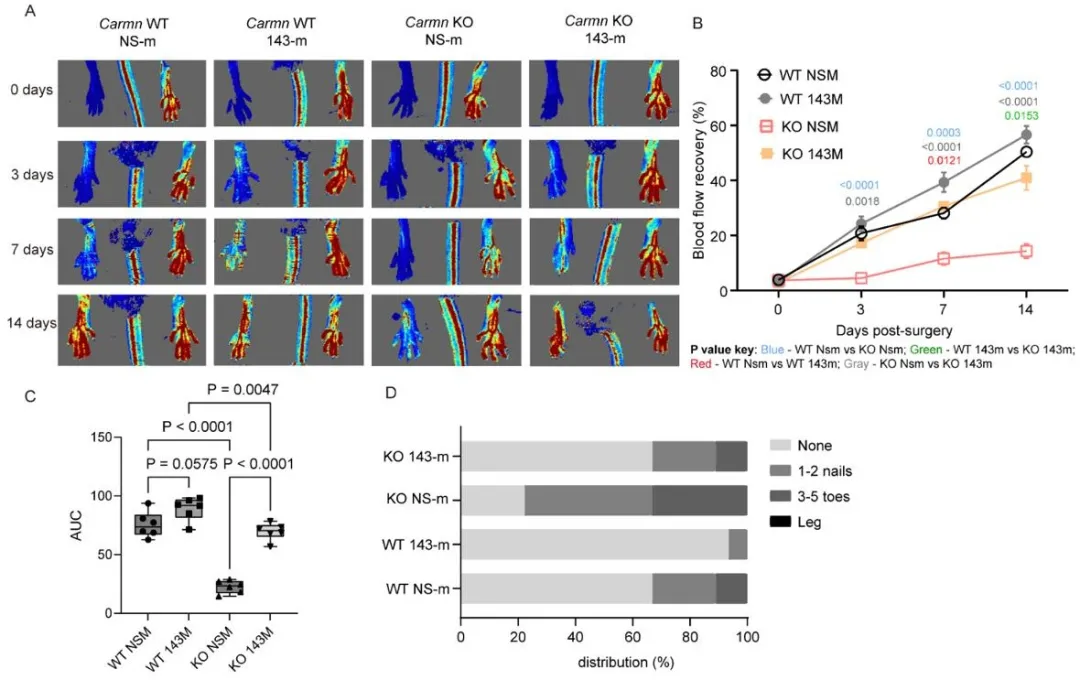
图5. 体内递送miR-143-3p可部分挽救CARMN KO小鼠受损的缺血后血流恢复情况。A. FAL术后不同时间点Carmn WT与KO小鼠后肢激光多普勒血流成像(LDI)代表性图像。各组小鼠于FAL术后14天内接受四次NS对照或miR-143-3p模拟物的肌内注射。B. 基于LDI图像的患肢/对侧肢血流量定量分析(以非手术肢标准化,n=8)。C. 各组小鼠血流恢复曲线下面积(AUC)定量。D. FAL术后两周缺血足坏死评分。
综上,该研究从临床样本到动物模型,再到细胞分子机制,层层递进地阐明了SMC富集的lncRNA CARMN在CLTI血管新生中的核心作用。其发现的“CARMN-miR-143-3p-HHIP-Hedgehog”信号轴,不仅填补了SMC与EC间旁分泌调控在缺血性疾病中的研究空白,更为CLTI治疗提供了精准靶点—无论是通过干预HHIP表达,还是调控miR-143-3p水平,都有望成为激活缺血区域血管新生、改善肢体血供的新策略,为千万CLTI患者带来避免截肢、改善预后的新希望。
上海交通大学医学院附属仁济医院住院医师翟鸣博士(于2023年8月- 2024年10月赴Brigham and Women's Hospital, Harvard Medical School访问交流学习)为该论文的第一作者,博士后Anurag、钱军(哈佛大学访问学者,博后)、Winona Wu (Beth Israel Medical Center Residency Doctor)、博士后Emre为共同第一作者,Brigham and Women's Hospital心血管中心Mark W. Feinberg教授为该论文的唯一通讯作者。该工作得到美国国立卫生研究院(NIH)/美国AHA基金的资助。
原文链接:
https://www.jci.org/articles/view/188559


