Genome Med:应建明/杨琳/周猛/孙杰团队开发基于病理图像的深度学习模型,实现小细胞肺癌的组织形态学分型和风险分层
时间:2025-09-05 12:09:28 热度:37.1℃ 作者:网络
小细胞肺癌(SCLC)是一种恶性程度极高的肺癌亚型,具有高侵袭性、预后差的特点,占所有肺癌病例的15%。准确的亚型和风险分层对SCLC的预后和临床决策至关重要,但由于SCLC的高度瘤内异质性和缺乏有效的风险分层策略,其治疗仍然具有挑战性。已有多项研究揭示了SCLC的生物多样性和异质性,促进了其分层和分型,但这些研究多依赖于昂贵和耗时的组学测序以及对新鲜或冷冻肿瘤组织的需求,很大程度上仍不适合广泛的临床实践。
9月2日,中国医学科学院肿瘤医院应建明、杨琳团队联合温州医科大学周猛、孙杰团队等在Genome Medicine发表文章“Deep learning-based histomorphological subtyping and risk stratification of small cell lung cancer from hematoxylin and eosin-stained whole slide images”。研究团队在一项多中心队列研究中,系统地解决了与SCLC肿瘤亚型和风险分层相关的挑战。通过使用基于数字化全切片病理图像(WSI)的无监督深度学习对SCLC进行组织形态学表型(HIPO)分析和肿瘤生态系统多样性表征,该研究鉴定了15个HIPO。基于HIPO谱的无监督聚类可将SCLC分为两个组织形态学亚型(HIPOS):HIPOS-I和HIPOS-II。分析发现,与临床特征和分子亚型无关,HIPOS-I组患者的总生存期(OS)和无病生存期(DFS)优于HIPOS-II组。多模态分析显示HIPOS-I肿瘤的特征是免疫浸润和免疫激活增强,而HIPOS-II肿瘤表现出纤维化增加、细胞多形性和氧化代谢失调。研究团队在独立队列中验证了这些亚型的预后价值。

苏木精和伊红(H&E)染色切片的组织病理学检查是SCLC诊断的金标准。随着数字病理学和人工智能(AI)的进步,深度学习方法已经成为从这些数字图像中提取复杂隐藏信息的强大工具,为研究肿瘤异质性提供了新的视角。
研究团队对有福尔马林固定石蜡包埋(FFPE)肿瘤切片的517例SCLC患者及其WSI进行分析。在发现阶段,研究人员将348例患者以6:4的比例随机分配到发现组和内部验证组。利用发现队列,研究团队开发了一个深度表征学习框架来构建HIPO图谱,识别基于HIPO的稳健SCLC亚型并验证。在第二阶段,研究开发并验证了用于数字组织病理学表型分析的深度学习模型HIPOS,以预测发现阶段患者队列中的组织形态学亚型。在第三阶段,研究验证了HIPOS在两个独立队列中的预测和预后性能,以确保模型的稳健性和临床适用性。
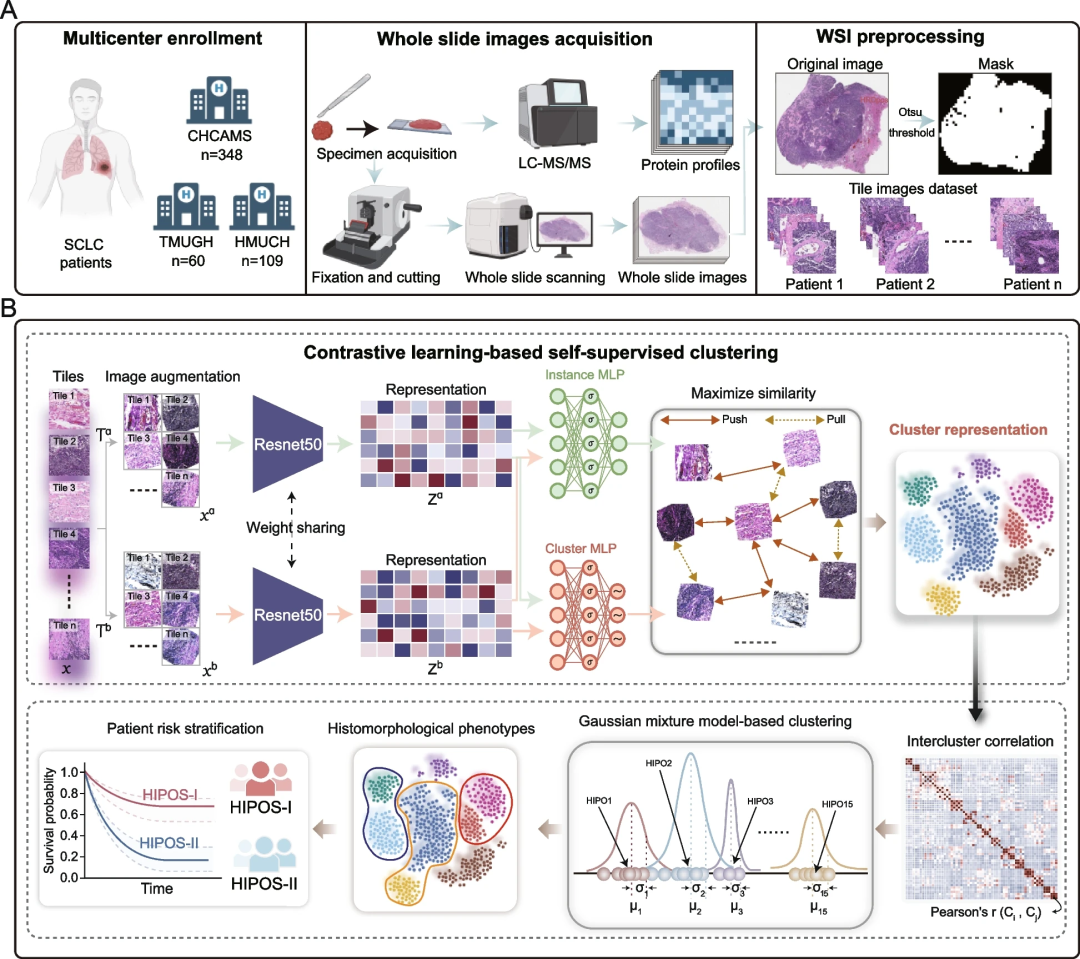
图1.研究设计和深度学习框架概述
研究团队对发现队列中209例WSI进行了深度表征学习,全面表征了SCLC的瘤内组织形态学,并鉴定了15个不同的HIPO(图2)。分析显示,15个HIPO具有不同的组织形态学特征,与肿瘤组织相关的HIPO在肿瘤纯度、纤维化和坏死比例上存在显著差异。
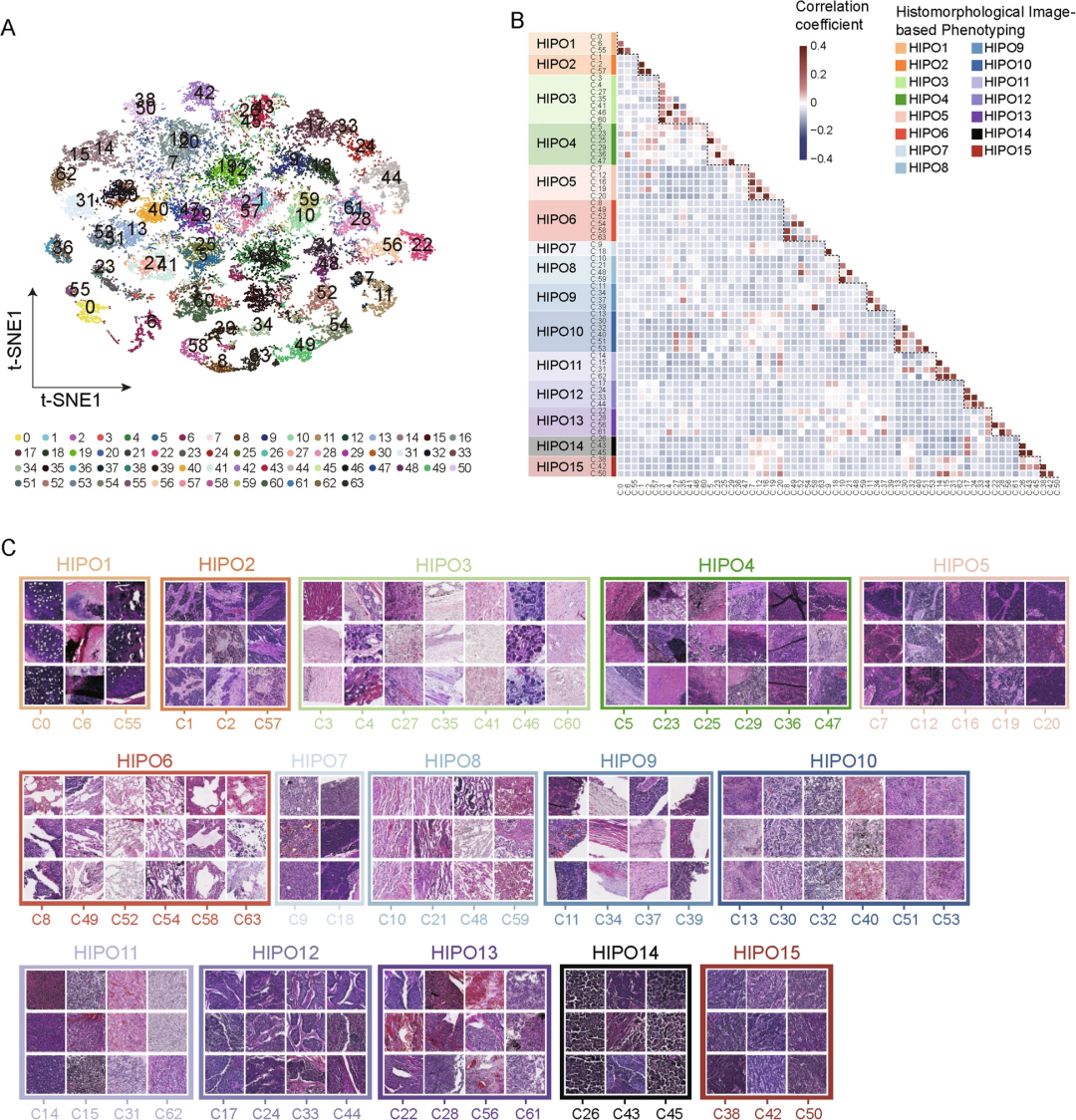
图2.瘤内组织形态学表型的鉴定和表征。
通过对发现队列中209名患者的HIPO谱进行无监督聚类,研究确定了两种不同的HIPOS:HIPOS-I和HIPOS-II(图3),两种亚型之间特异性HIPO的组成存在显著差异。
临床相关性分析表明,基于HIOP的亚型对预后有重要价值。在发现队列中,与HIPOS-II相比,HIPOS-I组的患者表现出明显更好的OS和DFS(图3C)。同样,在内部验证队列中,HIPOS-I与较好的OS相关(图3D)。进一步回归分析证实,在调整各种临床病理特征后,基于HIOP的亚型对OS和DFS具有独立的预后价值(图3E)。此外,研究显示,基于HIPO的分型是一种独立于现有分子分类和临床特征的具有临床意义和可重复性的SCLC分型系统。
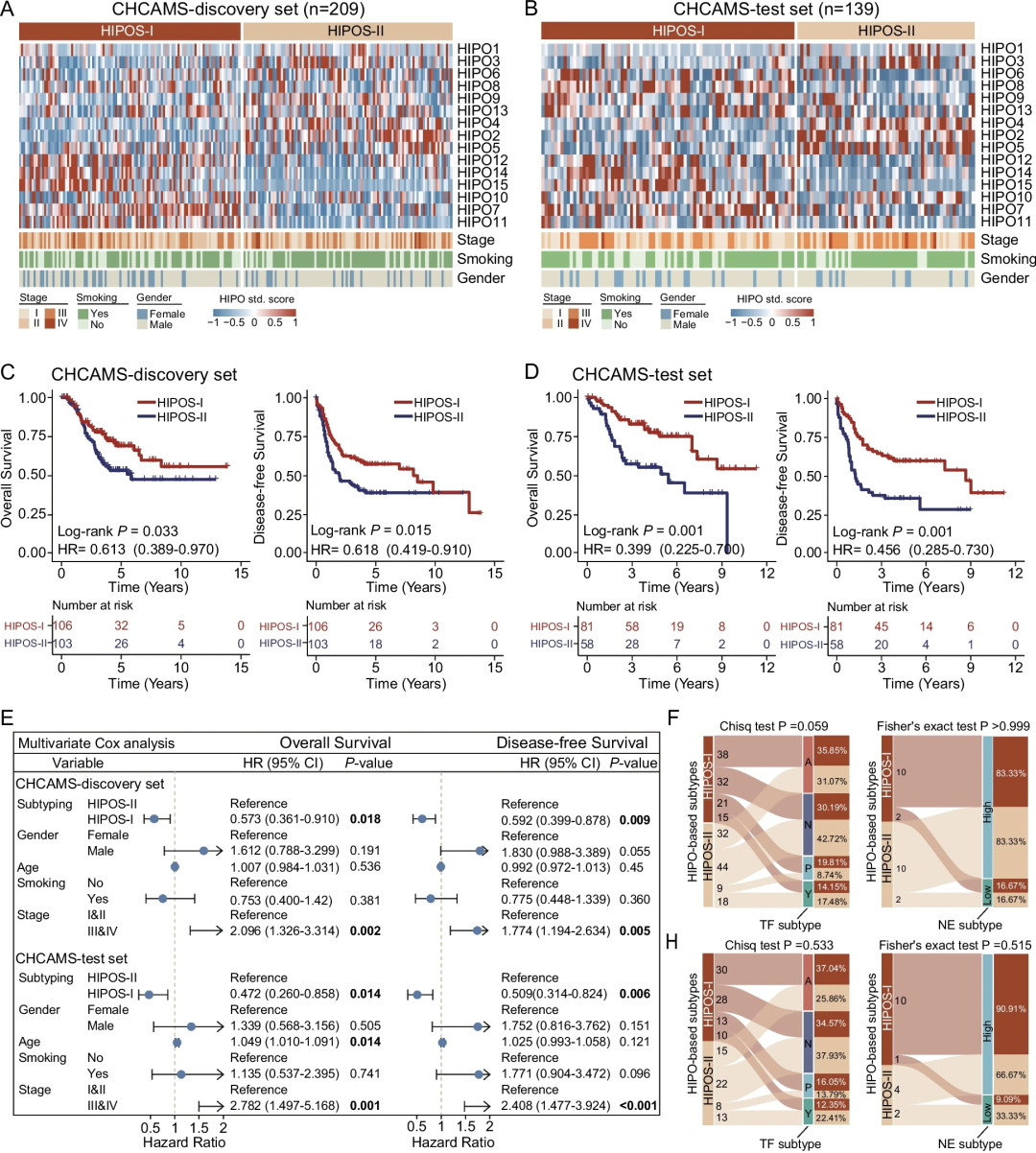
图3.发现队列中基于HIOP的亚型和预后风险分层。
随后,研究团队开发了一种简化的基于深度学习模型HIPOS,可以预测基于HIOP的亚型和风险分层(图4)。HIPOS在发现集中AUC为0.981,在区分HIPOS-I和HIPOS-II亚型的验证集中AUC为0.976(图4A)。将HIPOS应用于两个独立验证队列,发现HIPOS-I患者的OS和DFS明显优于HIPOS-II患者,证实了基于HIPO亚型的独立预后价值。此外,HIPOS能够进一步将早期(I-II)或晚期(III-IV)肿瘤患者细分为HIPOS-I和HIPOS-II亚型,其生存结果存在显著差异。
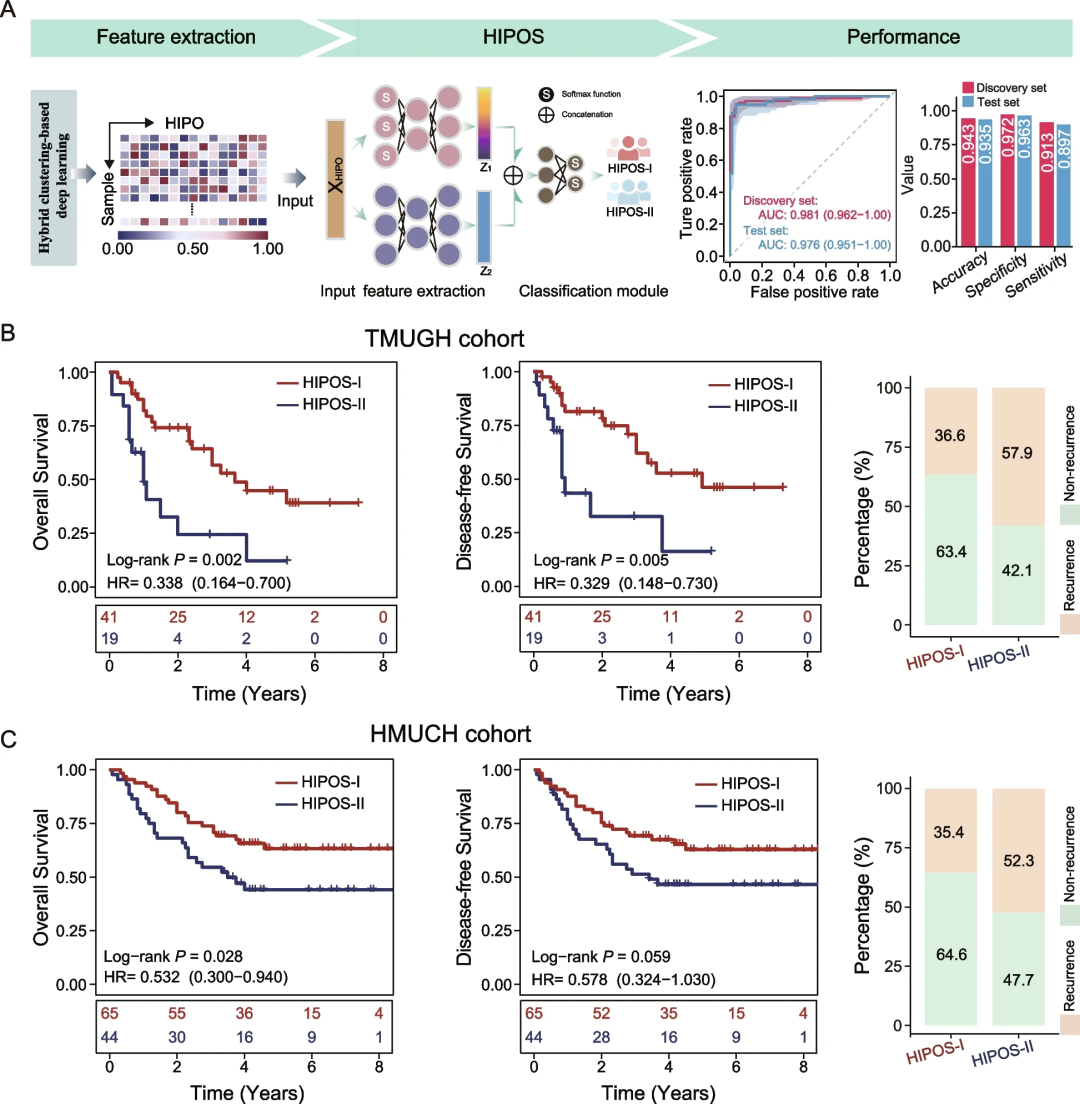
图4.HIPOS亚型和风险分层的多中心验证。
为了提高深度学习模型HIPOS的可解释性,研究团队将鉴定的HIPO映射到WSI的相应区域,在模型高度关注的区域发现了不同的组织形态学特征,特别是肿瘤细胞、肿瘤相关坏死和间质组织的区域。通过分析每个特征的相对重要性和方向性影响,研究确定了不同的形态模式预测每个亚型。HIPOS-I具有肿瘤纯度高的特点,肿瘤组织内常出现肿瘤浸润淋巴细胞;HIPOS-II主要与肿瘤纯度降低、大量坏死和肿瘤巢周围突出的间质带以及淋巴细胞浸润减少相关。
最后,研究团队利用蛋白质组学数据鉴定了在不同HIPOS亚型中显著富集的功能基因集。分析发现,免疫相关基因集在HIPOS-I肿瘤中富集,氧化磷酸化在HIPOS-II肿瘤中富集(图6A和B)。与HIPOS-II肿瘤相比,HIPOS-I肿瘤具有更强的免疫活性,免疫细胞的估计丰度明显更高。免疫组化染色显示,与HIPOS-II肿瘤相比,CD45在HIPOS-I肿瘤中的表达明显更高,这些结果支持了HIPOS-I肿瘤为免疫浸润性SCLC、HIPOS-II肿瘤为冷型免疫SCLC的特征。
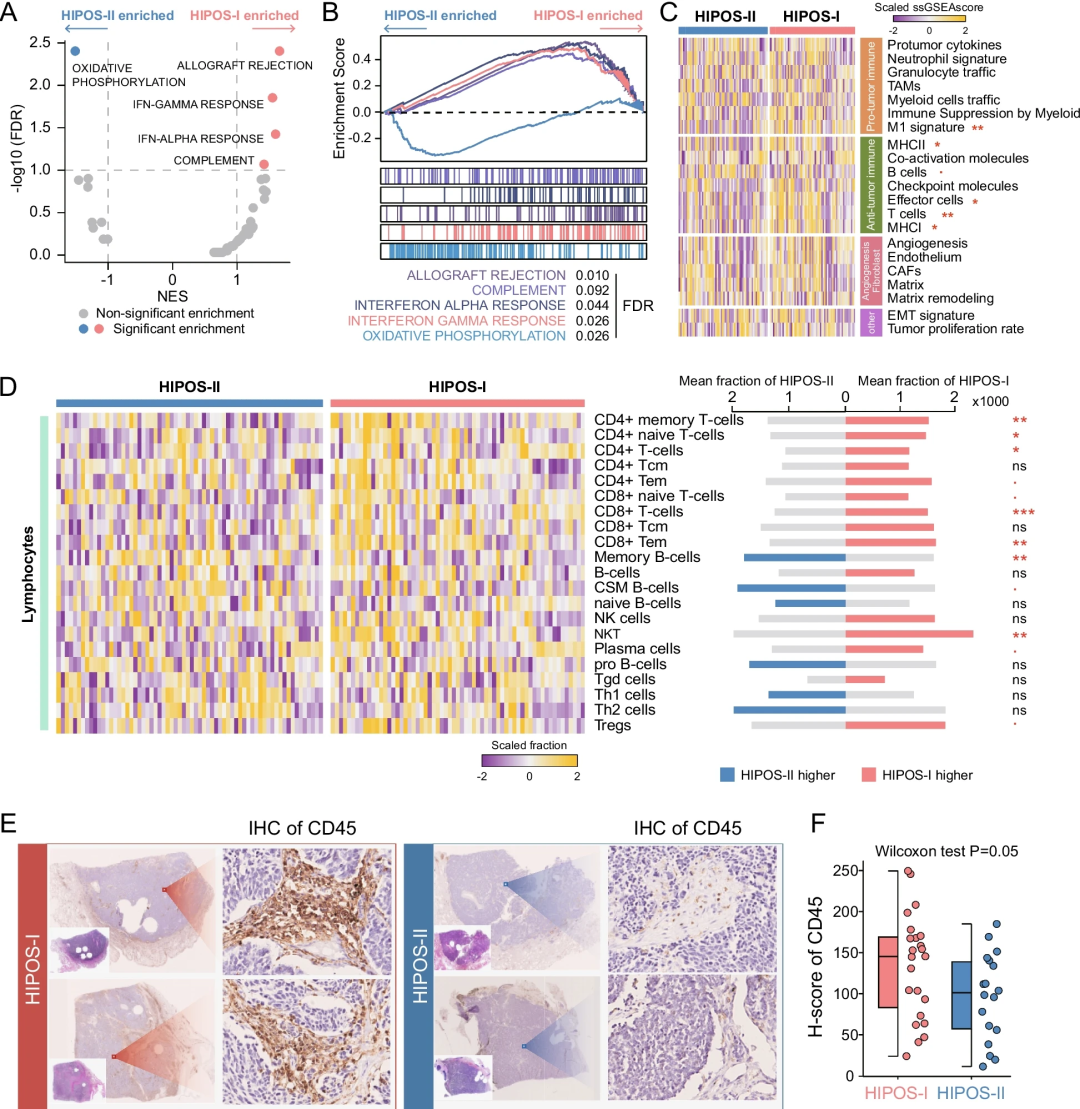
图5.生物和肿瘤微环境分析对HIPOS决策的影响。
该研究开发和验证了基于病理图像的SCLC亚型和患者风险分层模型HIPOS,确定了稳健的、具有临床意义的两种新数字病理亚型HIPOS-I和HIPOS-II。HIPOS分型将组织形态学特征与分子信息相结合,为患者分层提供了更全面和生物学基础的方法,为更精确和有效的SCLC管理提供了新的途径。研究发现,这种基于病理图像的亚型显示出显著的预后价值,HIPOS-I与更有利的临床结果相关,HIPOS-II与更差的预后相关,证明了基于深度学习的组织形态学亚型系统在改善SCLC患者分层和预后预测方面的潜力。
原文信息:
Zhang, Y., Liu, S., Chen, J. et al. Deep learning-based histomorphological subtyping and risk stratification of small cell lung cancer from hematoxylin and eosin-stained whole slide images. Genome Med 17, 98 (2025). https://doi.org/10.1186/s13073-025-01526-5


