【Nature】科学家揭示杏仁核-肝脏信号协调应激引起血糖水平升高的机制
时间:2025-09-06 12:15:03 热度:37.1℃ 作者:网络
急性应激引发高度协调的代谢反应,为心血管和肌肉提供能量,在支持对“逃跑还是战斗”适应性行为中发挥重要的作用。内侧杏仁核(MeA)整合威胁相关的外部及内部感觉信号,投射到调控内分泌、自主神经及代谢过程的应激相关脑区(下丘脑、和终纹床核,(BNST))。
2025年9月3日西奈山伊坎医学院S. A. Stanley团队在Nature杂志发表文章揭示了杏仁核-肝脏信号协调血糖对应激的反应机制。

1 MeA→VMH环路调控急性应激引起的血糖升高
小鼠接受急性束缚应激(30分钟)血糖水平快速升高,血浆皮质酮水平也升高,血浆胰岛素和去甲肾上腺素水平并未升高。免疫荧光实验发现急性束缚应激后MeA脑区激活的神经元数量显著增多。光纤钙成像系统记录到急性应激引起MeA脑区钙离子活性显著升高,这种升高发生在血糖水平升高之前。化学遗传学慢性激活MeA脑区神经元可引起血糖水平升高,并可持续1小时,并能短暂抑制摄食行为,皮质酮合成抑制剂并不会阻断血糖水平的升高。此外,激活MeA脑区神经元并不影响血浆胰岛素、皮质酮水平,也不影响焦虑和恐惧相关行为。光激活MeA脑区神经元也可引起血糖水平升高,抑制摄食行为。
顺行示踪实验发现MeA脑区神经元投射到腹内侧下丘脑(VMH)和BNST。MeA脑区神经元投射到这两个脑区的神经元群重叠的比例较少。免疫荧光实验发现与投射到BNST的激活神经元数量相比,急性应激激活MeA脑区投射到VMH的神经元数量更多。慢性激活禁食小鼠MeA→VMH环路后可引起血糖水平升高,不影响血浆皮质酮、去甲肾上腺素水平。抑制该环路可阻断急性应激引起的血糖升高。慢性激活MeA→BNST环路并不引起血糖水平变化。这些结果表明MeA→VMH环路调控急性应激引起的血糖升高。
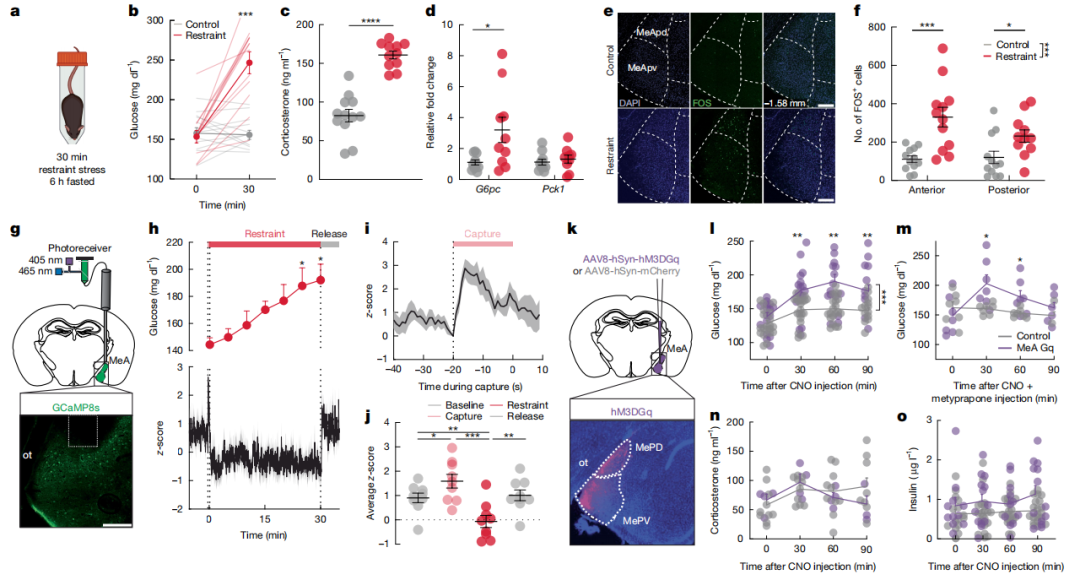
图1、MeA脑区神经元调控急性应激引起的血糖升高
2 MeA通过肝脏的交感神经调控肝脏糖异生过程
肝脏是合成葡萄糖的主要器官。急性应激显著增加小鼠肝脏葡萄糖-6-磷酸酶G6pc(可将催化葡萄糖-6-磷酸水解为游离葡萄糖)的表达,在抑制MeA→VMH环路后可抑制G6pc的表达。研究人员在MeA脑区注射携带绿色荧光顺行病毒,在肝脏注射红色荧光逆行示踪病毒,待病毒充分表达后在VMH脑区观察到红色、绿色荧光共同标记的神经元。慢性激活MeA→VMH环路可引起腹腔神经节神经活性的增强,表明存在MeA→VMH-liver环路。糖异生依赖于丙酮酸转化为草酰乙酸,最终转化为葡萄糖。腹腔注射丙酮酸后慢性激活MeA神经元或MeA→VMH环路可增加血糖水平,表明MeA调控肝脏糖异生过程。
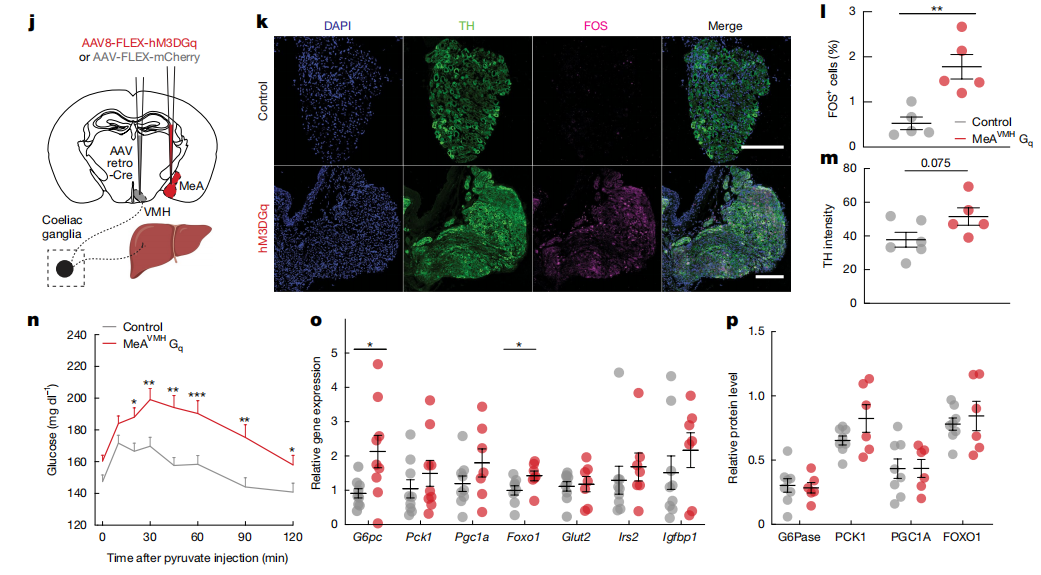
图2、MeA通过肝脏的交感神经调控肝脏糖异生过程
3 慢性应激通过抑制MeA神经元增加代谢异常的易感性
小鼠单次暴露在领地化应激鼠笼中,血糖水平升高,MeA神经元钙离子活性增加;暴露5次领地化应激鼠笼中血糖水平并不会升高,MeA神经元钙离子活性也不增加。在每天接受2次应激,连续5天的慢性应激也能减弱MeA神经元活性,表明慢性应激抑制应激诱发的血糖升高。肝脏的交感神经支配通过α2A肾上腺素能受体抑制胰高血糖素诱导的cAMP和葡萄糖输出,β2肾上腺素能受体促进葡萄糖输出。特异性诱导投射到VMH的MeA神经元后摄食行为增多,体重增加,并降低α2A肾上腺素能受体表达,增加β2肾上腺素能受体,G6pc的表达升高,并可阻断急性应激引起的血糖升高。
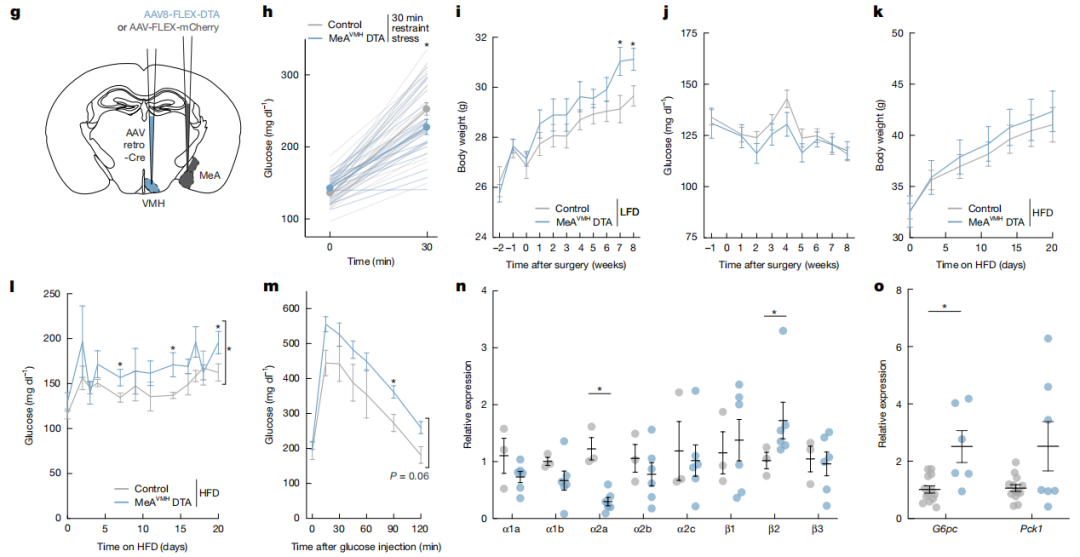
图3、慢性应激通过抑制MeA神经元增加代谢异常的易感性
总结:
本文发现急性应激通过杏仁核→下丘脑→肝脏环路调控急性应激引起的血糖升高,慢性应激通过抑制上述环路活性引起肥胖。
参考文献
https://doi.org/10.1038/s41586-025-09420-1


