LVAD学术 | 人工心脏术前心律失常的管理
时间:2025-09-09 12:11:37 热度:37.1℃ 作者:网络
终末期心力衰竭患者心律失常的管理是LVAD植入前评估的核心环节,其复杂性体现在血流动力学相互作用、心肌重构以及电生理基质改变之间的多重耦合效应。本文基于《中国左心室辅助装置候选者术前评估与管理专家共识(2023年)》及国际权威指南,深入探讨LVAD术前心律失常的病理机制、风险分层及治疗策略。
心律失常的病理生理学基础
心肌重构与电重构
终末期心力衰竭的心律失常发生涉及结构重构和电重构的复杂相互作用。在分子水平上,心肌细胞膜离子通道表达异常是关键环节:L型钙通道密度降低、钠钾ATP酶活性下降、内向整流钾电流(IK1)减少,导致动作电位延长和后除极易感性增加。细胞内钙处理异常,特别是肌浆网钙释放通道(RyR2)的高磷酸化状态,促进了触发活动的产生。
神经激素失衡与致心律失常基质
交感神经系统过度激活通过β1受体介导的cAMP-PKA信号通路,直接影响离子通道功能,并通过磷酸化CaMKII激活钙漏,形成延迟后除极(DAD)。肾素-血管紧张素-醛固酮系统激活通过促进心肌纤维化、间质胶原沉积,形成折返激动的解剖基础。
右心室电生理特殊性
右心室的电生理特性与左心室存在显著差异,动作电位时程更短、传导速度相对较慢。在终末期心衰中,右心室压力负荷增加导致的机械牵张激活牵张敏感离子通道,通过机械-电耦合机制影响传导系统,使得室性心律失常对LVAD术后右心功能的影响更为显著。
房颤的精准化管理策略
病因识别与纠正
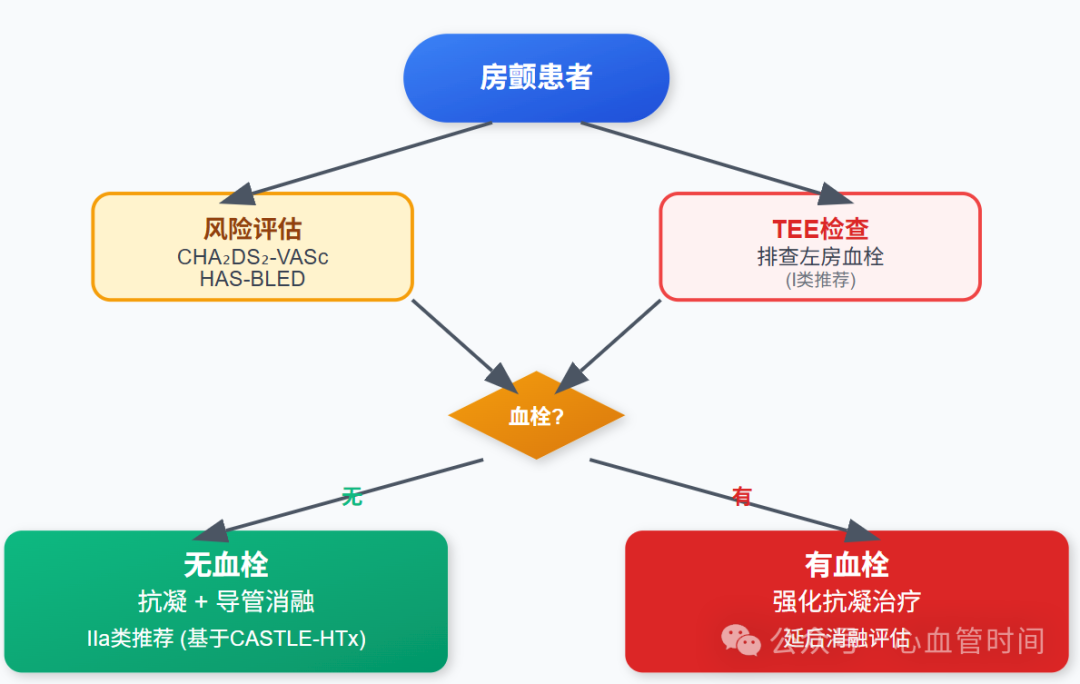
2023年专家共识明确提出(I类推荐),首先要识别和纠正潜在病因或促发因素,包括感染、电解质紊乱(低钾血症、低镁血症、高钾血症)、心肌缺血、甲状腺功能亢进等。当心力衰竭改善、交感神经活性和心室率降低时,房颤有自发转窦性心律的可能。
抗凝治疗的循证决策
专家共识建议(I类推荐)使用CHA₂DS₂-VASc和HAS-BLED评分来分别评估患者血栓栓塞和出血风险,以决定是否行抗凝治疗。对于肥厚型心肌病合并房颤的患者,应直接给予抗凝治疗(I类推荐)。
血流动力学不稳定的紧急处理
若房颤伴随血流动力学不稳定,需要紧急施行电复律(I类推荐)。这在LVAD候选者中尤为重要,因为这类患者的血流动力学储备已经极其有限。
左心房血栓排查与预防
专家共识明确指出(I类推荐),建议所有房颤患者均应排查有无左心房血栓,这通常需要经食管超声心动图检查。为预防血栓栓塞事件,建议术中同期行左心耳切除术(IIa类推荐)。
导管消融的循证医学证据
CASTLE-HTx试验的重要发现
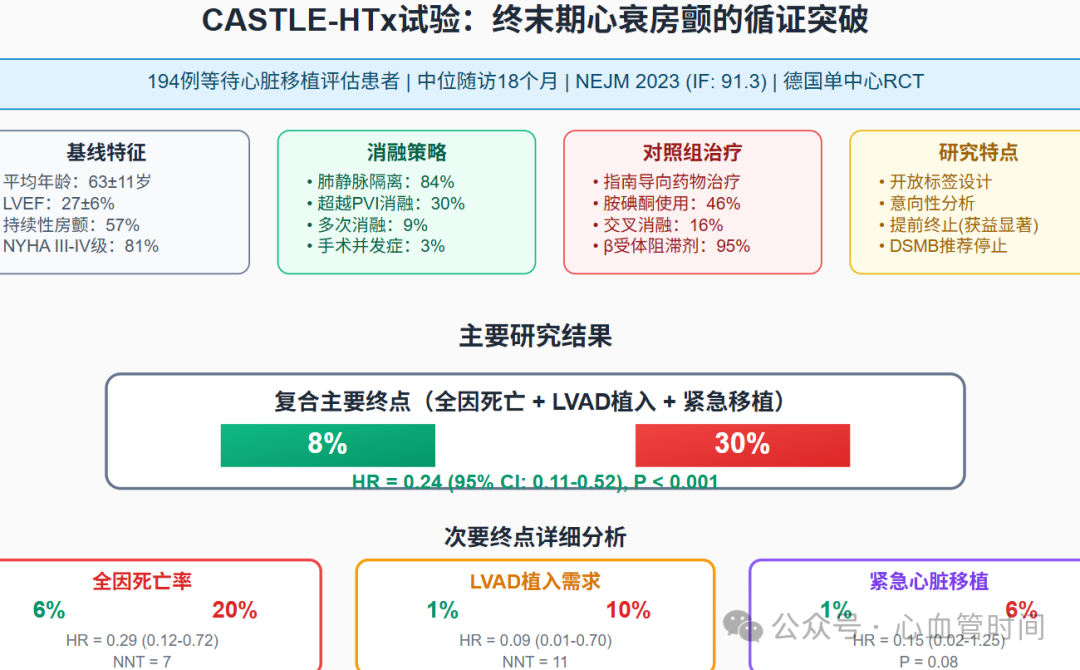
该里程碑式研究(NEJM 2023)为终末期心衰房颤患者的导管消融提供了强有力的证据。194例等待心脏移植评估的患者中,导管消融组相比药物治疗组显示出显著优势:
-
复合主要终点:8% vs 30%(HR 0.24, 95% CI 0.11-0.52, P<0.001)
-
全因死亡率:6% vs 20%(HR 0.29, 95% CI 0.12-0.72)
-
LVAD植入需求:1% vs 10%(HR 0.09, 95% CI 0.01-0.70)
基于此证据,对于终末期心衰合并有症状性房颤的患者,导管消融联合药物治疗应被视为IIa类推荐。
💡 笔者提示
CASTLE-HTx试验的结果改变了我们对终末期心衰房颤患者的治疗理念。在实际临床工作中,对于等待心脏移植或LVAD植入的房颤患者,应该积极考虑导管消融治疗,特别是那些症状明显、药物治疗效果不佳的患者。
室性心律失常的循证管理
血流动力学优化的首要原则
专家共识强调(I类推荐),所有失代偿性心力衰竭合并反复发作的室性心律失常的患者,在LVAD术前,均应尝试积极改善患者血流动力学状态。这一原则基于室性心律失常往往与可逆性因素相关的认识。
可逆性病因的系统性处理
治疗原则首先应纠正潜在的病因或诱因(I类推荐),包括低钾血症、低镁血症、心力衰竭加重、心肌缺血,以及应用导致心律失常的药物等。对于持续性室速患者,或随着血流动力学改善仍然反复发作的室速,术前应评估有无心肌缺血(I类推荐),特别是患者合并已知冠心病时。
抗心律失常药物的循证应用
β受体阻滞剂的核心地位
专家共识明确指出(I类推荐),药物治疗首选β受体阻滞剂,在抗心律失常药物中,只有它能减少射血分数降低的心力衰竭患者的猝死发生风险。PARADIGM-HF研究亚组数据分析显示,NYHA心功能分级Ⅰ级或Ⅱ级与NYHA心功能分级Ⅲ级或Ⅳ级相比具有更显著的获益,但β受体阻滞剂在心律失常管理中的地位依然重要。
胺碘酮的应用策略
在优化β受体阻滞剂治疗后,胺碘酮是首选的抗心律失常药(I类推荐)。但在终末期心衰患者中需要特别谨慎:
-
负性肌力效应:通过钙通道阻断作用,可能进一步恶化心功能
-
器官毒性监测:肺毒性、甲状腺功能异常、肝毒性需要密切监测
-
药物相互作用:与华法林、地高辛等的相互作用需要关注
射频导管消融的适应证
除了药物治疗外,专家共识提到射频导管消融也是一种选择(IIb类推荐)。对于药物难治性、血流动力学不稳定的室速,应积极评估导管消融的可行性。
💡 笔者提示
在LVAD候选者中应用胺碘酮需要格外谨慎。临床实践中,我们通常从最小有效剂量开始,密切监测心功能变化。对于反复发作的室性心律失常,早期考虑导管消融可能比单纯药物治疗更为有效。
特殊临床情况的管理
电解质平衡的精细化管理
电解质紊乱是心律失常的重要诱因,在LVAD候选者中需要特别重视(I类推荐):

钾代谢管理
-
目标范围:维持血钾4.0-5.0 mmol/L
-
利尿剂相关性低钾:袢利尿剂与保钾利尿剂的联合应用
-
肾功能不全相关性高钾:必要时使用钾结合剂
镁缺乏的识别与纠正
-
血清镁正常但细胞内镁缺乏的隐匿性影响
-
镁与钾的协同作用:镁缺乏时钾补充的无效性
-
硫酸镁的抗心律失常机制
围手术期抗凝管理
抗凝桥接策略
基于风险分层的个体化抗凝桥接方案(I类推荐):
-
高血栓风险患者:CHA₂DS₂-VASc≥4分,需要桥接治疗
-
中等风险患者:个体化评估决策
-
低风险患者:可以不进行桥接治疗
华法林的标准化管理
专家共识推荐华法林作为LVAD患者的标准抗凝药物(I类推荐),目标INR 2.0-3.0。新型口服抗凝药在LVAD患者中的应用证据仍然有限,不作为首选推荐(III类推荐)。
术前评估的标准化流程
心电学检查的规范要求
根据专家共识要求(I类推荐),所有LVAD候选者术前均需行:
-
标准心电图:12导联或18导联心电图检查
-
动态心电图监测:24小时连续监测,评估心律失常负荷
-
运动负荷试验:对于症状稳定患者,评估运动诱发的心律失常
血流动力学评估
右心功能的综合评估
专家共识强调(I类推荐),右心功能衰竭是导致LVAD术后不良事件和死亡的重要原因之一。评估包括:
-
超声心动图指标:右心室舒张末期短/长轴比≥0.6、右心室面积变化率<34%、三尖瓣环收缩期位移<14mm
-
右心导管检查:CVP/PCWP >0.63的患者术后右心功能衰竭发生率更高
-
肺动脉搏动指数:PAPi >2者术后右心辅助装置植入率较低
影像学评估的重要性
左心房评估
(I类推荐):
-
经胸超声心动图:评估左心房大小、功能
-
经食管超声心动图:排查左心房血栓,所有房颤患者必须进行
-
心脏MRI:评估心肌纤维化程度,指导治疗策略选择
循证治疗的个体化决策
基于INTERMACS分级的治疗策略
不同INTERMACS分级患者的心律失常管理策略:
INTERMACS 1级患者
-
血流动力学极其不稳定,心律失常管理以紧急抢救为主
-
电复律为首选治疗(I类推荐)
-
胺碘酮静脉应用控制室性心律失常(I类推荐)
INTERMACS 2-3级患者
-
血流动力学相对稳定,可以考虑导管消融治疗
-
房颤患者推荐导管消融联合药物治疗(IIa类推荐)
-
室性心律失常首选β受体阻滞剂+胺碘酮(I类推荐)
INTERMACS 4级及以上患者
-
可以进行全面的心律失常评估和择期治疗
-
导管消融可作为一线治疗选择(IIa类推荐)
总结
LVAD术前心律失常的管理需要基于循证医学证据的个体化策略。房颤管理的核心在于血栓栓塞风险评估、抗凝治疗优化以及基于CASTLE-HTx试验证据的导管消融应用。室性心律失常的管理则以β受体阻滞剂为基石,胺碘酮为重要补充,必要时考虑导管消融治疗。


