KRAS野生型胰腺导管腺癌:常检出可用药基因变异,早发性患者尤其富集ALK/BRAF/RET融合
时间:2025-09-09 12:12:13 热度:37.1℃ 作者:网络
约10%的胰腺导管腺癌(PDAC)病例为KRAS野生型(KRAS-wt)。其中,仅一小部分存在可药物靶向的基因组变异,这引发了何时应采用更广泛的下一代DNA测序检测的问题。全球范围内,早发性(EO)PDAC发病率不断上升,近期有证据表明年轻患者中KRAS-wt病例占比更高。本回顾性观察研究分析了预设数据库中的二次数据。采用FoundationOne CDx或Liquid基因检测 panel,对标准治疗失败的患者进行基因组变异检测。根据KRAS状态对病例进行分类,并将KRAS-wt患者分为早发组(EO,≤52.5岁)和晚发组(LO,>52.5岁)。依据欧洲肿瘤内科学会分子靶点临床可操作性量表(ESMO ESCAT)对变异进行评估。
对224例PDAC和10例胰腺腺泡细胞癌(PACC)患者进行了下一代测序。在PDAC患者中,23.2%(52/224)为KRAS-wt。KRAS-wt病例中可靶向的TIER I-III变异更为常见(23.1% vs 11.6%,P=0.04),且基因融合事件仅见于KRAS-wt病例(9.6% vs 0%,P=0.0006)。在KRAS-wt PDAC中,早发性PDAC(EO-PDAC)的可药物靶向TIER I-III变异频率显著更高(6例 vs 6例,即54.5% vs 14.6%,P=0.006)。值得注意的是,与晚发组相比,KRAS-wt早发性PDAC中可靶向基因融合显著富集(4例 vs 1例,即36.4% vs 2.4%,P=0.005)。
较年轻患者确诊的KRAS-wt PDAC更常存在可靶向突变,这凸显了全面基因组分析在指导该患者群体靶向治疗干预中的重要性。
-
一小部分PDAC病例为KRAS-wt基因型,且该群体中可药物靶向的基因变异尤为富集;
-
约36%的早发性(≤52.5岁)KRAS-wt PDAC中,可直接药物靶向的基因融合更为富集;
-
年龄是识别KRAS-wt PDAC中可靶向基因融合的关键临床因素;
-
KRAS-wt状态的年轻患者应优先接受全面基因组分析。
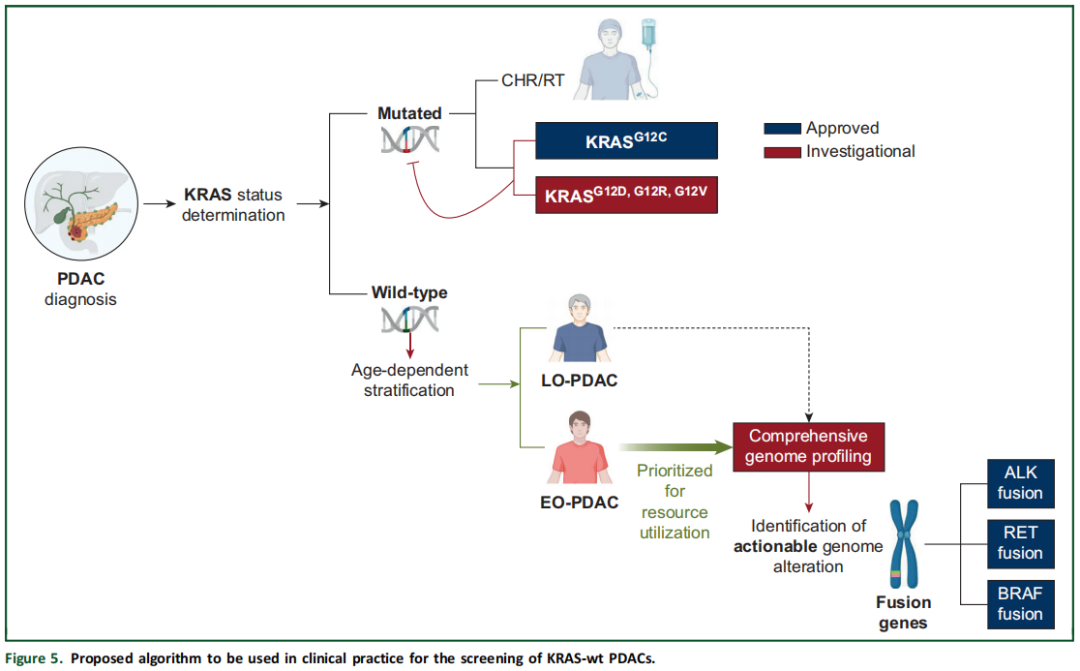
图5
研究背景
胰腺导管腺癌(PDAC)是一种极具侵袭性和致命性的恶性肿瘤,预后极差。目前,PDAC是全球第三大癌症相关死亡原因,预计未来十年将升至第二。尽管PDAC主要影响老年人,发病高峰约在70岁左右,但早发性PDAC(诊断年龄<50岁)的发病率正在上升。
PDAC预后不良主要归因于约85%的患者在确诊时已处于不可切除阶段,且该疾病对标准化疗方案具有显著耐药性。即便有最新进展,如NALIRIFOX方案在NAPOLI-3试验中显示出优于标准白蛋白结合型紫杉醇联合吉西他滨方案的疗效,转移性患者的中位总生存期(mOS)仍不足1年。此外,与其他恶性肿瘤不同,靶向治疗和免疫治疗在PDAC中尚未显著改善预后。这些发现凸显了仅靠化疗难以实现显著生存改善的困境,强调了在该疾病中开发新型靶向治疗策略的迫切需求。
KRAS是人类癌症中最常见的突变癌基因,PDAC中KRAS突变频率最高,几乎占90%的病例。近四十年来,由于其结构特性,KRAS一直被认为是不可成药靶点。然而,近期药物研发的进展已催生了首批KRAS抑制剂,为KRAS突变驱动的PDAC带来了改善治疗选择的希望。矛盾的是,未来几年可能出现的情况是,10%-15%的KRAS-wt PDAC患者的治疗选择可能少于KRAS突变型肿瘤患者。
缺乏KRAS突变常导致存在独特的分子驱动因素,这既带来了独特挑战,也为患者提供了潜在治疗机会。事实上,KRAS-wt PDAC中可靶向变异更为富集,尤其是在受体酪氨酸激酶(RTK)-RAS-MAPK信号通路中。这包括涉及BRAF、ALK、ROS1、FGFR2、RET、MET和RAF1的点突变和基因融合,以及FGFR3、ERBB2、MET和NTRK的扩增。这些变异不仅在KRAS-wt患者中更常见,且几乎为该亚型所特有,为靶向治疗提供了前景,而这些治疗可能不适用于KRAS突变型PDAC。
为识别和靶向这些变异,通过NGS进行全面基因组分析(CGP)至关重要。NGS可对癌症相关基因进行全面分析,能够检测到可能对靶向治疗有反应的罕见但可靶向的突变或基因融合。然而,NGS在常规临床实践中的应用面临技术复杂性和高成本的挑战。这也可能限制其在KRAS-wt PDAC中的广泛使用,尽管该亚型病例占比相对较小,但每年涉及的患者数量仍相当可观。
在这方面,确定有助于富集KRAS-wt PDAC患者群体(更适合进行NGS检测)的临床特征至关重要。为特定患者亚群量身定制NGS检测,可提高该方法的临床实用性,确保其应用于最有可能发现可靶向分子靶点的场景。
本研究回顾性评估了234例确诊为PDAC或胰腺腺泡细胞癌(PACC)且接受NGS全面基因组分析的患者的KRAS状态及相关分子特征。本分析揭示了早发性PDAC(≤52.5岁)与晚发性PDAC(>52.5岁)在分子层面的差异,尤其是在KRAS-wt亚组中。这些发现提示了一种更具可持续性的策略,即在常规临床实践中优先对年轻患者进行广泛基因组分析。关注早发性KRAS-wt PDAC可能提高检测到可靶向变异的可能性,进而为这些患者提供更多靶向治疗选择。
研究结果
KRAS状态与患者分层:
2017年2月至2025年2月期间,234例确诊胰腺癌患者接受了基于F1CDx或F1Liquid NGS检测的CGP。其中,224例(95.7%)经组织学证实为PDAC。PDAC患者的中位年龄为61岁(范围23-89岁),其中女性占46.4%,男性占53.6%;PACC患者的中位年龄为56岁(范围43-70岁),女性占30%,男性占70%。患者人口统计学数据详见表1。
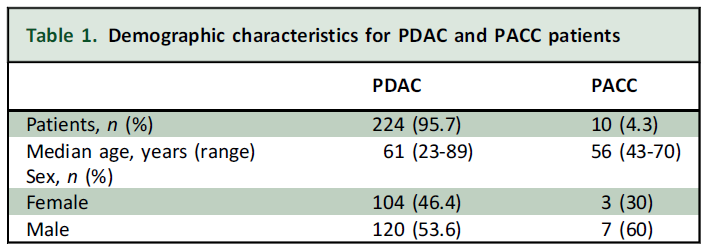
表1
在PDAC患者中,172例(76.8%)为KRAS突变型(KRAS-MUT)肿瘤,52例(23.2%)为KRAS野生型(KRAS-wt)基因型(图1)。10例(4.3%)确诊为PACC的患者均未检测到KRAS突变。
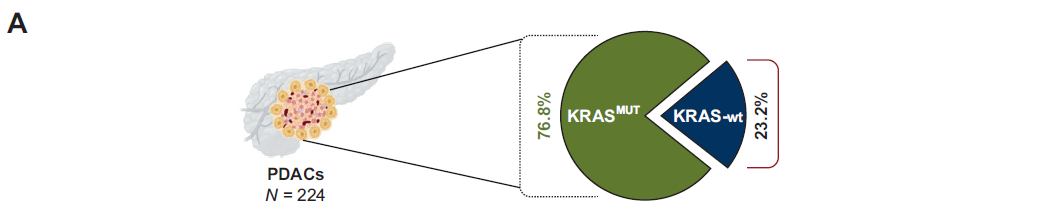
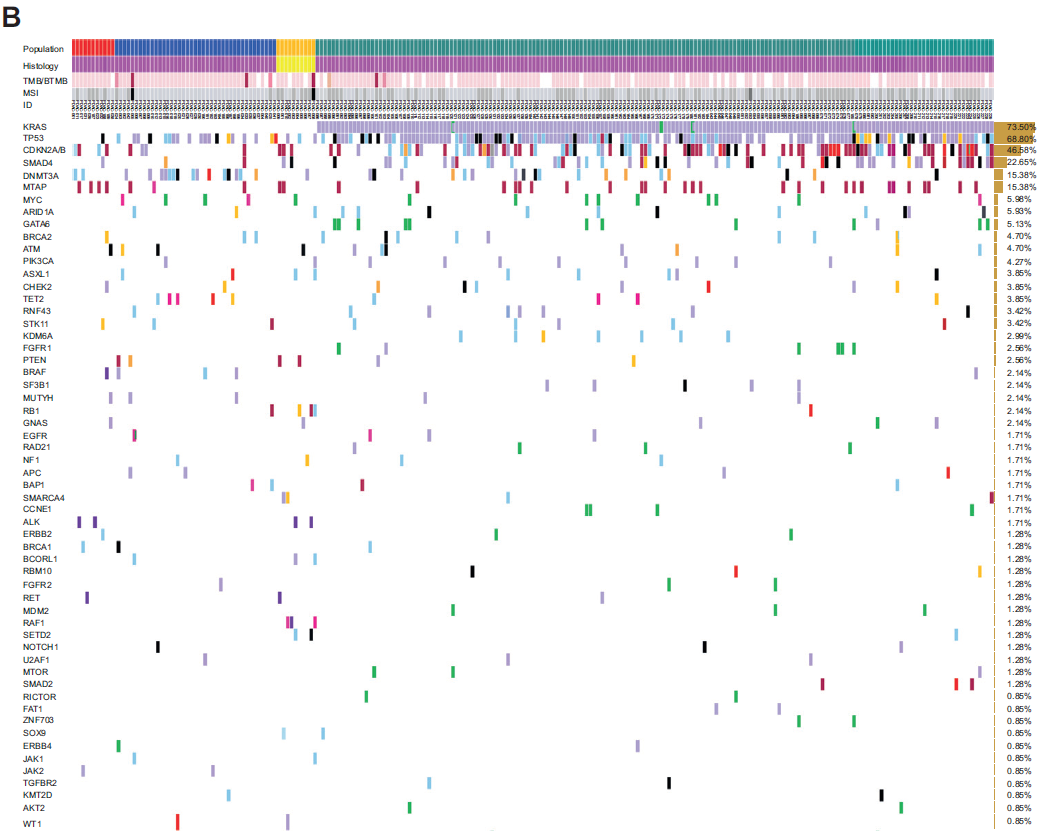
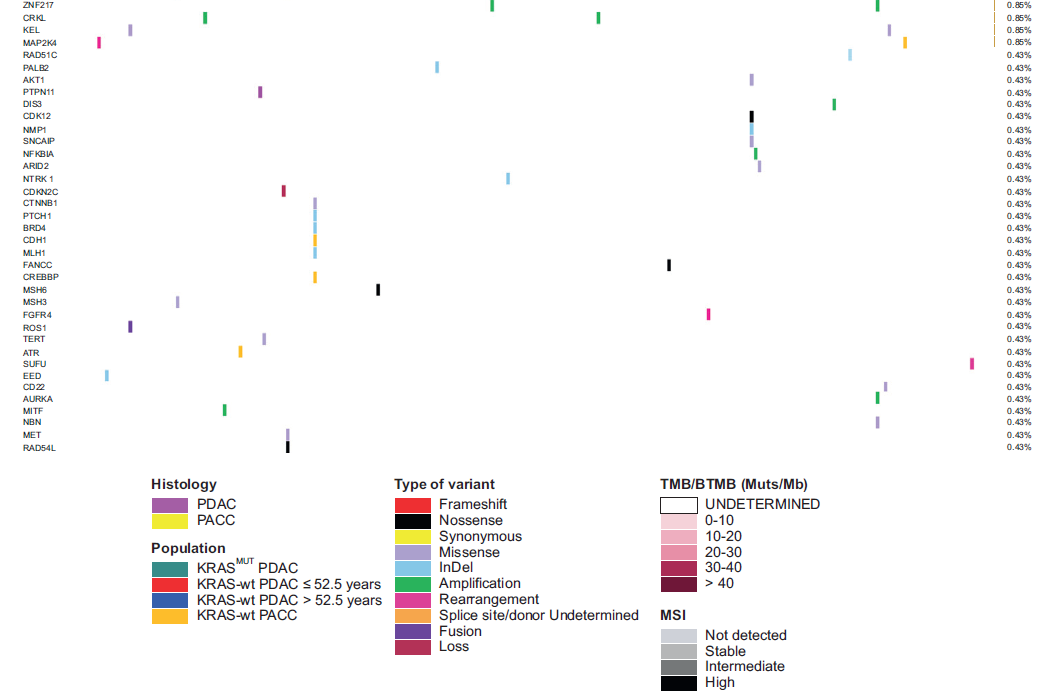

图1
与既往研究一致,PDAC队列中,关键抑癌基因(尤其是TP53、CDKN2A/B和SMAD4)的功能缺失性变异在KRAS-MUT肿瘤中显著多于KRAS-wt肿瘤。具体而言,81.4%(140/172)的KRAS-MUT病例检测到TP53变异,而KRAS-wt PDAC中仅36.5%(18/52)(P<0.0001);57%(98/172)的KRAS-MUT病例检测到CDKN2A/B变异,KRAS-wt PDAC中仅15.4%(8/52)(P<0.0001);27.9%(48/172)的KRAS-MUT病例检测到SMAD4变异,KRAS-wt PDAC中仅5.8%(3/52)(P=0.0009)(图2A)。相反,KRAS-wt肿瘤中DNMT3A基因变异的频率显著更高(32.7% vs 10.5%,P=0.0003)。
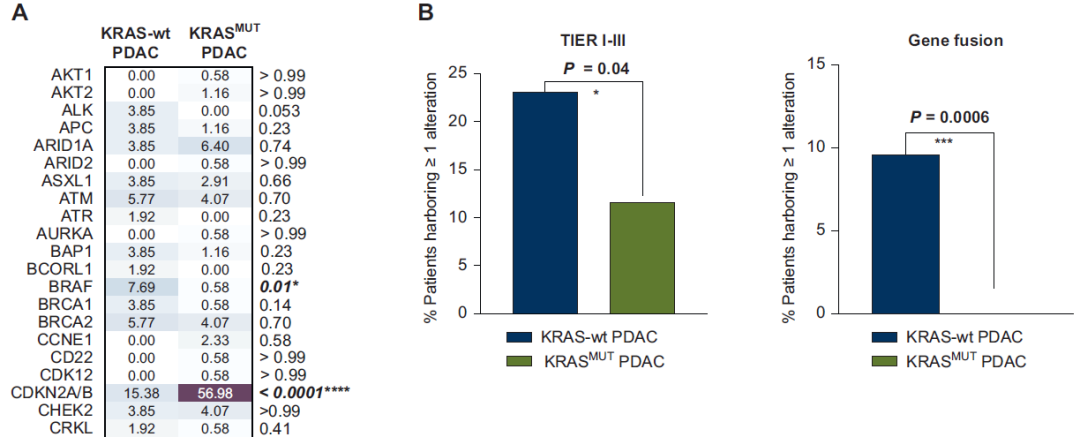

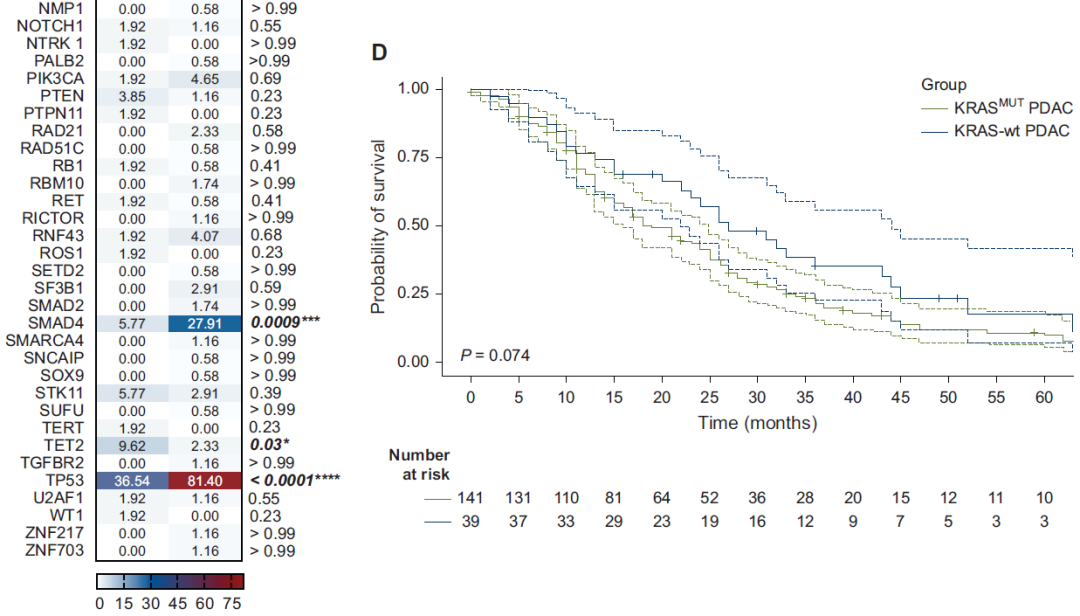

图2
根据ESMO ESCAT标准评估队列中基因变异的临床可干预性,发现PDAC人群中,KRAS-wt病例的ESCAT TIER I-III级可靶向变异更常见(23.1% vs 11.6%,P=0.04)(图2B)。例如,2例KRAS-wt PDAC和1例KRAS-MUT PDAC检测到BRCA1突变(3.8% vs 0.6%,P=0.14);BRCA2和ERBB2突变在两组中的频率相近(BRCA2:5.8% vs 4.1%,P=0.70;ERBB2:1.9% vs 1.2%,P=0.55)。相反,PIK3CA可靶向突变在KRAS-MUT中更常见(8例 vs 1例,4.7% vs 1.9%,P=0.68);MDM2变异仅见于KRAS-MUT PDAC(3例,1.73% vs 0%,P>0.99)。
值得注意的是,TIER III级可靶向基因融合事件仅见于KRAS-wt PDAC(9.16% vs 0,P=0.0006)(图2B)。BRAF变异在KRAS-wt PDAC中显著富集(7.7% vs 0.58%,P=0.01),其中融合和V600E点突变仅见于2例KRAS-wt PDAC(3.8% vs 0%,P=0.06)(图2C)。同样,ALK可靶向融合仅在2例KRAS-wt PDAC中检出(3.8% vs 0%,P=0.053);RET突变在两组中各检出1例(KRAS-wt:1.92% vs KRAS-MUT:0.6%,P=0.41),但可靶向RET融合仅见于KRAS-wt组(1.9% vs 0%,P=0.23)(图2C)。这些结果表明,KRAS-wt PDAC中潜在可靶向融合和变异存在独特富集,凸显了该亚群中个体化治疗策略的潜力。
在PACC病例中,60%(6/10)检出TIER III级致癌融合或重排,涉及RAF1、ALK和RET基因。此外,仅1例PACC患者为微卫星高度不稳定(MSI-H)(10%),未检出BRCA1/2突变。
对KRAS-wt和KRAS-MUT PDAC患者的mOS分析显示,KRAS-wt队列存在生存改善趋势,但差异无统计学意义:KRAS-wt患者mOS为27个月,KRAS-MUT患者为19个月[HR 0.69,95%CI 0.46-1.04,P=0.074](图2D)。
KRAS野生型PDAC中基因融合与可干预性的识别:
本研究旨在探索KRAS-wt PDAC中发病年龄与替代性致癌驱动基因的潜在可靶向体细胞变异之间的关系。
为评估年龄对可靶向基因融合的鉴别能力,通过ROC曲线分析确定KRAS-wt PDAC中年龄阈值为52.5岁(敏感性80%,95%CI 37.55%-98.97%;特异性85.1%,95%CI 72.31%-92.59%)(AUC 0.8085,95%CI 0.5825-1.000,P=0.0244)。基于该阈值,根据诊断和/或基因组分析时的年龄,将KRAS-wt PDAC进一步分为早发性(EO-PDAC,≤52.5岁)和晚发性(LO-PDAC,>52.5岁)。在KRAS-wt PDAC中,11例(21.2%)为EO-PDAC,诊断中位年龄47岁(范围23-52岁);41例(78.8%)为LO-PDAC,诊断中位年龄63岁(范围53-86岁)(图1B和图3)。
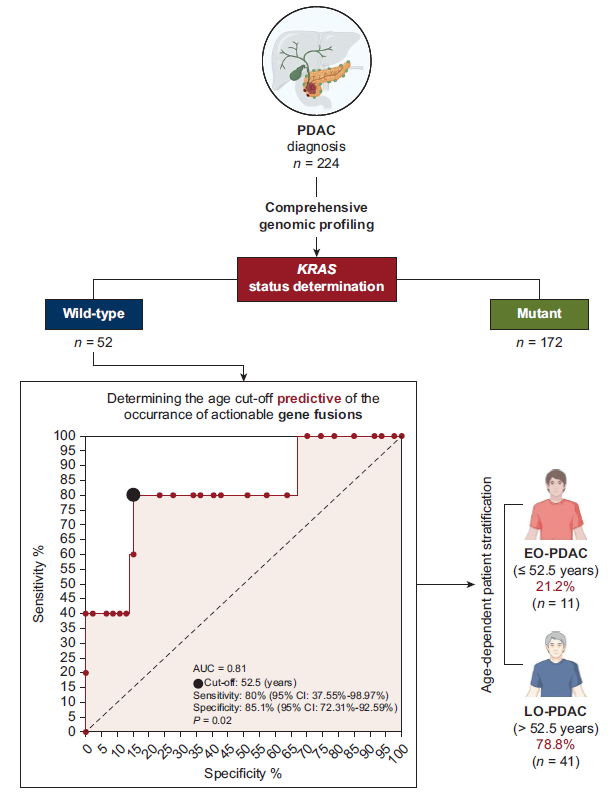

图3
基因变异频率分析显示,EO-PDAC和LO-PDAC患者存在独特的突变特征(图4A)。EO-PDAC中可药物靶向的TIER I-III级变异频率显著更高(6例 vs 6例,54.5% vs 14.6%,P=0.006)(图4B)。ESCAT TIER I级BRCA1突变在两个年龄亚组中各检出1例(9.1% vs 2.4%,P=0.38);BRCA2在1例EO-PDAC和2例LO-PDAC中检出(9.1% vs 4.9%,P=0.52);MSI-H状态仅见于1例KRAS-wt LO-PDAC(2.4% vs 0%,P>0.99)。KRAS-wt LO-PDAC中TP53突变发生率显著更高,18例检出,而年轻患者中仅1例(43.9% vs 9.1%,P=0.04)(图4A)。相反,KRAS-wt PDAC队列中,EO患者的MTAP变异显著富集,4例检出(均为基因缺失),而LO组3例(2例基因缺失,1例基因重排)(36.4% vs 7.3%,P=0.03)。
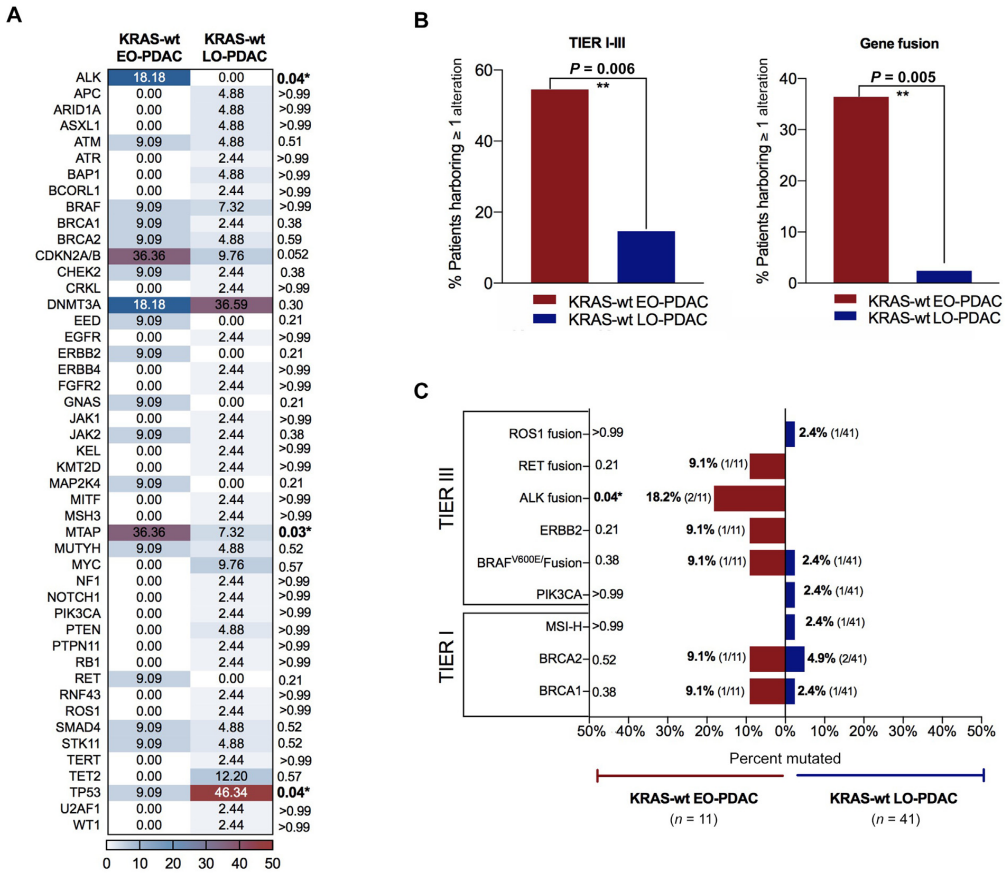
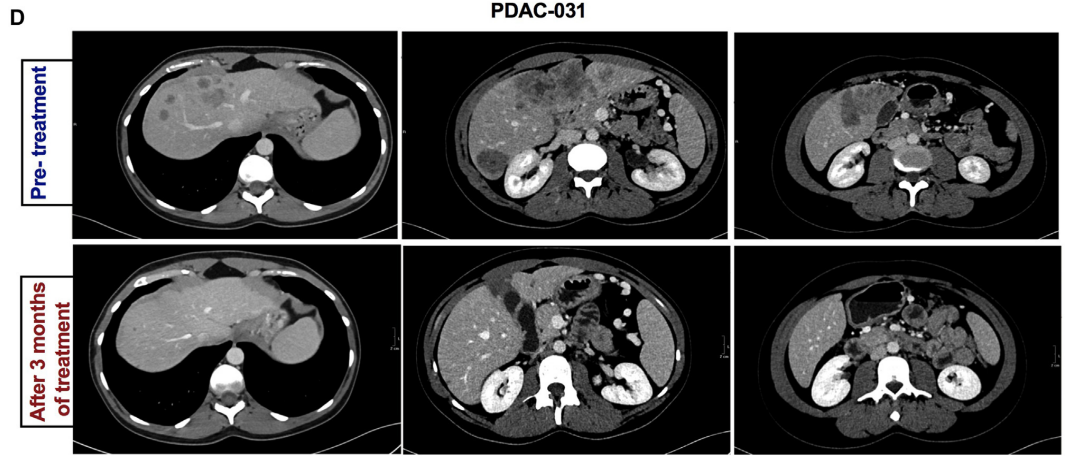

图4
值得注意的是,基因融合在EO-PDAC亚组中显著富集,4例患者检出,而LO组仅1例(36.4% vs 2.4%,P=0.005)。具体而言,1例EO-PDAC患者(9.1%)存在ALK exon 20与EML4 exon 13融合(EML4::ALK,变异体1),另1例(9.1%)存在ALK exon 20与EML4 exon 6融合(EML4::ALK,变异体3a/b)。1例51岁KRAS-wt EO-PDAC患者检出BRAF::TRIMM33可靶向融合。此外,1例EO-PDAC患者在10号染色体上存在两种致癌融合,即RET::KIAA121和RET::WDFY4(图4C)。该36岁女性在该院接受RET选择性抑制剂塞普替尼治疗,3个月后根据RECIST v.1标准评估为部分缓解,肝转移靶病灶明显缩小;治疗持续33个月,期间疾病保持稳定(图4D)。相反,LO-PDAC患者中,41例仅1例(2.4%)存在涉及ROS1的可靶向TIER III级融合,另2例存在BRAF和PIK3CA可靶向点突变(各2.4% vs 0%)(图4C)。
生存分析显示,KRAS-wt EO-PDAC患者总生存期存在改善趋势,但差异无统计学意义(52个月 vs 26个月,HR 2.27,95%CI 0.78-6.66,P=0.13)。
讨 论
约90%的PDAC存在KRAS突变,这是一个独立的不良预后因素,与治疗反应降低、化疗耐药及总生存期缩短相关。仅有一小部分患者为KRAS-wt基因型,并存在替代性疾病驱动分子变异。因此,KRAS突变状态已成为指导PDAC患者个体化治疗的潜在预测生物标志物。本研究提供的证据支持:KRAS-wt患者更可能携带额外的可靶向突变,应选择性对其进行CGP。研究结果强调,年龄是KRAS-wt PDAC人群中与可靶向变异高发生率相关的关键临床因素。尽管本研究中KRAS-wt PDAC的样本量有限,但确诊年龄≤52.5岁的患者与年长患者相比,潜在可药物靶向的基因融合频率显著更高(36.4% vs 2.4%,P=0.005)。这些结果提示,CGP在年轻KRAS-wt PDAC患者中可能发挥特别重要的作用,为该独特临床亚群提供个体化靶向治疗干预的潜力,有望显著改善预后。
近年来,KRAS-wt PDAC的分子谱日益清晰。与既往研究一致,本分析显示KRAS-wt PDAC队列中关键抑癌基因(包括TP53、CDKN2A/B和SMAD4)的变异频率显著更低(P<0.001)。这些发现凸显了KRAS-MUT PDAC中抑癌基因破坏的发生率明显更高,这可能与其更具侵袭性的表型和较差的临床结局相关。此外,对PDAC队列的生存分析显示,KRAS-wt患者与KRAS-MUT患者相比,OS可能存在优势(27个月 vs 19个月,P=0.07),尽管差异未达到统计学意义。
既往研究通过比较50岁以下与70岁及以上患者,探讨了发病年龄在KRAS-MUT或KRAS-wt PDAC患者中的作用。然而,这些分析排除了50-70岁的患者,可能引入偏倚并导致结果矛盾。一项利用真实世界DNA测序数据库的初步研究表明,50岁以下PDAC患者的KRAS突变发生率显著低于70岁及以上患者。在KRAS-wt亚群中,50岁以下患者的PDAC更可能由涉及NRG1和MET的基因融合驱动。最近一项研究(同时使用内部队列和验证队列)发现,50岁以下PDAC患者的ESCAT I-IIIA级变异发生率较70岁以上患者有升高趋势,但各年龄组的KRAS-wt病例中ESCAT变异的富集程度相似。本研究基于连续年龄谱分析,强调在52.5岁及以下确诊的KRAS-wt PDAC中,可直接靶向的变异更为富集,尤其是ALK、BRAF和RET基因融合仅在这些年轻KRAS-wt患者中检出。
尽管基因融合在PDAC总体人群中占比<0.5%,但其具有重要临床意义,在治疗决策和诊断评估中发挥关键作用。独立研究中应用广泛基因组分析显示,高达15%的KRAS-wt PDAC存在潜在可靶向基因融合,尤其是采用基于RNA的融合分析时。本研究的数据提示,仅在KRAS-wt EO-PDAC患者中,分子可靶向性发生率可高达36%,这为研究这些患者中RTK融合的治疗靶向提供了有力依据。ALK、BRAF和RET基因融合导致激酶持续激活,在PDAC中极为罕见。ALK融合在EO-PDAC中仅占0.16%-1.3%,且仅见于无KRAS突变的患者。近期研究报道,第三代ALK抑制剂洛拉替尼对携带ALK融合的患者具有临床获益。研究者最近报道了首例晚期PACC患者,其携带新型ALK融合伴侣——KN基序和锚蛋白重复结构域4(KANK4),在阿来替尼治疗下获得显著缓解。BRAF致癌突变通过激活MAP激酶信号通路,在多种癌症的肿瘤发生中起关键作用。尽管不常见,但BRAF融合(在约0.4%的PDAC中检出)明显仅限于KRAS野生型肿瘤。同样,RET融合在PDAC中偶见,约占0.6%的病例。LIBRETTO-001 I/II期临床试验数据显示,RET融合阳性PDAC对选择性抑制剂塞普替尼敏感。在本研究KRAS-wt EO-PDAC病例中,PDAC-031患者在检出RET基因融合后接受塞普替尼治疗,3个月后根据RECIST v.1标准评估为部分缓解,且持续33个月。
MTAP在甲硫氨酸补救途径中通过将多胺合成的副产物甲基硫腺苷再循环为甲硫氨酸而发挥关键作用。MTAP功能缺失与肿瘤发生相关。在本研究队列中,KRAS-wt EO-PDAC患者的MTAP基因缺失显著更频繁(4例 vs 2例,36.4% vs 4.8%,P=0.014)。这一发现尤其值得关注,因为近期I期临床数据显示,选择性PRMT5抑制剂对MTAP缺陷型PDAC具有抗肿瘤活性。
与导管腺癌相比,PACC被报道存在更多基因融合,尤其是涉及BRAF和RAF1的融合。在本研究队列中,10例PACC中有6例(60%)存在涉及RAF1、ALK和RET的潜在可靶向致癌融合和重排。尽管样本量有限,但本研究中观察到的可靶向变异高发生率与既往报道一致,支持对所有PACC患者进行常规分子谱分析,无论其他临床特征如何。
在个体化医疗时代,对于胆管癌等富含可靶向基因组变异的恶性肿瘤,越来越推荐通过NGS进行CGP。相比之下,未选择的PDAC中可靶向突变的历史低发生率限制了广泛基因组检测的常规应用。此外,即使仅针对KRAS-wt肿瘤,对所有PDAC病例进行大规模NGS检测也可能在成本和资源方面不切实际。总之,本研究发现支持对PDAC患者的分子谱分析采用更优化的诊断流程(图5)。具体而言,研究者建议先基于KRAS突变状态进行初筛,然后优先对52.5岁及以下患者进行CGP。这种靶向方法可提高资源利用效率,并增强临床获益,尤其是对于更可能携带可靶向基因变异的年轻患者。
参考文献:
Scarlato, E. et al. Early-onset enriches the identification of actionable alterations in patients with KRAS wild-type pancreatic ductal adenocarcinoma. ESMO Gastrointestinal Oncology, Volume 8, 100179


