非小细胞肺癌术后随访中国胸外科专家共识(2025 版)
时间:2025-09-14 12:12:23 热度:37.1℃ 作者:网络
摘 要
外科手术是非小细胞肺癌( non-small cell lung cancer,NSCLC)治疗的重要手段之一,术后定期随访是早期发现和及时治疗肿瘤复发、转移病灶或第二原发肿瘤的关键措施。科学合理的随访策略不仅可以延长患者生存期,还能显著提升生活质量,从而改善整体预后。本共识的制定旨在前一版随访共识基础上,根据目前最新临床研究进展,进一步根据不同治疗模式完善我国NSCLC早期患者的术后随访方案,为从事NSCLC术后随访管理的临床医师提供科学、可操作的参考依据。本共识希望通过优化随访策略,推动我国肺癌诊疗的规范化和标准化水平,助力更多患者获得更优质的治疗和长期管理。同时,本共识的发布也期望为国内外相关研究和临床实践提供借鉴,推动NSCLC术后管理领域的持续发展和创新。
正 文
肺癌是全球范围内最常见的恶性肿瘤之一,其死亡率长期位居首位,而术后复发和转移是导致早期肺癌患者死亡的主要原因。因此,术后随访监测显得尤为重要。通过有效的随访,可以早期发现复发、转移病灶或第二原发肿瘤,并及时干预和治疗,从而延长患者生存期,提高生活质量,改善总体预后。然而,目前关于非小细胞肺癌(non-small cell lung cancer,NSCLC)术后复发模式和随访策略的研究仍较为有限。国内外在NSCLC术后患者的随访方式、随访频率及检查方法等方面尚未达成一致意见,这在一定程度上限制了术后管理的规范化和科学化。为了填补这一领域的空白,进一步完善我国NSCLC术后随访方案,并提升我国肺癌规范化诊疗水平,我们在2020年组织国内众多胸外科专家,结合国内外的最新研究证据,共同探讨并发表了《非小细胞肺癌术后随访中国胸外科专家共识》[1]。此共识的发布为临床实践提供了科学指导,得到学界的广泛认可。随着近年来更多高质量临床研究成果的发表,我们对NSCLC术后随访的理解进一步加深。在此基础上,我们再次组织胸外科专家深入讨论,并联合撰写了《非小细胞肺癌术后随访中国胸外科专家共识(2025 版)》(以下简称新版共识)。新版共识不仅吸纳了近年来的最新研究证据,还进一步完善了随访策略的细节,为临床医生提供更具参考价值的随访指导。我们希望新版共识推动我国NSCLC术后随访的规范化管理,延长患者长期生存期并提高患者生活质量,同时为国际肺癌诊疗提供中国的实践经验与智慧。
1 方法与证据
检索PubMed、Web of Science、中国知网数据库及美国国立综合癌症网络(NCCN)指南、中国临床肿瘤学会(CSCO)指南等,分析近年来相关文献和研究资料,结合国际现行临床指南,旨在为负责NSCLC 术后随访的同道提供参考。本共识经3次专家讨论会修订并最终定稿。
2 随访策略适用人群
行根治性手术后、经病理诊断为 NSCLC 的患者。
3 随访方案
病史问诊与体格检查是疾病诊疗的基础,也是NSCLC患者术后复查随访的重要环节。通过系统的问诊和检查,可以全面了解患者的病情变化,并初步发现是否存在复发、淋巴结转移等异常,为进一步诊断提供依据。肿瘤标志物在监测肺癌复发方面发挥了关键作用。有研究[2-5]表明,定期检测肿瘤标志物有助于早期发现复发病灶,因此建议患者在每次随访中进行肿瘤标志物的监测复查。影像学检查是NSCLC术后随访的核心手段。其中,胸部CT已成为最常用的临床复查工具,并被各大指南广泛推荐。此外,由于腹部、颅脑和骨骼是肺癌远处转移的高发部位,这些区域的检查在全身复查中尤为重要。近年来,随着颅脑磁共振成像(magnetic resonance imaging,MRI)的普及,越来越多无症状脑转移患者被早期发现。MRI 在检测微小病变方面优于CT,因此建议进行颅脑增强MRI 作为首选检查方式[10-11]。对于疑似无症状复发的患者,全身正电子发射断层成像(PET)具有较高的敏感性和特异性。当标准CT难以区分肺部良性病变(如肺不张、肺实变或放射性纤维化)与恶性肿瘤时,全身PET-CT检查能够提供更加明确的诊断依据[13-15]。针对具体的复查方案,方案B 包括两种组合:一是依次检查胸部、腹部、颅脑和骨骼,二是直接进行全身PET-CT 检查。具体选择可以根据患者的病情、经济状况及个人意愿调整,以实现个性化管理。纤维支气管镜检查作为一种有创性诊断手段,并不建议常规使用(中央型肺癌行袖式切除或隆突重建的患者除外),仅当患者出现术后肺不张、咯血,或术后病理提示支气管残端轻度不典型增生等情况时,可酌情选择[9, 16]。此外,其他有创检查或细胞学检查仅在无创影像学检查无法明确诊断时作为补充手段择优选择。微小残留病灶(minimal residual disease,MRD)可能在NSCLC早期复发监测中具有潜在价值,但目前仍处于临床研究阶段[17-20],因此,尚未作为常规监测手段纳入;见表1。未来,我们期待更多临床数据支持其在复发预测中的实际应用。肺功能检测是评估术后肺功能残余能力和康复锻炼效果的重要指标,对患者术后健康管理具有指导意义。此外,肺癌生活质量评分近年来在NSCLC随机对照试验中被广泛应用,逐渐成为临床肿瘤学的重要工具,有助于全面评估患者的术后生活质量和生存状态,术后症状管理的患者报告结局模式和数字疗法亦具有一定的应用前景。通过多模式结合的随访策略,全面监测患者术后病情变化,不仅可以提高复发的早期检出率,还能够为患者的进一步治疗和康复提供有力支持,最大化术后管理的临床价值。

4 各类患者术后随访建议
本共识综合考虑患者是否接受术后辅助治疗及其基因突变状态的差异,分别阐述了适用于不同患者群体的随访方案;见表2。这一分类随访方案旨在提高复发监测的敏感性,优化随访资源的分配,通过结合个体化的治疗策略和病情特点,为患者提供更加精准的术后管理,改善长期生存和生活质量。
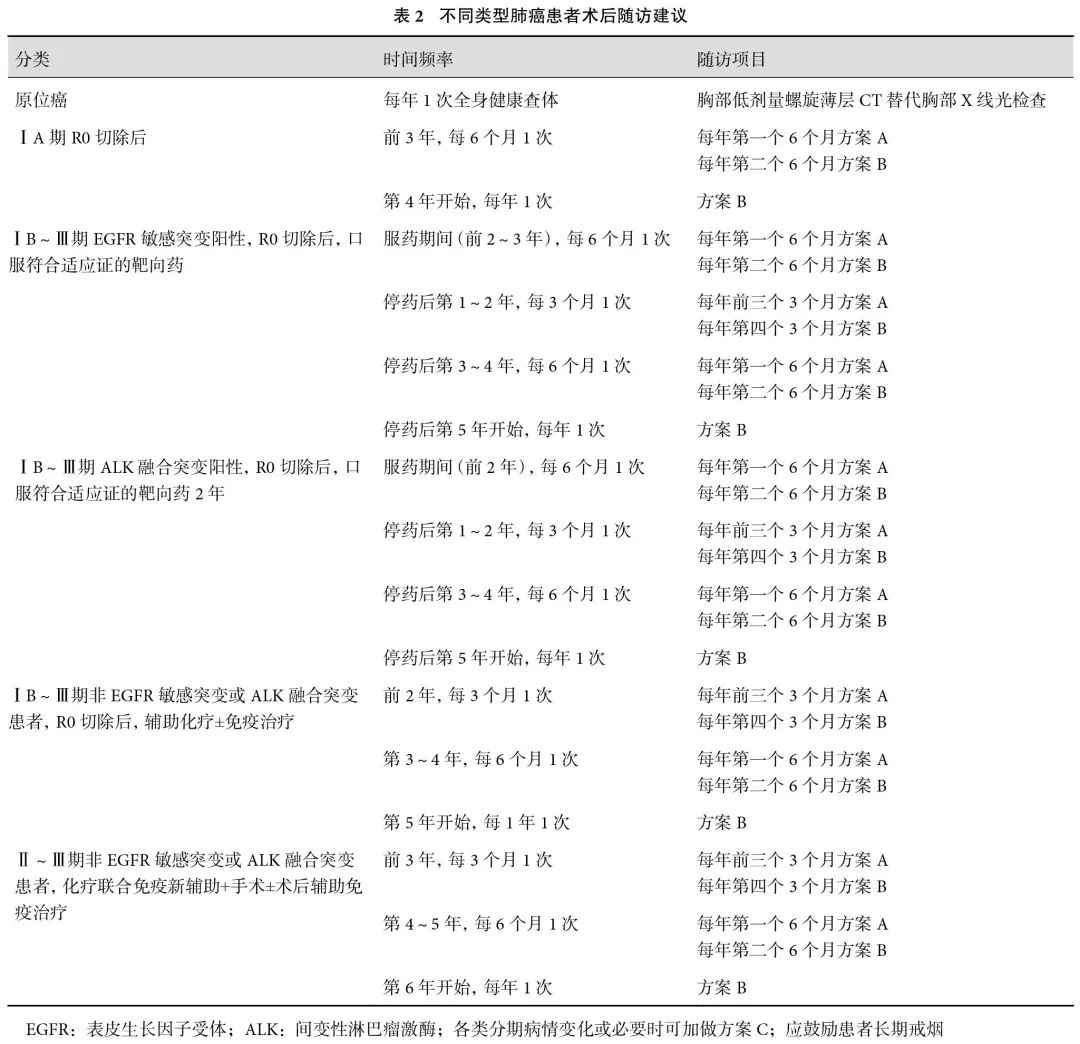
目前,手术仍是NSCLC患者的重要治疗方式之一。术后辅助治疗的选择通常基于患者的病理分期、高危因素以及基因突变状态等多个因素。这些因素不仅影响术后辅助治疗方案的制定,同时也对患者的复发模式和风险分布产生一定的影响。因此,需要针对不同的临床特征和治疗方案制定个性化的术后随访策略。
4.1 原位癌
目前针对NSCLC原位癌的复发模式研究仍较为有限。由于原位癌的生物学特性和临床表现决定了其复发率较低,已有的临床数据和文献研究较少涉及其具体的复发规律。现有临床观察显示, NSCLC原位癌患者术后复发的风险总体较低,且大多数患者在经过根治性手术后能够获得良好的长期预后。因此,为这类患者制定合理的随访策略显得尤为重要。
基于原位癌较低的复发风险,本共识建议患者术后每年进行一次常规全身健康检查,以便全面评估患者的健康状况和潜在的复发风险。特别是在影像学随访中,建议采用胸部低剂量螺旋CT(low dose spiral CT,LDCT)替代传统的胸部X线片检查。这是因为LDCT在检测早期肺部病变和微小复发病灶方面具有更高的敏感性,能够提高早期检出率,从而为患者争取更早期的干预机会。同时,相较于常规CT,LDCT具有辐射剂量低的优势,更适合作为长期随访的主要检查手段。
此外,尽管原位癌的复发风险较低,仍需关注患者个体化的风险因素。例如,对于有吸烟史或存在其他肺部基础疾病的患者,应在随访方案中适当增加检查频率和项目。此外,建议随访过程中结合患者的病史、手术方式以及术后恢复情况,综合评估复发可能性,以便制定更具针对性的管理策略。
未来,随着临床研究的深入和数据的积累,我们期待能进一步明确NSCLC原位癌的复发模式及其影响因素,从而优化随访和管理方案,提高患者的长期生存质量。通过科学合理的随访策略,可以在降低医疗资源浪费的同时,保障患者获得更精准和高效的术后管理。
推荐1:原位癌随访的时间频率为每年1次全身健康查体,随访方案为胸部低剂量螺旋薄层CT替代胸部X线片检查(表2)。
4.2 ⅠA期,R0切除后
根治性手术是ⅠA期NSCLC患者的主要治疗方式。传统上,肺叶切除术被认为是ⅠA期肺癌的标准根治性手术方式。然而,随着近年来多项针对ⅠA期NSCLC的前瞻性临床研究[21-25]结果的公布,根据影像学中肿瘤大小及肿瘤实性成分占比(consolidation tumor ratio,CTR)值的差异,亚肺叶切除(包括楔形切除术和肺段切除术)逐渐成为部分ⅠA期NSCLC患者的可行替代手术方式。这一趋势为患者提供了更多个体化治疗的可能,但目前不同术式对患者预后和生存的具体影响仍存在争议。因此,本共识中暂未对接受不同术式的ⅠA期患者制定差异化的随访方案。
研究[26-27]显示,ⅠA期NSCLC患者在根治性手术后的复发主要集中于术后3年内。初次复发的部位以胸部最为常见,其次是脑、骨骼和肾上腺。这一复发特征提示在术后随访中应加强对这些部位的监测,以便及时发现复发并采取相应治疗。此外,近年来同时多原发NSCLC的检出率逐步提高。文献[28]数据显示,Ⅰ期同时多原发NSCLC的5年总体生存率和无病生存率分别为86.1%和72.2%,与单独原发NSCLC患者的预后并无显著差异。因此,对于Ⅰ期同时多原发NSCLC患者,本共识中亦暂不对其随访方案作特别区分。
对于术后辅助治疗仍存在争议的ⅠA期患者,特别是那些具有高危病理特征的患者,如肿瘤表现出不良生长方式、气腔播散(spread through air spaces,STAS)、脉管侵犯等[29-37],临床医生可根据患者具体的危险因素适当增加随访频率,以更早地发现潜在的复发风险。这种灵活调整随访策略的方式,能够在兼顾资源利用效率的同时,为高危患者提供更精准管理。
在随访策略的实施上,建议采用多模式结合的方法,包括定期的影像学检查(如LDCT扫描)、肿瘤标志物的动态监测以及患者自我报告症状的评估等。全面监控术后病情进展不仅有助于提高复发的早期检出率,还能够为患者争取更多的干预机会,从而进一步延长无病生存期(disease-free survival,DFS)和总体生存期(overall survival, OS)。综上,根治性手术后的随访方案应根据患者个体特征进行灵活调整,以实现更优化的术后管理和生存获益。
推荐2:ⅠA期,R0 切除后患者的随访时间频率为前前3年每6 个月1次,第4 年开始每1年1 次;随访方案为:(1)前3 年每年第一个 6个月方案 A,第二个 6 个月方案 B;(2)第4 年开始,每年方案 B,病情变化及必要时可加做方案C(表2)。
4.3 ⅠB~Ⅲ期EGFR 敏感突变阳性,R0切除术后,口服符合适应证的靶向药
ADAURA研究[38]纳入ⅠB~ⅢA期(UICC/AJCC 第7 版)R0切除术后EGFR 敏感突变阳性NSCLC患者,基于医生判断用/不用辅助化疗,随机分配至奥希替尼组或安慰剂组辅助治疗,结果显示与安慰剂相比,奥希替尼辅助治疗3 年显著延长患者的DFS和OS[38-39]。4 年随访数据[40]显示,无论依据AJCC第7版还是第8 版分期,ⅠB~ⅢA各期都能从奥希替尼辅助治疗中获益,与安慰剂组相比,ⅠB~ⅢA期患者接受奥希替尼辅助治疗3年的中位DFS为65.8 个月(HR=0.27),奥希替尼组 ⅠB期、Ⅱ期和ⅢA期患者的4 年DFS率分别为80%、75% 和66%,而安慰剂组为60%、43%、16%。此外,与安慰剂组相比,奥希替尼可降低局部和远处复发风险,特别是降低中枢神经系统(central nervous system,CNS)复发风险,延长CNS-DFS(HR=0.24),进一步提示了奥希替尼在CNS 复发预防及延缓方面的优势。尽管如此,EGFR 突变患者的胸部和颅脑复发率仍较高,在制定术后复查方案时,需综合考虑不同治疗方式的复发特点,以拟定更全面的随访策略。值得注意的是,一代EGFR-TKI辅助治疗后复发高峰期发生在术后24~36 个月[41],提示患者接受EGFR-TKI辅助治疗至少需要3年。奥希替尼辅助治疗能显著降低复发几率,建议在术后前3年规律用药的基础上,可以适当减少随访频率,完成奥希替尼辅助治疗3年停药后,患者复发风险逐渐增加,因而在第4~5年期间,应增加随访频率以应对复发高峰风险。到第6年后,复发风险逐渐趋于平稳,此时的随访频率可相应调整以优化资源配置。此外,随访期间的不良事件(adverse event,AE)管理对于患者整体生活质量也至关重要。ADAURA研究[38]发现,使用奥希替尼辅助治疗的患者, AE多发生在用药第1年内,最常见AE 为腹泻、甲沟炎、皮肤干燥,因此,建议在用药第1年内着重监测AE 发生,并做好AE管理,AE 相关监测随访频率与肺癌术后复发监测频率不同,临床医生可根据相关药物AE规律进行调整,提升患者用药依从性。
EVIDENCE研究[42]纳入Ⅱ~ⅢA期(UICC/AJCC 第7版)R0 切除术后EGFR敏感突变阳性NSCLC患者,术后口服2 年埃克替尼,中位随访时间为24.9个月,埃克辅助治疗对比标准含铂化疗可以延长患者DFS 至47.0个月(HR=0.36),埃克替尼组最常见的AE为皮疹、丙氨酸氨基转移酶(alanine aminotransferase,ALT)升高和腹泻,脑部[7%(11/151)]是埃克替尼最常见的复发部位,化疗组则是局部复发[14%(18/132)],因此建议临床医生酌情增加埃克替尼术后辅助治疗的随访频率,并着重监测脑转移的复发风险,并且在停药后的两年增加随访频率。
综上所述,EGFR 敏感突变阳性患者术后辅助治疗的复发模式和时间特点提示我们,应根据治疗类型和复发趋势制定个性化的随访计划。通过结合影像学检查、CNS监测以及肿瘤标志物的动态评估,可以提高术后复查的检出率,同时延长患者的DFS 和OS。这种综合随访策略有助于最大限度地降低复发风险,进一步提升患者的术后管理效果。
推荐 3:ⅠB~Ⅲ期EGFR敏感突变阳性, R0 切除后,口服符合适应证的靶向药患者的随访方案为:(1) 服药期间(前2~3年),每 6 个月随访 1 次,每年第一个 6 月方案 A,每年第二个6个月方案B;(2) 停药后第1~2年,每 3 个月随访 1 次,每年前三个3 个月方案A,每年第四个3个月方案B;(3)停药后第3~4 年,每6个月随访1次,每年第一个6 个月方案A,每年第二个6个月方案B;(4)停药后第5年开始,每年随访1 次,每年方案 B。病情变化及必要时可加做方案 C(表2)。
4.4 ⅠB~Ⅲ期ALK融合阳性,R0切除术后,口服符合适应证的靶向药2年
对于可手术切除的NSCLC患者接受手术及辅助化疗,45% 的患者在2年内会发生复发[38]。相关研究[39-40]揭示ALK融合阳性的早期NSCLC侵袭性强,发生转移更早,术后复风险更高。进一步研究[41-42]显示不吸烟ALK阳性患者预后可能更差,以上研究发现均显示ALK融合阳性的患者仍然存在未满足的治疗需求。
ALINA研究是一项国际多中心Ⅲ期随机对照研究[43],研究纳入了共257 例ALK融合阳性的T≥4 cm合并或不合并淋巴结转移、R0 切除后的NSCLC患者,对比组选择标准的辅助化疗模式,试验组口服阿来替尼2年,经过中位27.8个月的随访,231 例Ⅱ~ⅢA期(UICC/AJCC 第7版)患者中, 阿来替尼对比辅助化疗降低了76% 的复发转移或死亡风险(HR=0.24,P<0.001,2 年无疾病复发率分别为93.8% 及63.0%,3年无疾病复发率分别为88.3% 及53.3%)。在总体人群[ⅠB(≥4 cm)~ ⅢA期,UICC/AJCC 第7 版 ]中,阿来替尼组获得同样显著的生存获益(HR=0.24,P<0.001),2 年无疾病复发率分别为93.6% 及63.7%,3年无疾病复发率分别为88.7% 及54.0%;同时,亚组森林图显示,无论患者分期、人种、性别还是吸烟状态,阿来替尼辅助靶向治疗延长DFS的趋势均一致,该研究建立了可手术切除的ALK融合阳性NSCLC的新标准治疗模式,完全手术切除后,口服阿来替尼2年。此外,ALINA研究数据显示阿来替尼辅助治疗的2年期间整体安全性良好,严重不良反应发生率为13.3%,因AE导致停药的比例为5.5%,不良反应多发生于开始治疗的前3个月尤其是第1个月,常见AE为血肌酸磷酸激酶升高、便秘、转氨酶升高等,因此随访期间,尤其是治疗前3个月主动做好AE管理,能提升患者用药依从性,临床医生可根据相关药物AE规律进行AE 监测复查频率调整。综上所述,对于术后服用阿来替尼辅助治疗的患者,在术后2 年内,复发风险显著降低,生存获益明显。因此,建议在这段时间内随访频率可以适当降低。然而,在患者停止阿来替尼治疗后,复发风险可能有所增加,因此停药后应适当提高随访频率,并特别关注脑和肝转移的可能性。通过动态调整随访频率,可以在保障患者生存获益的同时优化随访资源的配置,提高术后管理的效率和效果。
另外,对于第9版 TNM分期ⅠB期(T<4 cm) ALK融合突变患者,若使用了ALINA模式治疗,随访方案建议同Ⅱ~Ⅲ期ALK阳性使用ALINA模式治疗的患者。
推荐4:ⅠB~Ⅲ期ALK融合突变阳性, R0 切除后,口服符合适应证的靶向药2年的随访方案:(1)服药期间(前2 年),每 6 个月随访1 次,每年第一个 6 月方案 A,每年第二个6 个月方案B;(2)停药后第1~2年,每 3 个月随访 1次,每年前三个3个月方案A,每年第四个3 个月方案B;(3)停药后第3~4年,每6 个月随访1次,每年第一个6 个月方案A,每年第二个6个月方案B;(4)停药后第5年开始,每1年随访1次,每年方案 B。病情变化及必要时可加做方案C(表2)。
4.5 ⅠB~Ⅲ期非EGFR敏感突变或ALK融合突变患者,R0切除后,辅助化疗联合或不联合免疫治疗
对于Ⅱ~Ⅲ期非EGFR 敏感突变或ALK融合突变的患者,术后辅助治疗主要采用辅助化疗或辅助化疗联合免疫治疗的策略。这种治疗方式在提高患者预后方面有一定作用,但仍存在一定的局限性。根据IMpwoer 010 和KEYNOTE-091 研究[44-45]的结果,相对于单纯术后辅助化疗,联合术后辅助免疫治疗可一定程度上降低患者术后复发风险,但相较于新辅助免疫治疗模式的获益略欠佳,复发和进展的风险仍然略高,术后复发事件高峰期集中在术后两年内,因此建议在术后随访中特别是前2年采取更为严密的监测方案,以便及时发现潜在问题,优化后续治疗。
进一步分析表明,对于此类患者,术后辅助免疫治疗和化疗联合策略能够在一定程度上延长DFS,但效果并未显著超越靶向治疗在驱动基因阳性患者中的表现。因此,在制定随访方案时,需要考虑患者的整体风险因素和个体特征,以及复发时间发生的高峰期,进而调整复查随访频率。尽管当前共识未根据驱动基因突变情况对Ⅱ~ⅢA期患者的随访方案进行细化区分,但我们建议在实践中密切关注患者治疗后的反应和复发风险,通过综合考虑治疗模式和病情发展动态,进一步完善随访管理策略,以期最大限度地改善患者的长期预后和生活质量。
另外,对于第9 版 TNM 分期ⅠB期非EGFR敏感突变或ALK融合突变患者,术后辅助治疗策略争议较大,预后相关影响因素较复杂,对于未行术后辅助治疗或行辅助化疗±免疫治疗模式的患者,建议随访方案同Ⅱ~Ⅲ期非EGFR敏感突变或ALK融合突变患者辅助化疗±免疫治疗的患者。
推荐5:ⅠB~Ⅲ期非EGFR 敏感突变或ALK融合突变患者,R0 切除后,辅助化疗±免疫治疗的随访方案:(1)前 2 年,每 3 个月随访 1次,每年前 3 个 3 个月方案 A,第 4 个 3 个月方案B;(2)第 3~4 年,每 6 个月随访 1 次,每年第1 个 6 个月方案 A,第 2 个 6 个月方案 B;(3)第5 年开始,每年随访 1 次,每次方案 B。病情变化及必要时可加做方案 C(表2)。
4.6 Ⅱ~Ⅲ期非EGFR敏感突变或ALK融合突变患者,新辅助化疗联合免疫治疗及手术±术后辅助免疫治疗
随着AEGEAN、KEYNOTE-671、NEOTORCH、 CheckMate 77T、RATIONALE-315以及CheckMate 816等研究[46-50]结果的陆续公布,我们对术前和术后辅助治疗的效果有了更深入了解。这些研究的新辅助及术后辅助夹心治疗模式相较于IMpower 010和KEYNOTE-091研究的模式,患者术后复发风险进一步降低,复发事件集中高峰期进一步延长,远期预后有所提升。
因此,相较于单纯术后辅助模式,进行了夹心模式治疗患者的复发高峰期被拉长为3年,进而本共识将此类模式的高频随访期延长为3年。严密的随访可以帮助早期发现复发迹象,为患者争取进一步治疗的机会,同时也为未来优化治疗策略积累临床数据。
推荐6:Ⅱ~Ⅲ期非EGFR敏感突变或ALK融合突变患者,新辅助化疗联合免疫治疗及手术±术后辅助免疫治疗后的随访方案:(1)前3年,每 3 个月随访 1 次,每年前 3 个 3 个月方案A,第 4 个 3 个月方案 B;(2)第 4~5 年,每 6个月随访 1 次,每年第 1 个 6 个月方案 A,第 2 个6 个月方案 B;③ 第 6 年开始,每年随访 1 次,每次方案 B。病情变化及必要时可加做方案C(表2)。
5 总结
本共识主要针对NDCLC患者在根治性手术后无症状的情况下制定随访策略。在执行随访方案的基础上,应特别强调鼓励患者长期戒烟,因为戒烟不仅可以降低肿瘤复发和进展的风险,还能显著改善患者的整体健康状况。此外,应加强随访期间患者AE管理,提升患者用药依从性。患者在随访期间若出现任何身体不适或异常症状,都应及时就医进行评估和处理,以避免因AE 处理不及时导致可能的治疗及病情延误。随访中一旦发现病情进展,应根据患者的具体情况进行进一步的检查和治疗,以制定最适宜的个体化治疗方案。
随访管理的核心目标是通过定期监测和及时干预,尽可能延长患者的DFS和OS。目前的随访策略在一定程度上能够满足这一需求,但仍存在优化空间。特别是对于术后复发模式和长期预后的研究,尚需更多高质量的临床数据支持。未来,我们希望能有更多的大规模、多中心临床研究结果,尤其是基于中国患者的真实世界数据,这对于完善术后随访策略至关重要。
进一步来看,理想的随访策略应结合患者的个体特征,如肿瘤分期、驱动基因突变状态、术后治疗方案以及合并症状等。此外,利用人工智能和大数据分析技术,有望在随访中实现更精准的风险预测和动态监测,进一步提升患者管理的精确性和有效性。最终,优化后的随访策略不仅有助于延长患者生存期,还将提升其生活质量,真正实现研究成果的临床转化,为患者带来实质性的生存获益。
免责声明:本文中公布的临床实践专家共识内容由专家组成员依据现有医学证据及实践经验共同讨论形成,以为相关人员作出术后随访策略提供参考。其中的内容可能不够全面或不够充分。医学知识发展迅速,在本共识产生到发表期间均可能出现新的证据,而这些可能并没有体现在本共识中。专家组对因使用本共识内容而造成的或与之相关的任何人身伤害或财产损失,或任何错误或遗漏不承担任何责任。
利益冲突:无。
特别顾问:赫捷(中国医学科学院肿瘤医院)
特邀专家:张逊(天津市胸科医院)、支修益(首都医科大学宣武医院)、姜格宁(上海市肺科医院)、刘德若(中日友好医院)
执笔:卢笛(南方医科大学南方医院)、麦世杰(南方医科大学南方医院)、冯思阳(南方医科大学南方医院)
问题提出及讨论专家(按姓氏笔画排序):王炜(广州医科大学附属第一医院)、王磊(空军军医大学唐都医院)、刘成武(四川大学华西医院)、李文雅(中国医科大学附属第一医院)、李旸凯(华中科技大学同济医学院附属同济医院)、李鑫(天津市胸科医院)、杨寒(中山大学肿瘤防治中心)、杨豪帅(中日友好医院)、冷雪峰(四川省肿瘤医院)、汪灏(复旦大学附属中山医院)、陈晨(中南大学湘雅二医院)、林济红(福建医科大学附属协和医院)、赵晋波(空军军医大学唐都医院)、赵泽锐(中山大学肿瘤防治中心)、袁勇(四川大学华西医院)、徐金明(浙江大学医学院附属第一医院)、梅建东(四川大学华西医院)、阎石(北京大学肿瘤医院)、滕啸(浙江大学医学院附属第一医院)、戴晨阳(上海市肺科医院)
审稿专家(按姓氏笔画排序):于修义(厦门大学附属第一医院)、于振涛(中国医学科学院肿瘤医院深圳医院)、马金山(新疆维吾尔自治区人民医院)、马海涛(苏州大学附属第一医院)、方文涛(同济大学附属东方医院)、牛立志(广州复大肿瘤医院)、尹荣(江苏省肿瘤医院)、王光锁(深圳市人民医院)、王述民(中国人民解放军北部战区总医院)、王昊飞(南方医科大学南方医院)、王继勇(广州中医药大学第一附属医院)、王铭辉(中山大学孙逸仙纪念医院)、王群(复旦大学附属中山医院)、车国卫(四川大学华西医院)、付向宁(华中科技大学同济医学院附属同济医院)、田辉(山东省千佛山医院)、龙浩(中山大学肿瘤防治中心)、乔贵宾(南方医科大学珠江医院)、刘阳(中国人民解放军总医院)、刘宏旭(辽宁省肿瘤医院)、匡裕康(江西省肿瘤医院)、孙大强(天津市胸科医院)、孙伟(海南医科大学第二附属医院)、牟巨伟(中国医学科学院肿瘤医院)、许顺(中国医科大学附属第一医院)、闫小龙(空军军医大学唐都医院)、闫天生(北京中医药大学东方医院(中西医结合肺结节暨胸部疾病诊疗中心)、许林(江苏省肿瘤医院)、佟倜(吉林大学第二医院)、吴庆琛(重庆医科大学附属第一医院)、吴楠(北京大学肿瘤医院)、张力为(新疆医科大学第一附属医院)、张兰军(中山大学肿瘤防治中心)、张合林(河北医科大学第二医院)、张临友(哈尔滨医科大学附属第二医院)、张建华(南方医科大学深圳医院)、张健(中山大学附属第三医院)、张鹏(天津医科大学总医院)、张毅(首都医科大学宣武医院)、李小飞(西安国际医学中心医院)、李印(中国医学科学院肿瘤医院)、李庆新(中国人民解放军联勤保障部队第940医院)、李向楠(郑州大学第一附属医院)、李志刚(上海市胸科医院)、李单青(北京协和医院)、李树本(广州医科大学附属第一医院)、李强(四川省肿瘤医院)、李辉(首都医科大学附属北京朝阳医院)、杨林(深圳市人民医院)、杨浩贤(中山大学肿瘤防治中心)、闵家新(陆军军医大学新桥医院)、陈汉章(广州医科大学附属第一医院)、陈龙奇(四川大学华西医院)、陈克终(北京大学人民医院)、陈克能(北京大学肿瘤医院)、陈和忠(上海长海医院(海军军医大学第一附属医院))、陈亮(江苏省人民医院)、陈保富(台州市中心医院)、陈海泉(复旦大学附属肿瘤医院)、陈铭伍(广西医科大学第一附属医院)、陈锋夏(海南省人民医院)、陈椿(福建医科大学附属协和医院)、沈韦羽(宁波市李惠利医院)、周明(广州医科大学附属肿瘤医院)、姜杰(厦门大学附属第一医院)、林慧庆(武汉大学人民医院)、茅乃权(广西医科大学肿瘤医院)、贲晓松(广东省人民医院)、赵松(郑州大学第一附属医院)、赵珩(上海市胸科医院)、赵健(广州医科大学附属肿瘤医院)、赵德平(上海市肺科医院)、钟文昭(广东省人民医院)、高文(复旦大学附属华东医院)、耿庆(武汉大学人民医院)、徐全(江西省人民医院)、徐步远(浙江省平阳县人民医院)、顾春东(大连医科大学附属第一医院)、梁朝阳(中日友好医院)、崔键(哈尔滨医科大学附属第四医院)、喻本桐(南昌大学第一附属医院)、曹庆东(中山大学附属第五医院)、程超(中山大学附属第一医院)、郭占林(内蒙古医科大学附属医院)、傅剑华(中山大学肿瘤防治中心)、韩开宝(厦门市弘爱医院)、韩育宁(宁夏医科大学总医院)、谢德耀(温州医科大学附属第一医院)、黄云超(云南省肿瘤医院)、黄志勇(南方医科大学南方医院)、蒋仲敏(山东省千佛山医院)、谭群友(陆军军医大学大坪医院)、谭黎杰(复旦大学附属中山医院)、廖永德(华中科技大学同济医学院附属协和医院)、蔡松旺(暨南大学附属第一医院)、蔡瑞君(南方医科大学南方医院)、薛涛(东南大学附属中大医院)、魏立(河南省人民医院)


