《欧洲寡转移食管胃癌临床实践指南》解读
时间:2025-09-14 12:12:20 热度:37.1℃ 作者:网络
摘 要
近年来随着微创外科技术及围术期综合治疗的临床应用,局部晚期食管癌的生存率显著提高。而转移性食管癌治疗仍以系统性治疗为主,免疫治疗联合化疗已成为一线治疗方案,延长了转移性食管癌患者的生存期。寡转移性食管癌则有望通过系统治疗联合局部治疗带来生存获益。《欧洲寡转移食管胃癌临床实践指南》2024年正式发布,对寡转移性食管胃癌的定义、诊断和治疗进行了规范,以便于进一步开展前瞻性研究。笔者对这一指南进行解读,尤其对食管鳞状细胞癌寡转移的临床证据进行梳理,为国内寡转移性食管癌的诊疗提供参考。
正 文
2022年全球食管癌(esophageal cancer, EC)发病约511 054例,死亡445 391例,中国EC发病224 012例,死亡187 467例[1]。西方国家多以食管或交接部腺癌为主,而包括中国在内的东亚国家则以鳞状细胞癌(鳞癌)为主。EC一旦确诊,总体5年生存率约10% ~30%,预后较差[1]。约20%~30% 的EC确诊时就出现了远处转移,系统治疗包括化疗、靶向治疗及免疫治疗成为晚期不可手术的EC的标准治疗方案[2]。多中心研究[3, 4]果显示,转移性食管胃癌患者中寡转移发生率为24%,食管胃癌术后寡转移的发生率39%。随着系统治疗方案不断更新,患者生存期延长。这为晚期EC患者提供了局部治疗的可能性,同时,中国作为食管癌大国,寡转移性食管癌也将成为现阶段或未来亟待解决的临床问题之一,逐渐受到关注。
寡转移性疾病的概念是1995 年由Hellman和Weichselbaum提出,用来描述局限性和多发转移性疾病之间的生物学状态,即少量的远处转移[5]。寡转移概念的提出进一步使得局部治疗,包括转移瘤切除术或立体定向放射治疗(stereotactic body radiation therapy,SBRT)成为可能,延长患者的疾病进展时间和总体生存期[5-6]。越来越多的研究对寡转移性疾病开展了系统联合局部治疗的方案,但由于患者特征、分期方法和寡转移性疾病定义的差异,直接比较或引用已发表和正在进行的相关临床研究结果存在困难。基于此,欧洲寡转移性食管胃癌(oligometastatic esophagogastric cancer,OMEC)项目基于文献和专家共识为寡转移性食管胃癌的定义、诊断和治疗提供了临床实践指南[7]。鉴于东西方EC的病理类型、复发转移模式、治疗方案等存在一定差异,因此,本文对这一指南进行解读,重点对食管鳞癌寡转移的临床证据进行梳理,为国内寡转移性食管鳞癌的诊疗提供参考。
1 欧洲寡转移性食管胃癌项目简介
OMEC 由5 个子项目组成,目前已经完成4 个[8]。首先,对现有文献中关于寡转移性食管胃癌的定义进行了系统回顾,并对寡转移性肿瘤局部治疗后的生存结果进行了荟萃分析(OMEC-1)[9]。其次,来自欧洲的多学科专家团队对真实世界中的临床病例进行讨论,重点是寡转移性食管胃癌的定义和治疗(OMEC-2)[10]。第三,在相同的中心和专家之间进行了Delphi共识研究,包括首次会议、两轮Delphi问卷调查和最终共识会议(OMEC-3)[11]。第四,根据临床实践指南的AGREEⅡ和GRADE 原则制定转移性食管胃癌临床实践指南[7],并约定5年内使用相同的方法进行更新(OMEC-4)。OMEC对寡转移性疾病的定义基于两个目的:首先,确定哪些患者可以认定为寡转移性疾病,有望通过局部治疗获益;其次,确定哪些患者可能被认定为寡转移性疾病,并采用适度的局部治疗。该指南只纳入了新发寡转移性疾病的患者,腹膜或胸膜转移或脑转移被排除在外,这些疾病可能需要特定的治疗方案。
2 寡转移性食管胃癌的定义
指南[7]指出:寡转移性疾病是指食管胃癌患者,单个器官≤3 个转移或1站区域外淋巴结转移。此外,基线患者有寡转移的患者在全身治疗后转移数量没有进展(即疾病稳定、部分反应、完全反应或仅在大小上进展),仍可视为寡转移疾病。同时有器官和区域外淋巴结转移的患者,或在基线时诊断寡转移疾病在全身治疗后转移数量出现进展,则认为不是寡转移。器官特异性定义包括≤ 3个单叶肝转移、≤3 个单侧肺转移、单侧肾上腺受累或1个骨或软组织转移。
关于受累器官寡转移的定义,OMEC-1[9]共纳入28 个临床研究或研究方案,包括1 439 例患者, EC占82%,鳞癌占53%;26 个研究将单个器官转移定义为寡转移(100%一致性),17个研究将≤ 3个器官转移定义为寡转移(100% 一致性);关于区域外淋巴结转移,共纳入13 个临床研究或研究方案,包括217例患者,胃癌占59%,腺癌占70%, 12 篇将单个区域外淋巴结转移定义为寡转移(100%一致性);其它器官特异性寡转移的数据见表1。

经过对指南的产生过程和文献来源的分析,我们可以看出食管鳞癌占比并不高,因此该指南在很大程度上反映了欧洲专家的观点,相较于亚洲患者(食管鳞癌)更适用于西方患者(食管癌或胃腺癌),故而将这一寡转移性疾病的定义推广至食管鳞癌可能是不恰当的。
淋巴结转移是食管鳞癌最常见的转移部位[12],AJCC/UICC[13]及日本JES[14]均对食管鳞癌的区域淋巴结进行了规定,区域淋巴结以外的淋巴结定义为M1。12版JES放弃了原来根据肿瘤位置进行分期的方法,采用了和AJCC一致的根据区域淋巴结数目进行分期的方法,并将锁上淋巴结归为非区域淋巴结(M1a)[14]。对于食管鳞癌来讲,区域淋巴结包括颈部的气管食管沟淋巴结,胸腔的食管旁、左右喉返神经旁、隆突下、双侧肺门及膈上淋巴结,腹腔的贲门旁、胃小弯、胃左动脉旁、肝动脉旁、脾动脉旁及腹腔干淋巴结。这些区域以外的淋巴结为非区域淋巴结。ESO-Shanghai13[15]研究中将寡转移食管鳞癌定义为原发病变可控并≤4个转移灶。一项来自日本的研究纳入126例食管鳞癌根治术后复发患者,其中58例患者诊断为寡转移(单器官<5个转移灶或一个区域<5个淋巴结),寡转移患者的生存显著优于非寡转移患者[12]。食管鳞癌肺转移较肝转移多见,可通过局部切除获得较好的长期生存[16-18]。因此,寡转移的定义是以患者获益为终极目标,如何筛选获益人群并采用相应的局部治疗应该是寡转移性食管鳞癌定义的内涵。
3 寡转移性食管胃癌的诊断
指南[7]18 推荐F-脱氧葡萄糖(18F-FDG)正电子发射断层扫描(PET)与集成计算机断层扫描(CT)用于寡转移性食管胃癌的基线评估,并在系统治疗后进行再分期。对于(疑似)寡转移性疾病和1 8 F - F D G P ET 阳性的患者,建议在基线时进行18F-FDG PET/CT 成像,以排除多发转移性疾病[11]。对于18F-FDG PET 阳性的肿瘤患者,建议在全身治疗后重新进行18F-FDG PET/CT 成像,以评估对寡转移性疾病进行局部治疗[11]。
4 寡转移性食管胃癌的治疗
指南[7]指出,对于患有同时性寡转移或异时性寡转移疾病且无病间隔≤2 年的患者,建议首先接受全身系统治疗。在系统治疗后转移数量没有进展的情况下(即疾病稳定、部分反应、完全反应或仅存在病变大小的进展),考虑对寡转移性疾病(以及同时性寡转移性患者的原发性肿瘤)进行局部治疗。多学科治疗团队决定寡转移性疾病的局部治疗类型(如转移瘤切除术、射频、射频消融或SBRT)。对于异时性寡转移且无病间隔>2年的患者可以接受寡转移的局部治疗或全身治疗后重新评估。对于患有寡转移性疾病的患者,应该考虑至少3个月的全身治疗后再考虑对寡转移性疾病进行局部治疗。此外,在对寡转移性疾病进行全身治疗和局部治疗后,可以考虑免疫检查点抑制剂巩固治疗。
需要指出的是,这些建议没有根据原发性肿瘤的组织学类型进行细分(例如腺癌或鳞癌、抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性、微卫星不稳定性或综合阳性分数(CPS)。目前化疗联合免疫治疗已经成为晚期食管癌的一线治疗方案,同样适用于寡转移性食管胃癌患者[2];在系统治疗及寡转移病灶无进展的情况下可以开展针对寡转移的局部治疗,包括转移灶切除术,射频或放疗[3]。
最近的一项Meta分析[19]纳入1 项前瞻性和10 项回顾性研究,共计14 489例进展期食管或食管胃结合部癌患者,结果显示局部治疗联合系统治疗可显著延长患者无进展生存时间[HR=0.52, 95%CI(0.37, 0.73);P<0.001]和总生存期[HR=0.69,95%CI(0.58,0.81);P<0.000 1]。亚组分析结果显示寡转移性疾病或复发患者开展联合治疗的生存获益更显著,提示患者精准选择对于治疗决策的重要性,临床中针对进展期食管癌患者筛选肿瘤负荷较小的寡转移性疾病开展联合治疗的临床意义可能最大。
5 寡转移性食管鳞癌治疗现状
一项针对寡转移食管鳞癌的多中心前瞻性 Ⅱ期随机对照研究(ESO-Shanghai 13)纳入我国6家医院104 例患者,随机分配至全身治疗组(51例)或全身+局部治疗组(53例),全身治疗包括化疗、免疫治疗或化学免疫联合治疗,局部治疗包括放疗、手术或热消融;结果显示与单独的全身治疗相比,食管鳞癌在全身+局部治疗后的无进展生存(15.3个月vs. 6.4个月,P<0.001)和总生存期(未达到 vs. 18.6 个月)显著延长[15]。两项来自中国的针对食管鳞癌患者的研究[20, 21]调查了SBRT对寡转移性疾病的治疗价值,结果显示接受SBRT的食管鳞癌患者的中位总生存期分别为24.6个月[20]和12.8个月[21]。
既往回顾性研究中系统治疗方案主要采用化学治疗,免疫治疗的应用能够进一步改善生存,值得进一步探索。ESO-Shanghai 13 研究[15]中接近40%的患者采用程序性细胞死亡蛋白-1(programmed cell death protein-1,PD-1)抗体为基础的系统治疗方案,有趣的是接受免疫治疗的患者局部治疗仅改善无进展生存,而对总生存并无显著差别。另外一项针对一线治疗失败的寡转移性食管鳞癌的前瞻性单臂研究[21]结果显示,二线采用了低剂量放疗联合化学免疫治疗的策略进一步提高了患者生存率。免疫治疗制剂的不断更新,新的靶向联合免疫治疗的研究也在进行中,未来针对寡转移性疾病,在免疫治疗作为系统治疗的基础上,局部治疗的介入能否给患者带来获益尚不明确。
目前多数研究主要聚焦于异时性寡转移,而针对同时性寡转移的治疗策略,更需要考虑 :原发性肿瘤的治疗、局部寡转移的治疗、全身治疗、危害或风险[7]。REGATTA Ⅲ期临床试验包括伴有同时寡转移的胃癌患者,结果发现与单独的全身治疗相比,原发性肿瘤切除加全身治疗并不能提高总生存[22]。在这项研究中同时性寡转移患者进行了胃切除术加D1 淋巴结清扫术,淋巴结清扫并不充分,也未针对寡转移进行局部治疗,提示我们在寡转移性疾病的背景下,原发性肿瘤和寡转移病灶可能均需要给予适当的局部治疗。而AIO-FLOT3Ⅱ期研究选择寡转移性胃癌患者接受了≥4个周期的FLOT化疗后,进行了D2淋巴结切除和所有转移灶切除后,显示出良好的生存获益[23]。
如前所述,包括中国在内的EC多以鳞癌为主,和腺癌相比,其生物学行为,包括寡转移的特征、对免疫治疗的反应等均存在显著差异。针对寡转移的系统治疗,遵循晚期食管癌的治疗指南,包括化疗、免疫治疗及靶向治疗等。目前针对晚期食管鳞癌,化疗联合PD-1 抑制剂的化疗与免疫治疗联合方案已经成为一线治疗方案。淋巴结转移是食管鳞癌最常见的转移部位,其次是肺转移和肝转移。针对不同的转移病灶开展以系统治疗为主的综合治疗,在取得降期后采取局部治疗进而改善患者生存。采用何种局部治疗方案,比如放疗、手术切除、射频消融等,仍有待进一步探索。
欧洲指南中也没有具体说明原发性肿瘤的治疗,但建议遵循最新局部晚期食管癌治疗指南。局部晚期食管鳞癌的治疗包括新辅助放化疗/化疗辅助食管切除术+淋巴结清扫术。一项回顾性研究纳入2010—2020年伴随淋巴结转移的食管鳞癌患者,包括69 例区域外淋巴结转移(dLN+)和111 例区域淋巴结转移(dLN−),在进行放化疗或化疗后给予食管切除及淋巴结清扫术,研究结果提示dLN+患者5 年生存(25.5% vs. 51.9%,P < 0.001)和无进展生存(18.1% vs. 47.2%,P < 0.001)均差于dLN−患者;进一步分析发现不同亚组生存结果如下:dLN− pCR(病理完全缓解)(组生存最优,dLN− non-pCR和dLN+ pCR组生存相当,dLN+ non-pCR 生存最差[24]。
另外一项来自日本的研究[25]评估了80例非区域淋巴结寡转移性食管鳞癌的数据(No.104、 112aoP、106pre及16a2),所有患者接受新辅助化疗后施行根治性手术切除,生存分析发现是否存在非区域淋巴结转移并不是影响患者生存的独立因素。因此针对寡转移性食管鳞癌患者,在接受以放化疗或化疗为主的新辅助/转化治疗的基础上,开展原发灶和转移灶在内的手术切除可改善部分患者的长期生存。此外,临床工作中针对寡转移性患者,临床医生和患者充分讨论治疗的潜在危害和益处并做出一致性决定非常重要[7]。
另外一项研究[26]回顾了4 例同时性寡转移性食管胃癌患者的数据,所有患者在系统治疗后均进行了针对原发灶和转移灶的根治性放疗,并最终获得长期生存(7~13年)。该研究为原发肿瘤及转移灶采用放疗为主的治疗策略提供了一定的参考。此外,针对肝转移[27]或肺转移[28]进行的质子放疗也给患者提供了新的治疗选择。
6 小结与展望
该指南对寡转移性食管胃癌的定义、诊断和治疗进行了规范,核心要点如下:对于单个器官≤ 3个转移或1 站区域外淋巴结转移,以及在基线时患有寡转移性疾病且在全身治疗后再评估转移数量没有进展的患者,可以考虑为寡转移性疾病;针对寡转移疾病应该首先进行系统治疗,然后重新进行分期,考虑对寡转移性疾病进行局部治疗。
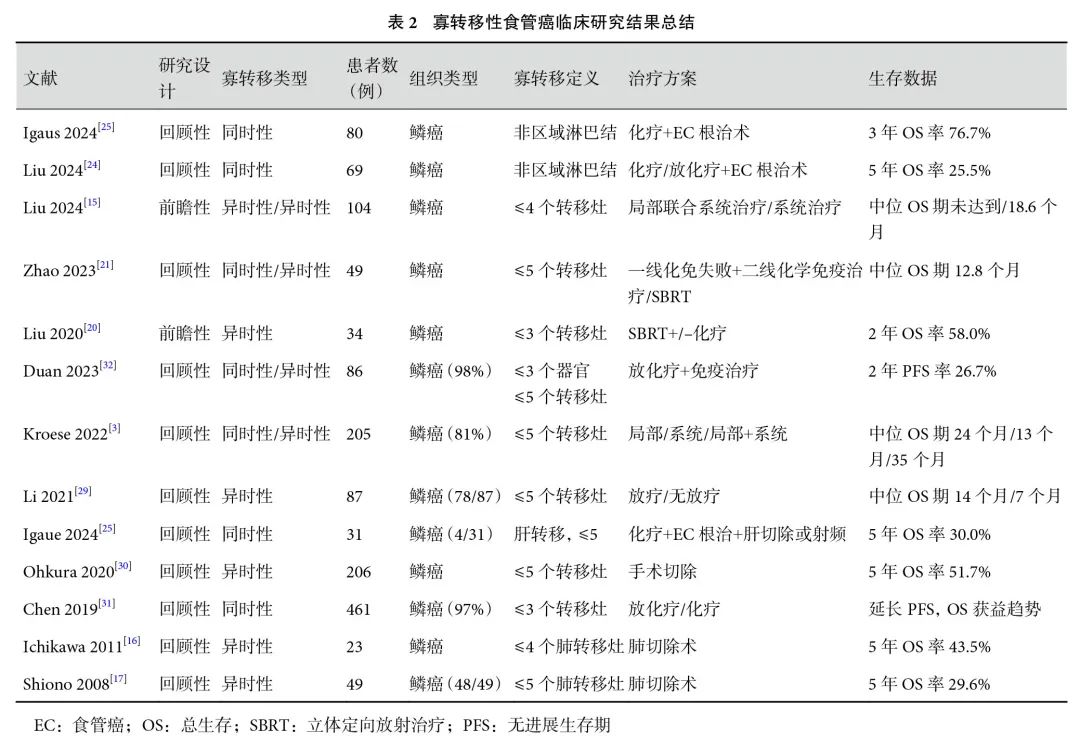
该指南是否适用于食管鳞癌并指导食管鳞癌的治疗,值得商榷和探讨,目前关于寡转移性食管鳞癌的研究见表2,仅2项前瞻性研究,多数为回顾性研究,证据并不充分[16, 18, 29-31]。ESO-Shanghai13研究作为唯一的前瞻性多中心Ⅱ期研究,证据级别并不高。这些研究中部分患者通过系统治疗联合局部治疗获得了长期生存获益,再次强调了患者选择的重要性,以及根据转移的类型和位置对患者进行分层治疗的必要性。因此未来应进一步探索寡转移性食管鳞癌的生物学特性,识别生物标志物或临床特征,以预测哪些患者将从局部治疗中获益最多。寡转移性食管鳞癌患者的筛选应以患者获益为目标,筛选适合的患者开展局部治疗进而延长生存是寡转移性食管鳞癌的核心。以PD-1抑制剂为代表的免疫治疗在晚期[2, 32]及局部晚期食管癌[33]中取得了优异的表现,以免疫治疗为主的新的治疗方案能否改变寡转移性食管胃癌的治疗模式,针对寡转移性疾病的局部治疗的介入能否进一步改善患者的生存有待进一步研究。针对不同的寡转移部分采用何种局部治疗策略依然缺乏高级别证据,放疗、射频及转移灶切除如何选择依然考验临床医师的智慧,局部治疗给患者带来的风险和获益可能是临床决策制定的重要参考。此外,严密检测随访策略和新的检测和筛查技术,如ctDNA等在检测寡转移疾病进展和治疗反应方面有广阔的前景,有助于早期发现寡转移性疾病,并积极开展干预治疗。
利益冲突:无。
作者贡献:段晓峰负责翻译、文献查阅,论文撰写及总体设计;王尚任负责翻译及文献查阅;岳杰、姜宏景负责文章修改及审阅。


