2024 年WCLC/ESMO 肺癌围手术期免疫治疗进展解读
时间:2025-09-16 12:26:55 热度:37.1℃ 作者:网络
摘 要
2024年世界肺癌大会(World Conference on Lung Cancer,WCLC)和欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)年会这两场肿瘤学盛会相继落下帷幕。作为肺癌及整个肿瘤领域最具权威性的年度盛会,WCLC和EMSO大会汇聚了全球顶尖的肿瘤学专家和科学家,共同分享、探讨和发表肿瘤领域的最新前沿进展。两次大会中,肺癌免疫治疗仍然是备受关注的热点话题。本文拟对两场大会报道的非小细胞肺癌围手术期免疫治疗重要研究进展进行总结和讨论。
正 文
2024年9月,2024年世界肺癌大会(World Conference on Lung Cancer,WCLC)和欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)年会已分别于美国圣地亚哥和西班牙巴塞罗那盛大召开。两场大会对肿瘤领域众多前沿研究进行公布和更新,肺癌免疫治疗的新进展再次成为焦点,多个临床研究数据振奋人心,精准治疗策略从晚期肺癌延伸至早期。本文主要聚焦非小细胞肺癌(non-small cell lung cancer,NSCLC)围手术期免疫治疗的多个重磅研究的进展更新,以更好地理解免疫治疗在NSCLC围手术期中的应用及未来发展方向。
1 辅助免疫治疗仍存争议
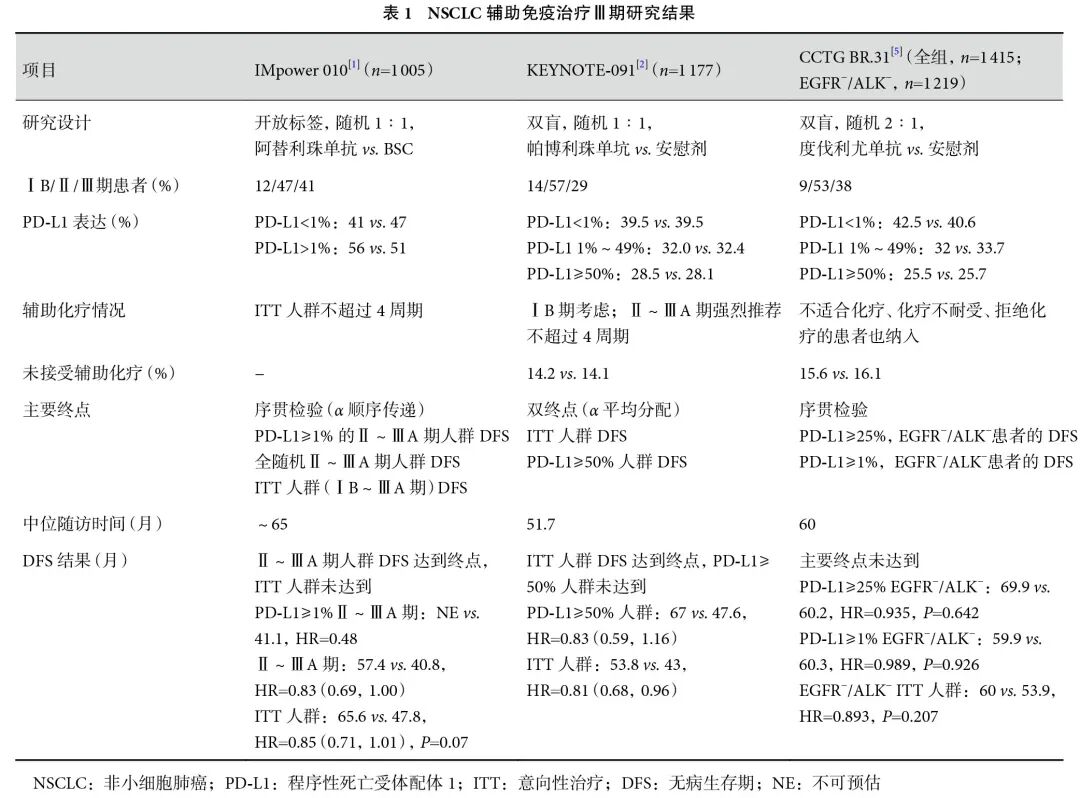
根治性手术切除是早期NSCLC的首选治疗,如何降低患者术后复发率和死亡率,进一步延长患者生存一直是临床探索的重点话题,辅助免疫治疗应运而生。目前辅助免疫治疗已成为早期肺癌根治性切除术后的标准治疗,基于IMpower010研究[1]和KEYNOTE-091研究[2],国家药品监督管理局已批准阿替利珠单抗用于经根治性手术切除、含铂双药化疗后的程序性死亡受体配体1(programmed death-ligand 1,PD-L1)肿瘤细胞(tumor cell,TC)≥1% Ⅱ~ⅢA期NSCLC患者的辅助治疗;帕博利珠单抗也被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于经根治性切除和含铂化疗后ⅠB期(≥4 cm)~ⅢA期NSCLC的辅助治疗。
今年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会首次公布IMpower010研究[3]5年随访结果,结果显示在PD-L1 TC≥1%的Ⅱ~ⅢA期NSCLC患者中,与最佳支持治疗(best supportive care,BSC)相比,阿替利珠单抗延长了无病生存期(disease-free survival,DFS)31.2个月[68.5个月 vs. 37.3个月,HR=0.70(0.55,0.91)],提升了5年DFS率(53.2% vs. 42.7%)。本次是DFS的最终分析,意向性治疗(intention-to-treat,ITT)人群(ⅠB~ⅢA期)的DFS未达到终点,根据统计学序贯检验的设计原则,ITT人群总生存(overall survival,OS)不能进行统计学检验,仅对结果进行描述性呈现,两组5年OS率差异无统计学意义(70.9% vs. 69.8%)。2024年WCLC更新了PD-L1 TC≥1%的Ⅱ~ⅢA期患者5年亚组分析和复发模式[4]。结果显示,无论疾病分期(Ⅱ/ⅢA期)或pN状态(N1/N2)如何,阿替利珠单抗组的DFS和OS都较BSC组患者有获益趋势。阿替利珠单抗组的总复发率低于BSC组(36.7% vs. 50.4%),在PD-L1 TC≥50%人群中降低得更明显(27.8% vs. 47.4%)。此外,阿替利珠单抗明显降低了影响术后患者长期生存的远处转移及脑转移率。然而,令人遗憾的是今年ESMO报道的度伐利尤单抗辅助治疗NSCLC的全球随机Ⅲ期研究CCTG BR.31[5]未达到主要终点。该研究是目前已公布的辅助免疫研究中规模最大的研究,入组1415例患者(EGFR−/ALK−患者1219例),按2∶1比例随机分配接受度伐利尤单抗或安慰剂治疗,主要终点为PD-L1 TC≥25%的EGFR−/ALK−患者的DFS。中位随访60个月,度伐利尤单抗组的中位DFS为69.9个月,安慰剂组为60.2个月,差异无统计学意义。此外,在PD-L1≥1%的患者及全人群中也未观察到差异。结合已经公布的IMpower010和KEYNOTE-091研究,3个研究入组的患者特征并无显著差异,为何呈现出不同结果尚不清楚(表1)。CCTG BR.31研究的阴性结果挑战了当前对早期肺癌辅助免疫治疗应用的理解,提示辅助免疫疗法尚需进一步探索,需寻找可靠的预测标志物,筛选出能获益的患者。ANVIL[6]、ALCHEMIST-Chemo-IO、LungMate-008、NADIM-ADJUVANT[7]等多项辅助免疫治疗的Ⅲ期研究正在进行,期待这些研究的结果能为辅助免疫治疗的困惑带来些许答案。
既往肿瘤界对早期肺癌患者首选新辅助治疗还是辅助免疫治疗一直有争议。度伐利尤单抗围手术期治疗NSCLC患者的Ⅲ期研究AEGEAN[8]达到主次要终点,而辅助治疗的CCTG BR.31研究却失败了,结合新辅助、辅助免疫治疗的理论机制[9-10]、SWOG S1801研究[11]头对头比较帕博利珠单抗围手术期治疗黑色素瘤的DFS显著优于辅助治疗的结果,以及新辅助免疫治疗NSCLC的5个Ⅲ期研究均取得成功的证据,提示免疫治疗提前至手术前能带来更好的疗效。
2 新辅助免疫治疗的长期生存
WCLC公布了NADIM研究的5年临床结局。NADIM研究是首个探索免疫治疗联合化疗新辅助治疗ⅢA期(AJCC第7版)NSCLC的Ⅱ期研究,5年前因其前所未有的60%以上的病理完全缓解率(pathological complete response,pCR)而轰动整个学术界[12]。5年结果显示,ITT人群5年无进展生存率为65.0%,5年OS率为69.3%,排除5例非肺癌死亡患者(3例因新型冠状病毒感染、1例因肺炎、1例因胰腺癌死亡),5年肺癌特异性OS率达到82.2%[13],提示新辅助纳武利尤单抗+化疗的高病理缓解率转化为生存获益。既往新辅助化疗治疗ⅢA期患者的5年OS率仅为36%[14]。ESMO公布的NEOSTAR 和CheckMate 159研究合并分析的5年结果显示,纳武利尤单抗单药(单免,n=60)新辅助治疗Ⅰ~ⅢA期NSCLC的5年无事件生存(event-free survival,EFS)率和OS率分别为57.7%和70%,纳武利尤单抗联合1周期的伊匹木单抗(双免,n=30)新辅助治疗Ⅰ~ⅢA期NSCLC的5年EFS率和OS率分别为50.3%和66.9%。无论单免还是双免,5年长期生存率都远高于既往新辅助化疗,进一步巩固与彰显新辅助免疫治疗的长期价值。虽然双免整体的生存期不优于单免,但是对于PD-L1<1%及KRAS伴STK11、KEAP共突变和/或SMARCA4突变患者,纳武利尤单抗单药的EFS率明显降低(PD-L1≥1% vs. PD-L1<1%,HR=0.27;突变阳性vs. 突变阴性,HR=3.57),而双免则没有观察到该相关性(PD-L1≥1% vs. PD-L1<1%,HR=1.02;突变阳性vs. 突变阴性,HR=0.77),提示双免可用于对单免原发性耐药的部分患者。由于是不同研究的合并分析且样本量小,证据级别有限,需要在前瞻性大样本研究中进一步验证。
3 “夹心”模式的进展
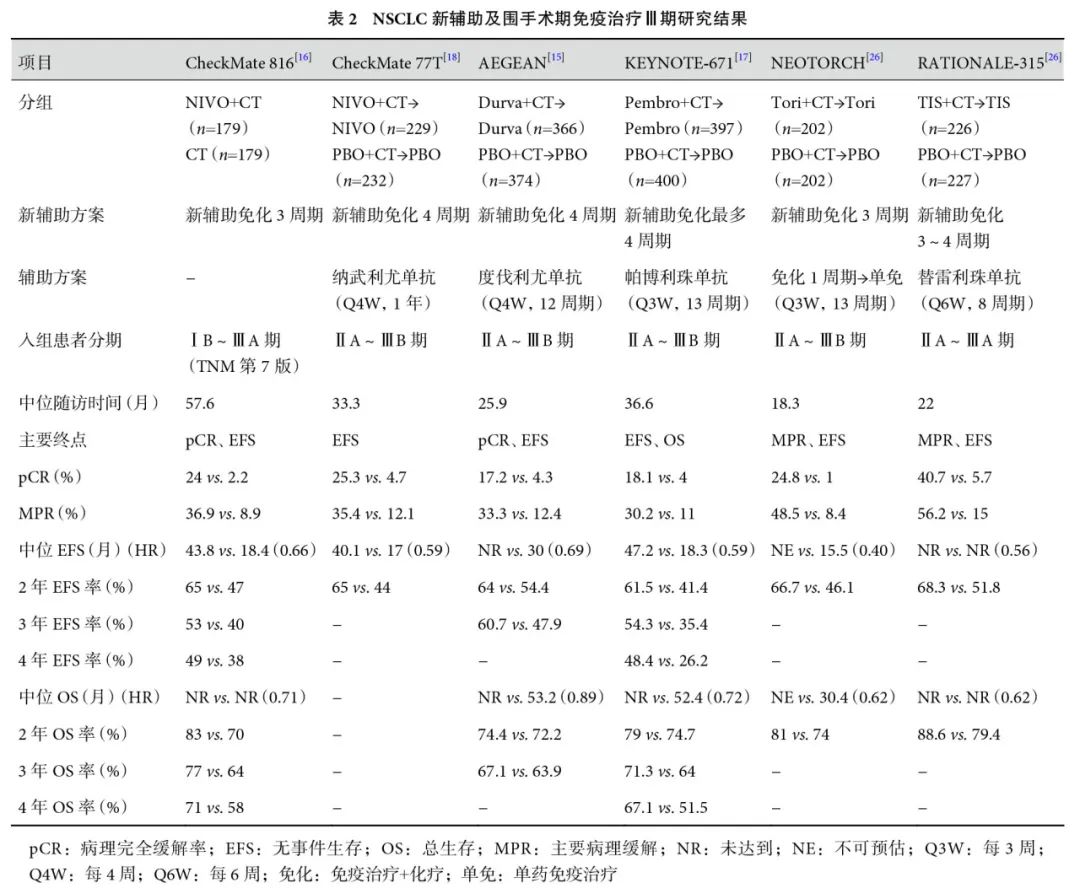
WCLC报道了AEGEAN研究[15]的第2次EFS中期分析及DFS、OS结果,截至2024年5月10日,中位随访25.9个月,所有患者都已结束了试验方案的治疗,度伐利尤单抗+化疗和安慰剂+化疗组分别有49.4%和40.1%的患者完成了1年的辅助治疗。第2次EFS中期分析结果显示,试验组依然保持获益,3年DFS率提高12.2%(60.1% vs. 47.9%),同时观察到DFS也有改善[未达到(NR) vs. NR,HR=0.66(0.47,0.92)];中位OS差异无统计学意义,但有获益趋势[NR vs. 53.2个月,HR=0.89,95%CI(0.70,1.14)]。相比已公布OS结果的其他全球Ⅲ期研究,CheckMate 816[16]和KEYNOTE-671[17]研究的HR分别为0.71和0.72;AEGEAN研究的OS结果优势不明显,两组3年OS率差异无统计学意义(67.1% vs. 63.9%),再次提示同样都是程序性死亡受体1(programmed death-1,PD-1)/PD-L1抑制剂,作用机制相似,但是药物之间有明显差异。
CheckMate 77T研究[18]已于2023年首次公布EFS结果:纳武利尤单抗+化疗围手术期治疗NSCLC的EFS显著优于化疗[HR=0.58,95%CI(0.42,0.81),P=0.00025],pCR和主要病理缓解(major pathological response,MPR)也得到改善,分别为25.3% vs. 4.7%和35.4% vs. 12.1%。今年ESMO更新了CheckMate 77T研究[19]的EFS结果,中位随访33.3个月,试验组依然保持显著获益[40.1个月vs. 17个月,HR=0.59,95%CI(0.45,0.79)],2年EFS率提高21%。无论pCR状态如何,根治性手术后EFS的Landmark分析均显示纳武利尤单抗组更优。基于CheckMate 77T研究的优异结果,2024年10月3日,FDA批准纳武利尤单抗联合含铂化疗行新辅助治疗,术后辅助纳武利尤单抗治疗肿瘤直径≥4 cm或淋巴结阳性、EGFR−/ALK−的可切除NSCLC[20]。CheckMate 77T的研究结果重现了CheckMate 816研究纳武利尤单抗联合化疗单纯新辅助治疗的结果,无论是病理缓解率还是生存期,两个研究结果都很相近。一方面说明纳武利尤单抗新辅助治疗NSCLC结果的稳健性,两个大型Ⅲ期研究相互印证;另一方面,从整体人群来说,新辅助免疫治疗可能已经足够,术后继续辅助免疫治疗1年未带来更多获益,而辅助治疗还会带来毒副反应,增加经济负担。
CheckMate 77T研究的ctDNA探索性分析[19]显示,在可评估ctDNA的患者中(试验组76例,对照组64例),新辅助治疗结束时试验组ctDNA清除率高于对照组(66% vs. 38%);无论试验组还是对照组,ctDNA清除的患者pCR率(试验组50% vs. 对照组12%)高于未清除患者(试验组0% vs. 对照组2%),ctDNA的清除预示更好的生存结局,这与CheckMate 816研究结果一致;术后治疗期间,试验组的ctDNA复发更少(8% vs. 20%),提示辅助纳武利尤单抗有潜在获益。ESMO也报道了ctDNA清除与病理缓解和生存期相关性的探索性分析[21]。结果显示,基线时ctDNA阳性患者(89.6%)中,在新辅助治疗至第4周期第1天(C4D1)时,所有pCR患者和>93%的MPR患者均显示ctDNA清除,ctDNA未清除患者达到pCR的概率均较低,试验组和对照组在C4D1时的阳性预测值分别为40% vs. 12%;ctDNA清除与EFS和OS改善相关,试验组中更明显;未实现 ctDNA 清除且未达到 pCR 患者的 EFS 结局最差,而ctDNA清除患者无论是否达到pCR,其EFS均长于未实现ctDNA清除且未达到pCR的患者;在完成手术的患者中,与ctDNA阴性患者相比,辅助治疗至C1D1时,检测到ctDNA的患者DFS最差。LCMC3研究[22]也印证了这一结果,与术后ctDNA未清除患者相比,术后ctDNA清除患者的DFS(HR=0.25)和OS(HR=0.26)均显著升高;达到MPR(无论有无实现ctDNA清除)的患者EFS和OS最长,3年EFS和OS率均为100%,其次为未达到MPR但ctDNA清除的患者,未达到MPR且ctDNA未清除的患者生存最差。以上这些结果都展示了ctDNA在围手术期免疫治疗潜在的疗效预测及作为替代终点的价值,但是目前公布的数据都是探索性分析,需要在前瞻性研究中进一步验证。
WCLC公布了KEYNOTE-671研究[23]病理退缩与EFS相关性的事后分析。帕博利珠单抗+化疗组和安慰剂+化疗组分别有80.6%(320/397)和75.0%(300/400)患者进行了病理评估。结果显示,新辅助免疫治疗+化疗与更显著的病理缓解相关,试验组的中位残留存活肿瘤百分比(%RVT)为29.5%,对照组为52.0%。其中,试验组%RVT为0%~5%、5%~30%、30%~60%以及>60%的患者分别占31.9%、19.1%、31.6%和17.5%,对照组分别占12.3%、14.7%、38.0%和35.0%。无论是试验组还是对照组,%RVT与EFS呈负相关,%RVT越低,EFS越长。%RVT<60%的各亚组中,试验组的EFS均较对照组改善,%RVT在0%~5%、5%~30%、30%~60%的患者中位EFS分别为NR vs. NR(HR=0.58)、NR vs. 39.1个月(HR=0.73)、39.2 个月vs. 32.1个月(HR=0.65),而在%RVT>60%的患者中,两组的EFS无显著差异,中位EFS分别为15.0个月vs. 18.5个月[HR=0.90,95%CI(0.60,1.36)]。该结果与CheckMate 816研究结果一致。CheckMate 816研究中由于只有纳武利尤单抗联合化疗组的%RVT与2年EFS率相关,对照组没有观察到此现象,因此只分析了试验组。试验组中%RVT为0%~5%、>5%~30%、>30%~80%以及>80%的患者分别占45%、17%、18%和21%,相应的EFS分别为NR、NR、26.6个月和18.9个月[24]。这些结果提示%RVT>60%或80%的患者,新辅助免疫治疗的获益不佳。后续探索应进一步明确预测疗效的%RVT的最佳阈值,关注对新辅助免疫治疗应答不佳患者的特征,寻找治疗此类患者的理想方案。
4 新辅助与“夹心”模式对比
从2021年单纯新辅助免疫治疗联合化疗的CheckMate 816研究首次公布以来,已经相继有5个新辅助免疫治疗联合化疗+辅助免疫“夹心”模式的Ⅲ期研究(AEGEAN、KEYNOTE-671、CheckMate 77T、NEOTORCH、RATIONALE-315)在可切除NSCLC患者中取得阳性结果(表2),免疫治疗联合化疗已取代化疗成为Ⅱ~Ⅲ期NSCLC的新标准治疗。但这也伴随一系列的新问题,其中,新辅助免疫治疗已经足够还是需要新辅助+辅助的“夹心”模式一直争议不断。如前所述,对于ITT人群,对CheckMate 816与CheckMate 77T研究的EFS间接比较,结果显示无显著差异。此外,CheckMate 816与KEYNOTE-671研究的OS结果也相似,CheckMate 816研究[25]中OS的HR为0.71,4年OS率提高13%(71% vs. 58%),KEYNOTE-671研究[17]中OS的HR为0.72,4年OS率提高14.6%(67.1% vs. 51.5%)。一项Meta分析[26]对单纯新辅助与“夹心”模式的结果也进行了对比,结果也显示EFS[HR=0.90,95%CI(0.63,1.30),P=0.588]和OS[HR=1.18,95%CI(0.73,1.90),P=0.511]均无显著差异。
今年WCLC公布了一项基于CheckMate 816与CheckMate 77T研究的患者个体水平数据的分析,这是首个基于患者个体数据对纳武利尤单抗新辅助治疗与新辅助治疗+辅助治疗的疗效进行比较[27],试图解答上述争议。该分析纳入CheckMate 816 研究经纳武利尤单抗+化疗行新辅助治疗后接受手术的患者,以及CheckMate 77T研究中经纳武利尤单抗+化疗行新辅助治疗后手术,后续接受至少1次纳武利尤单抗辅助治疗的患者。采用探索性倾向性评分加权分析提高两组间基线的均衡性,减少混杂。结果显示,与单纯纳武利尤单抗+化疗行新辅助治疗相比,术后继续行纳武利尤单抗辅助治疗可以进一步将疾病复发或死亡风险降低约40%[HR=0.61,95%CI(0.39,0.97)]。亚组分析显示未达到pCR和PD-L1<1%的患者更能从术后辅助免疫治疗中获益,提示达到pCR的患者,新辅助免疫治疗可能已经足够。CheckMate 816研究中达到pCR的患者4年EFS率达95%,继续提高的空间非常有限。今年WCLC报道了一项真实世界前瞻性单中心队列研究[28],结果显示经新辅助免疫治疗+化疗达到pCR的患者继续辅助免疫治疗与未继续辅助免疫治疗的DFS无显著差异,生存曲线大部分重叠(P=0.6325)。PD-L1<1%的患者获益更多,推测可能是这部分患者中达到pCR的比例较PD-L1>1%患者低,所以术后继续辅助免疫治疗能带来额外获益。但鉴于这项研究间的交叉分析具有探索性质,应谨慎解读这些结果。CheckMate 77T研究中纳入手术后继续接受至少1次辅助免疫治疗的患者,可能筛选出更多免疫优势人群。与CheckMate 816相比,虽然两个研究试验组整体pCR相似(24% vs. 25.3%),而在基于这两个研究的分析中,筛选出的患者pCR差异达到10%(30.5% vs. 40.7%)[27],该结果也似乎印证了这一推测。
迄今为止,仍缺乏头对头比较的坚实证据。临床上更多的是结合患者肿瘤分期、新辅助治疗的耐受性、病理缓解情况、预测标志物及患者意愿等进行个体化治疗。2024年7月,FDA肿瘤药物咨询委员会(ODAC)在审评AEGEAN研究时提到,对于围手术期免疫治疗的研究设计,很难区分新辅助和辅助各阶段对患者生存获益的贡献,对“夹心”模式可能出现的过度治疗表示担忧。ODAC专家组以11∶0比例一致同意未来开展的NSCLC围手术期研究,应采用新的试验设计方案以充分评估不同治疗阶段的贡献。AEGEAN研究的申办方承诺支持两项Ⅲ期研究INSIGHT(NCT06498635)和ADOPT-Lung(NCT06284317),探索不同治疗阶段的疗效贡献及根据病理缓解情况辅助治疗的获益情况,届时将解答部分目前的困惑,为临床医师优化治疗选择提供更加确凿的证据。
5 新辅助/辅助免疫治疗在Ⅰ期人群的探索
Ⅰ期 NSCLC患者手术切除后预后良好,但是仍有部分患者在完全切除后复发,ⅠA期患者的5年DFS率为84.3%,ⅠB期患者为65.8%[29]。有微乳头、实性成分或分化不良的肿瘤复发风险高于其他病理类型,复发高峰在1年左右。既往辅助化疗的探索未取得令人满意的疗效。
今年ESMO公布了一项在日本开展的纳武利尤单抗单药新辅助治疗临床高危Ⅰ期NSCLC的单臂Ⅱ期研究POTENTIAL[30]。入组52例纯实性或实性成分2~4 cm的EGFR、ALK、ROS1阴性的Ⅰ期患者,新辅助纳武利尤单抗治疗3个周期,所有患者都接受手术,研究结果达到了主要终点,pCR率23.1%,超过了预设的10%阈值,MPR率为46.2%,中位随访33.7个月,中位RFS尚未达到,3年RFS率85.6%,3年OS率89.1%。由于仅用单药2个周期,安全性良好,3~4级不良事件发生率仅13.5%,无5级不良事件。同样在ESMO会议,韩国一研究团队报道了一项帕博利珠单抗辅助治疗微乳头状或实性Ⅰ期腺癌的单臂Ⅱ期研究[31]。主要终点RFS,统计预设3年DFS从历史对照的65%提高到80%则达到终点,采用2009—2014年接受手术切除的相似人群的数据作为历史对照。结果显示3年DFS率为83.2%,达到预设终点,排除EGFR突变患者,3年DFS率达到92.7%,显著高于历史对照组73.6%[HR=0.2,95%CI(0.05,0.83),P=0.028]。这两项研究提示,无论新辅助还是辅助免疫治疗都进一步改善高危Ⅰ期NSCLC患者的疗效,但是单臂小样本研究的证据有限,Ⅰ期患者预后相对较好,今后需要结合其他标志物如ctDNA筛选出真正需要治疗的患者并在更大样本的随机研究中进行验证。
6 新型药物的探索
免疫治疗联合化疗在可手术切除NSCLC患者中取得长足进步,改变了原有的治疗格局,但是目前疗效已经达到新的瓶颈,且有部分患者不能耐受化疗,亟需探索新型药物。
Relatlimab是一种新型淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)抑制剂,与T细胞上的LAG-3结合,可以恢复耗竭T细胞的效应功能。纳武利尤单抗联合relatilimab在临床前研究及黑色素瘤临床研究中都被证实可以协同增效。NEOpredict-Lung是首个LAG-3单抗新辅助治疗NSCLC的多中心、非比较Ⅱ期研究,纳入ⅠB~Ⅲ期NSCLC患者,随机分配至A组接受纳武利尤单抗2周期,B组接受纳武利尤单抗联合relatlimab(80 mg)2周期,每组30例。2022年ESMO已公布达到主要终点:43 d内行根治性手术的可行性,两组都100%达到[32]。今年WCLC报道了延长随访的更新结果[33],中位随访29.8个月,A组和B组的pCR分别为13.3%和18.5%,A组2年DFS率和OS率分别为75.3%和92.3%,B组分别为69.1%和88.6%,间接比较两组的病理缓解率和生存期差异不大,不过B组的TNM分期降期尤其是淋巴结降期率(28.6% vs. 66.7%)明显更高。此外,研究修订了方案,增加C组以探索纳武利尤单抗联合更高剂量的relatlimab(240 mg)。期待后续结果以明确更高剂量relatlimab是否能进一步提升疗效。
依沃西单抗是抗PD-1/血管内皮细胞生长因子双特异性抗体,既往在晚期肺癌的研究显示无论单药还是联合化疗都有潜在疗效。今年WCLC报道了一项依沃西单抗±化疗围手术期治疗可切除NSCLC的Ⅱ期研究[34]。纳入Ⅱ~ⅢB期NSCLC患者,分为两个队列,队列1患者接受新辅助依沃西单抗单药(n=11),队列2患者接受依沃西单抗联合化疗(n=49),新辅助治疗3~4个周期,手术后依沃西单抗辅助治疗≤16个周期。结果显示队列2的病理缓解率在数值上更高,MPR率和pCR率分别为71.8%和43.6%,队列1的分别为60%和30%。对队列2的亚组分析显示,PD-L1阳性与阴性患者的病理缓解率相近(71.4% vs. 66.7%)。中位EFS尚未成熟,队列1和队列2两组12个月的EFS率分别为81.8%和80.3%。整体安全性良好,3级以上不良事件发生率分别为36.4%和32.7%。相比既往新辅助免疫治疗+化疗约25%的病理缓解率,依沃西单抗联合化疗展示出有前景的疗效。
NeoCOAST-2是一项全球多中心、多臂Ⅱ期临床研究,旨在评估围手术期PD-1/CTLA-4双抗(volrustomig)、TROP2-ADC(Dato-DXd)、抗CD73单抗(oleclumab)及抗NKG2A单抗(monalizumab)治疗NSCLC的疗效和安全性。既往NeoCOAST研究[35]已经证实度伐利尤单抗分别联合Oleclumab和Monalizumab新辅助治疗NSCLC安全有效。TROPION-Lung01研究[36]也证实Dato-DXd二线治疗晚期NSCLC的无进展生存优于多西他赛。今年WCLC公布了NeoCOAST-2研究[37]中组1(度伐利尤单抗+化疗+Oleclumab)、组2(度伐利尤单抗+化疗+Monalizumab)以及组4(度伐利尤单抗+化疗+Dato-DXd)的数据,结果显示3组患者的pCR分别为20%、26.7%和34.1%,MPR分别为45.0%、53.3%和65.9%。PD-L1阳性患者的病理缓解率相对更高,PD-L1<1%患者的pCR也分别达到17.6%、15%和25%。安全性总体可接受,新辅助治疗阶段,组1、组2和组4患者≥3级不良事件发生率分别为31.1%、29.6%和18.5%,辅助治疗阶段≥3级不良事件发生率分别为4.3%、12.5%和0.0%。从3组数据看,Dato-DXd方案的病理缓解率更高且安全性更好。但TROPION-Lung01研究[36]的最终OS结果显示,Dato-DXd与多西他赛无显著差异[HR=0.94,95%CI(0.78,1.14)],这为抗体偶联药物能否为早期NSCLC患者带来生存获益提出质疑。组1和组2采用四药联合的pCR率并未明显高于目前的标准治疗,MPR有一定优势,能否延长生存期有待后续更新结果的验证。
以上3项研究都显示,将新型抗肿瘤药物整合到NSCLC围手术期治疗增强了临床获益的可行性,尤其是疗效受PD-L1表达影响较小。但目前都是小样本非比较研究,且缺乏长期生存数据结果。未来需要在随机研究中比较这些新型药物与现有标准治疗,进一步明确其在围手术期中的价值。帕博利珠单抗联合芦康沙妥珠单抗(TROP2-ADC)对比帕博利珠单抗辅助治疗经新辅助免疫治疗+化疗后未达pCR的Ⅱ~ⅢB期可切除NSCLC的国际Ⅲ期研究TroFuse-019[38]正在招募患者。期待这些新型药物能为早期NSCLC患者带来更多的希望和选择。
7 总结与展望
2024年WCLC/ESMO大会上,肺癌围手术期免疫治疗的研究仍然呈现蓬勃发展态势,从过去粗狂发展模式逐渐转向精耕细作阶段。过去几年全面爆发的围手术期免疫治疗的相关研究迎来了长期生存结果的更新,短期疗效有效地转化为长期获益,进一步巩固了围手术期免疫治疗的价值。新辅助、辅助和“夹心”模式的利弊选择也进一步得到厘清。辅助免疫治疗Ⅲ期研究结果的失败及既往两个Ⅲ期研究结果的不一致,提示免疫治疗介入到术前更有优势。新辅助免疫治疗后达到pCR和%RVT残留较多的患者可能不需要继续辅助免疫治疗。此外,围手术期免疫治疗的标志物、扩展到Ⅰ期人群以及多种新型药物也在全面探索中,都取得了初步的积极结果,为今后的研究指明了新的方向。着眼未来,围手术期免疫治疗仍需要持续优化。
利益冲突:无。
作者贡献:李家贺、卢佳煜、张宸源、范锐涛参与起草、撰写、修改论文;张旭旭、徐欣瑶、李桂珍、张继朋、李玮参与资料分析,设计及修改论文;卢强参与选题、设计和修改论文。


