Nature:酒精“调虎离山”,细菌趁虚入肝「eG学术观察」
时间:2025-08-29 12:13:14 热度:37.1℃ 作者:网络
导读
长期以来,医学界将酒精性肝病(alcohol liver disease, ALD)的肠-肝轴机制归结为一个相对简化的过程:饮酒可致肠道菌群失调和肠道屏障功能受损,进而引发肠源性内毒素血症,最终加重肝脏损伤。这一观点已被写入《内科学》教材,成为ALD的核心发病机制之一。然而,一个更关键的问题悬而未决:酒精究竟是如何精准瓦解肠道屏障的防御体系的?
近日,美国加州大学圣地亚哥分校研究团队于顶刊Nature发表的题为"mAChR4 suppresses liver disease via GAP-induced antimicrobial immunity"的研究,揭示了ALD的肠-肝轴发病机制。该机制宛如一场“调虎离山”:酒精首先抑制肠上皮杯状细胞的关键受体——毒蕈碱型乙酰胆碱受体M4(muscarinic acetylcholine receptor M4, mAChR4)的功能;继而导致由其控制的杯状细胞相关抗原通道(goblet cell-associated antigen passage, GAP)这一种重要的免疫监视结构关闭,造成肠道免疫监视系统瘫痪;最终,为肠道细菌“趁虚而入”攻击肝脏并引发肝损伤提供了可乘之机。这项研究不仅阐明了ALD发生的分子序贯事件,也为其防治策略提供了新方向。

肠-肝轴:酒精先袭肠道,再伤肝
已有研究表明,饮酒可致肠道菌群失调、肠道屏障功能受损,细菌及其代谢产物(如内毒素)穿过肠黏膜屏障进入血液,经门静脉进入肝脏,激活免疫细胞,加剧炎症,这种现象属于“细菌易位”。然而,酒精具体是如何瓦解肠道屏障的?本研究将目光投向了肠上皮中的杯状细胞及其控制的免疫监视通道——GAP(杯状细胞相关抗原通道)。研究发现,酒精的真正“阴谋”,正是从关闭这一通道开始的。
GAP与mAChR4:肠道免疫系统的“烽火台”
杯状细胞不仅通过分泌黏液增强黏膜物理屏障,还通过形成一种特殊的抗原通道(GAP),维持肠道免疫稳态(推荐阅读:你好,我是杯状细胞)。这些微小的通道可以主动捕获肠腔中的细菌抗原,并将其递送给位于固有层的树突状细胞等抗原提呈细胞,从而启动保护性免疫应答(如激活ILC3亚群产生IL-22,促进抗菌肽的分泌)。GAP犹如古代城墙上的“烽火台”,是免疫系统第一时间获取“敌情”的重要前哨。
这一切的核心调控者,正是mAChR4。它位于杯状细胞的细胞膜上,通过激活PI3K通路,促进肌动蛋白聚合和微管运输,打开GAP通道,完成抗原采样。
“调虎离山”:酒精抑制mAChR4,关闭GAP
研究发现,在酒精使用障碍患者的十二指肠活检标本中,编码mAChR4的CHRM4 mRNA及其信号通路中的其他相关转录本的表达均显著下调。这种下调与转氨酶水平升高及疾病进展(脂肪肝或肝纤维化)相关。同样,在长期酒精喂养的小鼠模型中,也观察到CHRM4 mRNA水平降低和GAP数量减少。机制研究表明,酒精通过激活MAPK信号通路(如ERK1/2),抑制了mAChR4的表达。研究还发现,酒精能同时刺激杯状细胞增多和黏液分泌增加,看似加强了物理屏障,实则“明修栈道,暗度陈仓”——关闭了最重要的免疫采样通道GAP,使得肠道在细菌面前成了“睁眼瞎”。肠道屏障功能障碍导致细菌及其产物易位至肝脏,进而加剧炎症反应并加速ALD病情进展。
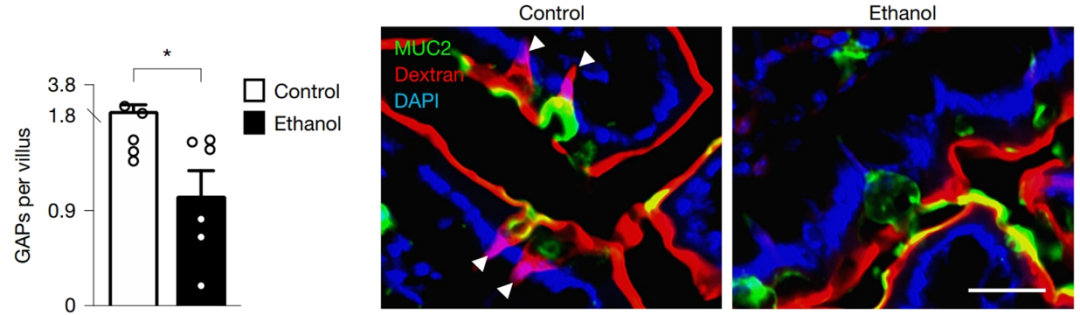
图1:实验组与对照组的十二指肠GAP数量差异(GAP:粉色)
图源:Nature原文
逆转战局:IL6ST与mAChR4激动剂重建肠道免疫
研究人员不仅揭示了致病机制,更进一步探索了逆转这一过程的方法。他们发现,激活肠道上皮细胞中的IL-6信号转导蛋白(IL6ST),可以对抗酒精对mAChR4的抑制作用。通过构建肠道特异性激活IL6ST的小鼠模型发现,即便在酒精喂养条件下,这些小鼠仍能维持较高的mAChR4表达和GAP功能。实验结果显示,模型小鼠肠道中抗原提呈细胞和ILC3s数量增多,IL-22和REG3蛋白水平上升,黏膜内细菌数量下降,细菌向肝脏的易位显著减少,最终实现了对ALD的有效防御。
同时,研究还发现,使用mAChR4激动剂,在酒精暴露条件下也可显著增加GAP数量、提升REG3表达水平、减少细菌易位,从而有效预防肝病。值得注意的是,mAChR4在中枢神经系统中也参与成瘾行为的调控。此前有研究表明,mAChR4激动剂可减少实验动物对酒精和可卡因的寻求行为。因此,靶向该受体的药物或许具备“一石二鸟”的潜力——既治肝病,又助戒酒。
展望
本研究为ALD及其他代谢性肝病的治疗开辟了新方向。展望未来,以下几点值得重点关注:
第一,推动临床转化。现有多种高选择性mAChR4变构调节剂已完成精神分裂症的临床研究,积累了宝贵的安全性数据,为开展ALD适应症临床试验奠定了基础,有望加速相关药物的上市进程。
第二,开发靶向给药系统。为避免中枢神经系统副作用,研究者可设计肠道特异性靶向递送技术,通过特殊制剂或纳米载体将药物精准输送至肠道,提高治疗效果并降低全身性不良反应。
第三,深化机制研究。需要进一步阐明IL6ST与mAChR4之间的信号传导机制,以及乙醇影响MAPK通路的具体机制,这将有助于发现更多潜在治疗靶点。
本研究革新了我们应对ALD的防治策略,从在肝脏“扑火”转为在肠道“防盗”。未来或许只需通过药物干预来重启被酒精抑制的免疫监视功能,就能从源头上阻止疾病发生。这不仅为患者带来新希望,更点亮了从被动防御到主动维稳的治疗新范式。
引证本文
Llorente, C., Raya Tonetti, F., Bruellman, R. et al. mAChR4 suppresses liver disease via GAP-induced antimicrobial immunity. Nature (2025).
https://doi.org/10.1038/s41586-025-09395-z


