2025年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO-GI)食管癌及胃食管结合部癌治疗进展解读
时间:2025-09-01 12:10:33 热度:37.1℃ 作者:网络
摘 要
2025年美国临床肿瘤学会胃肠道肿瘤研讨会(American Society of Clinical Oncology Gastrointestinal Cancers Symposium,ASCO-GI)于2025年1月23—25日召开。本次大会报道了多项食管癌、胃食管结合部癌治疗的重要研究,尤其是在围手术期和晚期治疗领域取得了显著进展。免疫治疗在食管癌新辅助治疗中显示出良好的前景,有望成为标准治疗方案。此外,胃食管结合部癌晚期治疗中,免疫治疗联合化疗的长期生存获益进一步得到验证。本文将对大会报道的食管癌、胃食管结合部癌围手术期及晚期治疗相关研究进行解读。
正 文
食管癌是全球常见的消化系统恶性肿瘤。鳞状细胞癌是我国发病率最高的食管癌组织学类型[1]。而胃食管结合部癌作为一种特殊的消化系统肿瘤,近年来的发病率逐渐上升[2]。2025年美国临床肿瘤学会胃肠道肿瘤研讨会(American Society of Clinical Oncology Gastrointestinal Cancers Symposium,ASCO-GI)汇聚了全球顶尖的胃肠道肿瘤专家,共同探讨领域内最新研究结果和发展趋势。本次大会不仅展示了多项针对食管癌及胃食管结合部癌围手术期及晚期治疗的重要研究,还深入探讨了免疫治疗与其他疗法相结合的可能性。本文将重点解读大会报道的最新进展,以期为临床实践提供参考。
1 食管癌围手术期治疗进展
目前,围手术期治疗已成为提高可切除食管癌手术切除率、改善预后的重要环节[3]。免疫治疗在食管癌领域取得了显著进展。基于其在晚期治疗中的良好效果,许多研究进一步将免疫治疗应用于围手术期,开展相关探索。以程序性死亡受体-1(programmed death-1,PD-1)/程序性死亡受体配体-1(programmed death ligand-1,PD-L1)为代表的免疫检查点抑制剂治疗备受瞩目[4]。
1.1 食管癌新辅助免疫治疗+化疗
本次大会报道了多项有关食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)新辅助免疫治疗联合其他治疗方案的临床研究[5-8](表1)。其中,备受瞩目的是SCIENCE研究[5],其为一项针对局部晚期食管癌患者,探索免疫治疗联合放化疗/化疗的多中心随机对照Ⅲ期研究。研究纳入了146例cT1N2~3M0或cT2~4aN0~3M0期局部晚期ESCC患者,1∶1∶1随机分配到3个新辅助治疗组。A组:信迪利单抗+白蛋白紫杉醇+卡铂;B组:信迪利单抗+白蛋白紫杉醇+卡铂+调强放疗(intensity-modulated radiation therapy,IMRT)/图像引导放疗(image-guided radiation therapy,IGRT)总计41.4 Gy;C组:白蛋白紫杉醇+卡铂+IMRT/IGRT总计41.4 Gy。所有患者均接受术前2个周期的新辅助治疗,并在术后实现了R0切除。共同主要终点包括病理完全缓解(pathological complete response,pCR)率和无事件生存期(event-free survival,EFS)。结果显示,A、B、C组pCR率分别为13%、60%和47.3%;B组和C组的pCR率显著高于A组[A组vs. B组:OR=10,95%CI(3.7,30.8),P<0.000 1;A组vs. C组:OR=6,95%CI(2.3,17.8),P=0.000 5],达到pCR率主要终点。此外,对肿瘤退缩分级(tumor regression grade,TRG),信迪利单抗联合放化疗组的所有患者均表现出良好的治疗反应。可以看出,含放疗组pCR率显著提高,化疗联合信迪利单抗可进一步提高pCR率。3组术后≥3级治疗相关不良事件(treatment-related adverse events,TRAEs)发生率分别为8.7%、31.1%和36.4%,术后并发症整体可控。值得注意的是,虽然含放疗组的pCR率显著提高,但B组和C组因化疗引起的血液学毒性显著高于A组。此外,B组与C组差异不显著(P=0.11),这可能引起争议:免疫治疗的加入是否真正显著提升了疗效,还是放化疗本身的作用更为关键?总体来看,信迪利单抗联合放化疗新辅助治疗局部晚期食管癌具有显著优势,但仍需进一步监测EFS以验证其长期疗效。信迪利单抗作为国产PD-1抑制剂,在国际舞台上展示了其疗效和安全性。该研究的发表进一步提升了国产免疫治疗药物的国际认可度,对行业具有积极推动作用。
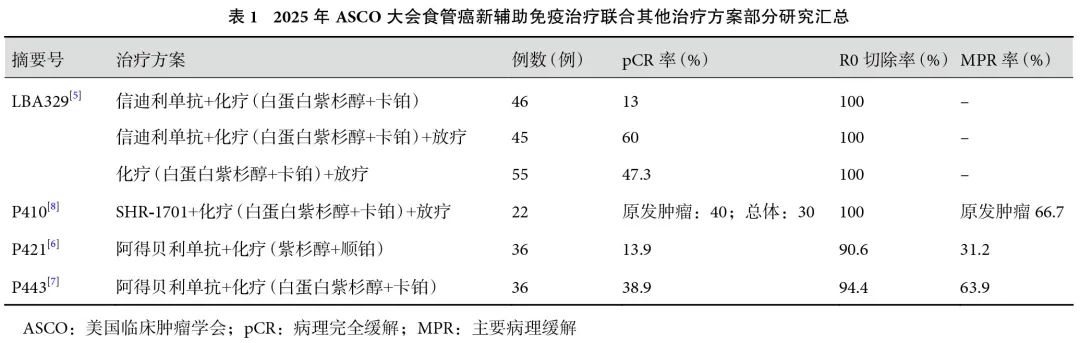
另一项研究[6]旨在评估阿得贝利单抗联合化疗作为新辅助治疗方案的有效性和安全性,其纳入了36例ESCC患者,接受2个周期的新辅助免疫治疗联合化疗(阿得贝利单抗+紫杉醇+顺铂)。最终,32例患者接受了手术治疗,主要终点为pCR率。结果显示,所有患者的pCR率为13.9%(5/36),R0切除率为90.6%,且有19.4%(7/36)患者术后发生了≥3级TRAEs。尽管pCR率相对较低,但该研究提供了初步的安全性和有效性数据。另一项类似的研究[7]同样探索了阿得贝利单抗联合化疗在新辅助治疗中的应用。该研究纳入了36例局部晚期ESCC患者,34例接受了手术治疗,所有手术均实现了R0切除。研究的主要终点pCR率为38.9%[95%CI(24.6%,59.3%)],显示出比前一项研究[6]更高的pCR率。此外,术后≥3级TRAEs发生率为17.6%(6/34)。综上,这2项研究分别探讨了阿得贝利单抗联合不同化疗方案在局部晚期ESCC新辅助治疗中的作用。虽然2项研究的pCR率存在差异,但都显示了抗PD-L1药物在提高局部控制方面的潜力。同时,安全性数据提示,尽管存在一定比例的≥3级TRAEs,但整体上这些治疗方案是可接受的。未来的研究需要进一步验证这些发现,并探索如何优化治疗组合以实现最佳疗效和最小毒性。
关于局部晚期食管癌的新辅助免疫治疗联合化疗的方案选择,一项Meta分析[9]综合了多种不同的免疫治疗联合化疗方案,旨在为临床医师提供科学依据以优化治疗策略。结果显示卡瑞利珠单抗+白蛋白紫杉醇+奈达铂方案在pCR方面表现最佳;卡瑞利珠单抗+白蛋白紫杉醇+顺铂方案则在实现主要病理缓解(major pathological response,MPR)率上最佳;信迪利单抗+白蛋白紫杉醇+顺铂方案不仅在疾病控制率(disease control rate,DCR)和客观缓解率(objective response rate,ORR)上表现出色,而且总体结局最为理想。值得注意的是,尽管这些方案在不同疗效指标上各有优势,但均显示出较单纯化疗更好的临床疗效和安全性。基于上述发现,目前的研究证据支持将新辅助免疫治疗联合化疗作为局部晚期食管癌一种新的标准治疗选择。然而,为进一步验证这些初步结果,并确定特定患者的个性化治疗方案,未来仍需开展更多大规模、前瞻性随机对照试验。此外,探索如何通过生物标志物或其他手段预测哪些患者最有可能从特定治疗方案中受益,也将是未来研究的重要方向之一。
1.2 新辅助治疗研究终点替代
新辅助治疗研究目前通常使用pCR率、EFS等作为主要终点。然而总生存期(overall survival,OS)是评估长期疗效的关键指标,但由于获取难度大及变量控制复杂,在新辅助治疗研究中直接测量OS具有挑战性。因此,一个广受关注的问题是,局部晚期食管癌的新辅助治疗短期pCR率能否替代OS评估长期获益?
这个问题目前仍需要更多的数据支持。已有研究表明其他终点可能替代OS进行评估。一项Meta分析[10]指出,可手术切除的食管癌患者中,接受新辅助化疗后的无复发生存期(recurrence-free survival,RFS)与OS之间存在较强的相关性[Kendall's Tau=0.797,95%CI(0.782,0.812)],特别是在对新辅助化疗反应良好的患者中更为显著。另一项Meta分析[11]评估了无病生存期(disease-free survival,DFS)能否替代OS,结果表明在不同治疗组间,DFS与OS之间存在较高的相关性,表明DFS是一个有效的替代终点[直接手术vs. 化疗后手术:Kendall's Tau=0.73,95%CI(0.71,0.75);直接手术vs. 放化疗后手术:Kendall's Tau=0.76,95%CI(0.74,0.77);化疗后手术vs. 放化疗后手术:Kendall's Tau=0.87,95%CI(0.78,0.92)]。本次大会公布的一项研究[12]系统回顾了23项涉及可切除晚期食管癌和胃食管结合部癌围手术期治疗的Ⅲ期随机对照试验,共纳入1 688例患者,探讨了pCR是否可以作为OS的替代终点。结果显示,在试验水平上,pCR能有效分层预后,显示出其作为替代终点的可能性。但在个体层面上,无论是比较新辅助化疗后患者的pCR与OS的相关性,还是新辅助放化疗后患者的相关性,亦或是TRG与OS的关联,均未显示出足够的证据支持pCR可作为OS的可靠替代指标。综上所述,尽管pCR在某些方面显示出了作为预后因子的价值,但其并不足以单独替代OS作为衡量长期疗效的标准。未来的研究应继续探索更加可靠的替代终点,以更好地指导临床决策。
1.3 食管癌术后辅助治疗
目前,对于可切除ESCC患者的术后治疗选择有限,现有的治疗方法在提高生存率方面效果有限。因此,迫切需要研究更有效且安全的术后辅助治疗方案。ALTER-E005研究[13] 探索了安罗替尼联合贝莫苏拜单抗在食管癌术后辅助治疗中的疗效和安全性。研究主要关注接受R0切除且术后6~12周没有复发的ESCC患者。截至2024年9月,中位随访时间为8.9个月,尽管主要终点DFS尚未达到,但初步数据显示,6个月和1年的DFS率分别为95.7%[95%CI(72.9%,99.4%)]和84.0%[95%CI(57.7%,94.6%)]。这表明在接受安罗替尼联合贝莫苏拜单抗治疗的患者中,疾病控制效果显著。在安全性方面,共有9例(30.0%)患者发生3级TRAEs,但未观察到≥4级TRAEs。初步结果表明,安罗替尼联合贝莫苏拜单抗在ESCC术后辅助治疗中显示出良好的疗效和安全性。这种靶向治疗与免疫治疗的组合为ESCC患者提供了新的希望,特别是在那些高复发风险患者中。然而,仍需持续随访以进一步验证这些早期发现,以确定长期疗效和安全性。
2 食管癌晚期治疗进展
2.1 一线免疫治疗联合其他治疗探索
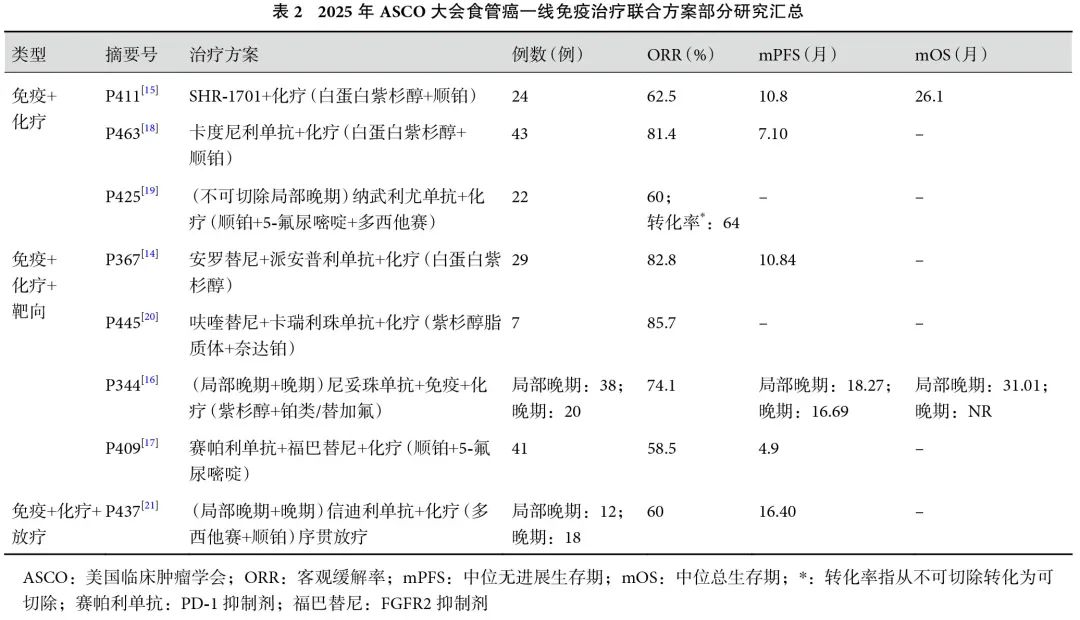
尽管免疫治疗联合化疗已成为晚期食管癌的一线标准治疗,但双药化疗引发的毒副反应引起了关注。靶向治疗联合免疫治疗方案显示出初步疗效,为晚期ESCC治疗提供了新方向。一项单臂开放标签Ⅱ期研究[14]探索了安罗替尼联合派安普利单抗和单一化疗方案一线治疗ESCC的疗效和安全性。研究纳入了30例经组织学证实的晚期ESCC患者,其中29例首次获得肿瘤反应的患者被纳入分析。绝大多数(96.6%)为Ⅳb期患者,超过一半(51.7%)曾行手术治疗。主要终点是无进展生存期(progression-free survival,PFS)。治疗方案:安罗替尼联合派安普利单抗及白蛋白结合型紫杉醇,共6个周期。截至2024年9月,中位PFS为10.84个月[95%CI(7.57,14.11)]。29例患者的ORR为82.8%[95%CI(64.2%,94.2%)],DCR为89.7% [95%CI(72.6%,97.8%)]。安全性方面,TRAEs发生率为20%,总体不良反应安全可控,以贫血、白细胞减少和外周神经毒性为主,患者整体耐受性较好。研究显示出安罗替尼联合派安普利单抗和单药化疗具有初步的良好疗效和安全性,为晚期ESCC患者一线治疗提供了新的选择。但还存在单臂设计、样本量较小及随访时间较短的局限性,ORR的可信区间较宽可能是样本量较小所致。未来还需要更大样本量的Ⅲ期试验来确认该结果,以确保其在更广泛群体中的适用性。
另一项单臂单中心Ⅱ期研究[15]探索了双功能抗PD-L1/TGF-β受体Ⅱ药物SHR-1701联合化疗一线治疗ESCC的疗效与安全性。研究最终纳入24例意向性治疗(intention to treat,ITT)患者分析,主要终点是ORR。经过6个周期的SHR-1701+白蛋白紫杉醇+顺铂诱导治疗及SHR-1701维持治疗后,截至2024年3月,ORR为62.5%,DCR为87.5%,中位PFS为10.8个月[95%CI(7.8,NR)],中位OS为26.1个月[95%CI(8.6,NR)],≥3级TRAEs发生率为45.8%,未观察到治疗相关死亡。SHR-1701联合化疗在晚期ESCC患者中显示出显著的抗肿瘤活性和持久的生存获益。ORR达到62.5%,表明超过一半的患者对这种组合疗法产生了明显的肿瘤缩小反应,而DCR高达87.5%,进一步证实了其良好的疾病控制效果。此外,中位PFS为10.8个月,中位OS为26.1个月,显示出该疗法在延长患者生存方面的潜力。尽管≥3级TRAEs的发生率较高,但大多数副作用可控且未导致治疗相关死亡,提示该方案可耐受性尚可接受。
本次大会报道了多项有关ESCC一线免疫治疗联合其他治疗方案的临床研究[14-21](表2),进一步探索免疫治疗与其他疗法的协同作用。其中,P344研究[16]评估了双免疫检查点抑制剂联合化疗在晚期ESCC中的疗效,结果显示,与单纯免疫治疗联合化疗相比,双免疫检查点抑制剂联合化疗的ORR和PFS短期疗效及OS长期获益显著提升。P409研究[17]显示,成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)靶向治疗联合免疫化疗暂未显著提升疗效,可能因为FGFR突变/扩增在ESCC中的发生率较低(约5%~10%)。综上,在免疫治疗联合化疗的基础上,结合抗血管生成靶向治疗、表皮生长因子受体靶向治疗及放疗等多种手段的联合应用,有望进一步提升ESCC的治疗效果。
2.2 PD-L1低表达患者如何获益:迈向精准医疗的新篇章
PD-L1抑制剂在食管癌的治疗方面展示出实质的有效性,这有赖于PD-L1在癌细胞上的表达。但目前对于PD-L1低表达的患者应用PD-L1抑制剂能否获益这一问题,仍尚存争议。美国食品药品监督管理局(Food and Drug Administration,FDA)此前已批准帕博利珠单抗和纳武利尤单抗用于化疗后晚期或转移性ESCC,且不考虑肿瘤PD-L1的表达状态如何[22-23]。
本次大会公布的一项系统评价[24]深入探讨了这一问题。研究纳入了8项Ⅲ期临床试验,旨在比较免疫治疗联合化疗与单纯化疗在PD-L1低表达ESCC患者中的疗效差异。研究评估了这些试验的PFS和OS的风险比(hazard ratio,HR)及其95%CI。结果显示,无论PD-L1表达水平或化疗方案如何,免疫治疗联合化疗的PFS和OS均显著优于单纯化疗组。高PD-L1表达组的PFS和OS较低表达组有显著提升,该结果符合使用PD-1相关免疫治疗低表达患者获益小于高表达患者的预期。紫杉醇+铂类联合抗PD-1/PD-L1治疗比铂类+5-氟尿嘧啶方案PFS获益更显著,但OS提升并不显著。通过优化化疗方案来提升治疗效果是一个新的方向。综合来看,尽管免疫治疗联合化疗在PD-L1低表达患者中未能达到与高表达患者相同的长期生存获益,但仍优于单独化疗,这与研究[25]结论一致。为了最大化PD-L1低表达患者的治疗效益,研究者不断寻找额外的生物标志物来提高治疗选择的准确性。随着更多临床试验数据的积累和技术的进步,有望进一步优化PD-L1低表达患者的治疗策略。这一切都将推动肿瘤免疫治疗向着更加精准化、个性化的方向发展。
2.3 靶向治疗联合放化疗
大会上公布了ALTER-E009[26]的研究进展,其是一项多中心、多队列的回顾性研究。旨在评估抗血管生成药物安罗替尼联合放疗对局部晚期或转移性ESCC患者的疗效和安全性,特别关注了靶向治疗在改善患者生存率方面的潜力。研究包括2个队列,队列1为接受同步/维持放疗+安罗替尼治疗的转移性ESCC患者。队列2则针对局部晚期ESCC患者,并进一步分为对照组(含接受放疗/放化疗的患者)和观察组(含接受同步/维持放疗+安罗替尼的患者)。主要终点为OS。截至 2024 年 12 月 5 日,共纳入 150 例患者(队列1有 38 例,队列2观察组112 例)。结果显示,队列1的ORR和DCR分别为50.0%[95%CI(33.4%,66.6%)]和86.8%[95%CI(71.9%,95.6%)],晚期患者中位PFS为9.2个月[95%CI(7.5,11.0)],中位OS为24.0个月[95%CI(21.6,26.4)]。队列2观察组ORR和DCR分别为44.6%[95%CI(35.1%,54.3%)]和97.3%[95%CI(92.4%,99.4%)],局部晚期中位PFS为20.1个月[95%CI(NR,NR)],但中位OS尚不成熟。安全数据仍在收集,≥3级TRAEs发生率分别为10.5%(4/38)和10.7%(12/112)。总体结果显示,安罗替尼联合放疗对于局部晚期或转移性ESCC显示出良好的疗效和可控的安全性,尤其是在局部晚期患者中显示出较长的PFS。较高的DCR表明这种联合疗法在控制疾病进展方面具有潜在优势。值得注意的是,尽管两组之间的ORR相似,但队列2观察组的DCR明显更高,这可能提示联合治疗方案在局部晚期患者中的应用价值更大。但作为回顾性研究,可能存在选择偏倚,需要更大样本量的前瞻性研究进一步验证。其次,OS尚未成熟,长期安全性和耐受性仍待进一步评估。
3 胃食管结合部癌晚期治疗进展
本次会议亦对多项胃食管结合部癌晚期治疗研究[27-30]的进展进行了报道(表3)。纳武利尤单抗和帕博利珠单抗联合化疗在胃食管结合部癌晚期治疗中均被证明能够在一定程度上延长患者的生存时间,并提高生活质量。本次大会中,CheckMate649研究[27, 31]公布了最新的5年随访结果及在中国患者中的数据分析。研究将纳入的患者随机分为3组,治疗方案分别为纳武利尤单抗+化疗、单纯化疗和纳武利尤单抗+伊匹木单抗。5年随访结果显示,纳武利尤单抗+化疗组相较于单纯化疗组,患者OS持续改善,特别是在中国人群中死亡风险降低了37%[HR=0.63,95%CI(0.46,0.85)],且中位PFS延长至8.3个月[单纯化疗组为5.6个月,HR=0.57,95%CI(0.41,0.80)]。亚组分析显示,联合阳性评分(combined positive score,CPS)≥1和≥5的患者PFS和OS均显著获益。值得注意的是,对于伴有肝转移、腹膜转移的中国患者,OS亦有获益。安全性方面,国内患者接受纳武利尤单抗+化疗后,3/4级TRAEs发生率≤7%,未观察到5级事件。因此,认为纳武利尤单抗联合化疗继续表现出有临床意义的长期生存获益,且安全性可接受,进一步支持其作为晚期胃癌、胃食管交界部癌、食管腺癌患者的标准一线治疗。将中国患者与世界患者数据进行比较发现,纳武利尤单抗联合化疗在中国人群中展现出更低的疾病进展和死亡风险。
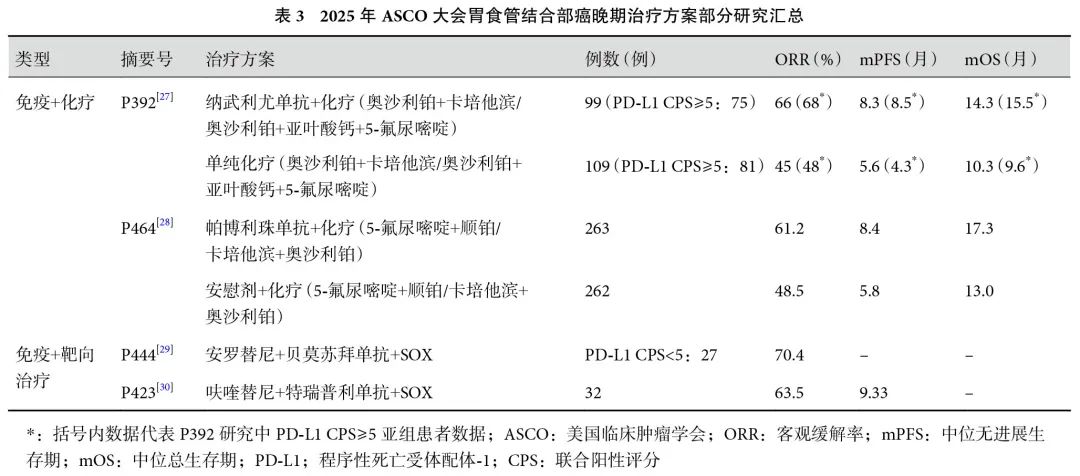
帕博利珠单抗同样作为FDA批准的晚期胃食管结合部癌一线用药,针对该药物的KEYNOTE-859研究[28]最新结果显示,亚洲的晚期胃或胃食管结合部腺癌患者中,帕博利珠单抗联合化疗仍能有效改善OS[HR=0.75,95%CI(0.62,0.91)]、PFS[HR=0.72,95%CI(0.58,0.89)]。结果仍保持乐观,且未观察到新的安全性信号,与全球人群中的结果一致,进一步支持帕博利珠单抗联合化疗作为该患者群体的一线标准治疗选择之一。
此外,靶向治疗联合免疫治疗及化疗也是值得探索的方向。在本次大会报道的研究中,该治疗方法显示出良好的抗肿瘤效果和安全性。一项安罗替尼联合贝莫苏拜单抗和SOX方案一线治疗PD-L1低表达胃食管结合部癌的单臂Ⅱ期研究[29]纳入了27例PD-L1 CPS<5的胃食管结合部癌患者,初步ORR为70.4%[95%CI(49.8%,86.2)],DCR为92.6%[95%CI(75.7%,99.1%)],安全性良好,3级以上TRAEs发生率为7%(2/27)。安罗替尼联合贝莫苏拜单抗和SOX方案一线治疗PD-L1低表达胃食管结合部癌显示出初步的疗效且安全性良好。另一项研究[30]聚焦于呋喹替尼联合特瑞普利单抗及SOX方案一线治疗胃食管结合部癌。Ⅰb期研究纳入了晚期胃癌、胃食管结合部癌患者9例、15例,Ⅱ期研究纳入32例。Ⅱ期主要终点为PFS,结果显示,中位PFS达9.33个月[95%CI(5.68,NR)]。且分层结果显示,PD-L1 CPS<1和<5的患者较CPS≥1和≥5的患者PFS可能有延长趋势,认为呋喹替尼联合特瑞普利单抗及SOX一线治疗晚期胃食管结合部癌显示出良好的抗肿瘤效果和安全性。在CheckMate649和KEYNOTE-859等研究[27-28]中,纳武利尤单抗和帕博利珠单抗联合化疗可以显著改善患者的生存率,尤其是对于PD-L1高表达的患者。然而,这些研究的治疗组合对于PD-L1低表达的患者,获益相对较小。而通过将靶向治疗(如抗血管生成药物)与免疫检查点抑制剂及化疗相结合,有望为PD-L1低表达的患者带来更显著的获益,期待后续的研究结果。
4 小结
本次ASCO-GI会议重点呈现了食管癌及胃食管结合部癌在围手术期与晚期治疗方面的多项重要进展。对于食管癌的围手术期治疗,新辅助免疫治疗联合化疗Ⅲ期研究的EFS结果仍令人期待,可使该疗法有成为标准治疗的潜力。靶向治疗、免疫治疗组合用于食管癌辅助治疗初显成效。同时,在对新辅助治疗研究终点替代问题上,期待能找出更好的终点来评估新辅助治疗的长期获益。在食管癌的晚期治疗方面,在免疫治疗联合化疗的基础上,抗血管生成靶向、表皮生长因子受体靶向、放疗等的联合应用可以带来进一步的疗效提升,尚待后续Ⅲ期研究继续验证。在PD-L1低表达患者获益的问题上,研究为免疫治疗联合化疗方案的选择提供了循证支持。
在胃食管结合部癌晚期治疗方面,CheckMate 649研究和KEYNOTE-859研究长期随访数据显示,纳武利尤单抗/帕博利珠单抗持续表现出有临床意义的长期生存获益,且安全性可接受,进一步支持其作为晚期胃食管结合部癌的标准一线治疗。靶向治疗联合免疫治疗和化疗在PD-L1低表达晚期胃食管结合部癌中显示出良好的抗肿瘤效果,期待后续研究继续验证及探索其中的机制。
利益冲突:无。
作者贡献:李家贺、卢佳煜起草、撰写、修改文章;张旭旭、徐欣瑶、张继朋、李玮、李桂珍参与资料分析、设计及修改文章;卢强参与选题、设计和修改文章。


