长期慢性胰腺炎也应关注遗传吗?WES测序检出CaSR新发变异和CFTR/SPINK1胚系变异查明病因
时间:2025-09-01 12:10:35 热度:37.1℃ 作者:网络
慢性胰腺炎常继发于酒精滥用,但无其他病因的胰腺炎常与编码酶原颗粒激活相关蛋白的基因变异有关。研究人员的目标是通过分析与胰内胰蛋白酶通路激活相关的扩展基因panel,鉴定患者的基因组变异。一名 23 岁女性因不明原因的慢性胰腺炎就诊,自 4 岁起反复发作。研究人员采用下一代测序技术分析了 9 个与胰腺炎相关的基因(CaSR、CFTR、CPA1、CTRC、CTSB、KRT8、PRSS1、PRSS2和SPINK1)。发现了 3 个错义变异:CFTR基因的p.Leu997Phe(母系遗传);SPINK1基因的p.Ile73Phe(父系遗传);以及CaSR基因的p.Phe790Ser(新发变异)。根据美国医学遗传学与基因组学学会标准指南,这些变异分别被归类为可能良性、意义未明变异,以及从未在文献中描述过的可能致病性变异。广泛的胰内胰蛋白酶通路激活基因测序检测到了其他基因筛查未发现的罕见变异,并表明不同基因的变异可能相互作用,共同促成胰腺炎表型的发生。
背 景
目前已知两种类型的胰腺炎,即急性和慢性胰腺炎,它们具有共同的临床结局、病因和遗传风险因素。后者是指胰腺的进行性炎症,引起腹痛并导致不可逆的形态学改变,不同程度地损害胰腺器官并影响邻近和远端器官。
胰腺腺泡细胞分泌消化酶,特别是以无活性形式产生胰蛋白酶——胰蛋白酶原,在十二指肠中由丝氨酸肠肽酶通过蛋白水解切割蛋白质N端的六肽而激活。反过来,胰蛋白酶能够激活糜蛋白酶原、弹性蛋白酶原和羧肽酶原B1(CPB1),而羧肽酶原A1(CPA1)和A2(CPA2)转化为其活性形式则需要胰蛋白酶和糜蛋白酶C(CTRC)的共同作用。胰蛋白酶原具有在胰腺内自激活的独特特征,在某些情况下会引发胰腺病变。
大多数胰腺炎风险基因编码胰蛋白酶依赖性通路蛋白。这些基因包括Kazal型1丝氨酸蛋白酶抑制剂(SPINK1),其功能是防止胰蛋白酶原在胰内过早激活;丝氨酸蛋白酶1和2(分别为PRSS1和PRSS2),对应胰蛋白酶原的两种同工型;糜蛋白酶C(CTRC),作为胰蛋白酶原向胰蛋白酶转化的介质;角蛋白8(KRT8),与角蛋白18(KRT18)形成功能性二聚体以维持上皮细胞的结构完整性;囊性纤维化跨膜传导调节因子(CFTR),一种控制上皮组织离子和水分泌及吸收的氯离子通道;组织蛋白酶B(CTSB),一种具有内肽酶和外肽酶活性的溶酶体半胱氨酸蛋白酶,在胰蛋白酶原激活中发挥作用;羧肽酶A1(CPA1),参与从膳食蛋白质中切割C端支链和芳香族氨基酸;以及钙敏感受体(CaSR),可检测细胞外钙水平的升高。后者是一种质膜结合的G蛋白偶联受体,在甲状旁腺、骨骼、肠道、肾脏、大脑以及胰腺的腺泡细胞和导管细胞中均有表达。在胰腺中,它通过增加导管液分泌来响应胰液中的高钙浓度,从而防止结石形成和胰腺炎。
CaSR基因(OMIM 601199)定位于3q13.3-q21,长120kb,包含8个外显子。该cDNA编码一种预测分子量为120kD的多肽,含有一个大的细胞外结构域和G蛋白偶联细胞表面受体特有的七个跨膜区域。SPINK1基因(OMIM 167790)位于5q32,长6个外显子。该基因编码的胰蛋白酶抑制剂由胰腺腺泡细胞分泌到胰液中,可防止胰蛋白酶催化胰腺和胰管内酶原的过早激活。CFTR基因(OMIM 602421)定位于7q31.2,由27个外显子组成。编码的蛋白是一种氯离子通道控制离子,并在上皮组织中执行水的分泌和吸收功能。该基因的致病变异会导致囊性纤维化,这是欧洲人群中最常见的遗传性疾病。此外,它在胰腺功能中也起着重要作用,明显增加了患胰腺炎的风险。此前已知,CFTR基因中具有功能丧失的遗传变异可诱发胰腺炎或加重现有炎症。
本文报告一名患有慢性胰腺炎的女性患者,其携带SPINK1和CFTR基因的遗传性变异,以及CaSR基因的一个新发可能致病变异。
案例详情
临床病史
患者女,23 岁,意大利人,临床表现为胰腺炎反复发作并多次住院治疗。患者足月出生,父母为非近亲、健康的意大利人,有一名健康的哥哥,无胰腺炎或遗传性疾病家族史。其母亲孕期及分娩过程均顺利。患者 6 岁时被诊断为慢性胰腺炎;2015 年接受胰空肠吻合术。术后 1 年患者状态良好,偶发胰腺疼痛,间断服用曲马多治疗,未再住院。
NGS检测
采集了先证者及其家属的外周血样本。将提取的DNA样本在NGS平台上进行全外显子组测序(WES),使用标准Sanger外显子测序对从外周血中重新提取的先证者及其父母的DNA样本确认结果。使用hg37/hg19作为参考基因组。
CaSR蛋白质分析
使用在线工具Varsome预测遗传变异对CaSR功能的影响。此外,通过3D分子建模分析展示蛋白质结构的变化:从AlphaFold数据集下载人类CaSR模型,并利用AlphaFold预测变异对该3D模型的影响。新发变异的致病性通过以下工具评估:AlphaMissense v.4预测软件(UniProt ID:P41180)及Varsome工具,后者采用参数为PM2中等(moderate)和PB1支持(supporting)。
测序与致病性分析
遗传分析显示,先证者在IPAT通路的三个不同基因(即CFTR、SPINK1和CaSR)中携带三个杂合错义变异。CFTR基因的c.2991G>C(p.Leu997Phe)变异位于19号外显子,由G突变为C,为母系遗传;根据文献报道,该变异被重新归类为可能致病性。CFTR2数据库将L997F归类为非囊性纤维化(CF)致病变异。该结论基于对携带该变异患者的临床特征评估、变异功能测试,以及在非CF个体中发现该变异(与CF致病变异共同存在)的结果。尽管该变异自1992年起就已被发现,但其致病作用仍不明确。目前已知的是,在特发性胰腺炎患者中,p.Leu997Phe变异还与SPINK1基因的变异(如p.Asn34Ser)相关。
SPINK1基因c.217A>T变异(p.Ile73Phe)来自父亲,位于4号外显子。第73位密码子的异亮氨酸(在物种间高度保守)被苯丙氨酸替代,后者为理化性质高度相似的氨基酸。迄今为止,c.217A>T变异尚未在慢性胰腺炎患者中报道,其对蛋白质功能的影响也未明确。据研究人员所知,本研究首次报道p.Ile73Phe变异,基于上述证据,该变异被归类为意义未明变异(VUS)。
CaSR基因的c.2379T>C(p.Phe790Ser)变异为新发变异(图1和图2),患者无家族性低尿钙性高钙血症家族史,此前未见报道,本研究为该变异的首次报道。Varsome和AlphaMissense变异效应预测软件均将该变异归类为可能有害;具体而言,AlphaMissense给出 0.781 的致病性评分。根据作者建议,研究人员将评分 >0.564 的变异归类为致病性,<0.34 的归类为良性。3D模型预测显示,尽管p.Phe790Ser变异的氨基酸与野生型(wt)相比具有不同的化学性质,但其蛋白结构特征与野生型相似(图3)。
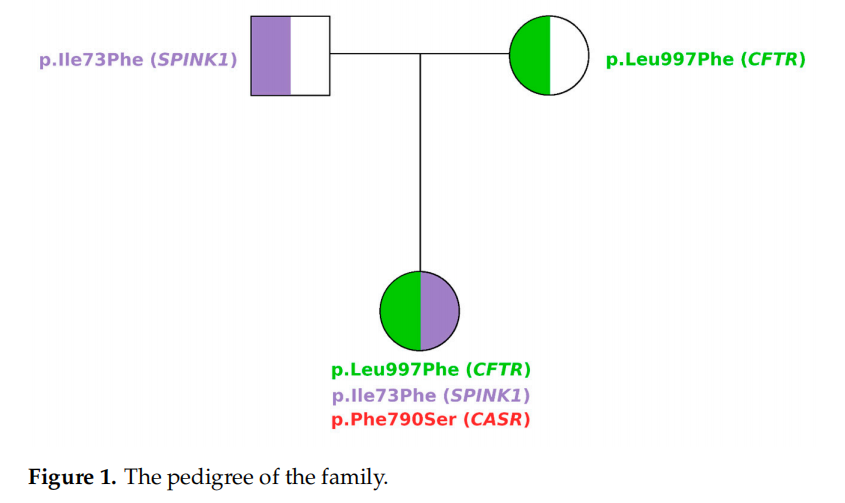
▲图1 患者家系
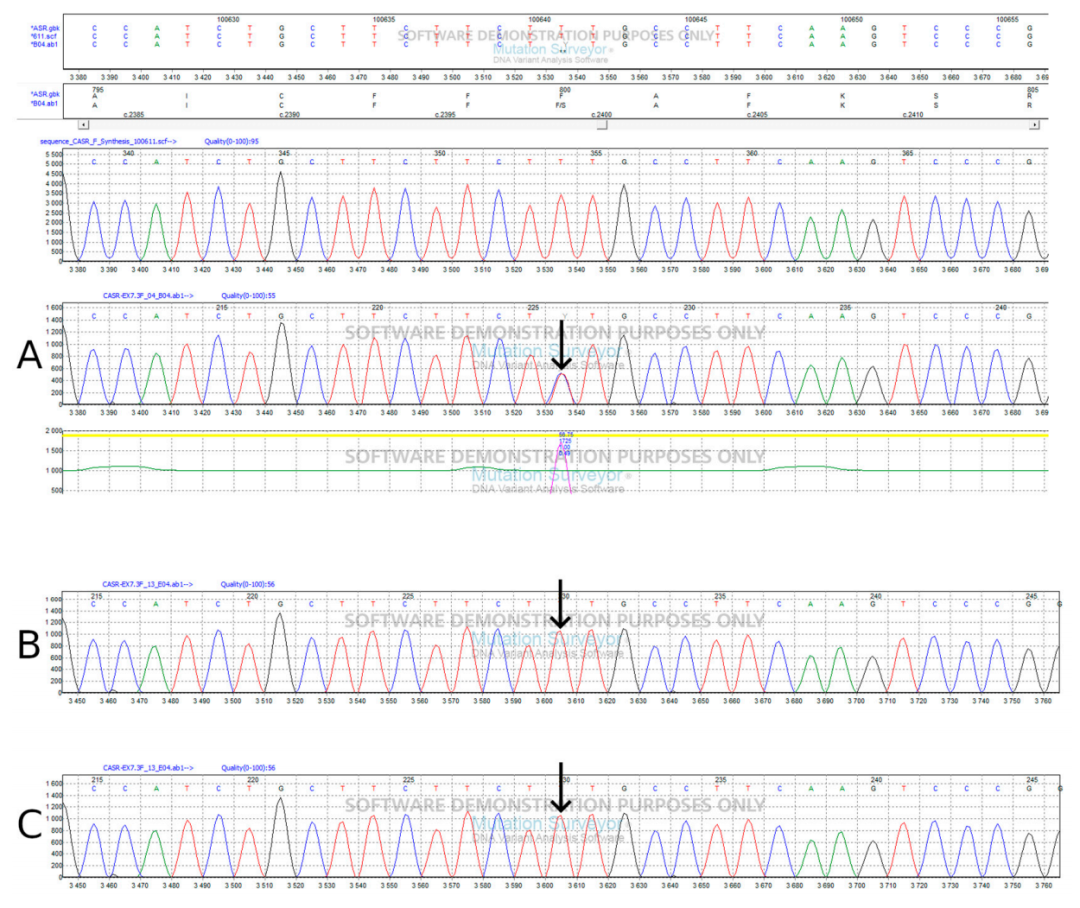
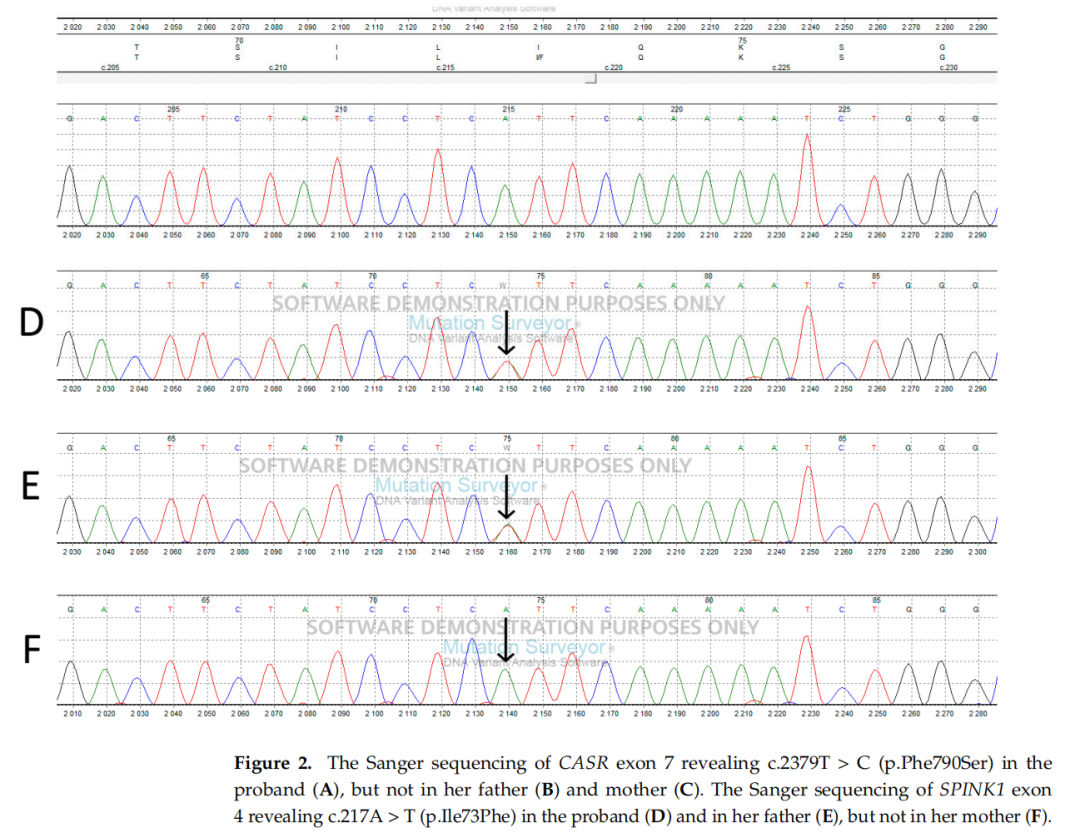
▲图2 CASR基因的sanger测序结果
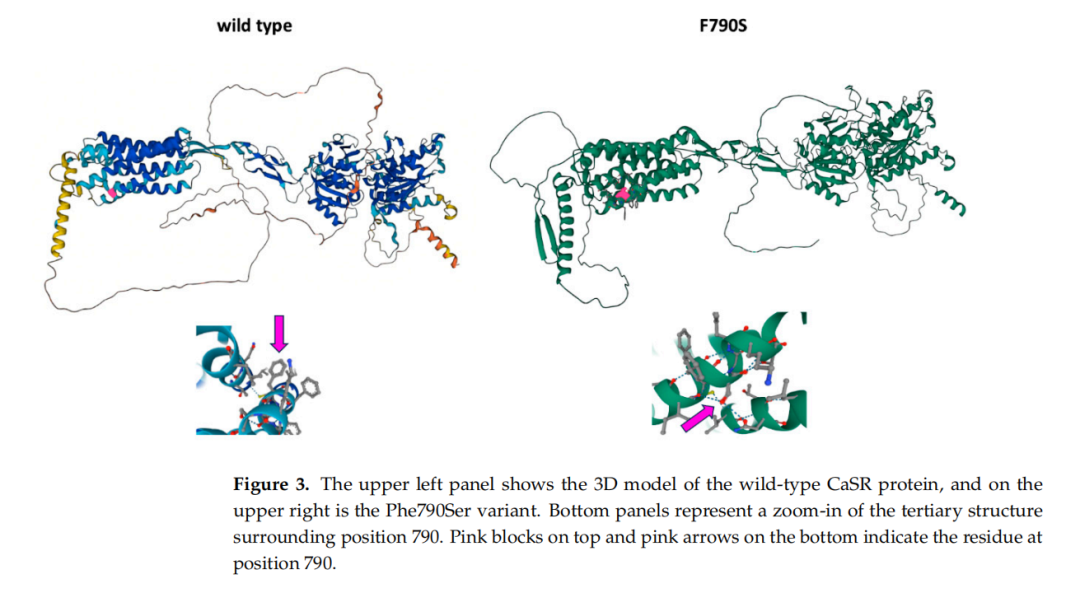
▲图3 左上图为野生型CaSR蛋白的3D模型,右上图为Phe790Ser变体
讨 论
本文报告了对一名胰腺炎女性患者进行的遗传学研究。通过结合分子遗传学检测和计算机模拟致病性预测,研究人员发现先证者携带分别遗传自父亲和母亲的SPINK1与CFTR基因错义变异,以及一个新发的CaSR基因错义变异。
已发现一组CFTR变异与慢性胰腺炎存在统计学显著关联。具体而言,p.Arg117His和p.Leu967Ser变异在病例组中的出现频率显著高于对照组;而p.Arg74Gln、p.Arg75Gln、p.Arg170His、p.Asp1152His、p.Ser1235Arg、p.Asp1270Asn和p.Leu997Phe变异由于相对罕见,单独分析时未发现与慢性胰腺炎存在统计学显著关联。然而,尽管汇总分析显示轻度关联,Berke及其同事指出,在获得更多数据之前,无法确定单个变异的具体作用。事实上,尽管p.Leu997Phe纯合子不会产生任何临床症状,但如果它与另一个已知致病变异形成复合杂合子,则可能促成CFTR相关疾病的发生。因此研究人员推测,虽然p.Leu997Phe突变本身可能不足以导致疾病,但它很可能与其他遗传因素协同作用,增加囊性纤维化相关疾病和胰腺炎的风险。
SPINK1与CFTR变异的共遗传已在早发性慢性胰腺炎或复发性急性胰腺炎患者中被发现。对胰腺炎患者的遗传学研究表明,CFTR的p.Arg75Gln变异与SPINK1的p.Asn34Ser和p.Pro55Ser变异共同作用时,会导致碳酸氢盐传导选择性缺陷并增加胰腺炎风险。
与CFTR突变类似,CaSR变异对胰腺炎风险的确切贡献仍存在争议,尽管已有研究表明这些变异可能损害钙感知并导致导管内Ca²⁺水平升高。近期文献研究报道,常见的CaSR变异不会改变慢性胰腺炎(CP)的发病风险,不应被视为胰腺炎患者遗传风险的原因。相反,本研究患者携带的p.Phe790Ser是一种新发CaSR变异,被归类为可能致病性变异,且其与上述两种变异(CFTR的p.Leu997Phe和SPINK1的p.Ile73Phe)的相互作用强烈提示胰腺表型的发生。CaSR基因的杂合失活变异可导致家族性低尿钙性高钙血症(FHH),这是一种常染色体显性遗传病,特征为血清钙升高和尿钙排泄减少。在少数FHH患者中,已发现SPINK1与CaSR变异的反式杂合性。CaSR变异似乎对胰腺没有直接的局部作用;事实上,FHH相关的胰腺炎可能是由高钙血症引起的,而高钙血症是众所周知的胰腺炎危险因素。
结 论
基于这些观察结果,本文患者携带的CaSR基因新发变异不太可能单独导致表型。重要的是,本文患者从健康母亲处遗传了CFTR变异,从健康父亲处遗传了SPINK1变异。综合来看,这些数据表明这三种变异的组合可能促成了该患者胰腺炎的发生。总之,IPAT通路基因的分析在识别胰腺炎遗传风险因素中发挥重要作用。这对儿童患者具有重要意义,早期诊断可指导特定的医疗干预,对患者的健康和生活质量产生积极影响。这三个已描述基因(CaSR、CFTR和SPINK1)共同参与同一通路,此现象此前从未被共同报道过,这通过反式杂合性机制支持了它们在该患者中的致病作用。需要进一步研究以揭示它们的相互作用,功能研究将阐明它们的作用方式,尤其是突变的CaSR蛋白。
参考文献:
Bontempo, P.; Surace, C.; Menale, L.; Alicata, C.; D’Elia, G.; Tomaiuolo, A.C.; Minervino, D.; Lorefice, E.; Novelli, A. A De Novo CaSR Missense Variant in Combination with Two Inherited Missense Variants in CFTR and SPINK1 Detected in a Patient with Chronic Pancreatitis. Biomedicines 2024, 12, 1278. https://doi.org/10.3390/biomedicines12061278


