《肺腺癌原发灶与肺内转移灶的病理及分子鉴别:IASLC的共识建议》解读
时间:2025-09-01 12:11:01 热度:37.1℃ 作者:网络
摘 要
临床实践中,多发性肺肿瘤结节的诊断率显著上升。在多发性肺肿瘤结节中,区分独立的原发性肺腺癌和肺内转移瘤对患者的分期、治疗和预后至关重要。《肺腺癌原发灶与肺内转移灶的病理及分子鉴别:IASLC的共识建议》强调了病理学和分子学在诊断及鉴别原发性肺腺癌与肺内转移灶中的重要性,并提出了结合组织学和分子学诊断的四步分类评估法,为临床医师提供了更准确的指导肺腺癌分期、治疗和预后的诊断工具。本文结合国内外研究现状,对该共识建议进行深入解读。
正 文
随着低剂量计算机断层扫描(computed tomography,CT)在高危人群中的广泛应用,以及高分辨率CT和正电子发射计算机断层扫描(positron emission tomography-computed tomography,PET-CT)的可及性增加,多发性肺肿瘤结节(multiple pulmonary tumor nodules,MPTN)在临床实践中的诊断率显著上升[1]。肺结节患者中MPTN的发病率在0.2%~14%之间,发病率差异范围较大可能归因于研究设计、人群特征(如年龄、性别、吸烟史等)以及诊断标准的不同[2-4]。在MPTN中,区分独立的原发性肺癌(separate primary lung carcinomas,SPLCs)和肺内转移瘤(intrapulmonary metastases,IPMs)对于患者的分期、治疗和预后至关重要。此外,MPTN还需与其他部位的转移性病灶以及良性或感染性病变进行鉴别。《肺腺癌原发灶与肺内转移灶的病理及分子鉴别:IASLC的共识建议》[5](以下简称“共识建议”)由国际肺癌病理研究委员会(International Association for the Study of Lung Cancer Pathology Committee,IASLC)牵头制定,基于系统性文献回顾和专家讨论,最终达成共识。该共识强调了病理学和分子学在诊断及鉴别SPLCs与IPMs中的重要性,并提出了结合组织学和分子学诊断的四步分类评估法,为临床医师提供了更准确的指导肺腺癌分期、治疗和预后的诊断工具。本文结合国内外研究现状,对IASLC提出的共识建议进行深入解读。
1 多发性肺肿瘤结节的分类
1.1 异时性与同步性及SPLCs与IPMs的区分
确定MPTN是同时性(synchronous)还是异时性(metachronous)往往具有挑战性。1975年,Martini和Melamed[6]提出了首个广泛应用的MPTN分类标准,该标准基于临床与病理数据的综合分析,涵盖了肿瘤的解剖位置、组织学类型、是否存在淋巴管浸润、原位癌成分及全身转移等因素。对于异时性多发结节,还纳入了肿瘤间的时间间隔指标,若间隔时间≥2年则支持多原发性结节的诊断。随着Martini-Melamed标准在临床应用中的局限性逐渐显现,近年研究主要基于肿瘤组织病理学及分子特征的相似或差异程度,致力于完善MPTN的分类体系。这些特征可表现为定性指标(如特定生长模式或标志物的存在与否)、定量指标(如不同生长模式占比或标志物的匹配百分比)或两者的组合。2009年,Girard等[7]提出综合性组织学评估方法,通过比较肿瘤间主要与次要组织学亚型,并结合细胞学及间质特征,以鉴别SPLCs与IPMs。除病理特征对比外,诸多研究还运用了多种分子或基因组学技术深入解析MPTN的关联性,其方法涵盖了从单一基因(如TP53)检测到基于二代测序技术(next-generation sequencing,NGS)的全基因组分析。
1.2 MPTN对临床分期和管理的影响
对于肺部表现为MPTN的病例,需考虑以下3种临床情形:首先为异时性(不同结节发生时间间隔≥2年)与同时性(不同结节发生时间间隔≤2年)SPLCs;其次为IPMs;最后为其他器官转移性病灶。同时还可能存在多种情形的复合型病例。若病灶为肺外器官转移所致,则治疗方案取决于原发部位。在排除其他器官转移可能后,鉴别SPLCs与IPMs对肿瘤分期至关重要。对于同时性SPLCs,分期依据最高T分期参数确定;而异时性SPLCs则需对各原发灶分别进行分期。根据目前公认且广泛应用的美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第八版以及于2025年1月1日正式实施的第九版分期建议,若病灶属IPMs,其分期归为T3期(同一肺叶内单发或多发转移瘤)、T4期(同侧不同叶单发或多发转移瘤)或M1期(对侧叶单发或多发转移瘤),对应ⅡB期或更晚分期,需采取差异化治疗策略[8]。除其他临床因素外,精准分期对制定最佳治疗方案具有决定性意义。然而,仅凭影像学表现与临床特征通常难以明确区分异时性或同时性SPLCs与IPMs。
1.3 MPTN的临床表现
IASLC于2016年发布了关于MPTN的鉴别、分类及分期标准化建议。该建议提出将MPTN划分为4类:(1)异时性或同时性SPLCs,(2)IPMs,(3)多灶性磨玻璃腺癌,(4)肺炎型腺癌,以期更精准地反映预后特征[9-11]。下文将基于临床与分期视角,结合IASLC最新补充的细化标准,系统阐述上述4类MPTN的临床特征及分期原则。
1.3.1 SPLCs
此类肿瘤彼此独立发生,互无关联。若两处病灶表现为不同的组织学亚型(如腺癌与鳞状细胞癌),诊断通常较为明确。对于不同病灶呈现相同组织学亚型的情况,需通过全面病理学评估以明确诊断(见2.2部分)。从临床角度,同时性SPLCs患者的预后通常取决于分期最高的肿瘤。各病灶应单独标注其T、N、M分期,并采用独立的T、N、M分期进行描述。
1.3.2 IPMs
IPMs影像学表现通常为实性、无磨玻璃样或部分实性成分的孤立性肺结节,并根据其临床特征进行分期。若病灶位于同侧肺叶内,应分期为T3期;若分布于同侧不同肺叶,则分期为T4期;若累及双侧肺叶,则归类为M1a期。SPLCs与IPMs的鉴别诊断高度依赖于系统的组织学评估,但两者亦可表现出不同的临床与影像学特征[12]。在此类病例中,除组织学评估外,还需结合分子检测以提高SPLCs与IPMs鉴别的准确性[13]。
1.3.3 多灶性磨玻璃腺癌
此类肿瘤属于SPLCs的亚型,其定义为胸部CT显示存在至少两个纯磨玻璃或部分实性结节。该类型在女性中更为常见,且无吸烟史人群中,该类型患病率显著高于普通肺腺癌。尽管多灶性磨玻璃特征腺癌患者后续新发病灶的风险较高,但其总体预后更佳,淋巴结转移及全身播散发生率较低[9]。尽管其发生机制仍存争议,目前学界将其归类为SPLCs,并依据T分期最高的病灶进行T分类(病灶数量标注于T分期后的括号内)。分期不受结节分布位置影响(如多发病灶位于同侧或对侧肺叶)。
1.3.4 肺炎型腺癌(侵袭性黏液腺癌)
肺炎型腺癌是肺腺癌的一种亚型,占肺腺癌的3%~10%,其多发生于肺外周,肺炎型肺腺癌在CT影像中通常表现为类似肺炎的斑片状实变或磨玻璃影,组织病理学上多对应为浸润性黏液腺癌(invasive mucinous adenocarcinoma,IMA)[14]。IMA通常以贴壁生长模式为主,病灶周围黏液内常可见大量游离的肿瘤细胞岛,这些结构被认为是IMA通过气道播散或黏液迁移导致肺内播散的重要原因[15]。与非黏液性腺癌相比,IMA患者较少出现淋巴结转移或远处转移,但肿瘤可广泛累及肺部多个区域,呈融合性或散在分布,常累及不同肺叶甚至对侧肺。与非黏液性腺癌的多灶性磨玻璃结节多提示SPLCs不同,IMA的多灶性病变多提示肺内转移性病变[9]。近期的分子研究支持了这一观点,IMA不同肺结节间常存在一致的遗传学异常,如共同存在KRAS突变及NRG1融合,而这与IMA独特的基因组改变特征一致,即KRAS突变、NRG1融合以及缺乏EGFR突变[16-19]。IMA的分期需综合评估病变范围:T分期需依据单发病灶的大小(对于黏液腺癌需同时包含鳞状细胞成分及浸润性成分);若单一肺叶完全实变则为T3期,同侧多肺叶受累则为T4期,若累及双侧至少两个肺叶则归类为M1a期。值得注意的是,相较于以磨玻璃影为特征的多灶性磨玻璃腺癌,肺炎型腺癌的预后更差,这可能与其更广泛的肺内播散及手术切除难度增加相关[20]。IMA术后复发最常见于肺部,即使完全切除后仍可能复发[21],且肺内复发可在完全手术切除后间隔长达12年出现,进一步提示其存在独特的生物学潜伏性。
2 多发性肺肿瘤结节的诊断
2.1 影像学诊断
共识建议指出,在存在单一较大原发性肺癌的情况下,若表现为外周肺野及下叶多发小圆形实性结节,则高度提示为IPMs[9]。然而,多发性双侧同时性肺腺癌亦非罕见,尤其当影像表现为多发性双侧磨玻璃结节或大小相近的亚实性结节,且无明确纵隔或肺门淋巴结肿大时[22-23]。此类病变可能对应于伴随原位腺癌、微浸润性腺癌存在的贴壁样生长型腺癌,或同侧肺叶及双侧不同肺叶独立发生的贴壁生长为主型肺腺癌[24]。就临床TNM分期而言,尽管磨玻璃成分对整体评估和治疗决策具有重要意义,且需记录包含磨玻璃成分的结节最大径线,但T分期的判定仅依据实性成分的最大径线[25]。值得注意的是,即便体积较小、生长缓慢的磨玻璃结节仍可能表征肺腺癌。研究显示,在初始尺寸<6 mm的多发磨玻璃结节患者中,95%的结节在8.5年间平均增长3.2 mm。因此,即使磨玻璃结节<6 mm且5年内保持稳定,当随访期间出现新发实性成分时,应需予以高度重视[26]。
2.2 病理学诊断
共识建议指出,在手术切除的肺腺癌中,组织病理学特征是最常用于区分SPLCs与IPMs的标准。现行AJCC分期系统建议在评估多发性肺腺癌的病理特征时采用全面组织学评估[9]。根据组织学亚型及适用条件下的细胞学特征,肿瘤可被归类为SPLCs或IPMs(图1)。若影像学表现为多发磨玻璃样结节且组织学对应非黏液性原位腺癌、微浸润性腺癌或贴壁为主型肺腺癌,则应视为独立原发灶,结合临床背景、特定组织学特征及分子检测结果有助于更精准的肿瘤分期[22]。
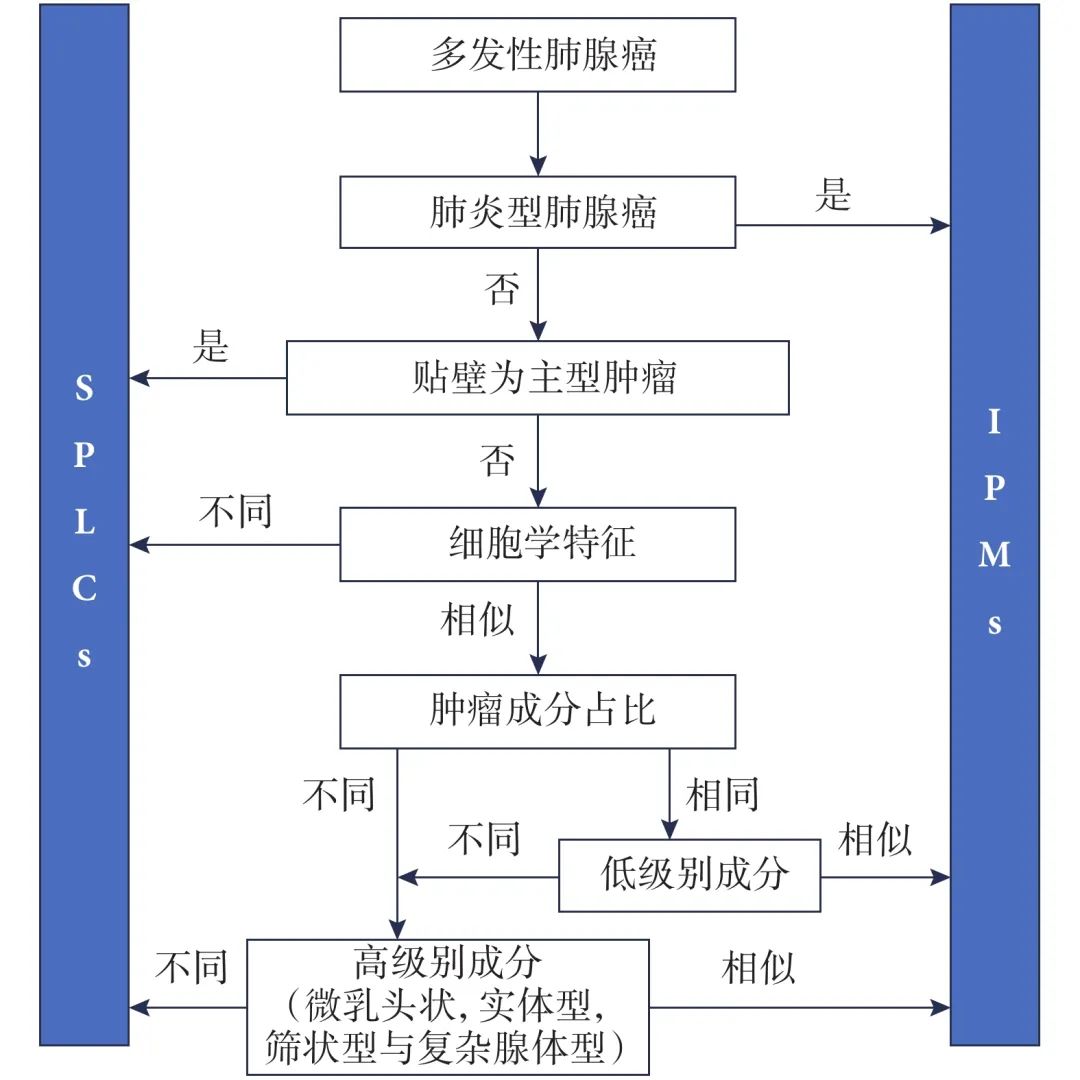
图1 用于确定MPTN病灶间克隆性关系的组织学评估方法
对于未归入上述分类的多发性非黏液性腺癌的诊断,共识建议指出,肺腺癌的全面组织学亚型分析仍是区分SPLCs与IPMs的主要方法,且AJCC第七版和第八版分期指南均纳入了全面的组织学评估原则,其组织学判定与分子检测结果的一致性可达91%[7]。但Chang等[13]的研究显示,仍有约22%的肿瘤存在组织学与NGS分类的矛盾,且IPMs的不一致率显著高于SPLCs。共识建议特别提到,在部分IPMs病例中,NGS判定为IPMs的肿瘤中非贴壁生长为主型的存在挑战了当前将“贴壁型生长模式等同于原发性肿瘤”的理论。因此,共识建议强调,组织学进展(如实体/微乳头成分比例增加)可能与SPLCs相关,但少数IPMs病例中亦可出现,可能干扰鉴别诊断[27]。尽管大多数IPMs仍保持相似的组织学特征,但少数病例的进展性改变可能限制全面组织学分析对SPLCs与IPMs的鉴别效能。观察者间的差异也可导致同一病例的不同诊断[28]。因此,尽管全面组织学评估在多数情况下是区分SPLCs与IPMs的有效工具,但由于其存在局限性,分子分析(尤其是NGS检测)成为鉴别SPLCs与IPMs的公认标准。
2.3 分子学诊断
过去数十年间,多项分子分析技术被用于鉴别SPLCs与IPMs,包括DNA微卫星分析、阵列比较基因组杂交(array comparative genomic hybridization,aCGH)、TP53检测及致癌驱动基因突变检测。近年来,基于多基因组合的NGS技术(又称为“高通量测序技术”)亦被应用于此领域。
2.3.1 杂合性缺失分析(loss of heterozygosity,LOH)
LOH分析依赖于人群中的多态性遗传标记。早期LOH分析主要通过DNA微卫星分析,其通过形态学与分子分析的对比,揭示形态相似的多发性肺腺癌中存在基因型谱的一致性与非一致性现象[29-30]。非一致性基因型谱常提示SPLCs。LOH分析中,一致性的缺失提示IPMs,但无法完全证实[31],因为特定染色体区域的变异在肺癌中发生率较高[32]。因此,共识建议指出,LOH非一致性可作为SPLC的可靠诊断依据,而一致性LOH仍存在分类不确定性。目前,LOH分析在临床实践中应用较少,多倾向于采用NGS等更先进技术。
2.3.2 aCGH
aCGH通过共杂交差异标记的肿瘤与正常DNA,实现全基因组染色体拷贝数变化的分析。染色体轴上的标记比值可定位基因组范围内的扩增与缺失[33]。共识建议指出,对于同时性肿瘤,aCGH的高一致性提示IPMs。然而,与LOH类似,肺癌中特定染色体区域的变异发生率较高,因此需更关注低变异率区域的拷贝数差异,此类差异低一致性为SPLCs的强提示指标[34]。
2.3.3 基因组断点
为区分SPLCs与转移癌,研究者[35]采用双末端测序及3 Kb跨域测序以提高基因组断点检出率。值得注意的是,体细胞断点具有患者特异性,而共享重排仅见于转移灶。尽管此技术在肺癌原发与转移的鉴别中前景广阔,但目前仍需冷冻组织样本,这限制了其临床常规应用。
2.3.4 基因突变分析
共识建议指出,当多处肺肿瘤中仅单肿瘤出现基因突变或存在不同突变,则支持SPLCs的诊断;当多处肺肿瘤存在相同的基因突变时,则支持IPMs的诊断。EGFR、KRAS、BRAF、CDKN2A及TP53突变在原发灶与转移灶间具有高度一致性[36]。Yatabe等[37]通过高灵敏度方法证实,EGFR突变在瘤内空间异质性分布极为罕见。这一发现支持以下假说:在未知关联的肿瘤间检测到相同突变时,尤其当该突变为驱动基因突变时,则提示克隆相关性(即原发灶-转移灶关系)。
此外,共识建议指出,还需要结合突变的人群流行率进行综合考量。例如,KRAS与EGFR基因热点突变在人群中普遍存在。但在西方国家,KRAS突变占比约26%,而亚洲国家KRAS突变率仅为12%,且二者热点突变基因的分布也存在差异[38]。EGFR突变在亚洲与欧洲人群中的流行率分别约为49%和13%,其中外显子19缺失在亚洲与欧洲病例中分别占49%和48%,而外显子21 L858R置换突变分别占41%和30%[39]。
共识建议还提到,“区域癌化效应”也是鉴别诊断需要考量的重要因素。该概念强调肺部多肿瘤在发生前,全肺暴露于经患者遗传特异性代谢酶活化后的致癌原中,这可能导致同一“癌化区域”内不同癌灶携带相同突变[40-41]。因此,基于人群水平的特定驱动突变流行率可能低估个体内突变概率。若同一患者两处肺腺癌中发现相同热点突变,可能源于暴露模式与突变流行率的叠加,而非克隆关系的绝对证据。
综上所述,多种分子学证据表明,患者体内两处肿瘤的驱动突变非一致性可明确支持SPLCs的诊断。尽管相同驱动突变提示IPMs可能性较高,但在热点突变高流行率背景下,仍不能排除SPLCs的可能性。采用靶向NGS技术扩大基因组合分析范围可显著提升克隆关系判定的准确性,以提升分子学分析技术的临床应用价值。
2.4 组织学评估与分子分析之间的相关性
共识建议指出,鉴于肺腺癌的瘤内异质性、肿瘤去分化及接受治疗可导致显著形态学改变等因素,采用“综合组织学评估”鉴别SPLCs与IPMs的方法存在一定局限性,以比较突变分析(comparative mutational analysis)为主的分子分析方法已成为评估多癌灶克隆相关性的有效可靠手段。以分子分析为诊断的金标准,组织学诊断IPMs的一致性率为29%~86%(均值54%),而诊断SPLCs的一致性率达80%~100%(均值84%),提示组织学预测的准确性因具体临床背景、检测方法及肺癌类型的不同存在显著差异。异时性肺结节的一致性率(71%)略高于同时性肺结节(66%)[42]。此外,Yang等[43]的最新研究表明,当3位病理学家达成诊断共识时,组织病理学预测与分子分析的一致性可达100%;而未达成共识时,该一致性率降至53.3%。这一发现强调了同行评议在SPLCs与IPMs组织病理学诊断中的潜在价值。
2.5 四步分类评估诊断方法
根据现有的文献证据,共识建议提出并构建了一种结合组织学与分子学特征的四步分类评估诊断方法用于鉴别SPLCs与IPMs(图2)。第一步,在特定组织学类型(如原位腺癌、微浸润腺癌、贴壁型为主的腺癌或黏液腺癌)中,单纯组织学评估即可明确SPLCs或IPMs诊断。但对于多发性肺黏液腺癌病例,若存在不同病灶间存在显著异质性组织学特征,则需进一步通过分子检测鉴定是否存在独特驱动基因突变以明确诊断。第二步,对于组织学分类无法明确诊断的肿瘤,共识建议推荐通过同行评议进行更为全面的组织学评估。第三步,若同行评议的组织学评估仍未达成一致,则需开展驱动基因(如KRAS、EGFR、ALK等)突变检测,若检测到不同驱动基因突变则可诊断为SPLCs。第四步,对于简单分子分析显示相同驱动基因突变或未检出突变的病例,则需采用大规模NGS测序组合、全外显子组测序或全基因组测序等高通量分子检测技术进一步分析。若肿瘤存在一个或多个除驱动基因突变以外的共有体细胞突变,则诊断为IPMs。但需要注意的是,若TP53突变状态不同,则更倾向于诊断为SPLCs。
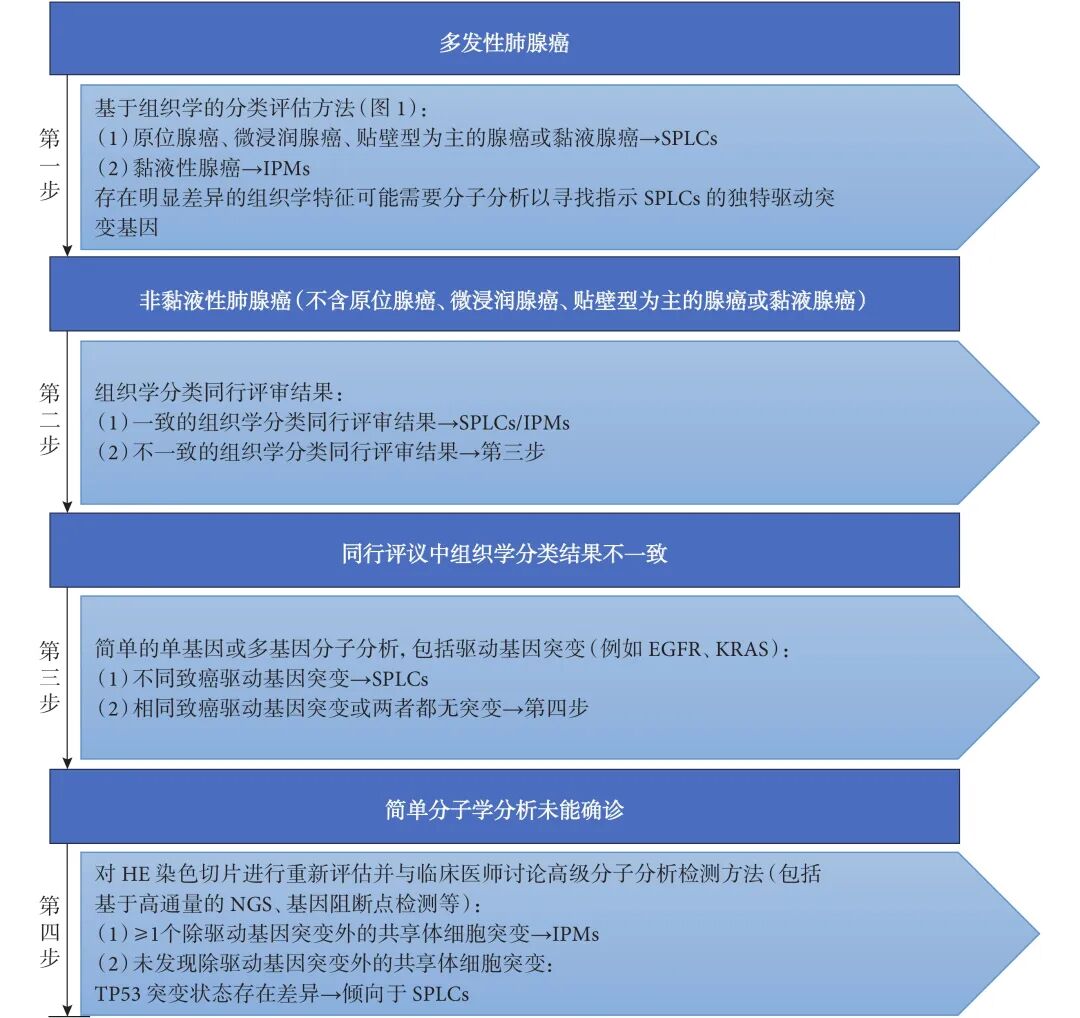
图2 结合组织学和分子学特征的四步分类评估诊断方法
3 异时性与同时性原发性肺癌的治疗
共识建议指出,根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南,手术是同时性或异时性SPLCs的标准治疗方式。而对于双侧同时性SPLCs,扩大手术切除范围(如肺叶或全肺切除)可能改善长期预后,尤其是当肿瘤分布在不同肺叶且无明确转移证据时,需结合肿瘤位置、患者肺功能、病理分期及分别评估各病灶的恶性程度制定个体化手术方案。对于无法手术的早期病灶,立体定向体部放疗可作为替代治疗方案,尤其适用于单个转移灶的局部控制[44-45]。对于局部晚期患者,若一个或多个SPLCs病灶分期为ⅠB~Ⅲ期,可考虑给予辅助化疗(NCCN指南推荐Ⅱ~ⅢA期)、奥希替尼[46](ⅠB~ⅢA期联合EGFR突变)或辅助化疗后联合阿替利珠单抗[47]免疫治疗[Ⅱ~ⅢA期联合程序性死亡受体配体1(programmed death-ligand 1,PD-L1)肿瘤比例评分≥1%]。然而,目前尚无随机临床试验指导SPLCs的辅助治疗决策,且同一患者不同肿瘤对特定治疗的生物学反应可能存在异质性,高肿瘤突变负荷或PD-L1阳性患者更可能从免疫检查点抑制剂靶向治疗中获益[48-49],故辅助治疗需个体化评估。值得注意的是,同步放化疗联合免疫治疗已被证明可显著延长患者的生存期[50]。对于异时性SPLCs患者,首次肺癌根治术后需密切监测第二原发癌的发生,尤其是吸烟或EGFR突变患者。研究[51-52]表明,EGFR突变患者可能因克隆演化出现异时性肿瘤,更需定期影像学筛查。对于复发的寡转移病灶,射频消融术联合褪黑素可改善局部控制,减少手术创伤[53]。全身治疗(包括化疗、免疫治疗、靶向治疗)在SPLCs患者的治疗中占据重要地位,铂类化疗联合免疫治疗(如帕博利珠单抗)在晚期患者中显示出协同效应,尤其在PD-L1高表达人群中。对于携带EGFR或ALK等驱动基因突变的患者,靶向治疗可显著延长生存期[54-55]。此外,共识建议特别提到,同时性SPLCs患者手术切除后的生存率与同分期单发肺癌无显著差异[56]。对于SPLCs患者,术后总体生存的最佳预测因素仍是TNM分期,其中淋巴结转移与死亡率增加显著相关[57-58]。由于缺乏大样本的队列研究及终止随访的转归不一致,同时性与异时性SPLCs的预后差异尚存争议。但Meta分析[59]提示,同时性SPLCs患者的总生存期可能短于异时性SPLCs患者,可能与同时性SPLCs病灶多、侵袭性较强有关。
4 总结与展望
综上所述,尽管系统性组织学评估可有效鉴别SPLCs与IPMs,但分子特征分析,尤其是基于高通量的NGS技术,在多数病例中可能具有更高的鉴别效能。因此,共识建议指出,在医疗条件允许的情况下,结合组织学评估与大规模NGS基因组分析的整合性诊断策略,即结合组织学和分子学特征的四步分类评估诊断方法应被视为区分SPLCs与IPMs的“标准诊疗流程”,尽管该方案对医疗资源配置要求较高。目前,单基因检测在鉴别SPLCs与IPMs中的诊断效能有限,明确诊断所需的最小基因检测组合仍待阐明。未来整合数字病理学与机器学习技术的创新方法有望发展为高效的诊断工具,为SPLCs与IPMs的精准鉴别提供新途径。
利益冲突:无。
作者贡献:卢潇负责数据整理与分析,论文初稿撰写、审阅与修改;李宁和耿庆负责论文设计、审阅与修改。


