神经内分泌肿瘤核医学精准诊疗临床指南(2025版)
时间:2025-09-01 12:11:04 热度:37.1℃ 作者:网络
神经内分泌肿瘤(NENs)是一组起源于神经内分泌细胞的肿瘤,全身广泛分布,具有高度异质性。多数NENs高表达生长抑素受体(SSTR)等共性靶点,部分表达胰高血糖素样肽-1受体(GLP-1R)等个性特征靶点[1-3]。国际上,利用放射性核素标记生长抑素类似物(SSA)作为显像剂,通过SSTR显像诊断和评估NENs已有30余年历史[3],早期采用111In或99mTc标记SSA进行全身扫描和单光子发射计算机断层显像(SPECT),随后发展为采用68Ga或64Cu标记SSA进行正电子发射断层显像(PET)等分子影像技术。
在治疗方面,基于“多肽-受体”的放射性核素治疗( PRRT)用于NENs已有20余年[3],使用的治疗性核素包括发射β射线的90Y、177Lu、161Tb及发射α射线的225Ac、213Bi等。近年来,针对部分NENs儿茶酚胺合成增加、GLP-1R或趋化因子受体4(CXCR4)高表达等的个性化靶向诊疗研究也非常活跃。目前,一系列用于NENs精准诊疗的放射性新药已在欧美等国家获批上市。针对NENs分子影像及核素治疗的主要靶点和相关药物详见表1。
表1 神经内分泌肿瘤分子影像及核素治疗的主要靶点和药物
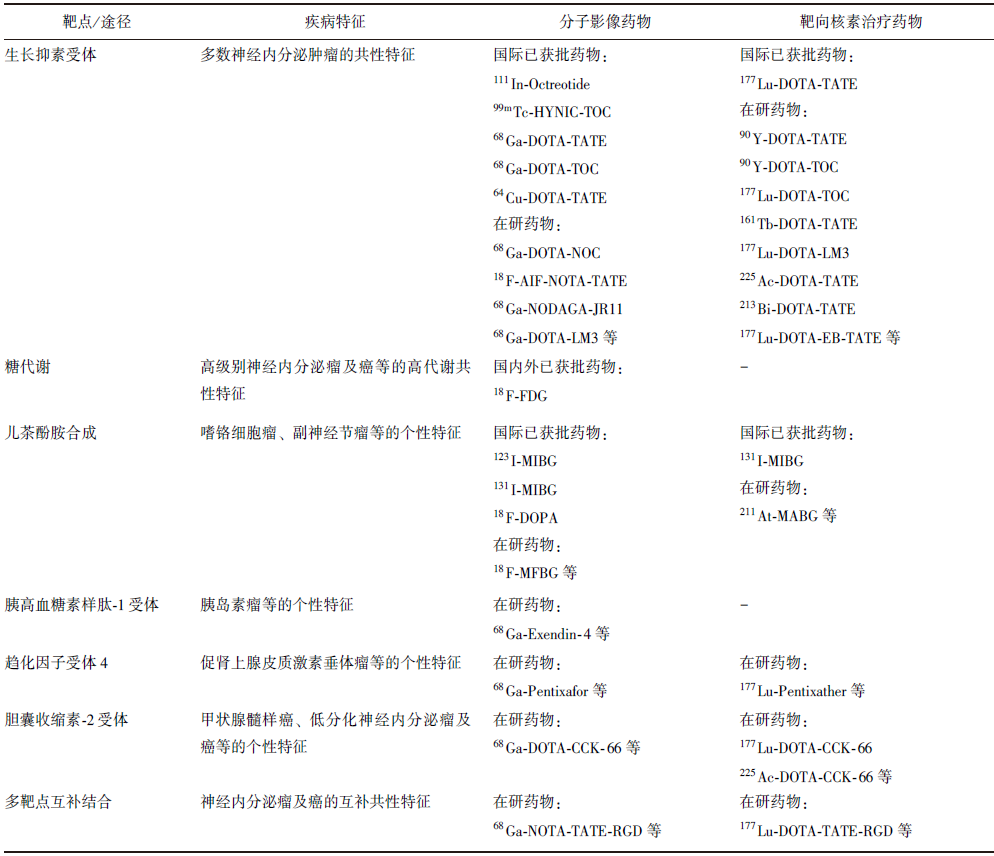
在我国,针对NENs的SSTR显像及靶向核素治疗临床研究已取得显著进展。1996年首次开展111In-奥曲肽显像临床研究,2001年建立了99mTc-HYNIC-TOC SPECT显像技术并在部分医院作为院内制剂应用于临床,2003年开始探索90Y-DOTA-TATE靶向治疗,2012年启动68Ga-DOTA-TATE PET/CT显像研究,2017年引入177Lu-DOTA-TATE治疗技术,同时国际上首次对改进药代动力学的177Lu-DOTA-EB-TATE开展临床转化研究[4-8]。
近年来,针对NENs不同分子靶点的新型放射性药物研究蓬勃发展,我国相关临床研究向国际先进水平迈进。2016年以来,中华医学会核医学分会成立68Ga/177Lu精准诊疗工作委员会,积极推进核医学精准诊疗技术在我国的临床转化与应用。目前,国际先进的核医学精准诊疗药物即将进入中国市场,国内企业自主研发的同类创新药物也已进入临床试验阶段。
基于此,中华医学会核医学分会联合中国医疗保健国际交流促进会神经内分泌肿瘤分会组织相关领域专家,在系统梳理国际最新研究进展和指南的基础上,并结合我国临床实践特点,制定了《神经内分泌肿瘤核医学精准诊疗临床指南(2025版)》,旨在指导我国NENs核医学精准诊疗的规范化应用。
1 指南制订方法
本指南受中华医学会核医学分会和中国医疗保健国际交流促进会神经内分泌肿瘤分会委托与指导,由中华医学会核医学分会 68Ga/177Lu精准诊疗工作委员会发起和推进,联合我国开展相关精准诊疗研究和应用的20家主要单位,由核医学、肿瘤内科、胰胃外科、肝胆外科、放射性药物和研究方法学等学科的26位专家(其中25位为高级职称,1位为副高级职称)共同研讨制定。
遵循国际实践指南报告规范(RIGHT),结合中国国情和相关政策法规,参考国际国内相关指南,执笔人系统梳理了NENs核医学精准诊疗的12个关键问题,通过专家组多轮咨询和讨论,最终确定21条推荐意见。秘书组根据最终确认的主要问题,进行多轮、多源中英文数据库及网络检索,包括PubMed、Embase、Clinicaltrials.gov、Cochrane Library、Web of Science、中国知网、万方数据知识服务平台、维普资讯网、核医学相关学会网站(snmmi.org和eanm.org),以及我国药品监督部门等相关管理机构网站(nmpa. gov.cn和cde.org.cn)。
参考分级的评估、制订与评价系统(GRADE)和牛津循证医学中心临床证据分级与推荐强度系统,证据纳入标准如下:
1类证据为经过验证的临床决策系统规则和高水平循证医学证据,包括我国相关政策法规、诊疗规范、临床路径和国际相关指南的强力推荐,以及设计严谨且结果一致的多中心随机对照试验或大样本队列研究;
2类证据为可靠性较高的前瞻性队列研究或病例对照研究等;其他等级证据暂不纳入本指南。推荐强度:A为专家组一致同意并强力推荐;B为专家组基本同意并中等推荐;其他推荐暂不纳入。
本指南于2022年2月正式启动(注册号:IPGRP-2022CN229),由指南执笔人向专家组成员陈述每条推荐意见,展示相关证据,阐明其质量等级。专家组成员对文献和证据进行确认,讨论形成最终意见。最后由执笔人撰写成文,并请所有专家修改完善。经专家组多轮反复研讨,题目和内容均有较大修改,遂于2025年6月重新注册(注册号:PREPARE-2025CN940),2025年7月定稿。指南适用于我国有条件开展NENs核医学精准诊疗的医疗机构,使用者为开展NENs诊疗的医务工作者,指南应用的目标人群包括NENs患者、可疑患者及高发人群等。
2 SSTR显像在NENs诊断中的临床应用
SSTR是一种G蛋白偶联受体家族糖蛋白,包含SSTR1~SSTR5 5种亚型,其中SSTR2又可分为SSTR2A和SSTR2B两种亚型。在NENs中表达最高的亚型为SSTR2、SSTR3和SSTR5[9]。目前,临床常用的显像剂主要为SSTR激动剂,如TATE(DOTA-TATE)、TOC(DOTA-TOC)等。近年来,以JR11、LM3为代表的拮抗剂类显像剂在研究中展现出良好的应用前景[10-12]。根据标记的放射性核素及显像设备的不同,SSTR显像主要分为采用111In和99mTc标记显像剂进行全身扫描及SPECT/CT显像,以及采用68Ga、18F、64Cu等标记显像剂进行 PET/CT或PET/MRI显像。
2.1 如何选择SSTR显像方法和显像剂?
推荐意见1
显像方法选择:SPECT/CT显像花费较低,可及性相对较高,可满足多数临床需求,可选择使用;PET/CT或PET/MRI目前花费较高,但空间分辨率、图像质量和定量准确性较佳,条件允许可选择使用。(证据等级:2;推荐强度:B)
推荐意见2
显像剂选择:SPECT/CT显像建议选择99mTc-奥曲肽等作为显像剂。PET/CT或PET/MRI可采用68Ga-DOTA-TATE或68Ga-DOTA-TOC等作为显像剂;利用68Ga标记JR11等SSTR拮抗剂进行显像,对肝脏等部位病变的检出具有优势,可根据需要选择使用;18F-AlF-NOTA-奥曲肽(或JR11)等制备虽相对复杂,但可及性更强,可选择使用。(证据等级:2;推荐强度:B)
推荐说明:我国SPECT/CT设备相对更普及,用于标记的99mTc也较易获得,因此虽有不足,但能满足90%以上的临床需求[13-14],适合作为临床常规检查。而PET/CT或PET/MRI设备成本和检查价格较高,68Ga可及性有限,但其在空间分辨率、图像质量和半定量分析准确性方面具有一定优势,系列68Ga标记SSA的PET显像已纳入欧美相关临床指南和临床常规应用[15-16],有条件时可选择使用。以上两种技术和相应显像剂,专家组根据我国目前发展现状,同等推荐。
在靶向SSTR的SPECT显像技术发展过程中,早期曾采用123I-奥曲肽(123I-Tyr3-Octreotide)等作为显像剂,但由于图像质量欠佳,其临床应用受到限制[17]。20世纪90年代,111In-奥曲肽(111In-DTPA-D-Phe1-Octreotide)因其更高的稳定性和显像效果逐渐成为主流,并被纳入相关临床指南[18-19]。
然而,111In的半衰期较长(2.83 d),且其γ射线能量较高(171 KeV),而99mTc的半衰期仅为6.02 h,γ射线能量适中(140 KeV),因此在临床中更为常用。至90年代末,随着99mTc-奥曲肽(99mTc-HYNIC-Tyr3-Octreotide)等新型显像剂的研发,SPECT显像的便捷性、图像质量和性价比得到进一步提升[20]。目前我国111In和123I均较难获得,而99mTc却方便可及,因此99mTc-奥曲肽是SSTR SPECT显像剂的最佳选择。
目前临床常用的SSTR PET显像剂包括68Ga-DOTA-TATE、68Ga-DOTA-TOC和68Ga-DOTA-NOC,均属于SSTR激动剂[21-22]。其中68Ga-DOTA-TATE主要对SSTR2有高亲合力,68Ga-DOTA-TOC不仅对SSTR2有较强亲合力,还对SSTR5有一定的亲合力,68Ga-DOTA-NOC对SSTR2和SSTR5均有较强亲合力,对SSTR3也有一定亲合力。尽管三者对NENs的检出效能存在差异,但总体诊断性能相近。
研究发现,SSTR拮抗剂68Ga-DOTA-JR11虽在绝对摄取量上低于激动剂,但其在肝脏等正常脏器中摄取更低,相对比值更高,有利于检出更多肝脏病灶,但对骨病灶的检出不如68Ga-DOTA-TATE[11]。
近年采用18F-AlF通过螯合剂NOTA连接,标记奥曲肽或JR11等新型显像剂也已获得了较好的初步结果,提示了优良的检出效能[10,23],但仍有待进一步优化和完善。
2.2 SSTR显像用于NENs诊断的适应证有哪些?
推荐意见3
在诊断方面,可用于具有NENs相关生化证据和临床症状,但常规影像学检查结果为阴性的患者;亦可用于疑似NENs但经皮或经内镜活检困难,需进一步评估病灶特征或寻找更适合活检的其他病灶的患者;对已确诊NENs转移的患者,可用于寻找原发灶。(证据等级:1;推荐强度:A)
推荐意见4
在分期方面,可用于病理已确诊的NENs首次分期,或用于对拟手术的NENs患者进行术前分期。(证据等级:1;推荐强度:A)
推荐意见5
在疗效评估方面,可用于SSTR高表达肿瘤的手术、介入治疗、靶向治疗、放疗、化疗等的疗效评估,以弥补常规影像学检查的不足。(证据等级:1;推荐强度:A)
推荐意见6
在复发监测方面,可用于临床或实验室提示进展患者的再分期,特别是在常规影像学检查结果为阴性时,或用于常规影像学检查发现新病变,但不确定是否为进展时的进一步评估。(证据等级:1;推荐强度:A)
推荐意见7
在预后判断方面,SSTR显像高摄取的NENs患者可从靶向SSTR的PRRT治疗或SSA治疗中获益更多;SSTR显像结果为阳性而18F-FDG显像结果为阴性提示预后更佳。(证据等级:1;推荐强度:A)
推荐说明:以上推荐意见主要参考国际相关指南[15-16,18-19,21-22]制定,专家组一致同意。
SSTR显像在NENs的诊断、分期、疗效评估、复发监测及预后判断等方面具有重要价值[15-19,21-22]。但SSTR高表达并非NENs的独有特征,乳腺癌、淋巴瘤、脑膜瘤等肿瘤均有不同程度的SSTR表达[1,17],部分炎性淋巴结、肉芽肿、前列腺增生和子宫肌瘤等良性病变也可表现为SSTR显像结果阳性,垂体、口咽部、胸腺等可能会有较高的生理性摄取[24]。因此,SSTR显像用于NENs诊断和分期时,需谨慎解释阳性发现,熟悉各种可能的非NENs导致的高摄取表现。
另一方面,并非所有的NENs肿瘤细胞均存在SSTR高表达。不同类型、不同个体,甚至同一肿瘤内都可能存在异质性[25],特别是靶向SSTR的PRRT治疗后,残存、复发的病灶往往SSTR表达明显降低[26]。虽然SSTR显像可用于评估受体高表达时NENs对治疗的反应,但需注意这一评估无法涵盖其中可能存在的SSTR低表达肿瘤细胞。因此,无论是疗效评估还是复发监测,SSTR显像都只是常规影像学检查的补充,目的是为了弥补其检出病灶和评价变化等方面的不足。
在选择最合适的患者接受PRRT或SSTR靶向治疗方面,SSTR显像可发挥关键作用[27]。该检查能够精准识别可能对治疗产生应答的病灶,因为只有摄取足够高的肿瘤,才有可能产生治疗反应。需特别注意的是,虽然SSTR高摄取是治疗反应的必要条件,但并非充分条件,不同个体间及病灶间的治疗敏感性仍存在显著差异。为提高患者选择的准确性,建议将SSTR显像与18F-FDG PET/CT联合应用,其更有助于筛选出适合靶向生长抑素进行核素治疗的患者,并更加可靠地预测治疗效果[28]。
2.3 如何判读SSTR显像?
推荐意见8
建议使用SSTR显像的报告和数据系统(SRI-RADS)进行分级判读。(证据等级:2;推荐强度:B)
推荐说明:国际上已提出了SSTR显像的报告和数据系统(RADS)分级标准(表2)[29-30],在以血池、肝脏摄取为界值,将摄取程度分为L1~L3的基础上,充分考虑好发部位和各种假阳性可能,专家组建议参照此标准进行分级判读。
表2 生长抑素受体显像的报告和数据系统分级

3 “多肽-受体”介导的NENs放射性核素治疗
PRRT是一种采用放射性核素标记多肽、针对特定受体的靶向治疗策略。其针对NENs的治疗原理是采用177Lu和225Ac等放射性核素标记SSA,通过其与NENs细胞表面高表达的SSTR特异性结合及内化,借助核素衰变发射的β或α射线诱导肿瘤细胞DNA损伤,从而实现选择性杀伤肿瘤细胞的目的。作为靶向放射性核素治疗的代表性技术,177Lu-DOTA-TATE已获得临床批准并广泛用于NENs治疗,鉴于其显著的应用潜力,多个国际权威学术组织制定了相关临床应用指南,以规范临床诊疗[31-34]。
3.1 如何选择PRRT的治疗性核素及靶向分子?
推荐意见9
治疗性核素选择:177Lu具有较优的物理性能,包括合适的β射线能量、半衰期和可用于显像的γ射线等,建议作为首选;90Y的β射线能量较高,可通过“旁观者效应”达到更大的杀伤效果,可用于治疗SSTR高表达的较大肿瘤;发射α射线的225Ac等具有更强的杀伤力,但目前获得成本高,在SSTR高表达而用177Lu和/或90Y标记的SSA治疗效果欠佳时,可进一步选择使用。(证据等级:1;推荐强度:A)
推荐意见10
靶向分子选择:为达到最佳治疗效果,核素标记的靶向多肽应在肿瘤中保持高摄取状态,而在正常组织和器官(特别是骨髓、肾脏等主要限制器官)中低摄取,且其药代动力学应与核素的半衰期相匹配。可选用177Lu或90Y标记DOTA-TATE或DOTA-TOC进行治疗(证据等级:1;推荐强度:A);DOTA-EB-TATE等优化药代动力学的多肽可减少放射性核素用量,效价比较高,亦推荐使用。(证据等级:2;推荐强度:B)
推荐说明:以上推荐意见主要参考国际相关指南和新的证据[31-40]制定,专家组一致同意。
目前应用最广泛的治疗性核素是177Lu,其半衰期为6.7 d,该核素既可发射γ射线用于显像定位,也可发射3种不同能量的β射线[497 KeV(78.6%)、384 KeV(9.1%)、176 KeV(12.2%)]用于治疗,组织穿透范围约为2.0 mm,且对肾脏、骨髓等重要脏器的副作用较小。另一种治疗性核素为90Y,其半衰期为64 h,只发射β射线,最大能量为2.27 MeV,组织穿透范围为2.5~11.0 mm,对体积较大的肿瘤疗效较好,但其对高摄取区周围正常组织或脏器(如肾脏、骨髓等)的副作用明显增加。
一项纳入1048例NENs患者的研究显示[35],联合应用90Y和177Lu治疗患者的总生存期和无进展生存期最长(66个月和24个月),其次是仅接受177Lu治疗的患者(44个月和17个月),而仅接受90Y治疗的患者最短(24个月和7个月)。225Ac是目前研究较多的发射α射线的核素,半衰期为9.9 d,能发射4种不同能量的α射线,能量范围为5.8~8.4 MeV,射程为47.0~85.0 μm。225Ac的长半衰期及产生多种α射线可能导致肾衰等副作用。
177Lu-DOTA-TATE的Ⅲ期临床试验表明[36-37],这一治疗对进展期、SSTR阳性、中肠来源的NENs具有较好疗效,其治疗后20个月的无进展生存率为65.2%(对照组为10.8%),治疗反应率为18%(对照组为3%),病死率为12.1%(14/116)[对照组为23.0%(26/113)],3级以上骨髓抑制率≤10%,无明确肾脏毒性,5年随访中位生存期为48.0个月(对照组为36.3个月) ,此外,177Lu /90Y标记的DOTA-TATE联合治疗可发挥更大作用[38]。177Lu /90Y标记DOTA-TOC治疗也获得了类似结果[39],但 177Lu-DOTA-NOC在全身正常组织中的分布显著较高[40],因此较少用于治疗,同时由于DOTA-TATE和DOTA-TOC在血液中清除快,大量放射性物质很快通过尿液排出,治疗效能低,放射性防护和废物处理的负担大,因此并非治疗药物的最佳选择。通过引入与血清白蛋白可逆结合的伊文思蓝(EB)等分子结构,177Lu-DOTA-EB-TATE在血液中滞留的时间延长,与肿瘤的SSTR结合显著增加,尽管骨髓和肾脏剂量有所增加,但可在不突破其剂量限值的情况下,用较小的剂量达到同样的治疗效果,从而减少药物成本,降低防护要求[5-8]。
3.2 PRRT的适应证和禁忌证有哪些?
推荐意见11
适应证:目前建议用于手术不能切除的经病理证实的晚期NENs,要求SSTR高表达(SSTR显像至少高于肝脏摄取),卡氏功能状态评分(KPS)至少为50分,或东部肿瘤协作组(ECOG)状态评估不超过2级,预期生存时间3个月以上。(证据等级:1;推荐强度:A)
推荐意见12
禁忌证:绝对禁忌证包括妊娠、严重或急性并发症、不可控制的精神障碍;相对禁忌证包括哺乳期、骨髓储备功能不佳(白细胞<2×109/L、中性粒细胞<1×109/L、血小板<9×1010/L,红细胞<3×1012/L、血红蛋白<80 g/L等)、肝功能不全(总胆红素>3倍正常上限、白蛋白<30 g/L等)、肾功能不全(肌酐清除率<40~50 mL/min等)或严重心功能不全。(证据等级:1;推荐强度:A)
推荐说明:以上推荐意见主要参考国际相关指南、Ⅲ期临床试验和大样本数据分析 [31-37]制定,专家组一致同意。
NENs的种类较多且异质性强,治疗反应和副作用的个体差别较大。因此,用SSTR显像精准指导基于同类配体分子的PRRT治疗非常必要,可以估算对肿瘤及正常脏器的内照射辐射剂量[41]。但需注意的是,部分肿瘤虽然高表达SSTR但对治疗不敏感,另有部分患者的正常组织对放射性极为敏感,容易出现较严重的副作用。这些都需要在临床治疗前充分准备,治疗过程中密切观察,一旦发现则及时处理。
3.3 PRRT治疗前、治疗中和治疗后的注意事项有哪些?
推荐意见13
治疗前:开展治疗的单位、场所和医务人员应具备相应资质;对患者进行全面评估,确认符合适应证且无禁忌证;对合并用药和治疗,如SSA治疗、化疗、放疗等,有充分的了解和相应处理措施;与患者充分沟通和宣教,确认患者了解预期疗效及可能风险,并签署知情同意书。(证据等级:1;推荐强度:A)
推荐意见14
治疗中:有规范的诊治流程,包括给药剂量、方式和疗程间隔等;有充分的放射防护措施;对类癌危象、呕吐等副作用有预防和应急措施;对注射部位的放射性药物渗漏及静脉炎等,有早期发现流程和积极处理措施;正确、合理使用肾脏保护剂;对大量输液导致的心功能负担和肾结石脱落等有应对措施。(证据等级:1;推荐强度:A)
推荐意见15
治疗后:及时、充分地对副作用进行观察、监测和处理,特别是血象和肝、肾功能的变化;恰当、准确地进行疗效评估;严格掌握出院标准;落实患者出院宣教。(证据等级:1;推荐强度:A)
推荐意见16
后续治疗:如治疗有效,副作用可接受,建议间隔6~12周后继续治疗,一般治疗4~6个疗程;此后再进展,预期患者仍可通过PRRT获益,可选择补救治疗。(证据等级:1;推荐强度:A)
推荐说明:以上推荐意见对于单位、场所和人员等的要求根据我国相关法规提出,注意事项和处理措施参考国际相关指南[31-34]。
医疗机构应具有卫生主管部门核发的《放射诊疗许可证》和环保主管部门核发的《辐射安全许可证》,并有足够剂量的177Lu和/或90Y等治疗性核素备案。PRRT应在许可使用足够剂量相应核素的核医学场所内完成。医务人员应持有核医学诊疗的执业证书和放射工作卫生许可证,具有相应临床研究经验或接受过相关培训。
177Lu标记的DOTA-TATE和DOTA-TOC一般按5.6~7.4 GBq(150~200 mCi)静脉输注给药;如用90Y标记的同样多肽,则按3.7 GBq(100 mCi)/m2体表面积给药。疗程间隔为6~12周,一般治疗 4~6个疗程。可根据临床情况特别是患者的基础条件和副作用等适当调整。
肾脏是PRRT的剂量限制器官之一。因此,治疗时有必要输注肾脏保护剂来减少肾脏的辐射吸收剂量。一般在给药前30~60 min开始静脉输注(25 g赖氨酸和25 g精氨酸配制2 L生理盐水),输注时间应>4 h。应注意观察和处理输注氨基酸导致的恶心、呕吐,以及高钾血症、高钠血症和代谢性酸中毒。
药物输注期间或治疗后2 d内,约1%的患者可能因激素或生物活性物质过度释放而出现类癌危象。典型的临床表现包括皮肤潮红、腹泻、支气管痉挛和高血压。应及时静脉注射大剂量生长抑素、皮质类固醇等进行处理,纠正电解质紊乱,并对症治疗功能性症状,如低血压、高血压、低血糖和高胃泌素血症等。
对于有严重心功能不全的患者,建议心内科医生参与治疗过程,且应选择氨基酸含量较低且体积较小的肾脏保护方案。合并肾结石的患者可能会因利尿剂的使用而导致肾结石脱落,引起急性肾绞痛,可通过减少输液总量予以避免。
注射部位可能会发生放射性药物渗漏,可通过热敷、加压和抬高渗漏处促进放射性药物的清除。给药前应保证静脉通道的顺畅性,给药期间如出现肿痛则应尽快干预。注射部位如发生氨基酸溶液渗漏相关静脉炎,应积极进行局部治疗。
若患者在治疗期间出现2级血小板减少、任何3级或4级血液毒性(淋巴细胞减少除外)、血清肌酐值较基线增加40%同时肌酐清除率降低40%以上,以及任何其他可能与治疗有关的3级或4级毒性,经多学科评估认为继续治疗仍可获益,可根据个体情况适当延长治疗间隔周期、减少给药剂量。一般延长治疗间隔周期最长至16周,如仍不能恢复则认为继续使用PRRT风险较大;如减少给药剂量,一般推荐采用标准剂量的50%进行治疗。上述情况若在下一个疗程继续出现,则认为患者暂时不适合继续使用PRRT;若上述情况未再发生,则下一次治疗可恢复至标准剂量。
治疗结束后1、3、6、12个月,以及此后每年均应进行疗效及毒副作用评估,直至出现疾病进展。此时,如果通过多学科讨论和评估,预期患者仍可通过PRRT获益,可行补救性PRRT。研究表明,若患者对上一轮PRRT治疗的反应良好,则补救性PRRT反应良好的可能性较大[42]。
4 靶向其他靶点和途径的分子影像诊断及靶向核素治疗
除靶向SSTR的分子影像诊断和核素治疗外,针对其他靶点和途径的核医学精准诊疗推荐,包括糖代谢、儿茶酚胺合成、GLP-1R、CXCR4和多靶点互补结合等。
4.1 18F-FDG PET/CT或PET/MRI糖代谢显像如何选用?
推荐意见17
18F-FDG PET/CT或PET/MRI可用于高级别神经内分泌瘤(NETs)及神经内分泌癌(NEC)等高代谢肿瘤的评估和预后。(证据等级:1;推荐强度:A)
推荐说明:分化较好的低级别NETs往往18F-FDG摄取不高,PET/CT或PET/MRI显像为阴性,而部分高级别NETs和NEC的18F-FDG摄取较高。因此,18F-FDG PET是NENs的独立预后因素[28], 与SSTR显像互补结合可更好地评估NENs[43]。
4.2 儿茶酚胺合成代谢显像及核素靶向治疗如何选择?
推荐意见18
可选择18F-DOPA PET/CT或PET/MRI用于NENs的诊断和评估;可选择131I(或123I)-间位碘代苄胍(MIBG)SPECT或SPECT/CT用于嗜铬细胞瘤、副神经节瘤的诊断和评估及指导131I-MIBG核素治疗;可用131I-MIBG对131I(或123I)-MIBG高摄取肿瘤进行核素治疗(证据等级:1;推荐强度:A)。可选择18F-MFBG PET/CT或PET/MRI用于嗜铬细胞瘤、副神经节瘤的诊断和评估,以及指导131I-MIBG核素治疗。(证据等级:2;推荐强度:B)
推荐说明:18F-DOPA作为合成儿茶酚胺的前体物质,可用于嗜铬细胞瘤、副神经节瘤等多种NENs摄取,用于诊断和评估[21]。MIBG是一种去甲肾上腺素的类似物,具有相同的摄取机制。123I/131I标记MIBG可用于嗜铬细胞瘤、副神经节瘤的SPECT显像,用于其诊断及定位,以及筛选适合131I-MIBG核素治疗的患者[44]。18F标记的间位氟代苄胍(MFBG)是一种新型正电子示踪剂,其PET显像具有更高的图像清晰度和空间分辨率,对小病灶的检出灵敏度更高[45]。
4.3 GLP-1R显像如何选用?
推荐意见19
可选择68Ga-Exendin-4 PET/CT或PET/MRI用于胰岛素瘤的诊断和评估。(证据等级:2;推荐强度:B)
推荐说明:GLP-1R在90%以上的胰岛素瘤中都有高表达,表达密度约为正常胰岛细胞的6~12倍。以GLP-1R为靶点的68Ga-Exendin-4 PET/CT显像对于胰岛素瘤的诊断灵敏度可达90%以上,具有高特异性,仅在胃泌素瘤、血管活性肠肽瘤、嗜铬细胞瘤、支气管类癌等NETs中有较低表达,在其他肿瘤中几乎不表达[46-47]。
4.4 CXCR4显像如何选用?
推荐意见20
可选择68Ga-Pentixafor PET/CT或PET/MRI用于促肾上腺皮质激素垂体瘤等的诊断和评估。(证据等级:2;推荐强度:B)
推荐说明:CXCR4是一种典型的G蛋白偶联受体,是趋化因子配体12(CXCL12)的受体。Pentixafor是由CXCL12合成的环五肽类似物组成的CXCR4配体,68Ga-Pentixafor对CXCR4具有高亲和力及高选择性,对促肾上腺皮质激素垂体瘤等具有较好的诊断敏感性和准确性,对高级别NETs及NEC的检出能力更高,可弥补SSTR显像的不足,并在标记治疗性核素后,可能用于靶向核素治疗[48-49]。
4.5 多靶点互补结合显像如何选用?
推荐意见21
可选择68Ga-TATE-RGD PET/CT或PET/MRI用于SSTR2或整合素αVβ3高表达NETs及NEC的诊断和评估。(证据等级:2;推荐强度:B)
推荐说明:靶向SSTR只能解决部分NENs的诊疗问题,寻找与SSTR互补的靶点,利用双靶向或多靶向的分子探针,可一次性诊断或治疗更多不同类型的肿瘤。整合素αvβ3是一种跨膜异二聚体,介导细胞和细胞之间以及细胞和细胞外基质之间的相互识别和粘附,与肿瘤的浸润、转移和新生血管生成密切相关,在高级别NETs和NEC中表达更高,与SSTR2的表达互补。研究发现,同时靶向SSTR2和整合素受体αvβ3的双靶点探针68Ga-TATE-RGD可检出更多NENs肝转移,且在18F-FDG高摄取的NENs中,68Ga-TATE-RGD的摄取高于68Ga-DOTA-TATE[50]。
5 小 结
针对多数NENs细胞表面SSTR高表达的共性特征和儿茶酚胺合成增加等个性特征,利用放射性核素标记相应配体进行精准诊断和靶向核素治疗的技术已在欧美等国家广泛应用,并日益得到临床认可。以西方国家为主的相关学会已制定多个诊疗指南。此类精准诊疗技术也将在我国初步应用,迫切需要建立适合中国国情的指导方案。本指南针对我国临床精准诊疗实际问题,结合国际相关指南、新的证据和中国国情,经国内具有相关经验的多学科专家反复论证完成,但仍存在不足之处,希望得到各方面专家的反馈意见,不断修订、补充和完善,以更好地指导相关临床实践,服务我国广大NENs患者。
参考文献
[1]Rogoza O, Megnis K, Kudrjavceva M, et al. Role of somatostatin signalling in neuroendocrine tumours[J]. Int J Mol Sci, 2022, 23(3): 1447.
[2]Wild D, Antwi K, Fani M, et al. Glucagon-like peptide-1 receptor as emerging target: Will it make it to the clinic?[J]. J Nucl Med, 2021, 62(S2): 44S-50S.
[3]刘清杏, 臧洁, 任家坤, 等. 靶向生长抑素受体的神经内分泌肿瘤核素诊断与治疗[J]. 协和医学杂志, 2020, 11(4): 370-376.
[4]Yang W D, Kang F, Chen Y, et al. Landscape of nuclear medicine in China and its progress on theranostics[J]. J Nucl Med, 2024, 65(S1): 29S-37S.
[5]Zhang J J, Wang H, Jacobson O, et al. Safety, pharmacokinetics, and dosimetry of a long-acting radiolabeled somatostatin analog 177Lu-DOTA-EB-TATE in patients with advanced metastatic neuroendocrine tumors[J]. J Nucl Med, 2018, 59(11): 1699-1705.
[6]Wang H, Cheng Y J, Zhang J J, et al. Response to single low-dose 177Lu-DOTA-EB-TATE treatment in patients with advanced neuroendocrine neoplasm: a prospective pilot study[J]. Theranostics, 2018, 8(12): 3308-3316.
[7]Liu Q X, Cheng Y J, Zang J, et al. Dose escalation of an Evans blue-modified radiolabeled somatostatin analog 177Lu-DOTA-EB-TATE in the treatment of metastatic neuroendocrine tumors[J]. Eur J Nucl Med Mol Imaging, 2020, 47(4): 947-957.
[8]Liu Q X, Zang J, Sui H M, et al. Peptide receptor radionuclide therapy of late-stage neuroendocrine tumor patients with multiple cycles of 177Lu-DOTA-EB-TATE[J]. J Nucl Med, 2021, 62(3): 386-392.
[9]Del Olmo-Garcia M I, Prado-Wohlwend S, Andres A, et al. Somatostatin and somatostatin receptors: from signaling to clinical applications in neuroendocrine neoplasms[J]. Biomedicines, 2021, 9(12): 1810.
[10]Xie Q, Liu T L, Ding J, et al. Synthesis, preclinical evaluation, and a pilot clinical imaging study of [18F]AlF-NOTA-JR11 for neuroendocrine neoplasms compared with [68Ga]Ga-DOTA-TATE[J]. Eur J Nucl Med Mol Imaging, 2021, 48(10): 3129-3140.
[11]Zhu W J, Cheng Y J, Wang X Z, et al. Head-to-head comparison of 68Ga-DOTA-JR11 and 68Ga-DOTATATE PET/CT in patients with metastatic, well-differentiated neuroendocr-ine tumors: a prospective study[J]. J Nucl Med, 2020, 61(6): 897-903.
[12]Zhu W J, Cheng Y J, Jia R, et al. A prospective, randomized, double-blind study to evaluate the safety, biodistribution, and dosimetry of 68Ga-NODAGa-LM3 and 68Ga-DOTA-LM3 in patients with well-differentiated neuroendocrine tumors[J]. J Nucl Med, 2021, 62(10): 1398-1405.
[13]Briganti V, Cuccurullo V, Di Stasio G D, et al. Gamma emitters in pancreatic endocrine tumors imaging in the PET era: is there a clinical space for 99mTc-peptides?[J]. Curr Radiopharm, 2019, 12(2): 156-170.
[14]Madrzak D, Mikołajczak R, Kamiński G. Influence of PET/CT 68Ga somatostatin receptor imaging on proceeding with patients, who were previously diagnosed with 99mTc-EDDA/HYNIC-TOC SPECT[J]. Nucl Med Rev Cent East Eur, 2016, 19(2): 88-92.
[15]Hope T A, Bergsland E K, Bozkurt M F, et al. Appropriate use criteria for somatostatin receptor PET imaging in neuroendocrine tumors[J]. J Nucl Med, 2018, 59(1): 66-74.
[16]Subramaniam R M, Bradshaw M L, Lewis K, et al. ACR practice parameter for the performance of gallium-68 DOTATATE PET/CT for neuroendocrine tumors[J]. Clin Nucl Med, 2018, 43(12): 899-908.
[17]Krenning E P, Kwekkeboom D J, Bakker W H, et al. Somatostatin receptor scintigraphy with [111In-DTPA-D-Phe1]- and [123I-Tyr3]-octreotide: the Rotterdam experience with more than 1000 patients[J]. Eur J Nucl Med, 1993, 20(8): 716-731.
[18]Balon H R, Brown T L Y, Goldsmith S J, et al. The SNM practice guideline for somatostatin receptor scintigraphy 2.0[J]. J Nucl Med Technol, 2011, 39(4): 317-324.
[19]Kwekkeboom D J, Krenning E P, Scheidhauer K, et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: somatostatin receptor imaging with 111in-pentetreotide[J]. Neuroendocrinology, 2009, 90(2): 184-189.
[20]Bangard M, Béhé M, Guhlke S, et al. Detection of somatostatin receptor-positive tumours using the new 99mTc-tricine-HYNIC-D-Phe1-Tyr3-octreotide:first results in patients and comparison with 111In-DTPA-D-Phe1-octreotide[J]. Eur J Nucl Med, 2000, 27(6): 628-637.
[21]Bozkurt M F, Virgolini I, Balogova S, et al. Guideline for PET/CT imaging of neuroendocrine neoplasms with 68Ga-DOTA-conjugated somatostatin receptor targeting peptides and 18F-DOPA[J]. Eur J Nucl Med Mol Imaging, 2017, 44(9): 1588-1601.
[22]Virgolini I, Ambrosini V, Bomanji J B, et al. Procedure guidelines for PET/CT tumour imaging with 68Ga-DOTA-conjugated peptides: 68Ga-DOTA-TOC, 68Ga-DOTA-NOC, 68Ga-DOTA-TATE[J]. Eur J Nucl Med Mol Imaging, 2010, 37(10): 2004-2010.
[23]Pauwels E, Cleeren F, Tshibangu T, et al. [18F]AlF-NOTA-octreotide PET imaging: biodistribution, dosimetry and first comparison with [68Ga]Ga-DOTATATE in neuroendocrine tumour patients[J]. Eur J Nucl Med Mol Imaging, 2020, 47(13): 3033-3046.
[24]Kagna O, Pirmisashvili N, Tshori S, et al. Neuroendocrine tumor imaging with 68Ga-DOTA-NOC: physiologic and benign variants[J]. AJR Am J Roentgenol, 2014, 203(6): 1317-1323.
[25]Feijtel D, Doeswijk G N, Verkaik N S, et al. Inter and intra-tumor somatostatin receptor 2 heterogeneity influences peptide receptor radionuclide therapy response[J]. Theranostics, 2021, 11(2): 491-505.
[26]Krenning E P, Valkema R, Kwekkeboom D J, et al. Molecular imaging as in vivo molecular pathology for gastroenteropancreatic neuroendocrine tumors: implications for follow-up after therapy[J]. J Nucl Med, 2005, 46(S1): 76S-82S.
[27]Park S, Parihar A S, Bodei L, et al. Somatostatin receptor imaging and theranostics: current practice and future prospects[J]. J Nucl Med, 2021, 62(10): 1323-1329.
[28]Zhang J J, Liu Q X, Singh A, et al. Prognostic value of 18F-FDG PET/CT in a large cohort of patients with advanced metastatic neuroendocrine neoplasms treated with peptide receptor radionuclide therapy[J]. J Nucl Med, 2020, 61(11): 1560-1569.
[29]Werner R A, Thackeray J T, Pomper M G, et al. Recent updates on molecular imaging reporting and data systems (MI-RADS) for theranostic radiotracers-navigating pitfalls of SSTR- and PSMA-Targeted PET/CT[J]. J Clin Med, 2019, 8(7): 1060.
[30]Werner R A, Solnes L B, Javadi M S, et al. SSTR-RADS version 1.0 as a reporting system for SSTR PET imaging and selection of potential PRRT candidates: a proposed standardization framework[J]. J Nucl Med, 2018, 59(7): 1085-1091.
[31]Hope T A, Abbott A, Colucci K, et al. NANETS/SNMMI procedure standard for somatostatin receptor-based peptide receptor radionuclide therapy with 177Lu-DOTATATE[J]. J Nucl Med, 2019, 60(7): 937-943.
[32]Bodei L, Mueller-Brand J, Baum R P, et al. The joint IAEA, EANM, and SNMMI practical guidance on peptide receptor radionuclide therapy (PRRNT) in neuroendocrine tumours[J]. Eur J Nucl Med Mol Imaging, 2013, 40(5): 800-816.
[33]Kwekkeboom D J, Krenning E P, Lebtahi R, et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: peptide receptor radionuclide therapy with radiolabeled somatostatin analogs[J]. Neuroendocrinology, 2009, 90(2): 220-226.
[34]Lawal I, Louw L, Warwick J, et al. The college of nuclear physicians of South Africa practice guidelines on peptide receptor radionuclide therapy in neuroendocrine tumours[J]. S Afr J Surg, 2018, 56(3): 55-64.
[35]Baum R P, Kulkarni H R, Singh A, et al. Results and adverse events of personalized peptide receptor radionuclide therapy with 90Yttrium and 177Lutetium in 1048 patients with neuroendocrine neoplasms[J]. Oncotarget, 2018, 9(24): 16932-16950.
[36]Strosberg J, El-Haddad G, Wolin E, et al. Phase 3 trial of 177Lu-dotatate for midgut neuroendocrine tumors[J]. N Engl J Med, 2017, 376(2): 125-135.
[37]Strosberg J R, Caplin M E, Kunz P L, et al. 177Lu-dotatate plus long-acting octreotide versus high-dose long-acting octreotide in patients with midgut neuroendocrine tumours (NETTER-1): final overall survival and long-term safety results from an open-label, randomised, controlled, phase 3 trial[J]. Lancet Oncol, 2021, 22(12): 1752-1763.
[38]Basu S, Parghane R V, Banerjee S. Availability of both [177Lu]Lu-DOTA-TATE and[90Y]Y-DOTATATE as PRRT agents for neuroendocrine tumors: can we evolve a rational sequential duo-PRRT protocol for large volume resistant tumors?[J]. Eur J Nucl Med Mol Imaging, 2020, 47(4): 756-758.
[39]Villard L, Romer A, Marincek N, et al. Cohort study of somatostatin-based radiopeptide therapy with [90Y-DOTA]-TOC versus [90Y-DOTA]-TOC plus [177Lu-DOTA]-TOC in neuroendocrine cancers[J]. J Clin Oncol, 2012, 30(10): 1100-1106.
[40]Wehrmann C, Senftleben S, Zachert C, et al. Results of individual patient dosimetry in peptide receptor radionuclide therapy with 177Lu DOTA-TATE and 177Lu DOTA-NOC[J]. Cancer Biother Radiopharm, 2007, 22(3): 406-416.
[41]Wang J N, Zang J, Wang H, et al. Pretherapeutic 68Ga-PSMA-617 PET may indicate the dosimetry of 177Lu-PSMA-617 and 177Lu-EB-PSMA-617 in main organs and tumor lesions[J]. Clin Nucl Med, 2019, 44(6): 431-438.
[42]Kim Y I. Salvage peptide receptor radionuclide therapy in patients with progressive neuroendocrine tumors: a systematic review and meta-analysis[J]. Nucl Med Commun, 2021, 42(4): 451-458.
[43]Panagiotidis E, Alshammari A, Michopoulou S, et al. Comparison of the impact of 68Ga-DOTATATE and 18F-FDG PET/CT on clinical management in patients with neuroendocrine tumors[J]. J Nucl Med, 2017, 58(1): 91-96.
[44]Pandit-Taskar N, Modak S. Norepinephrine transporter as a target for imaging and therapy[J]. J Nucl Med, 2017, 58(S2): 39S-53S.
[45]Wang P P, Li T, Cui Y Y, et al. 18F-MFBG PET/CT is an effective alternative of 68Ga-DOTATATE PET/CT in the evaluation of metastatic pheochromocytoma and paraganglioma[J]. Clin Nucl Med, 2023, 48(1): 43-48.
[46]罗亚平, 李方, 于淼, 等. 胰高血糖素样肽-1受体PET/CT定位诊断胰岛素瘤的技术规范[J]. 协和医学杂志, 2020, 11(4): 486-491.
[47]Luo Y P, Pan Q Q, Yao S B, et al. Glucagon-like peptide-1 receptor PET/CT with 68Ga-NOTA-exendin-4 for detecting localized insulinoma: a prospective cohort study[J]. J Nucl Med, 2016, 57(5): 715-720.
[48]Wu Y, Wu Y F, Yao B Y, et al. Diagnostic accuracy and value of CXCR4-targeted PET/MRI using 68Ga-pentixafor for tumor localization in Cushing disease[J]. Radiology, 2024, 313(3): e233469.
[49]Lindenberg L, Ahlman M, Lin F, et al. Advances in PET imaging of the CXCR4 receptor: [68Ga]Ga-PentixaFor[J]. Semin Nucl Med, 2024, 54(1): 163-170.
[50]Jiang Y Y, Liu Q X, Wang G C, et al. A prospective head-to-head comparison of 68Ga-NOTA-3P-TATE-RGD and 68Ga-DOTATATE in patients with gastroenteropancreatic neuroendocrine tumours[J]. Eur J Nucl Med Mol Imaging, 2022, 49(12): 4218-4227.


