重磅发布!复旦药学顶级刊文:鱼腥草多糖激活肠-肺免疫轴改善急性肺炎,科学解码“肠安则肺安”千年智慧!
时间:2025-09-03 12:11:56 热度:37.1℃ 作者:网络
呼吸道病毒与耐药细菌的共感染是临床中导致急性肺炎重症化、住院时间延长及死亡率升高的关键原因。流感病毒H1N1与耐甲氧西林金黄色葡萄球菌(MRSA)先后侵袭肺组织时,机体不仅面临病毒直接破坏上皮屏障的威胁,还要承受细菌超感染带来的剧烈炎症风暴。传统治疗思路倚重奥司他韦等抗病毒药物及利奈唑胺等抗MRSA抗生素,但病毒变异与细菌耐药使疗效日益受限,且药物本身难以阻断宿主过度的免疫损伤。
鱼腥草自古被《本草纲目》等典籍记载为“清热解毒、消痈排脓”之要药,现代药理研究证实其所含多糖类大分子具有显著抗补体活性,却几乎不被吸收入血,提示其可能在肠道局部触发免疫调节效应,从而间接改善肺部病变。
复旦大学李继扬/陈道峰团队在前期发现鱼腥草多糖可改善H1N1单病毒感染肺炎的基础上,进一步提取了分子量均一、结构明确的均一多糖HCPM(Mw≈19.1 kDa),并与传统水提粗多糖HCP比较,系统评价了二者对H1N1-MRSA共感染小鼠的保护作用与机制,为中医药防治病毒-细菌共感染提供了新的实验证据与理论框架。

图1 论文首图
HCPM和HCP减轻病毒-细菌共感染小鼠肺炎的严重程度
研究首先建立了低剂量H1N1(0.2 LD50)滴鼻感染后第3天再经鼻给予MRSA(10^7 CFU)的病毒-细菌共感染小鼠模型。与单一病原体感染相比,共感染组小鼠在5–6天内体重急剧下降,肺指数升至19左右,病理可见大片肺泡结构破坏、红细胞外渗及大量炎性细胞浸润,肺内病毒载量与MRSA菌落数同步升高,促炎因子TNF-α、IL-6、IFN-α/β/γ及髓过氧化物酶(MPO)呈爆发式增长。引人注目的是,在体外实验已证实HCPM与HCP对H1N1及MRSA均无直接抗病毒、抑菌活性的前提下,口服给予HCPM 80 mg/kg可显著提高14天生存率至36%,并抑制体重下降;HCP 80 mg/kg亦能使10%小鼠存活,而奥司他韦联合利奈唑胺阳性对照组生存率为82%。肺组织学观察显示,HCPM与HCP均能明显减轻肺泡壁增厚、出血及细胞浸润,恢复肺泡液体清除关键蛋白Na⁺,K⁺-ATPase α1的表达,提示其通过抑制炎症水肿而非直接杀菌/抗病毒发挥疗效。ELISA结果进一步证实,HCPM与HCP显著下调肺内多种促炎介质水平,降低病毒NP蛋白表达及MRSA载量,从而整体减轻共感染所致的重症肺炎。
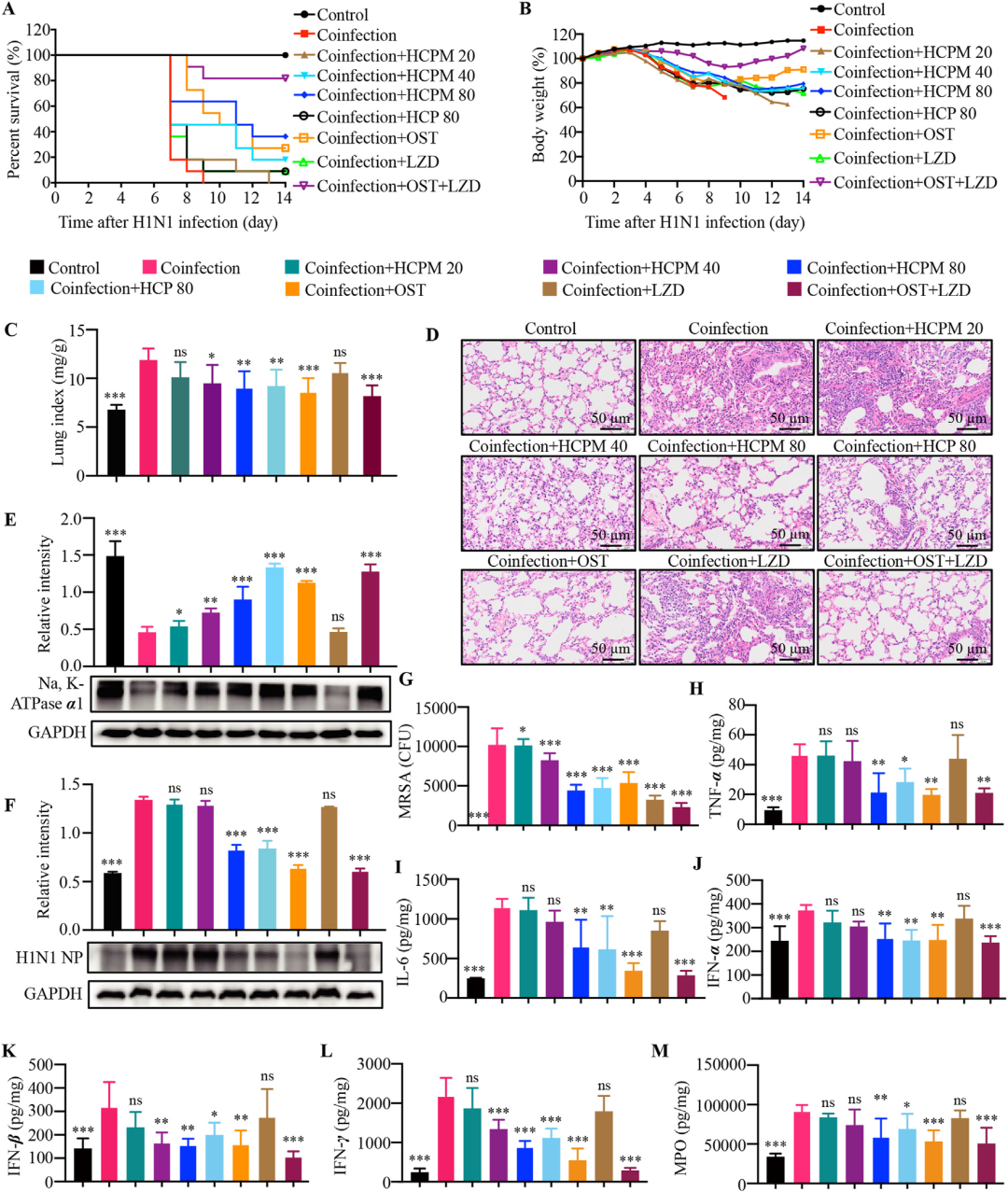
图2 HCPM和HCP减轻病毒-细菌共感染小鼠肺炎的严重程度
HCPM和HCP缓解病毒-细菌共感染小鼠的肠道损伤
在关注肺损伤的同时,研究者发现共感染小鼠的小肠亦出现明显病变:绒毛倒伏、缩短,隐窝结构破坏,杯状细胞减少,固有层大量炎性细胞浸润,紧密连接蛋白ZO-1、Occludin、Claudin-1表达显著降低,提示肠道机械屏障与化学屏障双重受损。HCPM与HCP治疗后,小肠组织学明显改善,杯状细胞恢复分泌蓝色黏蛋白,紧密连接蛋白表达回升,IL-6、IFN-γ及MPO水平随之下降,说明二者对肠道屏障功能具有直接保护作用,有助于阻断肠道来源的二次炎症信号向肺部扩散。
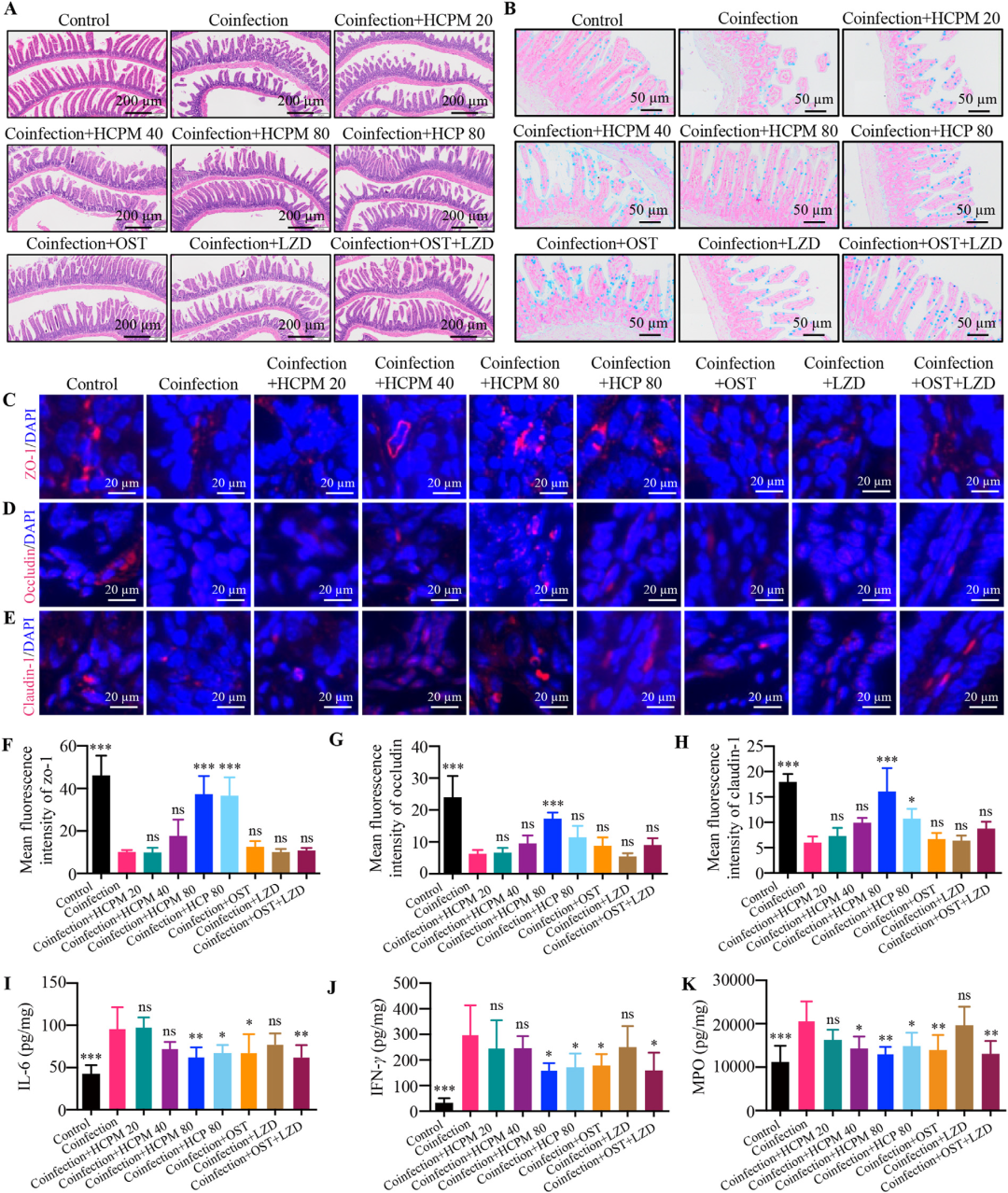
图3 HCPM和HCP缓解病毒-细菌共感染小鼠的肠道损伤
HCPM和HCP对肠道损伤的治疗作用早于肺部损伤
为厘清“肺-肠轴”中孰先孰后的时序关系,研究者动态观察了4 dpi与5 dpi两个时间点的肺、肠病理变化。结果显示,4 dpi时肺损伤尚轻,但小肠已出现显著病变;HCPM与HCP在4 dpi即显著改善小肠损伤评分,却对肺部病理无明显影响;至5 dpi,肺损伤进一步加重时,二药才开始显著缓解肺病。该“肠道优先”现象强烈提示,作为大分子的HCPM/HCP口服后主要滞留于小肠腔,与黏膜免疫系统直接接触并先行起效,随后通过免疫-神经-体液多途径远程调控肺免疫稳态,而非经血液循环到达肺部后再发挥作用。
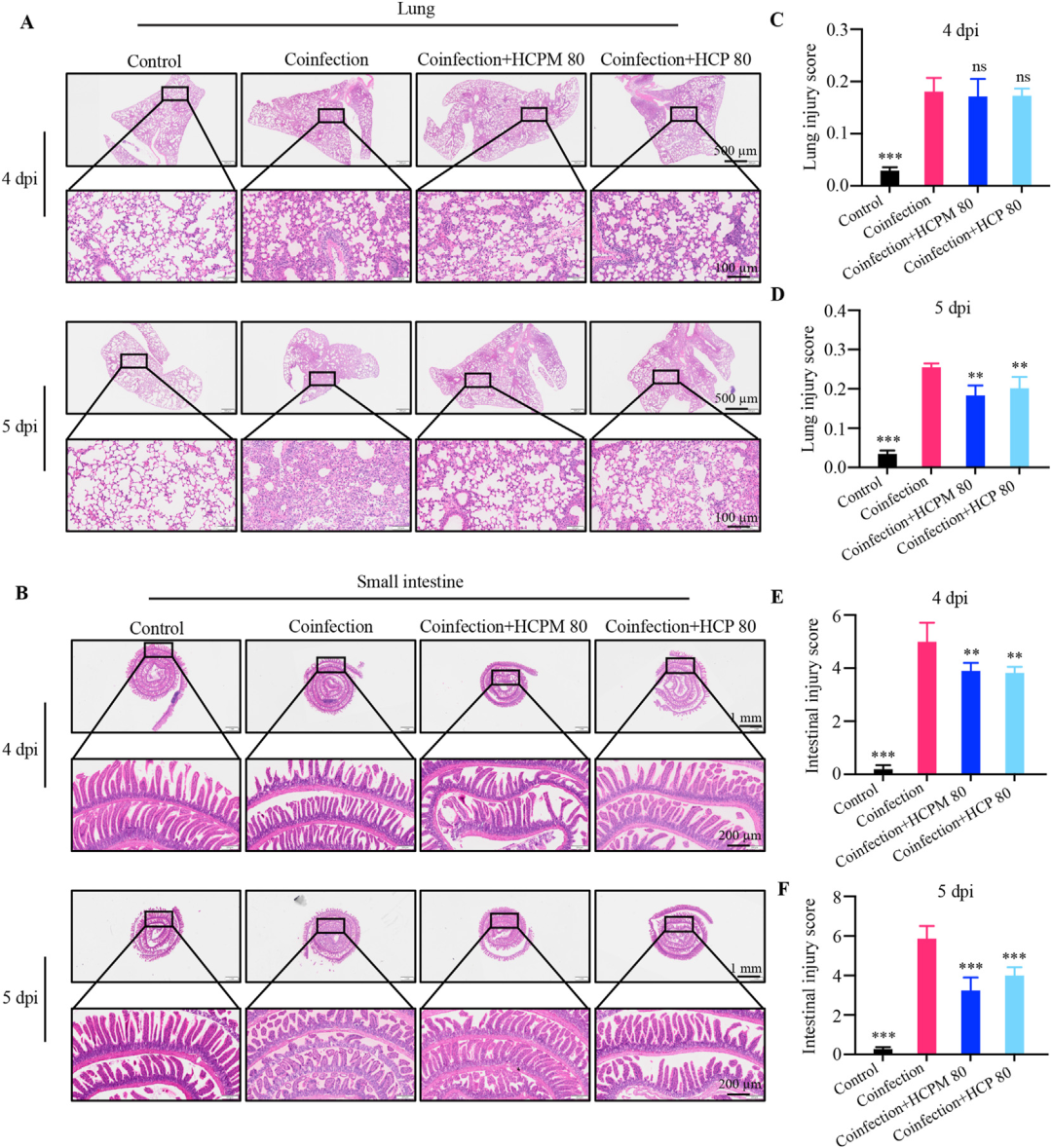
图4 HCPM和HCP对肠道损伤的治疗作用早于肺部损伤
HCPM和HCP抑制病毒-细菌共感染小鼠肠道补体的过度激活
补体系统过度激活是病毒-细菌共感染早期炎症放大的关键环节。研究通过免疫组化与ELISA检测发现,共感染后小肠组织内补体活化产物C3a、C5a水平在4 dpi即显著升高,5 dpi进一步加剧;HCPM与HCP治疗可在4 dpi即显著抑制C3a、C5a的生成,并持续至5 dpi。由于C3a/C5a作为过敏毒素可直接增加血管通透性、募集炎症细胞,该结果提示HCPM/HCP通过阻断肠道局部补体级联反应,从源头削弱炎症风暴的驱动力。
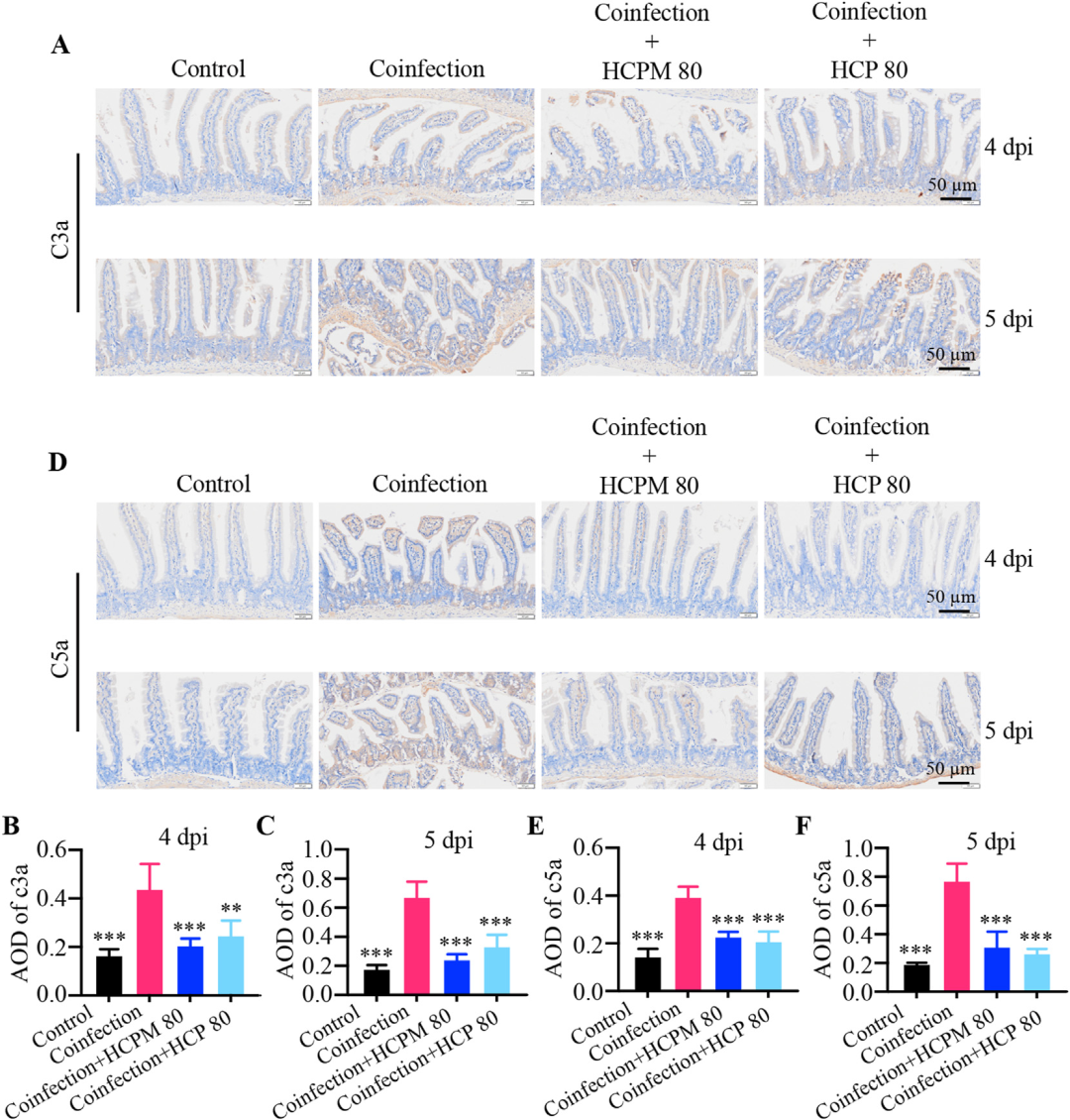
图5 HCPM和HCP抑制病毒-细菌共感染小鼠肠道补体的过度激活
HCPM和HCP抑制病毒-细菌共感染小鼠肠道NLRP3炎症小体的过度激活
NLRP3炎症小体是胞浆模式识别受体家族的重要成员,其活化后切割pro-caspase-1产生cleaved-caspase-1,进而催化IL-1β、IL-18成熟并释放,放大炎症反应。Western blot与免疫荧光显示,共感染小鼠小肠NLRP3蛋白及cleaved-caspase-1表达显著上调,ELISA亦检测到IL-1β、IL-18水平升高;HCPM与HCP几乎完全阻断上述蛋白表达及细胞因子释放。结合前述补体抑制结果,提示多糖可能通过“补体-C3a/C5a-NLRP3”信号轴协同抑制肠道炎症放大环。
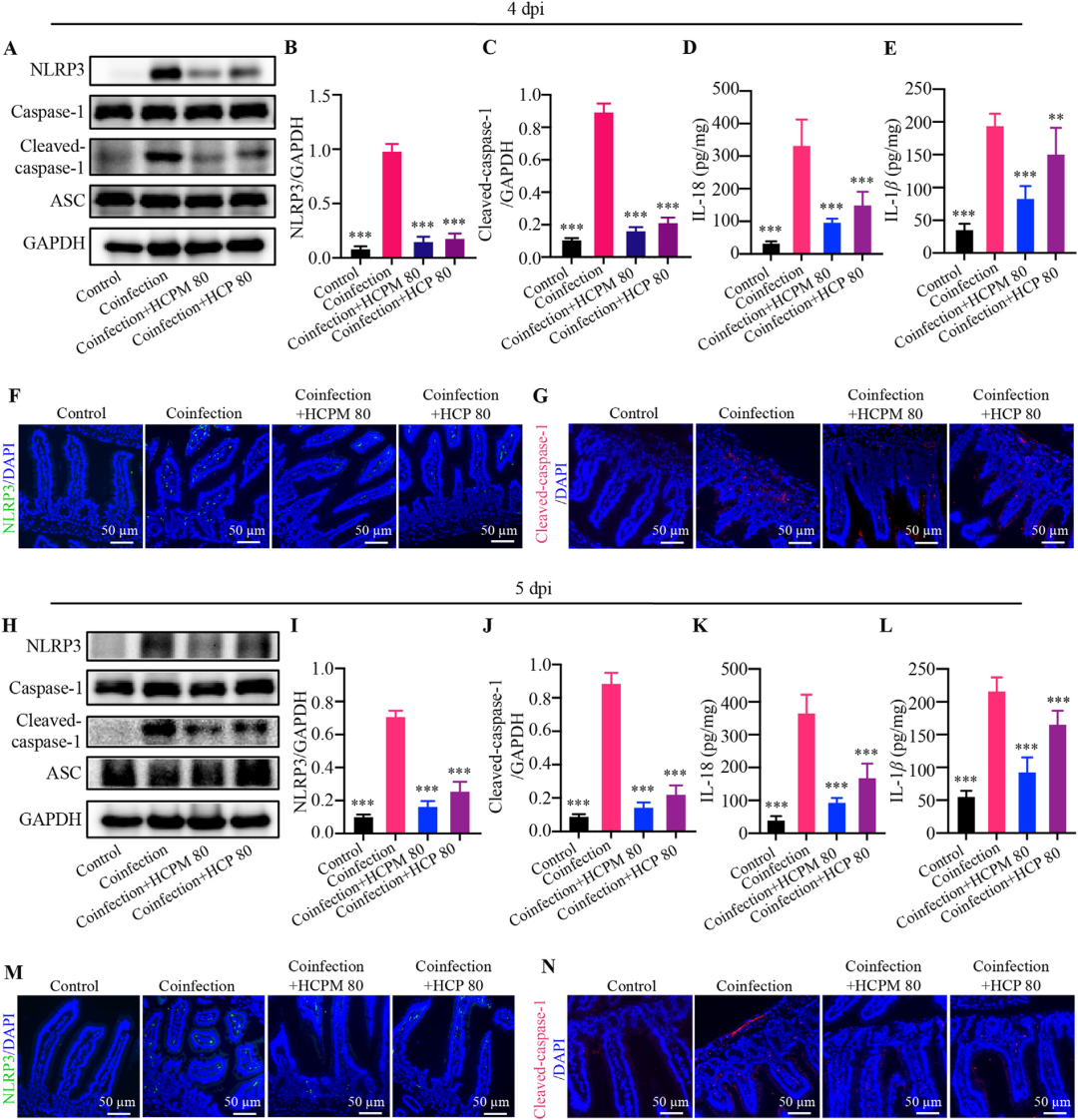
图6 HCPM和HCP抑制病毒-细菌共感染小鼠肠道NLRP3炎症小体的过度激活
HCPM对Treg/Th17细胞失衡的恢复作用可能与其对NLRP3炎症小体信号通路的影响有关
Treg(CD4⁺Foxp3⁺)与Th17(CD4⁺IL-17A⁺)细胞比例失衡是多种炎症性疾病的共同免疫学特征。流式细胞术显示,共感染小鼠小肠固有层及肺内Th17细胞比例显著升高,Treg细胞比例下降,Treg/Th17比值倒置。使用经典NLRP3抑制剂MCC950后,Th17细胞下调、Treg细胞回升,Treg/Th17比值趋于平衡,同时肺、肠病理损伤同步改善。HCPM处理组呈现出与MCC950极为相似的免疫表型及组织学修复效果,提示HCPM通过抑制NLRP3炎症小体信号通路,阻断IL-1β介导的Th17分化及Treg向Th17转化,从而恢复Treg/Th17稳态,减轻远端肺部炎症。
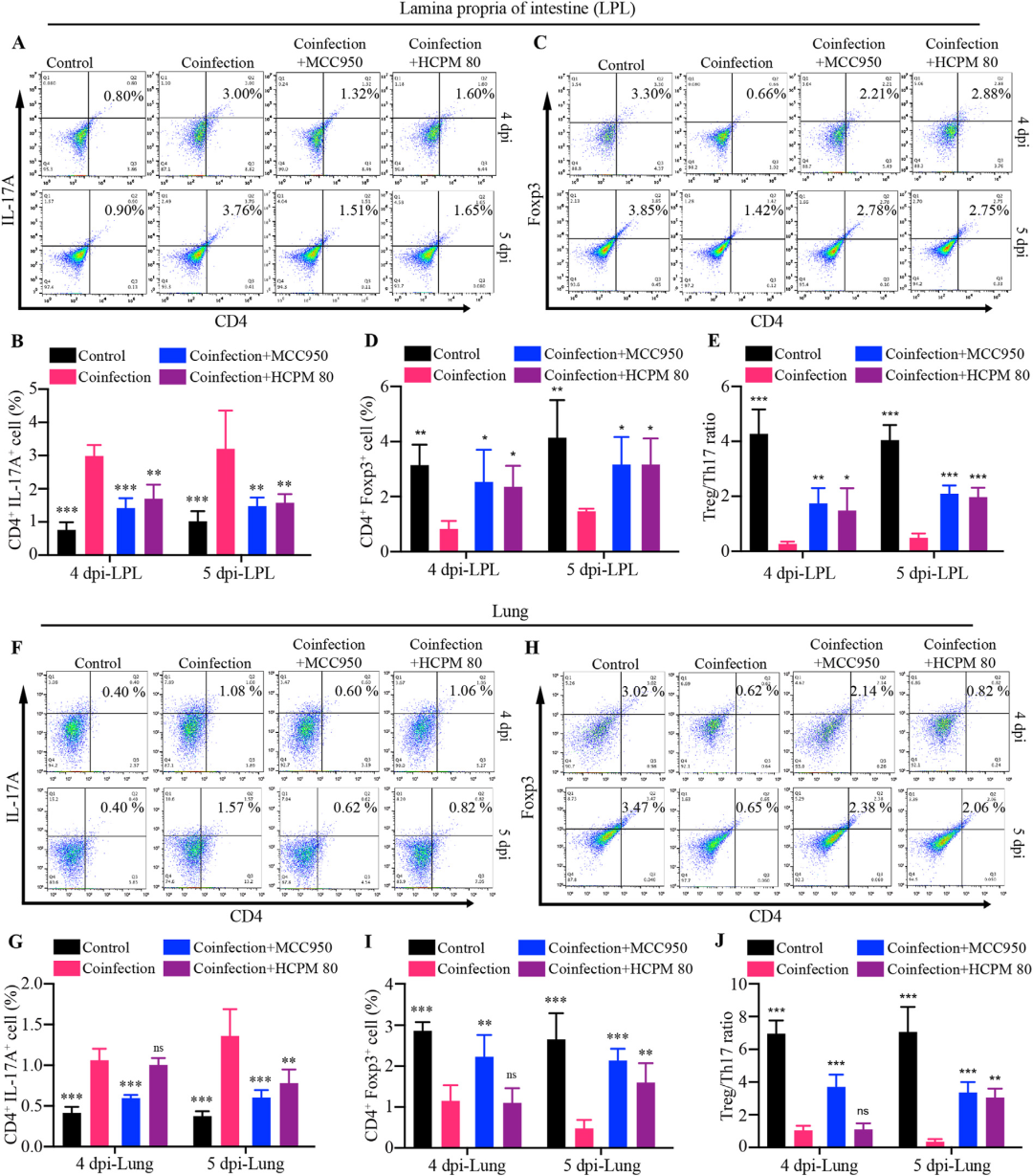
图7 HCPM对Treg/Th17细胞失衡的恢复作用可能与其对NLRP3炎症小体信号通路的影响有关
HCPM和HCP在病毒-细菌共感染期间调节肺和肠黏膜中Treg和Th17细胞的平衡
进一步聚焦局部黏膜免疫,研究分别检测了肺与肠组织中Treg与Th17细胞的动态分布。结果显示,共感染后肺与肠黏膜IL-17A显著升高、IL-10显著降低,Treg/Th17比例失衡;HCPM与HCP可显著逆转这一趋势,而奥司他韦、利奈唑胺或二者联合对肠黏膜Treg/Th17失衡无显著影响,提示化学抗病毒/抗生素主要作用于病原体本身,对宿主免疫调节有限。值得注意的是,多糖对脾脏Treg/Th17失衡无显著作用,再次印证其以“局部黏膜免疫”为核心的作用特点。
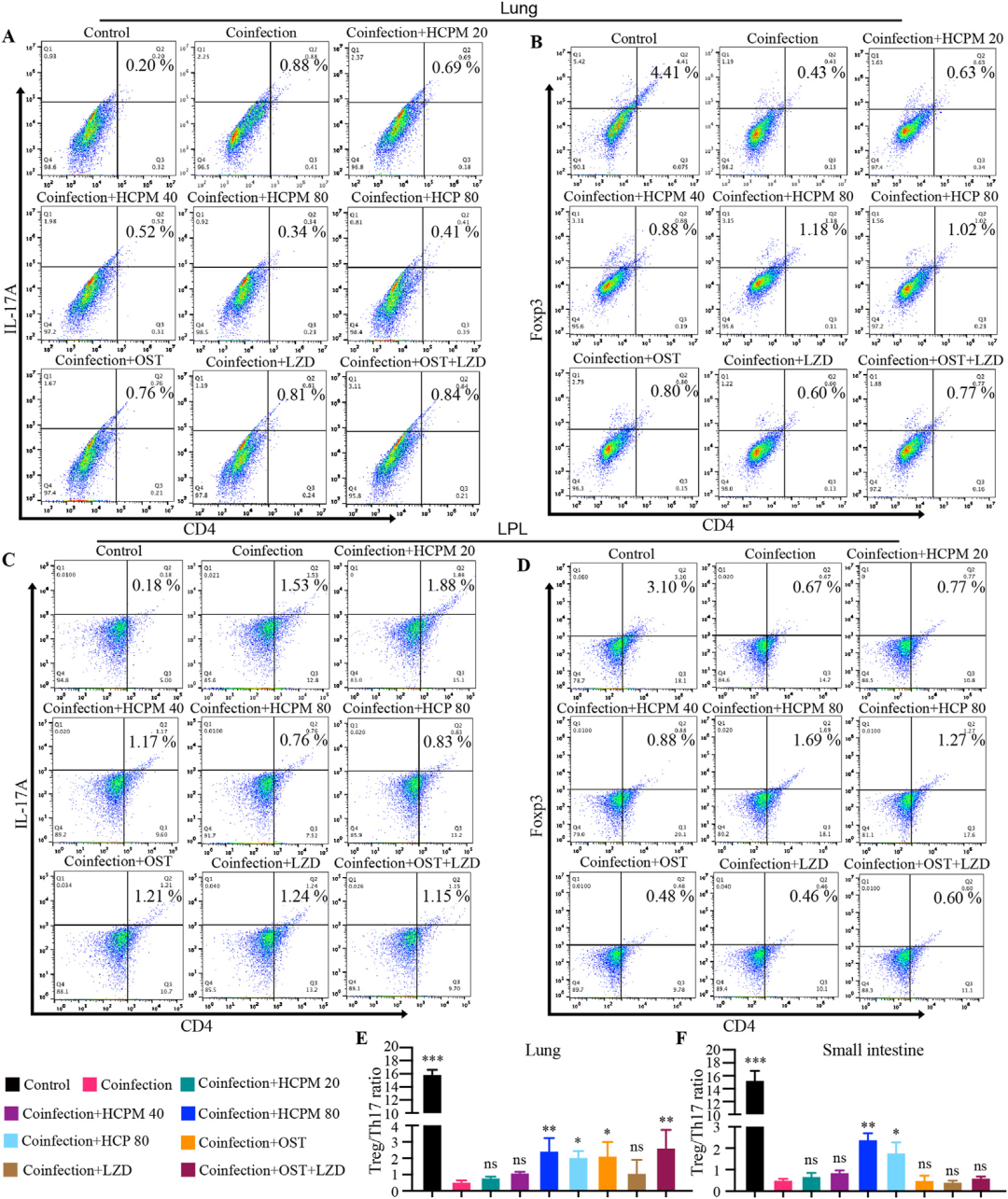
图8 HCPM和HCP在病毒-细菌共感染期间调节肺和肠黏膜中Treg和Th17细胞的平衡
HCPM和HCP在病毒-细菌共感染小鼠中恢复PP-MLN-肺轴中Treg和Th17细胞的频率
最后,研究以派伊尔结(PPs)-肠系膜淋巴结(MLNs)-肺为轴线,动态追踪Treg/Th17细胞迁移规律。结果发现,共感染4 dpi时PPs与MLNs内Th17细胞已显著升高、Treg细胞下降,该失衡状态于5 dpi延伸至肺;HCPM与HCP在4 dpi即可显著纠正PPs/MLNs内Treg/Th17失衡,5 dpi时肺内失衡亦随之恢复。该结果从细胞迁移与免疫网络角度验证了“肠-肺轴”理论:小肠作为免疫起始站,其GALT内的Treg/Th17稳态可通过共同黏膜免疫系统(CMIS)远程塑造肺部免疫微环境;HCPM/HCP口服后首先作用于肠道,通过恢复GALT的Treg/Th17平衡,进而经CMIS向肺部“传递”免疫稳态信号,最终实现对共感染肺炎的系统性保护。
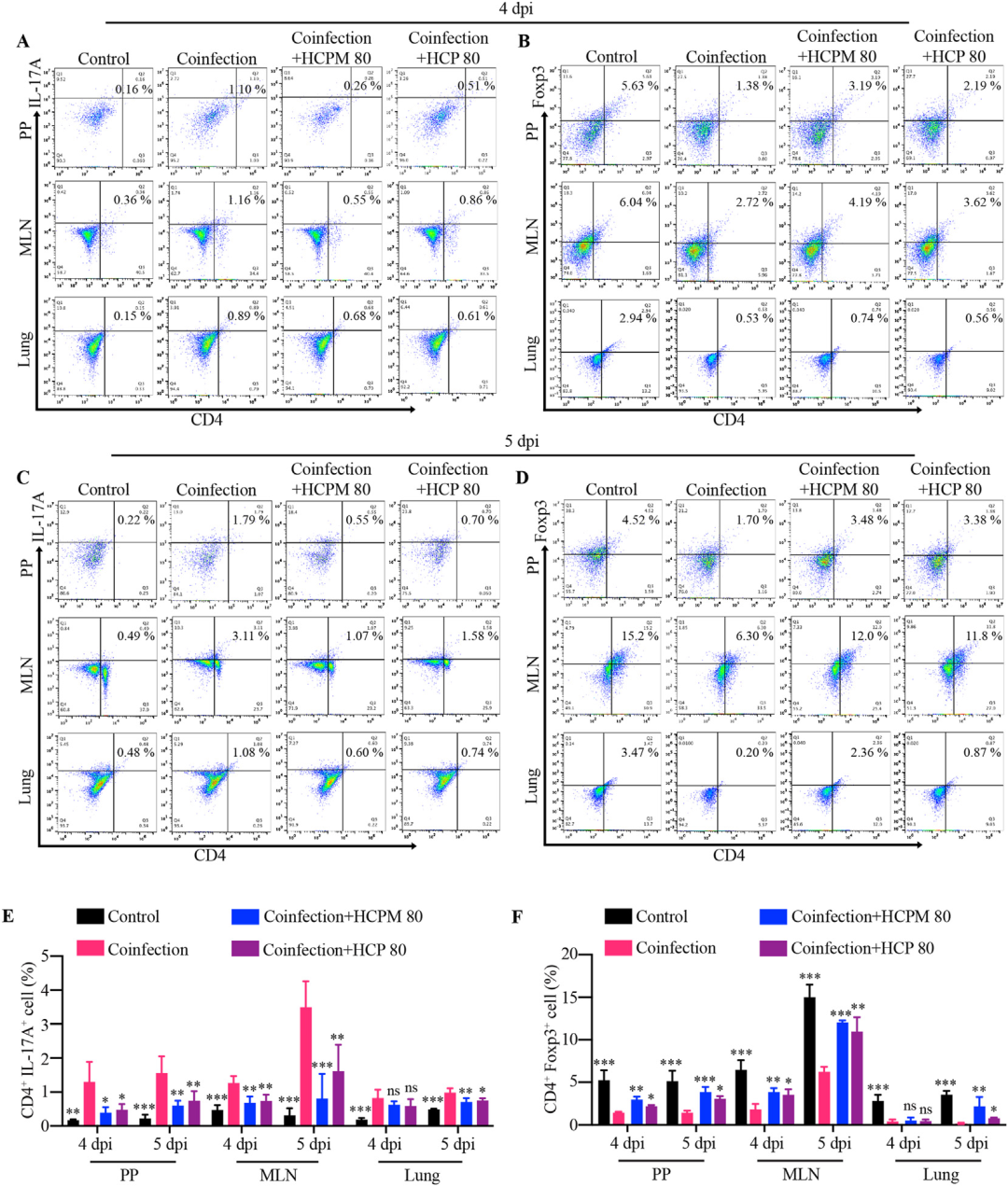
图9 HCPM和HCP在病毒-细菌共感染小鼠中恢复PP-MLN-肺轴中Treg和Th17细胞的频率
小结
综上,鱼腥草来源的抗补体多糖HCPM及粗多糖HCP在“无直接抗病毒、无直接杀菌”的前提下,通过口服途径首先抑制肠道补体过度激活与NLRP3炎症小体信号,继而恢复肠道Treg/Th17免疫平衡,并借助“肠-肺轴”将免疫稳态信号传递至肺部,最终显著减轻H1N1-MRSA共感染所致的重症肺炎。该研究不仅揭示了鱼腥草“清热解毒”传统功效的现代免疫学内涵,更提供了一种“以调代杀、以肠治肺”的全新策略:面对病毒变异与细菌耐药,与其不断追逐病原体,不如回归宿主免疫本身,通过重塑“肠-肺轴”免疫稳态实现广谱、低毒、低耐药的治疗愿景。未来,围绕HCPM的结构-功能关系、与肠道菌群的互作机制以及临床转化研究,将为中医药在重大呼吸道传染病防治中赢得更广阔的舞台。
参考文献:Li X, Ding W, Lu Y, Zhu H, Bao W, Liu Y, Lyu J, Zhou L, Li H, Li J, Chen D. An anti-complement homogeneous polysaccharide from Houttuynia cordata ameliorates acute pneumonia with H1N1 and MRSA coinfection through rectifying Treg/Th17 imbalance in the gut-lung axis and NLRP3 inflammasome activation. Acta Pharm Sin B. 2025 Jun;15(6):3073-3091. doi: 10.1016/j.apsb.2025.04.008. Epub 2025 Apr 10. PMID: 40654358; PMCID: PMC12254813.


