CONSORT 2025 声明:随机试验报告指南更新解读
时间:2025-09-03 12:13:24 热度:37.1℃ 作者:网络
摘 要
临床试验报告统一标准(Consolidated Standards of Reporting Trials,CONSORT)声明旨在提升随机对照试验(randomized controlled trial,RCT)报告质量,提供RCT报告的最低项目清单。CONSORT声明1996年首次发布,分别于2001年、2010年更新,2025年4月发布了最新版本,以不断反映新证据、方法学进展和使用者反馈。CONSORT 2025包含了30项必备清单条目和研究参与者流程图模板,清单主要变更包括:新增7个项目、修订3项、删除1项,并整合多个关键扩展版内容。本文对该声明进行全面解读,旨在帮助广大临床试验工作者、科技期刊编辑、审稿专家充分理解CONSORT 2025的内涵,在撰写RCT 报告、评审RCT 质量中正确运用CONSORT 2025,并为国内开展高水平RCT研究提供指引。
正 文
设计科学合理、实施过程和报告规范的随机对照试验(randomized controlled trial,RCT)是评价医疗卫生干预措施的最高循证医学证据。然而大量证据[1-3]表明,早期RCT报告存在不完整、不透明的问题,可能导致干预效果产生偏倚。为了促进RCT报告的完整性和透明性,1996 年,国际首部临床试验报告统一标准(Consolidated Standards of Reporting Trials,CONSORT)声明发布[4],之后分别在2001 年、2010 年和2025 年进行了三次更新。2013 年,试验方案标准条目:干预试验建议(Standard Protocol Items: Recommendations for Interventional Trials,SPIRIT)声明及其解释文件发布,进一步促进临床试验方案撰写及实施的规范化,并与CONSORT 互为补充[5-6]。
历经近30年的发展,CONSORT已获全球众多期刊及重要编辑组织的认可,如世界医学编辑协会(the World Association of Medical Editors)、国际医学期刊编辑委员会(International Committee of Medical Journal Editors)、科学编辑理事会(Council of Science Editors)。期刊采用CONSORT与RCT报告质量提升相关。多项研究[1,7-9]证据表明,期刊支持CONSORT 有助于改善RCT报告质量,而且报告质量随时间推移而逐步提高。
CONSORT和SPIRIT都是基于证据而制定的指南,指导RCT及其研究方案报告中应包含的必备清单以及试验流程图表,确保RCT及其研究方案报告的清晰性和透明度。CONSORT 和SPIRIT均属于动态指南,通过纳入新证据、方法学进展和使用者反馈定期更新,实时确保其价值和实用性。本次更新CONSORT 2010 声明和SPIRIT 2013(即将更新),是为了更好地协调RCT报告和试验方案设计的一致性,从而为使用者提供从试验设计、方案撰写、实施、分析到最终报告的全流程指导。协调报告流程应提高可用性和依从性,并带来更完整的报告。结合笔者团队两位专家曾通过专业研究联盟及学会推荐全程参与三轮德尔菲法意见征询的经验,本文对CONSORT 2025 声明进行深入解读,以帮助广大临床试验工作者、科技期刊编辑、审稿专家充分理解CONSORT 2025的内涵,在撰写RCT报告、评审RCT质量中正确运用CONSORT 2025,为国内开展高水平RCT研究提供指引。
1 CONSORT发展历史
20世纪90 年代初,基于改变RCT报告质量较差的现状,同时,受临床试验方法学研究的推动,1994 年,两项旨在制定报告指南的倡议“试验标准化报告(SORT)”和“Asilomar倡议”相继发布,进而推动1996 年第1版CONSORT 声明的发布[4]。2001 年,CONSORT工作组对CONSORT声明进行首次修订,内容包括1份清单(22 个条目)和1 个流程图。与CONSORT 1996年版相比,2001年版CONSORT 声明的清单增加了机构伦理审查委员会的批准、试验的资金来源以及试验注册号等内容,在该版本声明发表之前,CONSORT工作组已决定制定与特殊类型的临床试验设计相对应的CONSORT 声明扩展版,其中,整群随机临床试验和非劣效性与等效性临床试验报告的扩展版[10-13]已经发表,但其他类型的扩展版尚未完成。2010 年, CONSORT工作组又进行了第二次修订,清单由原先的22 条增加到25 条,对论文的文题、摘要、方法、结果及讨论部分的写作做了规定;增加了注册登记、试验方案和资助情况内容,流程图变化不大,还是要求对研究参与者的登记、分配、随访和分析阶段的研究参与者流动情况以流程图清晰展现临床试验过程中参与者的数量变化情况[14-15]。CONSORT 2010已开发出20个核心扩展版,其中,研究设计方面的扩展版包括适应性设计、整群试验、交叉试验、早期试验、非劣效性和等效性试验等;其他扩展版包括非药物治疗、结局、患者报告结局、替代结局、社会和心理干预、不良事件、中草药、针刺、人工智能等,以解决与不同类型试验设计、数据及干预措施报告相关的方法学问题,此外,还开发了SPIRIT和CONSORT在特定情境下的应用指南,如针对特定疾病领域或人群的试验[16]。
2012 年,一项纳入16 604 项试验的50 项评估的Cochrane 综述评估了期刊认可 CONSORT对其发表试验报告的影响,在27项与CONSORT相关的清单条目中,有25项在认可CONSORT的期刊上发表的试验报告中比在未认可的期刊上发表的报告中更完整[17]。
CONSORT自1996 年第1版声明发布以来,已被广泛引用,对提高临床试验报告的透明度、完整性、严谨性与临床试验的透明度、提高临床试验质量产生了广泛而深刻的影响,被以患者为中心的结局研究机构(PCORI)评定为20世纪健康研究的里程碑之一。据Web of Science统计,单篇最高被引频次达10 341 次[15]。根据Scopus统计, CONSORT 声明的被引频次在所有研究论文中位列前1%。CONSORT 2010已被翻译成13种语言,而SPIRIT 2013 则被翻译成7种语言[16]。
2 CONSORT 2025的适用范围与意义
2.1 适用范围
CONSORT 2025适用于所有RCT,但主要针对最常见的两组间的平行对照设计。为解决不同类型的试验设计、数据和干预措施报告相关的方法学问题,已开展对CONSORT声明扩展版本的更新工作,CONSORT工作组将与上述扩展指南的起草牵头人一起参与更新,在此期间,建议大家可继续沿用现行的CONSORT 扩展版本。
2.2 意义与传播
CONSORT 2025更新的目的在于帮助临床试验工作者更规范、科学、高效地设计、实施RCT研究,撰写RCT报告,同时,能够提升医学期刊编辑和审稿人评审RCT研究稿件的工作效率;此外,还有助于帮助广大同行、读者研读、评价已发表的RCT研究。“CONSORT 2025说明与详述”对清单中的各条目作了详细解释,CONSORT工作组非常推荐将说明与详述和清单联合使用,以便进一步做到完整、清晰和透明地报告RCT,并协助评估已发表的RCT报告[18]。
CONSORT 202 5正式发布后,将取代CONSORT 2010,CONSORT工作组将不断通过学术会议、合作期刊和社交媒体推广本声明。
此外,CONSORT工作组还建议:(1)各类医学期刊编辑应更新相应的作者写作及投稿指南;(2)期刊要求作者提交CONSORT清单作为稿件附件;(3)编辑委员会将CONSORT纳入审稿流程;(4)资助机构在项目申请中要求申请者提供CONSORT 清单。
3 CONSORT 2025更新制定方法与过程
CONSORT 2025 声明包含30 个条目的清单,规定了RCT报告的最低要求,以及RCT中研究参与者的流程图。更新CONSORT声明所采用的方法遵循了EQUATOR Network关于健康研究指南制
定者的指南[19-20]。
3.1 文献检索及构建数据库
通过文献检索工作来识别、收集已发表的建议修改和补充或反映CONSORT 2010优势和挑战的文献[21],CONSORT工作组还开发了一个名为 “SCEBdb”的项目特定数据库,用于存储与CONSORT相关的经验和理论证据以及有偏倚风险的RCT[22],综合文献检索中发现的证据及现有CONSORT主要扩展版本的牵头作者们提供的证据和推荐建议,作为下一步德尔菲法调查的研究基础。
3.2 德尔菲法调查
以现有的CONSORT 2010 清单为基础,利用从文献检索和推荐建议中收集的证据,创建了一个潜在的修改或补充清单,面向全球的终端使用者开展了一项大型在线的德尔菲法调查研究来征询反馈意见,共有317名参与者回应了第一轮调查, 303名回应了第二轮,290 名回应了第三轮。调查参与者通过现有的SPIRIT和CONSORT 合作以及专业研究联盟和学会确定,参与者还通过SPIRIT-CONSORT更新项目网站上的兴趣意向表招募参加者。参与者的职业背景较为广泛,最常见的是统计学家/方法学家/流行病学家198名、系统评价者/指南制定者73 名、临床试验研究者73 名、临床医生58 名、期刊编辑47 名和患者代表17 名。在为期三轮的德尔菲调查中,参与者用5分法的Likert量表评价CONSORT清单中每项条纳入更新后的同意程度,同时,SPIRIT-CONSORT更新项目网站提供自由文本框收集参与者对清单中每个条目的评论及新增条目的建议。所有德尔菲研究参与者均知情同意,德尔菲法调查的伦理审查批准由牛津大学中央大学研究伦理委员会授予(R76421/RE001)。
3.3 专家共识研讨
2023 年3月,通过Zoom举行了为期两天的在线专家共识会议,对德尔菲法调查的结果进行了展示和充分讨论,30 名受邀国际参与者出席了会议,代表了德尔菲调查中包括的不同利益相关者群体。会议期间,对CONSORT清单中每个新增或修改的条目均进行讨论并达成一致意见。最后,通过Zoom进行匿名投票以确定对讨论中存在不同意见条目的支持程度。
3.4 修改及定稿
2023年4 月,CONSORT工作组在牛津大学举行了为期两天的现场定稿会议,审议并通过了CONSORT 清单中每个新增或修改条目的格式和表述。随后,清单草案分发给共识会议的参与者,以确认这些条目是否代表工作组的共识或需要进一步阐明。根据反馈意见,CONSORT工作组进一步修订并确定了CONSORT 2025 内容。
4 CONSORT 2025更新内容
CONSORT 2025在CONSORT 2010 基础上有以下更新:在清单中新增7个条目、修订3个条目、删除1 个条目,整合多个关键扩展版内容。清单中新增条目主要基于以下几个方面的考虑:(1)加强研究数据的管理、使用权限及隐私保护等;(2)明确参加试验的所有作者均需披露经济及其他利益冲突,以增加试验的透明度,且减少对试验设计、实施、分析及结果报道的影响;(3)要求研究参与者全程参与试验,包括试验设计阶段,以帮助研究人员确定和优先考虑研究主题,改进试验设计,确定结局指标,提高试验的招募效率及可接受性等;(4)明确定义不良事件以及具体评估方法,以增强对研究参与者的安全性保护;(5)提供干预措施和对照措施的实际使用、依从性以及合并用药情况,增加干预措施对试验影响的透明度。
4.1 CONSORT 2025新增7个条目
条目4:数据共享,包括如何获取去标识化的个体参与者数据、统计代码及其他相关材料。
条目5b:论文作者的经济利益及其他利益冲突的披露声明。
条目8:患者和/或公众如何参与试验设计、实施和/或报告。
条目12b:研究中心及干预实施者的资格标准(如适用)。
条目15:不良事件及其他非预期事件的评估方法。
条目21:明确纳入每种分析的人群定义(如包含所有随机化研究参与者)及归属组别(条目21b),说明缺失数据的处理方法(条目21c)。
条目24:干预措施实施详情,包括干预和对照的实际给予方式(条目24a)及试验期间伴随治疗的细节(条目24b)。
4.2 完全修订的3个条目
条目3:除试验方案外,还应提供统计分析计划的获取途径。
条目10:应报道试验启动后的重要变更(包括未预设的结局或分析)。
条目26:需具体说明主要和次要结局的分析人数,以及各治疗组在不同时间点的有效患者数。
4.3 删除1个条目
删除原“试验结果外推性”条目,相关内容并入试验局限性(条目30)。
4.4 整合关键CONSORT扩展版的条目
CONSORT 2025新增3大类条目:(1)不良事件评估与分析相关条目(条目7、15、21a、23a、 27);(2)结局指标测量与分析相关条目(条目14、 26);(3)干预措施及对照措施的实际实施者与实施方式(条目24);见表1。


4.5 清单条目的结构调整
CONSORT 2025重组了清单的结构,新增一个新章节“开放科学(open science)”,包含如下条目:试验注册(条目2)、试验方案与统计分析计划(条目3)、数据共享(条目4)、资助和利益冲突(条目5)。部分条目措辞与SPIRIT清单保持一致。优化部分条目的表述,使其更清晰简洁。
5 CONSORT 2025主要内容
更新后的CONSORT 2025 声明清单分为7 个章节、30个具体条目,包括文题和摘要、开放科学、引言、方法、随机化、结果、讨论,见表1;CONSORT 2025 流程图见图1,CONSORT 2025 摘要清单见表2[23-25]。
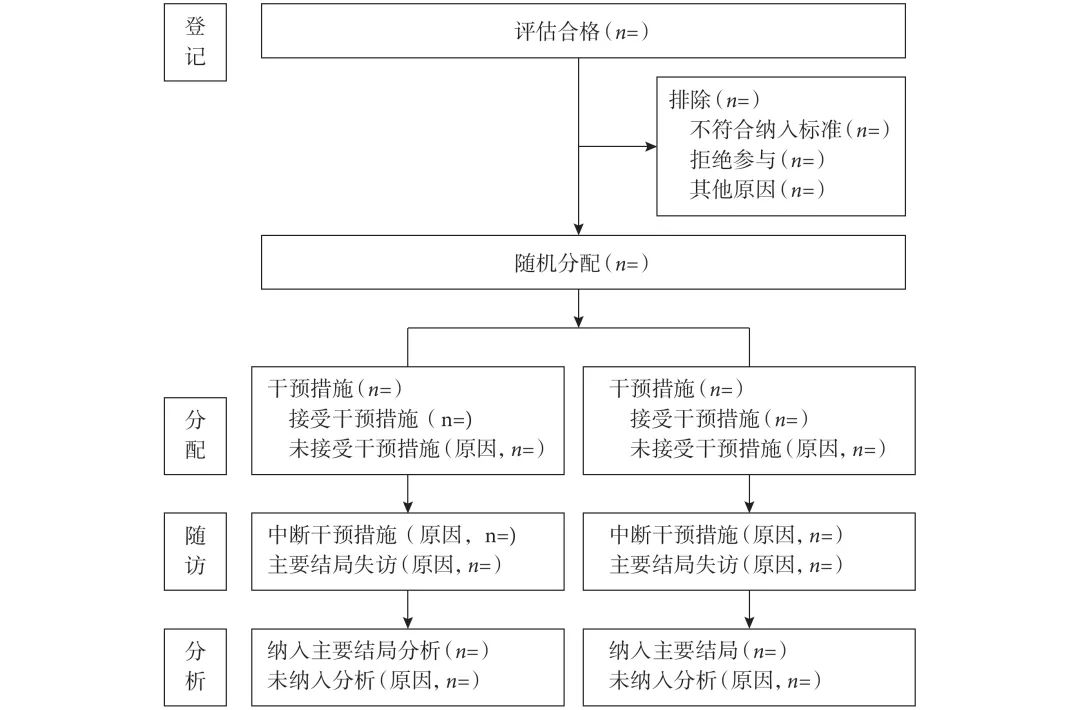
图 1 CONSORT 2025流程图

2025年4 月,CONSORT 2025 同时在BMJ、 JAMA、Lancet、Nature Medicine、PloS Medicine 发表[18, 23-26],而且BMJ在同一天同时发表了CONSORT 2025声明文件及解释文件,预计将有更多的期刊发表CONSORT 2025,其重要性可见一斑。CONSORT不仅是RCT报告的国际标准,也是RCT质量评价工具,极大推动了临床研究的透明度、完整性、严谨性,促进不同国家、地区和机构的科学交流,值得临床研究者、审稿专家、科技期刊编辑使用并推广。
利益冲突:本文作者雷芳、董敏、刘雪梅均为《中国胸心血管外科临床杂志》编辑部成员,参与此文的设计、撰写。作者声明,在本文的撰写和出版过程中,不存在任何可能影响本文客观性的财务、个人或其他利益冲突。
作者贡献:杨葛亮负责论文设计,文章撰写;周小芹、雷芳、董敏、冯天行负责整理文献,制作图表,文章撰写;郑莉参与修改论文;刘伦旭、朱云鹏、刘雪梅负责总体框架设计及对文章关键性修改;所有作者均同意发表。


