延寿20岁,二甲双胍太“神”了!多项研究:不仅将活到90岁的几率提升30%,全身性抗衰,还能修复脑功能,与MYC抑制剂协同抗癌
时间:2025-09-03 12:15:39 热度:37.1℃ 作者:网络
二甲双胍“先抑后补”的另类操作
最近,一项发表于Nature Communications的研究[1]更是让人眼前一亮:二甲双胍竟能通过调控线粒体代谢,增强少突胶质细胞的功能,加速髓鞘的形成。也就是说,这位“降糖老药”或许还能在多发性硬化(MS)等脱髓鞘疾病中,开启一条新的治疗路径。

髓鞘是包裹在神经轴突外层的脂质结构,犹如电线的绝缘层,既能加速神经信号传导,又能为轴突提供必要的代谢支持。而MS正是一种因免疫系统攻击髓鞘而导致神经功能受损的疾病,患者常出现视力模糊、肢体无力和平衡障碍等症状。
虽然大脑具有一定的自我修复能力——即再髓鞘化,但随着年龄增长,这种能力逐渐下降,尤其是少突胶质前体细胞(OPCs)——这些本应分化为成熟少突胶质细胞并形成髓鞘的“干细胞”——会逐渐失去响应分化信号的能力。
既往同一研究团队的研究发现,二甲双胍能够恢复老年大鼠OPCs的分化能力,促进髓鞘再生。这不禁让人好奇:二甲双胍在人体细胞中是否也有类似作用?

结果显示,二甲双胍能够显著促进hESC衍生的OPCs分化为成熟的少突胶质细胞。

这意味着二甲双胍不仅让更多轴突得到了保护,而且髓鞘厚度也有所增加,保护层更加坚固。
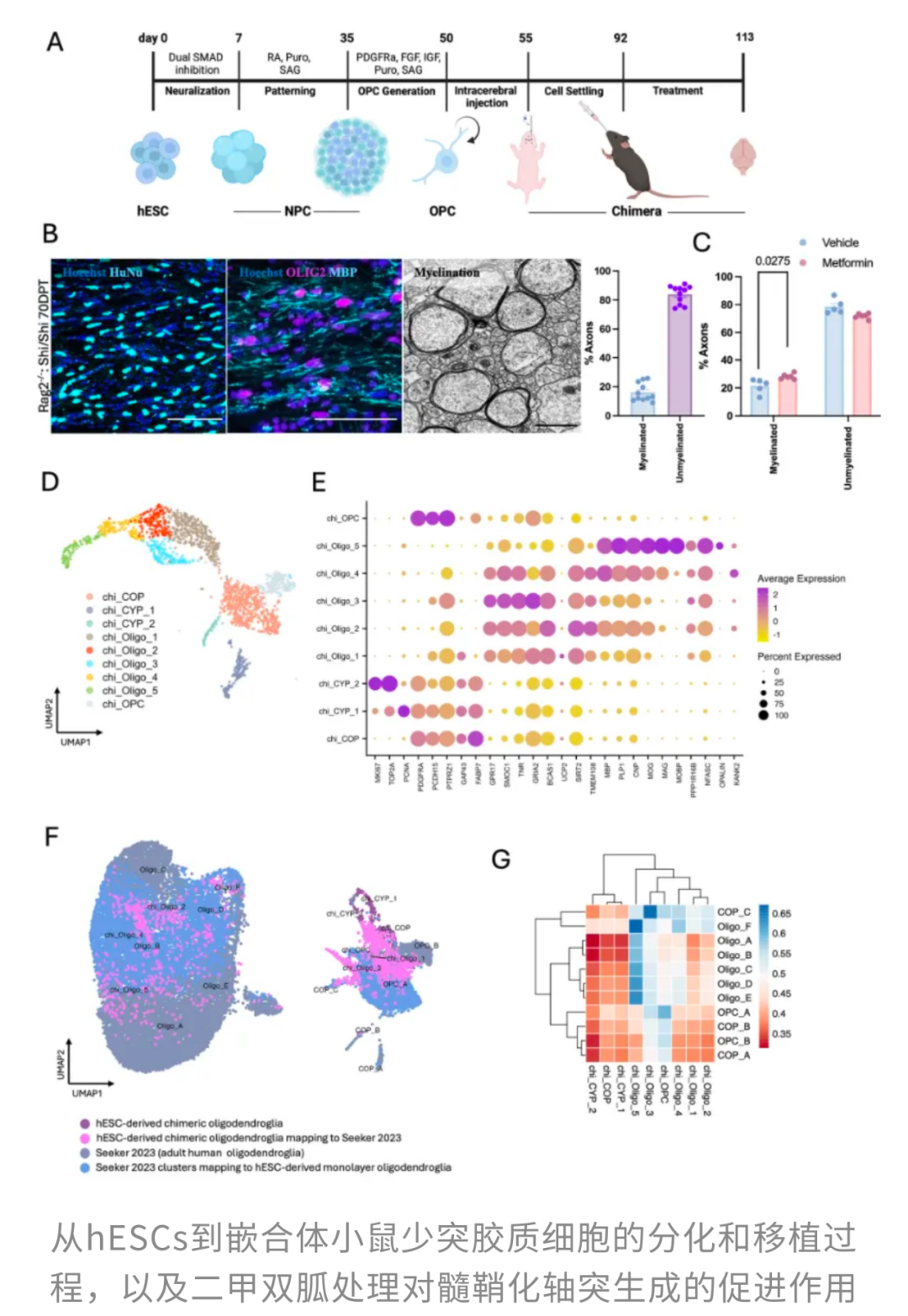
进一步地,研究者重新分析了先前发表的二甲双胍处理老年大鼠脑组织的电镜数据,发现轴突中同样存在着线粒体面积增加的趋势。
那么,这种线粒体的“蜕变”意味着什么呢?

换句话说,二甲双胍让这些细胞的“动力工厂”——线粒体“加班加点”,高效运转。
其中,NDUFA11、COX8A和EIF1尤其值得关注:NDUFA11是组装线粒体呼吸链复合物I的关键亚基,COX8A则是复合物IV的重要组成,而EIF1帮助细胞把线粒体相关的mRNA进行翻译。
此外,TOMM20和CHCHD2也在二甲双胍处理后被激活,其中TOMM20是代谢活性的标志,而CHCHD2调节线粒体动力学,提升氧化磷酸化效率。整体来看,二甲双胍通过重塑线粒体功能,间接推动少突胶质细胞成熟,从而促进髓鞘形成。
并且,这种作用并非只针对人源细胞。在小鼠自身的少突胶质细胞、星形胶质细胞、小胶质细胞乃至神经元中,二甲双胍同样诱导了关键基因的上调。
最后,研究者还分析了来自MS患者的大脑snRNA-seq数据,发现两名生前服用二甲双胍的患者,其少突胶质细胞中EIF1表达明显高于未服药的MS患者和健康对照组。
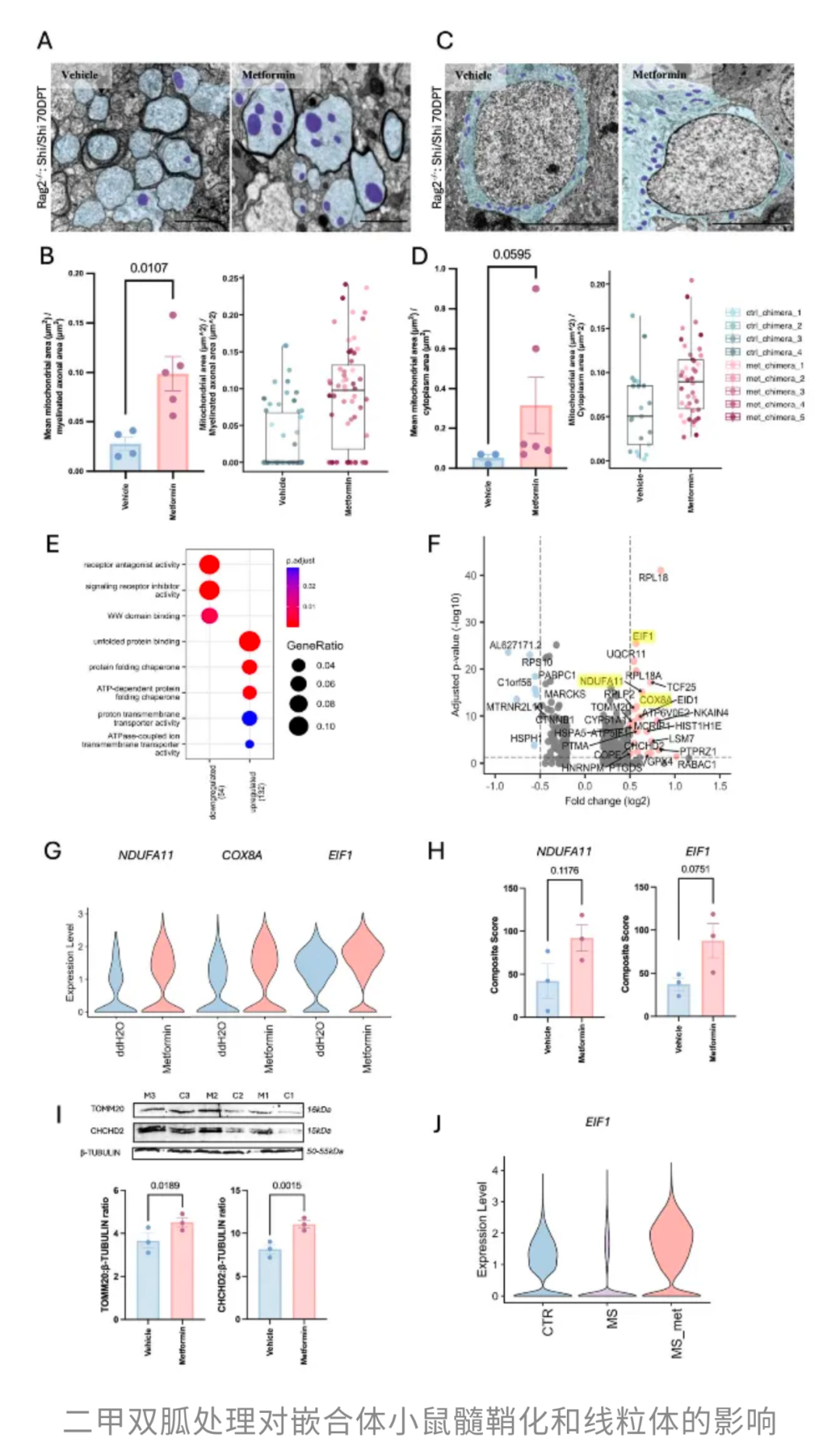
这自然引出了一个疑问:二甲双胍传统上是通过抑制线粒体复合体I来发挥作用,好比轻轻踩了一脚“能量油门”,短期让细胞里的ATP下降,并激活AMPK启动节能和代谢调控程序。为何在这里,线粒体相关基因反而被上调?
研究者解释道,这是一种细胞的自我补偿机制:线粒体通过增大体积或增加数量,并加快蛋白质翻译,好像在说:“能量不够?那我自己加班,多造几个发动机!”最终,不仅恢复了能量供应,还让代谢分配更高效。这种“先抑后补”的策略,很可能正是二甲双胍帮助少突胶质细胞更好造髓鞘的秘密。
总的来说,这项研究揭示了二甲双胍通过调控线粒体代谢和功能,增强人类少突胶质细胞分化和髓鞘形成的能力,从而可能为MS等脱髓鞘疾病提供神经保护的新思路。它不仅让“老药”焕发新生,也为未来治疗神经退行性疾病打开了新的大门。
不止杀肿瘤,还能调“免疫战场”
不难发现,从少突胶质细胞的髓鞘修复,到更多细胞类型的代谢调控,二甲双胍的核心作用始终绕不开线粒体复合体I。
有意思的是,越来越多的证据显示,这种对线粒体的“敲打”并不仅仅改变能量平衡,还可能与肿瘤生长的关键驱动力——MYC通路——发生意想不到的交集。发表于Science Advances的一项最新研究[2]就揭示,当二甲双胍与MYC抑制剂“联手”时,会形成一种合成致死效应,从而显著抑制肿瘤的生长。

MYC是什么?它是许多高侵袭、耐药肿瘤背后的关键驱动基因。因为异常激活和多癌种紧密相关,MYC曾长期被视为“不可成药”的“硬骨头”。近年来,终于出现了像MYCi975这样的候选抑制剂,疗效可期。那么,一个问题便自然而然产生了:要怎样把这类抑制剂的效果再推上一层?

也就是说,复合体I的受损,恰好能和MYC抑制彼此“补刀”。
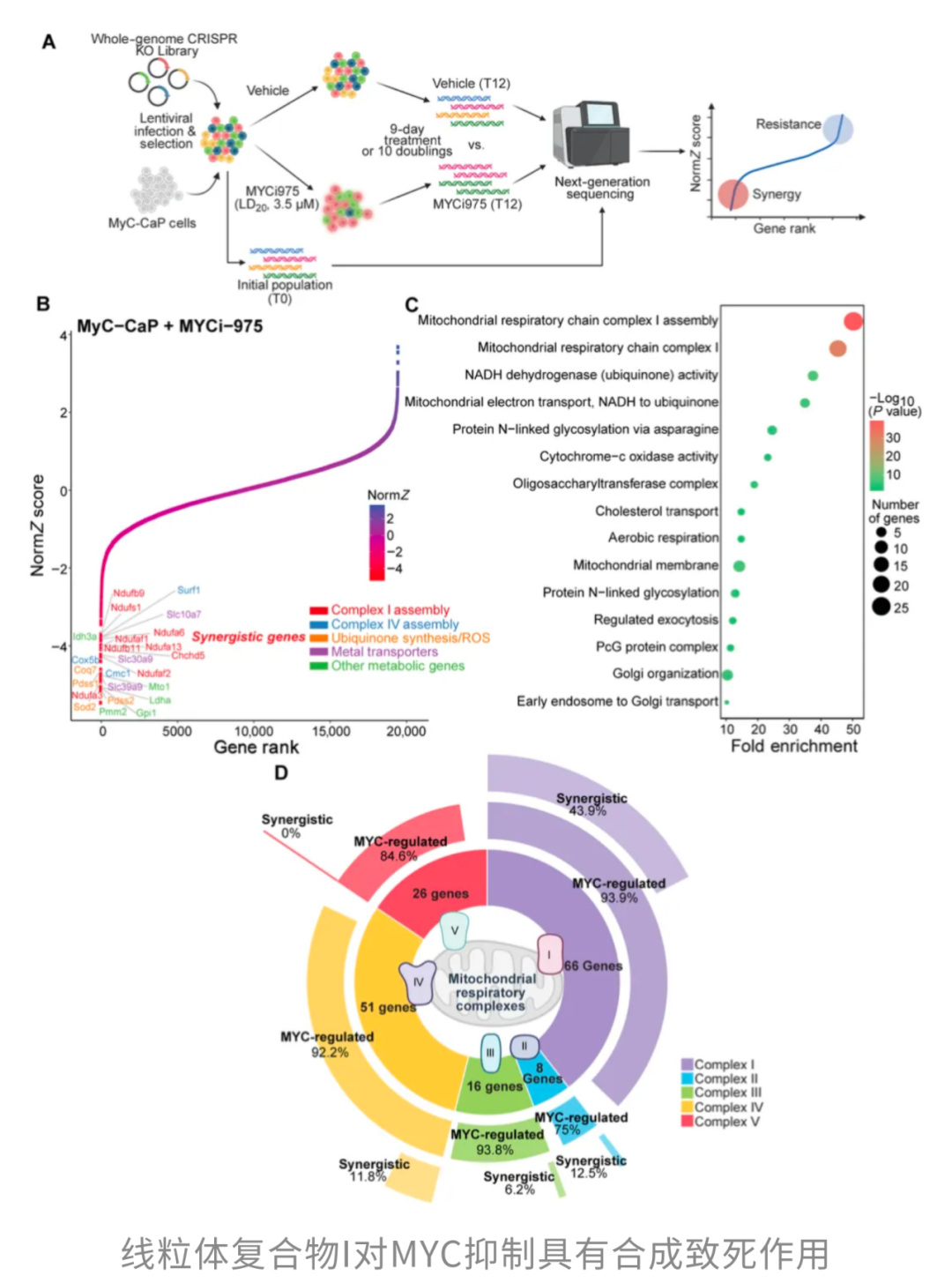
从机制上来说,MYCi975并不直接抑制复合体I的酶活性,而是通过调控核编码的线粒体基因表达,间接造成线粒体结构损伤。功能层面更“狠”:MYC抑制同时削弱了氧化磷酸化和糖酵解,肿瘤细胞陷入“能量双杀”的困境。
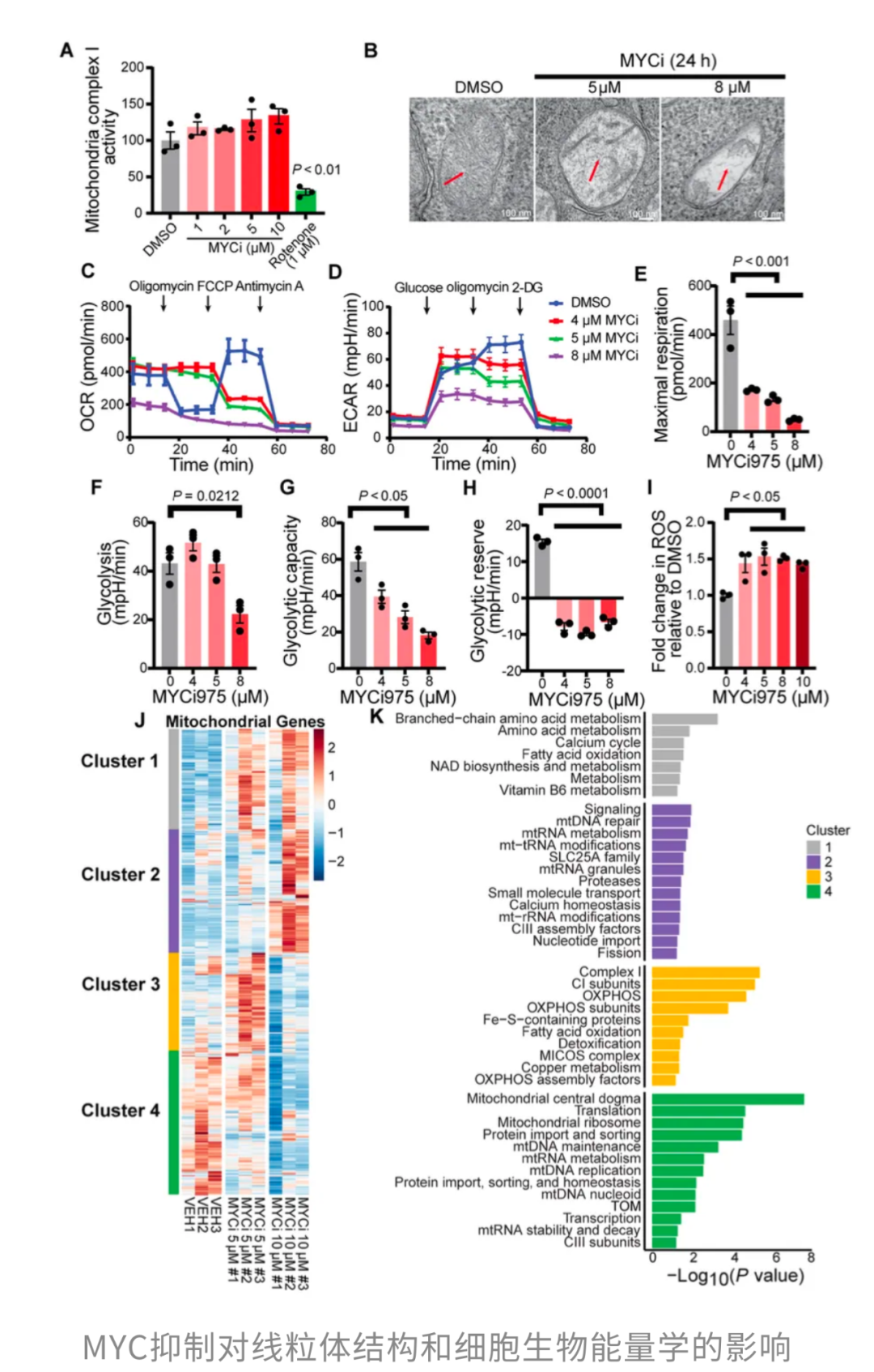
既然如此,研究团队自然想到了“老熟人”二甲双胍——这位已知能抑制复合体I的选手。果不其然,低剂量MYCi975与二甲双胍联用,在多种细胞系和小鼠肿瘤模型中都打出了强烈的协同杀伤效果。
更锦上添花的是,联合治疗还展现出免疫调节潜力。代谢组学显示,两药联用能显著提升肿瘤内嘌呤分解代谢的终产物——尿酸水平;同时,肿瘤组织里的CD8⁺ T细胞和巨噬细胞浸润明显增加。换言之,这套组合不仅直接杀伤肿瘤细胞,还可能重塑肿瘤微环境,让免疫大军更好发力。
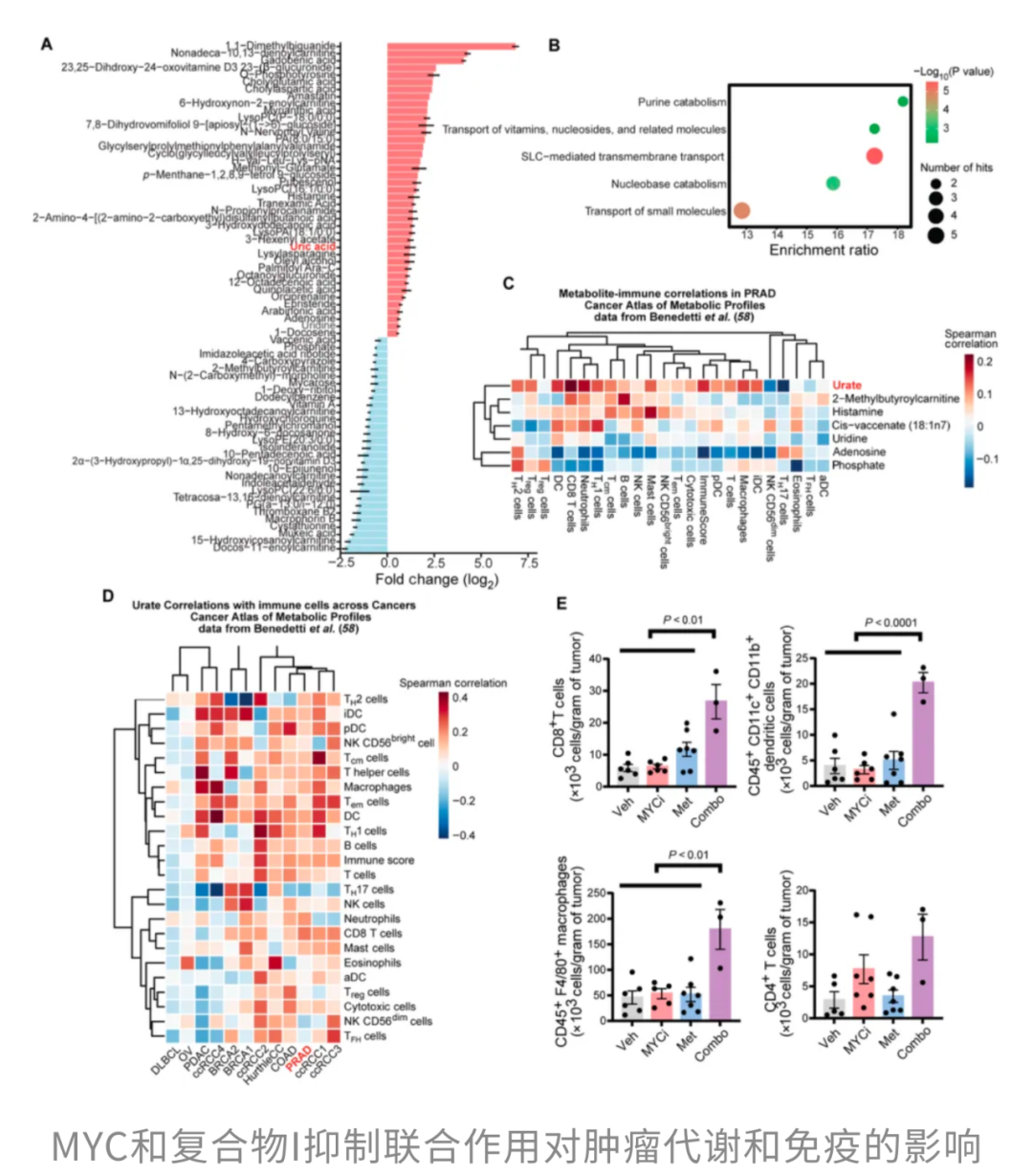
总的来说,MYC抑制与复合体I受损之间存在合成致死关系,而二甲双胍正好能把这种关系推到更强的档位。对于MYC驱动型肿瘤,这意味着一种切实可行的联合治疗策略——既瞄准能量“命门”,又推动免疫“收网”。
活到90及以上岁的几率提升30%
从神经修复到肿瘤抑制,我们已经看到二甲双胍在不同疾病场景下展现出的意外之力。它就像一位“老药新用”的探险者,总能在陌生的领域找到新的舞台。而当研究者把视野从疾病本身延伸到“衰老”这个更宏大的主题时,二甲双胍的故事又有了全新的注解。
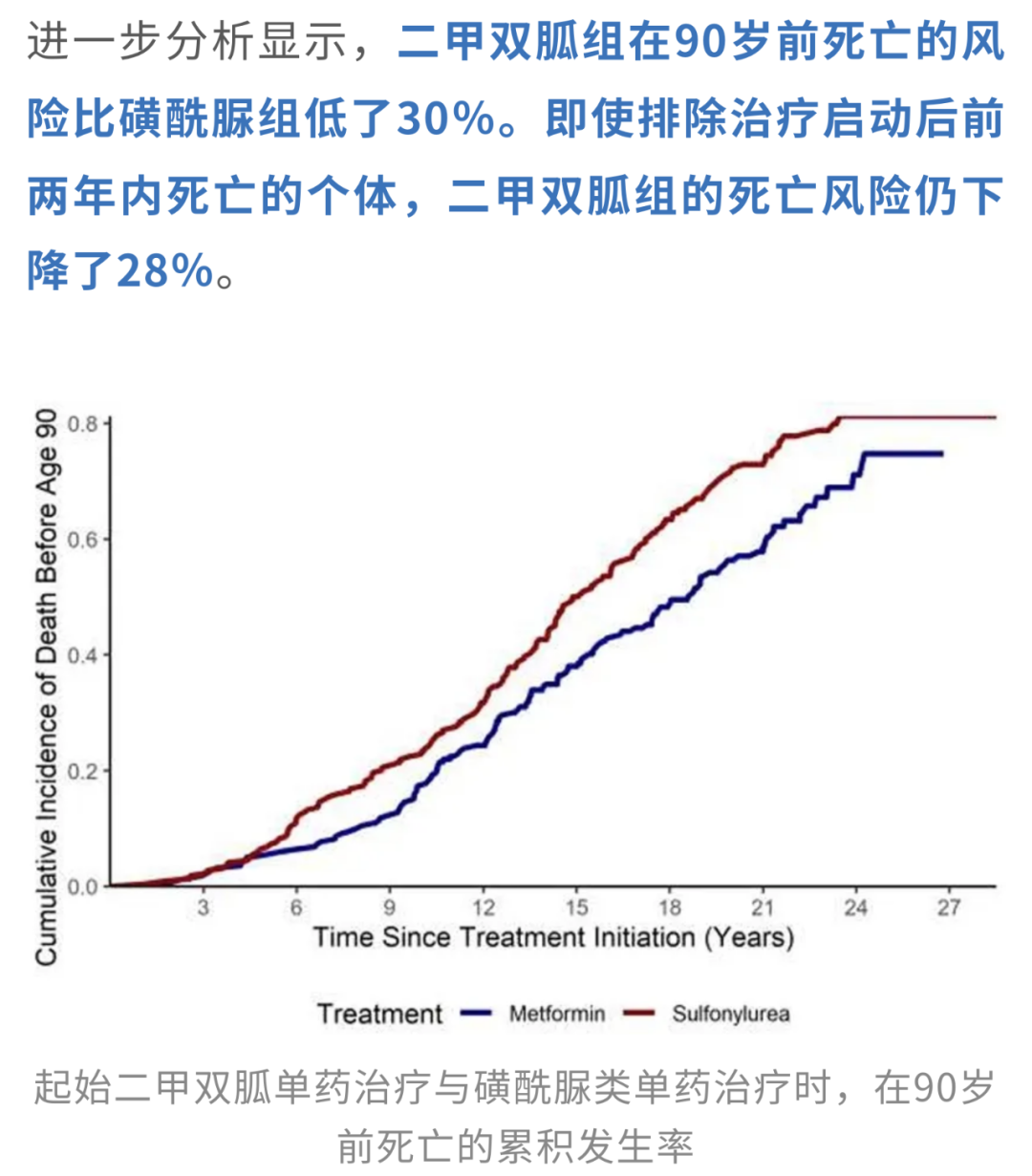
一项发表The Journals of Gerontology: Series A的研究[3]发现,与使用磺酰脲类药物的患者相比,服用二甲双胍的2型糖尿病女性活到90岁及以上的几率提升了整整30%。

这一差异意味着,在基础健康状况相似的前提下,二甲双胍使用者更可能长寿,早逝风险显著减少。
满60减20?
食蟹猴“年轻”了近6岁
其实,二甲双胍的抗衰潜力早已受到关注。在2型糖尿病女性患者数据出炉之前,一群更接近人类的动物“吗喽”(食蟹猴)已经率先体验了一把“返老还童”的快乐。
一项由中科院团队在Cell上发表的研究[4],通过观察48只食蟹猴长达40个月,全面评估了二甲双胍的抗衰老效果。研究发现,服用二甲双胍的食蟹猴在“衰老时钟”上年轻了6.41岁,相当于人类“减龄”近20年。不仅如此,这种“神药”还能起到保护大脑的作用,延缓认知衰退,使大脑的衰老进程“减速”了大约6年。

可谓是“从脑壳开始的青春重启”。
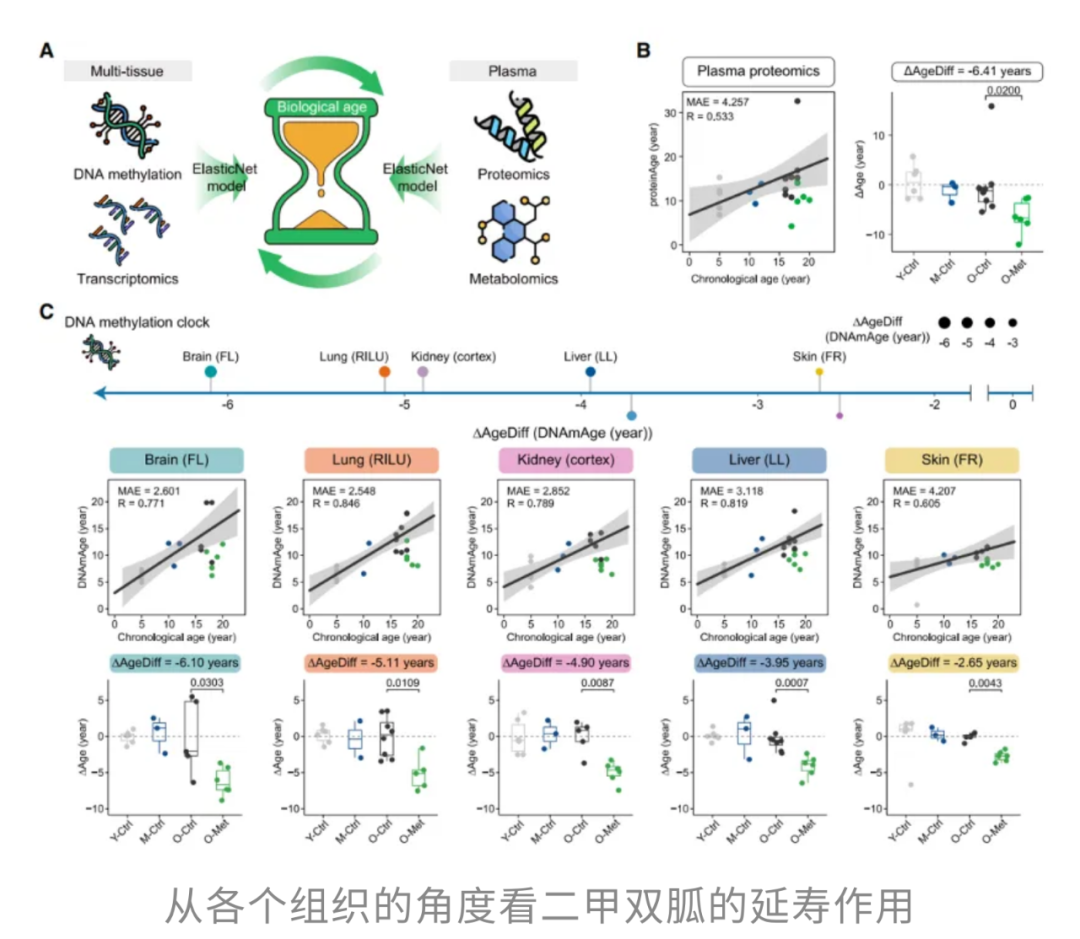
研究者进一步指出,二甲双胍通过激活细胞内的Nrf2通路,延缓神经元衰老,减少氧化应激水平,从而实现对大脑和整体机体的抗衰保护。
看来,二甲双胍还真是“开挂”了,从稳稳当当的降糖老将,一下子摇身一变,成了抗衰、抗癌、神经保护界的“多面手”。二甲双胍的故事还在继续,说不定哪天,它又会在别的领域给我们带来新的惊喜~
仍需指出的是,研究[1]中使用二甲双胍治疗的MS患者大脑样本数量有限,这可能限制了对二甲双胍在人类少突胶质细胞中作用机制的全面理解;研究[2]中对于MYC抑制剂与不同代谢调节剂结合使用的最佳剂量方案和相对效益还需要进一步的临床前和临床研究来验证;研究[3]基于观察性数据,不能直接推断因果关系;研究[4]主要基于雄性猕猴模型,未涵盖雌性数据,且未全面评估副作用及停药后的长期影响,其在人类中的普适性需进一步验证。
参考资料:
[1]Kazakou NL, Bestard-Cuche N, Wagstaff LJ, Horan K, Seeker L, Bøstrand S, Fetit R, Smith RS, Pohl FB, Neumann B, Keeler P, Franklin RJM, Williams A. Metformin alters mitochondria-related metabolism and enhances human oligodendrocyte function. Nat Commun. 2025 Aug 30;16(1):8126. doi: 10.1038/s41467-025-63279-4. PMID: 40885740; PMCID: PMC12398550.
[2]Yang W, Guo Q, Quan S, Chalmers ZR, Parker JB, Truica M, Dufficy MF, Kerber MM, Vasan K, Gupta DG, Steffeck AWT, Pan H, Siddiqui M, Pham HT, Schiltz GE, Chakravarti D, Chandel NS, Abdulkadir SA. Impaired mitochondrial metabolism is a critical cancer vulnerability for MYC inhibitors. Sci Adv. 2025 Jul 18;11(29):eadw5228. doi: 10.1126/sciadv.adw5228. Epub 2025 Jul 16. PMID: 40668928; PMCID: PMC12266110.
[3]Shadyab AH, Espeland MA, Odegaard AO, Manson JE, Haring B, Johnson KC, Chen Z, Zhang B, LaCroix AZ. Comparative Effectiveness of Metformin vs Sulfonylureas on Exceptional Longevity in Women with Type 2 Diabetes: Target Trial Emulation. J Gerontol A Biol Sci Med Sci. 2025 May 19:glaf095. doi: 10.1093/gerona/glaf095. Epub ahead of print. PMID: 40388602.
[4]Yang Y, Lu X, Liu N, Ma S, Zhang H, Zhang Z, Yang K, Jiang M, Zheng Z, Qiao Y, Hu Q, Huang Y, Zhang Y, Xiong M, Liu L, Jiang X, Reddy P, Dong X, Xu F, Wang Q, Zhao Q, Lei J, Sun S, Jing Y, Li J, Cai Y, Fan Y, Yan K, Jing Y, Haghani A, Xing M, Zhang X, Zhu G, Song W, Horvath S, Rodriguez Esteban C, Song M, Wang S, Zhao G, Li W, Izpisua Belmonte JC, Qu J, Zhang W, Liu GH. Metformin decelerates aging clock in male monkeys. Cell. 2024 Sep 12:S0092-8674(24)00914-0. doi: 10.1016/j.cell.2024.08.021. Epub ahead of print. PMID: 39270656.


