特别关注|胰岛素清除在代谢相关脂肪性肝病中的作用
时间:2025-09-04 12:10:32 热度:37.1℃ 作者:网络
非酒精性脂肪性肝病(NAFLD)是一种以肝细胞脂肪过度堆积(肝脏中脂肪含量>5%)为主要特征的进行性疾病,涵盖非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎、肝纤维化及肝癌等不同阶段。近年来,随着生活方式和饮食习惯的改变,尤其是高热量膳食摄入的增加,NAFLD的患病率持续攀升,已成为全球最常见的慢性肝病,影响全球约30%的人口,预计到2040年其患病率将高达55.7%。近期,国际消化肝病领域的两大权威期刊Gastroenterology和Journal of Hepatology相继发布共识声明,建议将NAFLD更名为代谢相关脂肪性肝病(MAFLD)。新定义更加突出了代谢因素在疾病发生中的关键作用。MAFLD的发病机制复杂,涉及胰岛素抵抗(IR)、脂质代谢、内质网应激、肠-肝轴以及炎症免疫因素等。近年来,随着对癌胚抗原相关细胞黏附分子1(CEACAM1)介导的胰岛素清除分子基础的发现,胰岛素清除减少在MAFLD进程中的作用逐渐受到关注。本文旨在探讨胰岛素清除与MAFLD之间的关系,为阐明MAFLD的发病机制及药物研发提供理论依据。
1胰岛素清除概述
1.1 胰岛素清除的生理机制
胰岛素在胰腺β细胞中合成并分泌后,通过门静脉循环首先到达肝脏。在肝脏中,胰岛素经由肝血窦毛细血管窗孔被输送至肝细胞,并与内吞受体结合后被清除。通过这一过程,约50%的胰岛素在肝脏中被“首过”清除。剩余的胰岛素通过肝静脉进入体循环,经过体循环再次通过肝脏时,约25%的胰岛素被进一步清除。体循环中的胰岛素浓度约为门静脉的1/3。进入体循环的胰岛素到达靶组织发挥作用后,通过内化被清除。在靶组织中,约25%的内源性胰岛素被肾脏清除,约15%的胰岛素被骨骼肌和脂肪组织清除。最终,残留的胰岛素进入肾脏被消除。由此可见,肝脏是胰岛素清除的主要场所。
1.2 CEACAM1与肝脏胰岛素清除
CEACAM1最初在胆汁中被发现,被认为是人体消化道正常组织抗原而被称为胆汁糖蛋白。CEACAM1是一种细胞表面跨膜蛋白,属于高度糖基化的细胞黏附分子CEA家族成员,主要表达于上皮和内皮细胞,在骨骼肌细胞和软骨细胞中不表达。CEACAM1可被胰岛素受体、表皮生长因子受体及其他酪氨酸激酶磷酸化,从而参与信号传导。CEACAM1在肝脏中高表达。在肝脏中,CEACAM1通过胰岛素受体酪氨酸激酶的磷酸化参与胰岛素代谢和脂质合成。胰岛素自胰腺β细胞脉冲式释放后,导致门静脉胰岛素浓度急剧升高,激活肝细胞中胰岛素受体酪氨酸激酶的磷酸化,进而通过信号传递使底物CEACAM1发生磷酸化并转化为活化形式。活化的CEACAM1促使门静脉中的胰岛素进入肝细胞的网格蛋白小泡,并最终在溶酶体中被降解。
2胰岛素清除影响MAFLD的发生发展
近年来,多项临床研究表明,胰岛素清除率下降与肥胖及NAFLD密切相关。肝硬化患者的肝脏对胰岛素的清除能力显著减弱。此外,临床研究发现,与非MAFLD组相比,MAFLD患者的胰岛素清除能力下降的同时,高胰岛素血症也更为明显。动物实验显示,高脂饮食喂养3周后,小鼠肝脏中CEACAM1水平降低,导致胰岛素清除受损并出现高胰岛素血症,最终加剧肝脂肪变性。值得注意的是,CEACAM1基因突变小鼠可发生肝炎并出现桥接纤维化,这是代谢功能障碍相关脂肪性肝炎(MASH)的主要特征。由此可见,胰岛素清除在MAFLD的发生和发展中具有重要作用。
3胰岛素清除影响MAFLD发生发展的作用机制
3.1 胰岛素清除与高胰岛素血症、IR
多中心长期临床循证医学研究证实,MAFLD是一种与IR密切相关的获得性代谢应激性肝损伤。IR被认为是MAFLD进展的独立预测因子和危险因素,贯穿于MAFLD的整个病程。IR的本质是外周组织(如肌肉组织、脂肪组织及肝脏等胰岛素靶组织)对胰岛素敏感性降低,临床主要表现为高胰岛素血症。传统观点认为,高胰岛素血症是IR状态下胰岛β细胞代偿性分泌增加的结果。然而,多项研究表明,肝脏胰岛素清除受损是肥胖患者高胰岛素血症的主要原因。更有直接证据表明,MAFLD患者的高胰岛素血症与胰岛素清除受损密切相关。动物实验发现,CEACAM1磷酸化位点突变的小鼠会出现胰岛素清除障碍并导致继发性IR。相反,肝脏中CEACAM1的过表达可改善高胰岛素血症,提示过表达的CEACAM1可能通过促进胰岛素清除来改善IR状态。肝脏对胰岛素的清除具有可调节性。动物研究表明,肝脏胰岛素清除率的降低是IR状态下机体维持β细胞功能的早期稳态机制。同样,基于胰岛素在外周组织中对葡萄糖及其他营养物质代谢的调节作用,当发生IR时,肝脏胰岛素清除率会适应性降低以弥补靶组织对胰岛素敏感性的下降,从而维持血液中胰岛素的较高水平。因此,IR/高胰岛素血症与胰岛素清除减少之间互为因果,形成恶性循环。然而,也有学者认为,支持“胰岛素清除降低导致IR”的临床证据有限,而“胰岛素清除率降低是对IR状态的一种适应”的观点更被广泛接受。
3.2 胰岛素清除与肝脂质代谢
现代医学研究表明,肝脂肪变性是MAFLD的主要特征,贯穿于其整个病程,而肝脂肪变性与其脂质代谢调节受损密切相关。肝脂质从头合成是导致MAFLD发生的重要因素之一。研究显示,高浓度胰岛素可诱导肝脂质从头合成,这一过程与脂肪酸合成酶(FASN)这一关键酶密切相关。最新研究发现,CEACAM1可与FASN发生交联,从而抑制FASN的活性。在生理条件下,胰岛素脉冲式释放使CEACAM1迅速磷酸化,加快肝脏对胰岛素代谢的同时,大量磷酸化的CEACAM1可下调FASN酶活性,保护肝脏免受高胰岛素水平带来的潜在脂肪生成效应。高脂饮食条件下,一方面,高脂肪通过过氧化物酶体增殖物激活受体α依赖性下调CEACAM1,导致胰岛素清除受损并出现高胰岛素血症,高胰岛素血症通过刺激食欲和棕色脂肪生成基因的表达,加剧肝脂肪变性;另一方面,当CEACAM1下调幅度>60%时(高脂肪摄入后约3周),其对FASN活性的负调控作用被消除,从而产生脂肪生成效应。反之,肝脂肪沉积也会影响肝脏对胰岛素的清除作用。在一项以大鼠肝细胞为研究对象的体外实验中,研究人员发现,高水平的循环游离脂肪酸(FFA)降低了胰岛素与其受体的结合和降解,从而导致肥胖患者肝脏胰岛素清除受损。同样,体内试验也证实了这一结果。此外,基于IR与脂质代谢互为因果、相互影响的关系,胰岛素清除受损也可能通过影响IR进一步干扰脂质代谢。
3.3 胰岛素清除与肝脏炎症
慢性炎症是代谢性疾病的重要特征之一。肝脏炎症的触发因素可能来源于肝脏外部(如脂肪组织或肠道),也可能来源于肝脏内部(如脂毒性、先天免疫反应、细胞死亡途径、线粒体功能障碍和内质网应激)。在MAFLD中,脂质过度积累会导致脂毒性。一方面,脂毒性会引起线粒体功能障碍和电子传递链受损,从而导致活性氧(ROS)的积累;另一方面,ROS会进一步损伤线粒体,加重MAFLD的病理进程,最终形成恶性循环,诱发炎症。持续的炎症反应会导致慢性炎症性改变,加剧组织损伤,并促使MAFLD向MASH和肝纤维化进展。研究表明,CEACAM1可通过与FASN交联抑制其活性,减少高浓度胰岛素介导的脂肪合成,从而降低脂毒性。从这一角度来看,高脂饮食引起的CEACAM1表达下调可能间接参与了肝脏炎症反应的发生与发展。此外,先天性免疫的激活会进一步促进炎症细胞在肝脏中的浸润和积聚,从而加剧炎症和组织损伤。例如,在肝损伤的早期阶段,中性粒细胞通过形成中性粒细胞胞外陷阱与其他促炎免疫细胞相互作用,推动肝脏代谢性炎症的发展。而CEACAM1能够调控粒细胞生成并延迟中性粒细胞凋亡,从而抑制过度炎症反应。近年来的研究还发现,CEACAM1可通过抑制蛋白酪氨酸磷酸酶1依赖的T淋巴细胞活性,进一步调控免疫反应。小鼠CEACAM1基因缺失会导致炎症加剧以及骨髓细胞和淋巴细胞的过度活化。由此可见,CEACAM1具有潜在的抗炎作用,因此可以推测,肝细胞中CEACAM1表达的减少可能促进MASH的发生与发展。
综上所述,总结胰岛素影响MAFLD发生发展的作用机制见图1。
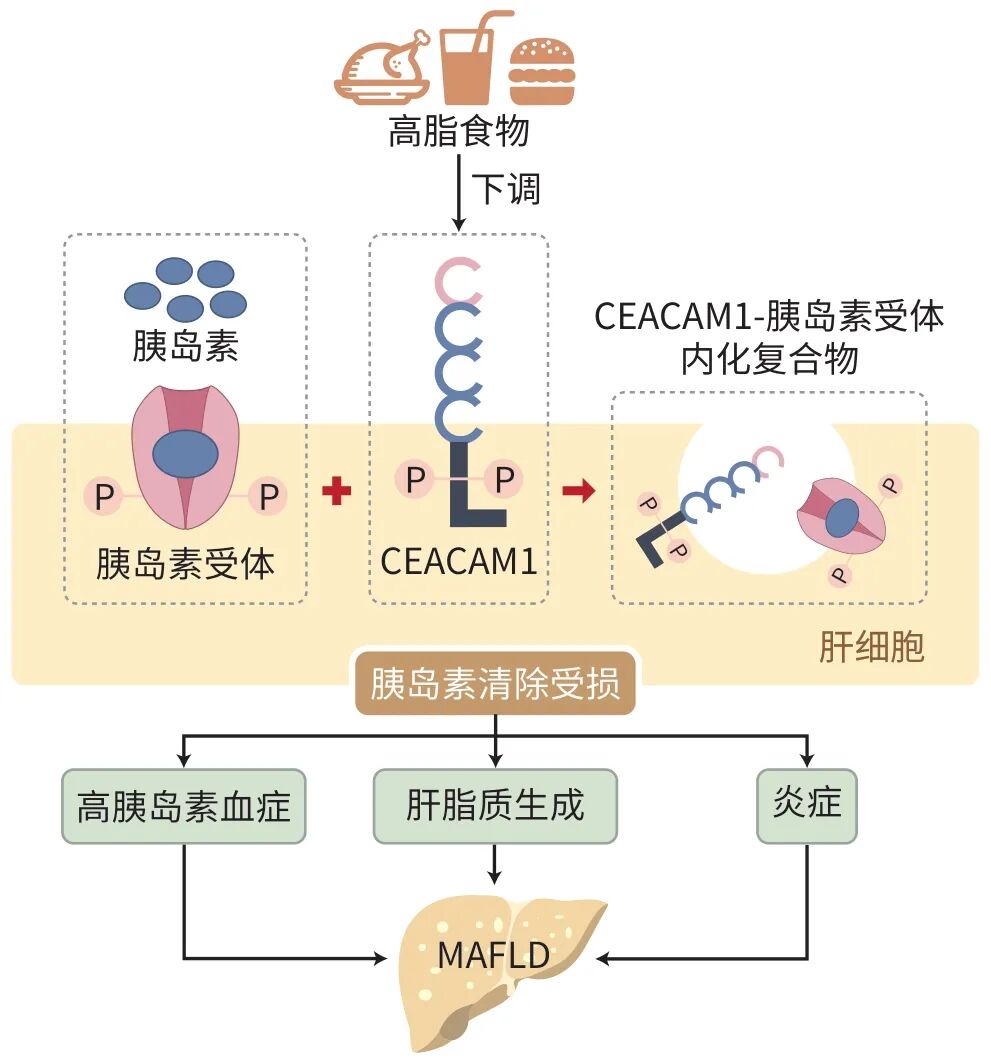
图1 胰岛素清除影响MAFLD发生发展的作用机制
4小结与展望
在物质生活日益丰富的今天,人类疾病多以代谢紊乱为基础,以NAFLD为例,其新定义——代谢相关脂肪性肝病更加凸显了代谢紊乱和代谢障碍在其进展中的重要性。事实上,多项多中心的长期临床循证医学研究已证实,MAFLD是一种与高胰岛素血症密切相关的获得性代谢应激性肝损伤。然而,目前主流观点认为,胰岛素分泌的代偿性增加是高胰岛素血症的核心机制,而对胰岛素清除与高胰岛素血症的关系关注较少。随着研究的深入,有学者发现胰岛素清除能力的下降可能早于胰岛素分泌的增加,推测胰岛素清除可能是代谢性疾病相关高胰岛素血症发生的初始因素。因此,本文聚焦于胰岛素清除,通过探讨其对IR、高胰岛素血症、肝脏脂质代谢及肝脏炎症的影响,阐明其在MAFLD发生发展中的重要作用。然而,胰岛素清除在多大程度上影响MAFLD的具体机制仍不明确,有待未来更多研究进一步验证。随着CEACAM1相关胰岛素清除分子机制研究的不断深入,有望为MAFLD、糖尿病、肥胖等代谢性疾病的治疗开辟新的途径。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50728



