厦门大学方华攀、田华雨/吉林大学吴宏团队Biomaterials:高分子基因/药物共递送系统用于治疗视网膜新生血管疾病
时间:2025-09-06 12:16:32 热度:37.1℃ 作者:网络
视网膜新生血管疾病主要包括早产儿视网膜病变(ROP)、增殖性糖尿病视网膜病变(PDR)和视网膜静脉阻塞(RVO)。随着社会的进步和医疗的改善,视网膜新生血管疾病的发病率正在迅速增加。最近研究报告指出,从2020年到2045年,全球糖尿病视网膜病变(diabetic retinopathy,DR)的人口将增加55.6%(5740万)。因此治疗视网膜新生血管疾病迫在眉睫。近年来的研究表明,视网膜新生血管疾病的发病机制除了血管内皮生长因子(VEGF)的参与,还有炎症因子的参与。基于此,厦门大学方华攀/田华雨教授团队与吉林大学吴宏教授团队合作在Biomaterials上发表了题为“Polymer-based gene-drug co-delivery system effectively inhibits pathologic retinal neovascularization through dual anti-inflammatory and anti-neovascular actions”的学术论文。在这项研究中,作者开发了一种基于苯硼酸修饰的聚乙烯亚胺(LPEI-PBA)的高效基因递送系统,该系统能够高效地递送治疗基因(pshVEGF)和地塞米松(DSP),该递送系统经玻璃体腔给药后能够有效抑制氧诱导视网膜疾病的进展。
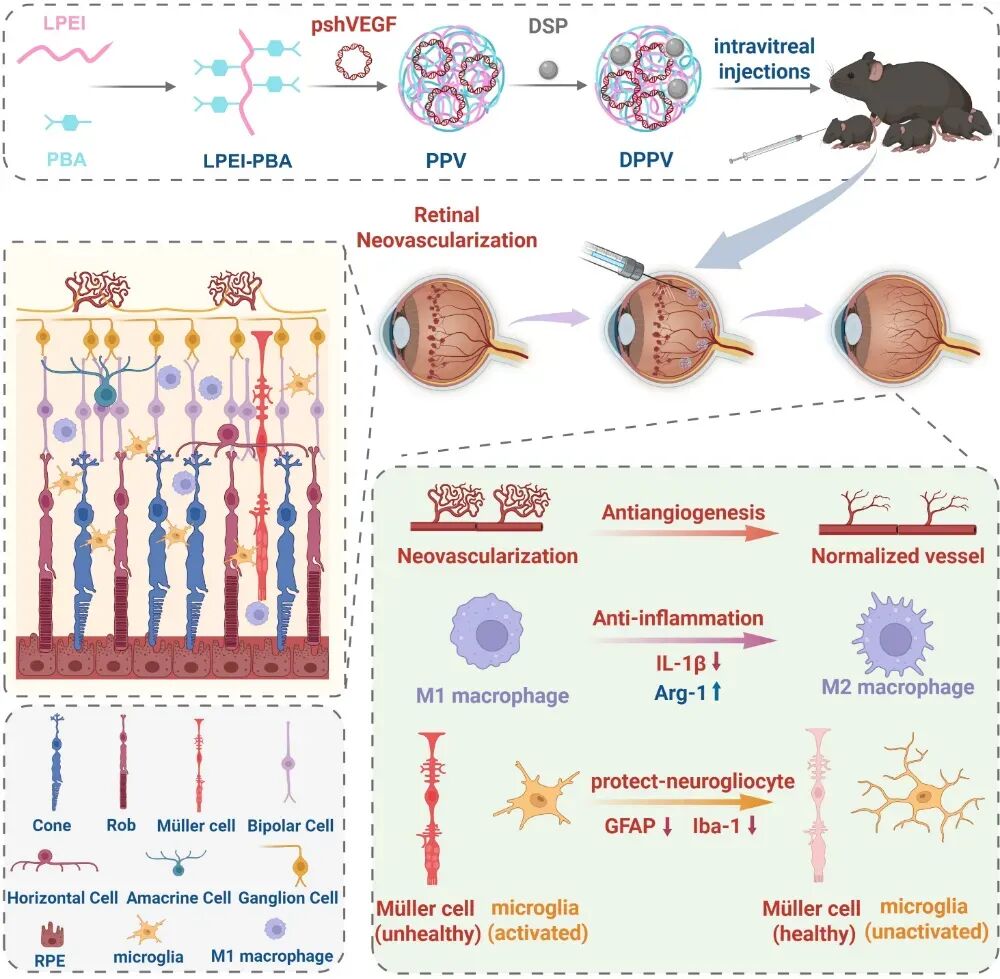
图1.高分子基因/药物共递送系统用于治疗视网膜新生血管疾病。研究中,作者建立了氧诱导视网膜病变(OIR)小鼠模型,单次玻璃体腔内注射 DSP/LPEI-PBA/pshVEGF三元复合物(DPPV)后,可显著抑制病理性新生血管生成,促进迂曲扩张的眼底大血管的恢复成正常结构。由于OIR小鼠的病变部位呈现出炎症微环境,VEGF与巨噬细胞、小胶质细胞及促炎细胞因子共同促进了新生血管的形成,因此LPEI-PBA负载的抗炎药DSP可以被细胞吸收并发挥一定抗血管生成作用。
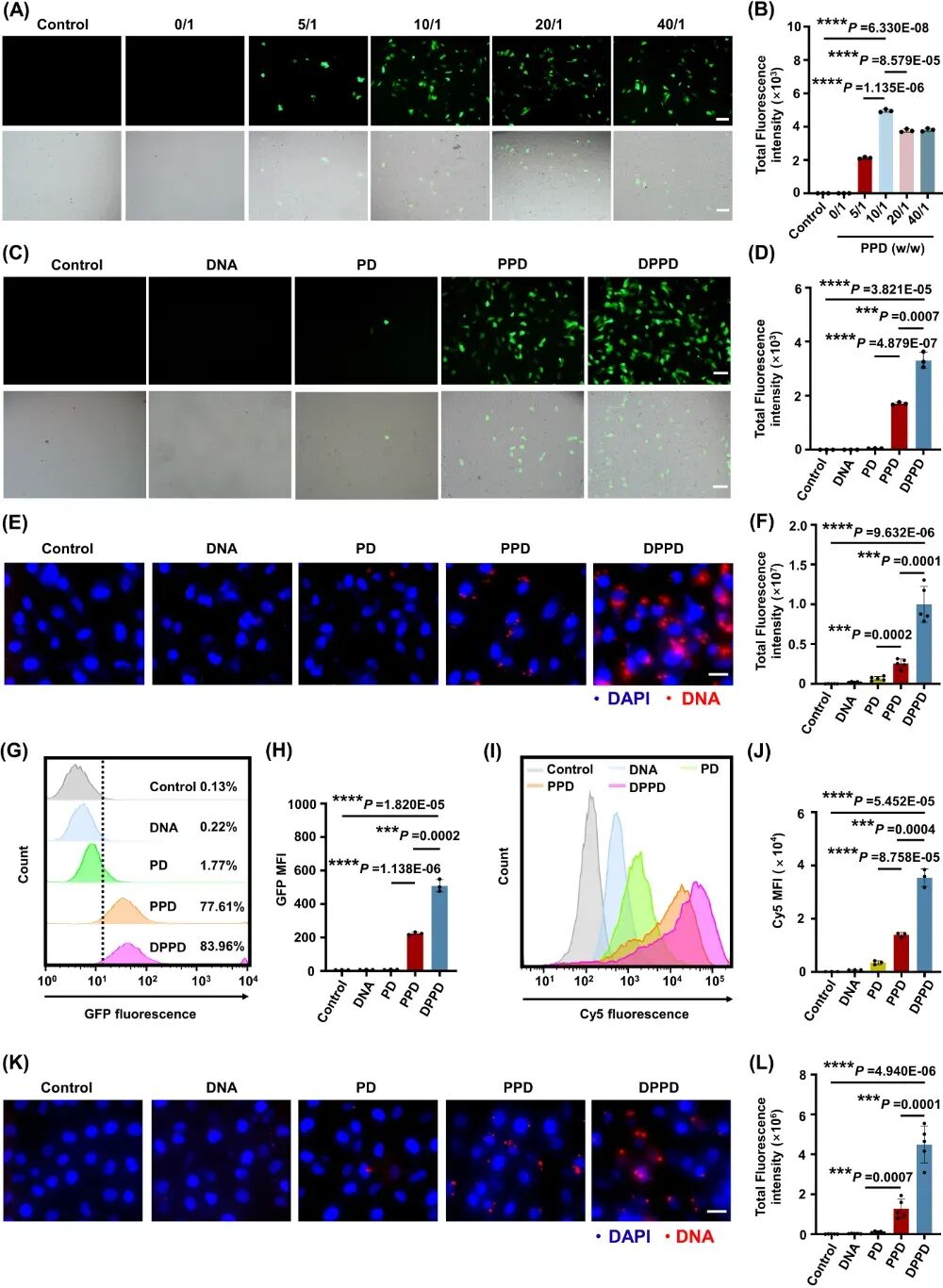
图2. 聚合物基因/药物共递送系统有效促进了细胞摄取与转染效率。
高分子载体上的苯硼酸基团与核酸分子间的氢键相互作用促进复合物形成纳米颗粒,同时与细胞膜的氢键作用进而促进细胞摄取。地塞米松作为一种临床常用的糖皮质激素受体激动剂,不仅能发挥抗炎作用,而且能够与细胞膜形成疏水作用显著提高聚合物载体的基因转染性能。
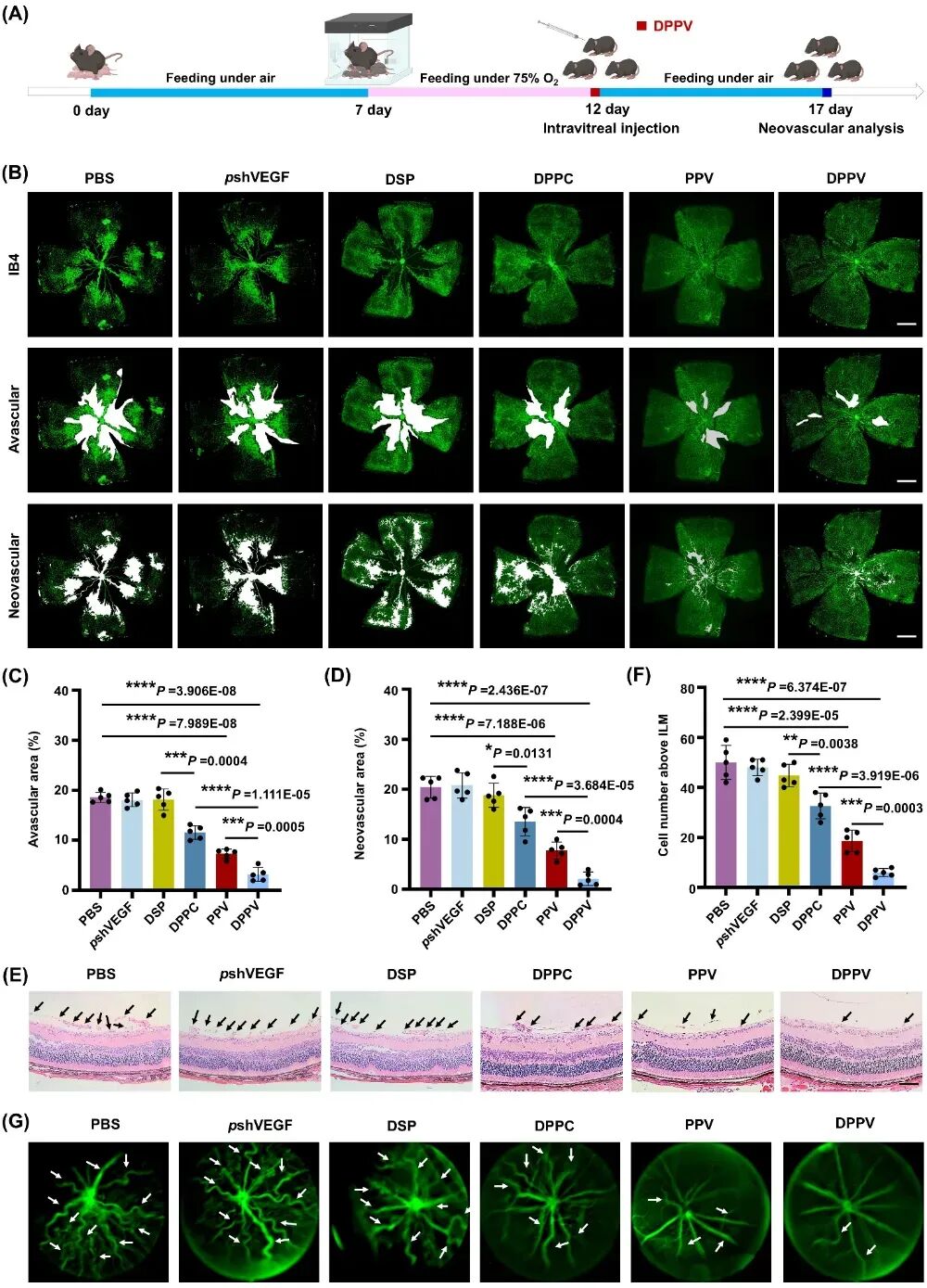
图3. 高分子基因/药物共递送系统显著缓解氧诱导视网膜新生血管疾病进展。
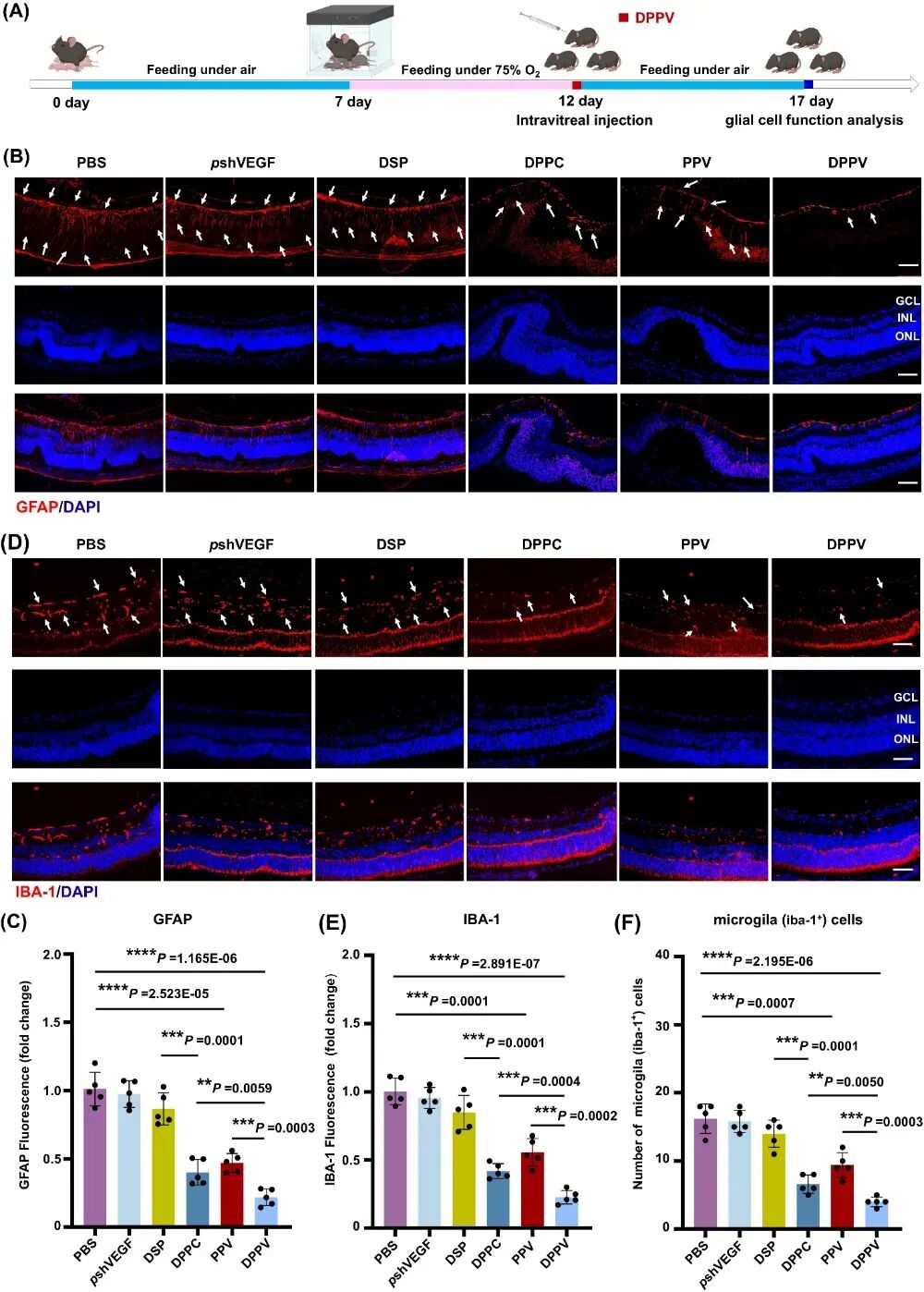
图4. DPPV有效抑制OIR小鼠模型的视网膜胶质细胞的激活。
与PBS组(无血管区18.6%,新生血管区20.41%)相比,高分子基因/药物共递送系统DPPV单次给药可显著抑制病理性新生血管,使无血管区和新生血管区分别降至3.18%和2.1%,效果优于游离pshVEGF、DSP及载体DPPC。且抗炎药物DSP通过缓解炎症微环境增强了PPV的抗血管生成效能。且DPPV有效抑制OIR小鼠视网膜小鼠Müller细胞和胶质细胞的激活。单次玻璃体注射DPPV可通过协同抗炎与抗血管生成作用,显著抑制OIR小鼠视网膜胶质细胞活化。
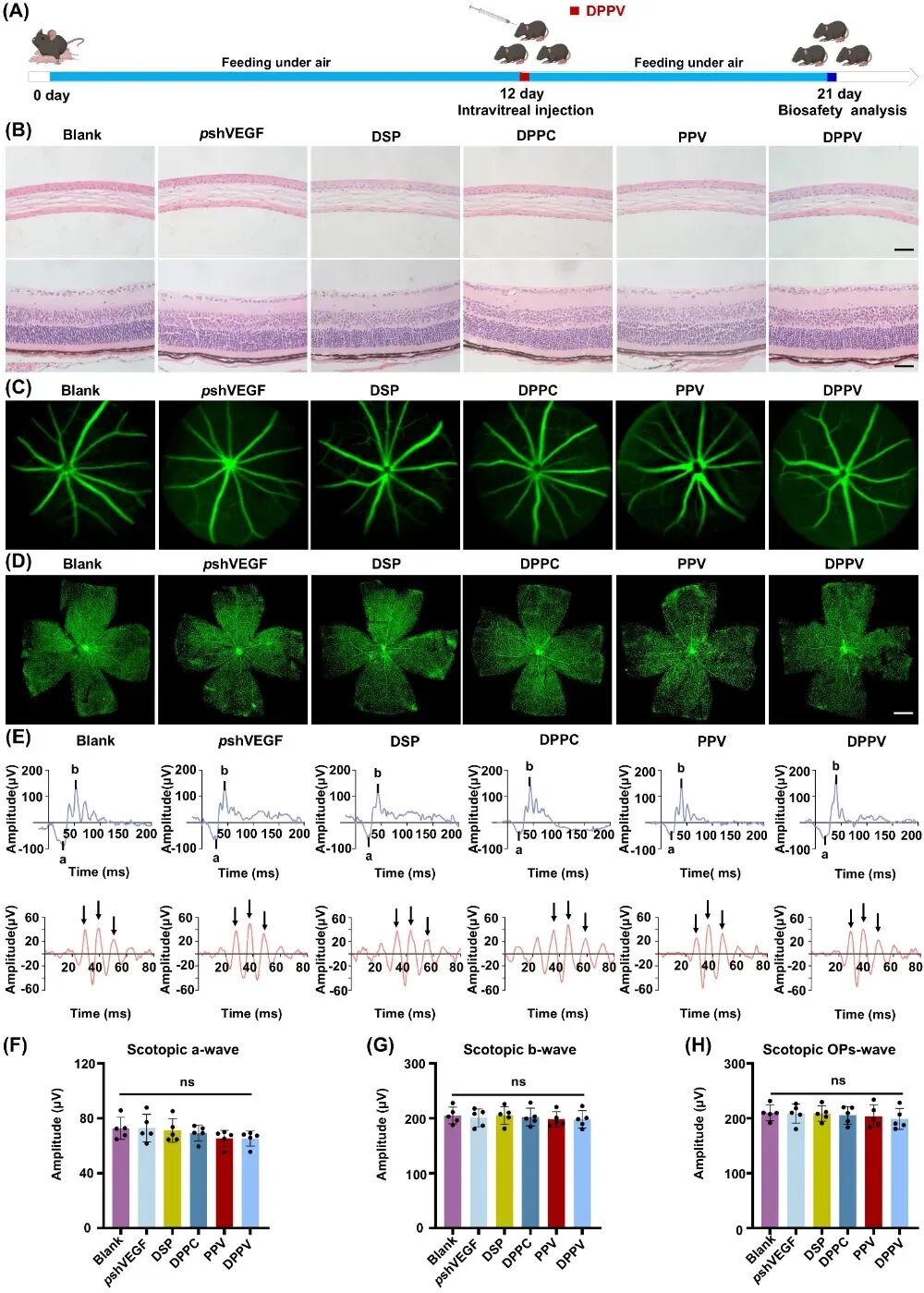
图5. 高分子基因/药物共递送系统具有良好的体内安全性。
作者采用H&E染色评估角膜和视网膜的组织病理学变化。与空白组相比,DPPV治疗组小鼠的角膜和视网膜组织未见明显病理改变。随后通过眼底荧光素血管造影检测DPPV治疗后视网膜主要血管形态,结果显示DPPV组与空白组之间未见显著差异。此外,异凝集素GS-IB4视网膜铺片染色表明DPPV对视网膜微血管形态影响极小。为评估DPPV玻璃体注射后的视网膜功能,我们进一步进行视网膜电图(ERG)检测,发现DPPV治疗组的a波、b波和振荡电位(OPs)波幅值与空白组相当,提示其对正常视网膜功能无影响。对所有主要全身器官的HE染色切片进行组织学检查显示,DPPV未引发任何结构改变,由此证实其载体系统具有良好的体内安全性。
本研究运用高分子载体担载治疗基因与抗炎药物,通过提高转染效率、抗炎抗新生血管和抑制神经胶质激活多重策略治疗视网膜新生血管疾病,为该类疾病治疗提供新范式,具备重要临床应用前景。本论文的通讯作者为厦门大学方华攀副教授与吉林大学第二医院吴宏教授,该论文得到了田华雨教授的悉心指导。该研究得到国家自然科学基金、国家重点研发计划及中央高校基金等项目的资助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S014296122500599X


