【论著】卒中后视空间忽略患者皮质形态与皮质结构协变网络的特征分析
时间:2025-09-07 12:09:40 热度:37.1℃ 作者:网络
摘要:目的探索卒中后视空间忽略(VSN)患者的皮质形态变化和皮质结构协变网络拓扑特征。方法回顾性连续纳入2023年12月至2025年2月就诊于首都医科大学宣武医院康复医学科的急性期卒中患者。收集并比较患者的一般及临床资料,包括年龄、性别、卒中类型(出血性卒中、缺血性卒中)及发病至首次头部MRI检查时间。所有患者通过线段等分测试、线段划消测试和星形划消测试评估是否存在VSN,存在VSN的患者为VSN组,无VSN的患者为无VSN组。通过头部MRI获得所有患者的大脑结构图像,将T1加权成像原始数据导入Freesurfer软件进行全脑分割,并依据Desikan-Killiany分区将左、右大脑半球皮质分为对应的68个脑区,提取每个脑区的皮质参数[皮质表面积(CA)、皮质平均曲率(CC)、皮质厚度(CT)、皮质体积(CV)]和颅内总容积,基于患者每个脑区的皮质参数计算区域特异性不对称指数(AI),评估各脑区的侧化特征,AI=(左侧-右侧)/(左侧+右侧)。采用结构协方差方法分别对每种皮质参数进行结构协变网络分析,以反映各脑区在结构形态变化上的协同变异模式。通过线性回归去除颅内总容积、年龄以及性别的影响,在组水平上分别计算各脑区之间皮质参数的Pearson相关系数的绝对值,获得68×68脑区皮质结构协变网络矩阵。将矩阵以0.1~0.4网络稀疏度(实际存在边数与最大可能边数之比)、0.01步长转化为二值矩阵,并进行图论分析。针对不同稀疏度采用置换检验比较两组皮质结构协变网络在每种皮质参数下的全局和局部图论指标。全局指标包括聚类系数、路径长度、小世界属性相关指标[包括归一化聚类系数(Gamma)、归一化路径长度(Lambda)和小世界指数(Sigma)]、全局效率、平均局部效率;局部指标包括节点度数、节点介数中心性、节点效率。结果(1)共纳入109例急性期卒中患者,男81例,女28例,年龄30~80岁,平均(64±9)岁,其中VSN组54例,无VSN组55例。VSN组和无VSN组在年龄、性别、卒中类型和发病至首次头部MRI检查时间方面差异均无统计学意义(均P>0.05)。(2)各脑区皮质参数比较结果显示,VSN组CA与无VSN组CA比较差异有统计学意义的脑区为右侧岛叶[2466.50(2143.75, 2662.50)mm2比2128.00(1961.00, 2479.00)mm2,P= 0.037],其他各脑区各参数两组间差异均无统计学意义(均P>0.05)。与无VSN组相比,VSN组CT在右侧扣带回峡部[-0.01(-0.05,0.03)比002(-0.01, 0.06), P=0.028]和中央后回[-0.02(-0.04, 0.00)比0.00(-0.02, 0.02), P=0.026]的AI更低。两组间其他各脑区各皮质参数的AI差异均无统计学意义(均P>0.05)。(3)全局指标方面,在CA协变网络中,VSN组的Sigma值在不同稀疏度和平均稀疏度(P<0.01)上均高于无VSN组;在CT协变网络中,VSN组的Lambda值在大多数稀疏度和平均稀疏度(P=0.004)上均高于无VSN组;在CC协变网络中,VSN组的聚类系数和平均局部效率在大多数稀疏度和平均稀疏度上(P<0.01)均低于无VSN组;两组间CV协变网络的全局指标在大多数稀疏度和平均稀疏度上差异无统计学意义。(4)局部指标方面,CV协变网络中,VSN组在左侧颞下回的节点效率在大多数稀疏度上低于无VSN组,平均稀疏度上也低于无VSN组[0.35(0.29,0.50)比0.65(0.51,0.72),P<0.01],两组间其他皮质参数协变网络局部指标在大多数稀疏度和平均稀疏度上差异无统计学意义。结论VSN患者存在异常的皮质形态和皮质结构协变网络拓扑特征,表现为整体整合效率下降和局部关联减弱,同时伴随小世界性增强和代偿性连接重组。本研究结论尚待多中心、大型、前瞻性研究验证。
视空间忽略(visuospatial neglect, VSN)是卒中后常见的认知障碍,主要表现为患者对病灶对侧空间刺激的注意力不集中,多见于右脑半球损伤的患者[1-2]。空间注意的偏侧障碍常严重影响患者的日常生活能力及康复效果[3-5]。既往的影像学研究多采用功能MRI(functional MRI,fMRI)[6]和弥散张量成像(diffusion tensor imaging,DTI)[7]等技术,从功能和结构连接角度对VSN进行分析。多项研究结果显示,VSN的发生主要与右侧顶叶病变相关,特别是边缘上回、角回和颞顶交界区等区域[8-9]。随着研究的不断深入,越来越多的证据表明,除了局部脑区的结构和功能改变之外,关注大规模脑网络连接情况或有助于更全面地理解VSN[10]。有研究表明,注意相关脑网络的功能连接异常,尤其是背侧、腹侧以及额顶注意网络的功能连接异常或失衡与VSN的临床表现密切相关[11-12]。另有研究显示,白质纤维束损伤,特别是上纵束和下额枕束损伤,也与VSN患者的临床症状密切相关[13-14],但其具体的神经机制尚不清楚,能够用于诊断和评估VSN的神经影像学标志物尚未明确。此外,尽管fMRI和DTI在揭示脑区间功能与结构连接变化方面具有较高的敏感性,但其临床普及率较低、操作流程复杂、检查成本较高,因此从多个角度和维度深入探讨VSN的神经机制,尤其是通过更为常规且易于推广的影像学技术全面理解其病理基础具有重要意义。
常规MRI成像因其操作简便、诊断性强,广泛应用于卒中患者的评估,其中基于T1加权成像的皮质形态学分析已成为多种神经疾病研究和临床实践中的重要工具。有研究表明,大脑皮质厚度变化不仅与卒中后运动障碍、失语等多种神经功能障碍的发生与严重程度密切相关[15-16],还可能反映潜在的病理过程或代偿机制[17-18]。此外,T1加权成像还可以提供脑组织结构协方差网络情况[19],描述结构性脑指标(如体积、表面积等)的协变[20],从而反映脑区间的潜在结构和功能联系。
本研究拟尝试从形态和连接模式的角度对卒中后VSN患者皮质结构的潜在变化进行初步分析,以期有助于对VSN患者的早期识别与干预,提升整体康复效果。
1 对象与方法
1.1 对象
回顾性连续纳入2023年12月至2025年2月就诊于首都医科大学宣武医院康复医学科的急性期卒中患者。
纳入标准:(1)年龄18~80岁;(2)存在经MRI证实的右侧大脑半球卒中。缺血性卒中的诊断符合《中国急性缺血性卒中诊治指南2023》[21],出血性卒中的诊断符合《中国脑出血诊治指南(2019)》[22];(3)病灶累及但不局限于皮质下;(4)发病至首次头部MRI时间为1~14d;(5)右利手;(6)完成VSN相关量表评估。
排除标准:(1)存在偏盲、视野缺损或其他严重视觉障碍;(2)既往卒中史;(3)既往存在神经系统疾病、精神疾病、神经发育障碍或其他已知可导致认知功能缺损的疾病;(4)脑肿瘤;(5)严重的心脏、肺部或肾脏疾病;(6)其他影响神经功能的严重疾病;(7)资料不完整。
本研究方案经首都医科大学宣武医院医学伦理委员会审核批准(伦理审批号:[2024]284号-001)。所有患者或家属签署了诊疗知情同意书。
1.2 资料收集
收集患者的一般及临床资料,包括年龄、性别、卒中类型(出血性卒中、缺血性卒中)及发病至首次头部MRI检查时间。
1.3 VSN评估及分组
所有患者在首次MRI检查前后3d内由2名中级及以上级别的康复科医师通过纸笔测试评估是否存在VSN。
纸笔测试均在水平放置的A4纸上完成。(1)线段等分测试[23]:患者需标记分布在纸上的5条不同长度(80~160mm)的水平线的中点,测量患者所标记的中点偏离实际中点的距离R(mm),偏向右侧为正值,偏向左侧为负值;线段长度为L(mm),患者的忽略分数计算公式为R/(L/2)×100%;忽视分数超过12%提示存在VSN。(2)线段划消测试[24]:测试纸上有30条长度为15~20mm、宽约1mm的短线段,左右视野各分布15条,要求患者划掉其看到的所有线段,若左侧划消的线段比右侧少3条以上,提示存在VSN。(3)星形划消测试[25]:要求患者标记测试纸上干扰物中对称分布的所有小星星(左侧区域27个,中间区域2个,右侧区域27个),左侧遗漏5个提示存在VSN。2个及以上测试项目阳性的患者诊断为VSN。
诊断VSN的患者为VSN组,无VSN患者为无VSN组。
1.4 MRI图像采集和数据处理
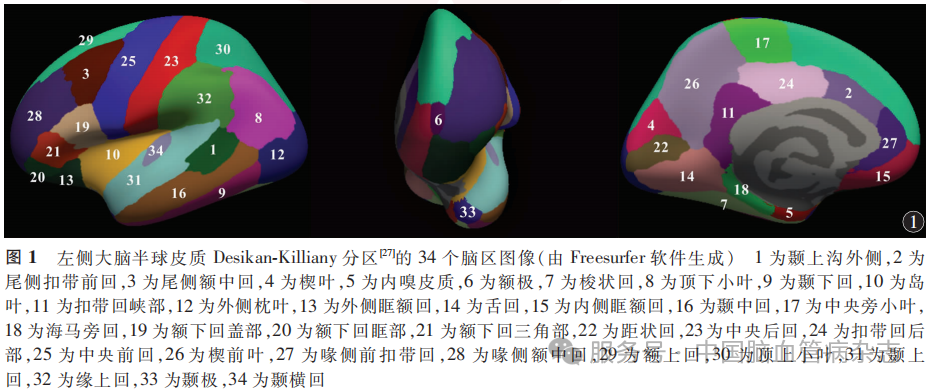
所有患者采用PHILIPS-KA5OD6A 1.5T(Philips,荷兰)和GE-pioneer 1.5T(GE,美国)MR扫描仪获得大脑结构图像。将T1加权成像原始DICOM数据转化为Nii格式,导入Freesurfer软件[26]进行全脑分割,并依据Desikan-Killiany分区[27]将左、右大脑半球皮质分为对应的68个脑区(图1)。全脑分割过程包括去头骨、头动校正、灰白质分割、非均匀强度标准化处理等31个步骤。基于分割后的结果,在stats输出文件中提取每个脑区的皮质参数[包括皮质表面积(cortical area,CA)、皮质平均曲率(cortical mean curvature,CC)、皮质厚度(cortical thickness,CT)、皮质体积(cortical volume,CV)]和颅内总容积。对于次优分割[28]导致的皮质参数缺失值,采用R语言中基于随机森林的缺失值插补方法(missForest包)进行插补[29],其插补结果在准确性上高度接近准确值[30]。基于患者每个脑区的皮质参数计算区域特异性不对称指数(asymmetry index,AI),评估各脑区的侧化特征。AI=(左侧-右侧)/(左侧+右侧)[31],AI为正值表示左侧大脑半球的皮质参数较高,AI为负值表示左侧大脑半球的皮质参数较低,以反映大脑皮质结构的不对称性。
1.5 皮质结构协变网络分析
基于前述获得的68个脑区的皮质参数(CA、CC、CT、CV),利用MATLAB (R2024a版)软件,采用结构协方差方法分别对每种参数进行皮质结构协变网络分析[32],以反映各脑区间在结构形态变化上的协同变异模式,揭示潜在的结构性耦合关系。通过线性回归去除颅内总容积、年龄以及性别的影响,在组水平上分别计算各脑区之间皮质参数的Pearson相关系数的绝对值,获得68×68脑区皮质结构协变网络矩阵。将矩阵以0.1~0.4网络稀疏度(实际存在边数与最大可能边数之比)、0.01步长[33-34]转化为二值矩阵,并进行后续图论分析。为保证网络拓扑结构的稳定性及分析结果的稳健性,针对不同稀疏度采用置换检验比较两组皮质结构协变网络在每种皮质参数下的全局和局部图论指标。全局指标包括聚类系数、路径长度、小世界属性相关指标[包括归一化聚类系数(Gamma)、归一化路径长度(Lambda)和小世界指数(Sigma)]、全局效率、平均局部效率;局部指标包括节点度数、节点介数中心性、节点效率。各参数特点[35-36]见表1。其中对于小世界属性相关指标,在每个稀疏度下生成100次随机网络用于归一化计算,进而衡量网络聚集性和整合性的相对水平。为辅助判断两组图论指标差异的整体趋势和跨稀疏度的稳健性,对两组患者图论参数差异在多个稀疏度下进行曲线下面积(area under the curve,AUC)置换检验,以更直观地展示图论指标的P值,体现平均稀疏度的差异。若两组在大多数稀疏度阈值下均表现出差异,并在平均稀疏度水平上也存在差异,则表示该差异能反映真实且稳定的网络组织特征[35,37-38]。

1.6 统计学分析
采用SPSS22.0软件对数据进行统计学分析。对于一般及临床资料,采用Shapiro-Wilk法检验计量资料的正态性。符合正态分布的计量资料以x-±s表示,组间比较采用t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,组间比较采用χ2检验。对于大脑皮质参数及AI,采用Mann-Whitney U检验比较两组之间的差异,并对组间差异进行错误发现率(false discovery rate,FDR)校正。对于皮质协变网络图论指标的组间差异采用置换检验的校正方法,经1000次置换检验验证网络图论指标的非随机性,并对局部图论指标进行FDR矫正。以P<0.05为差异有统计学意义。
2 结果
共纳入109例急性期卒中患者,男81例,女28例,年龄30~80岁,平均(64±9)岁,其中VSN组54例,无VSN组55例。
2.1 一般及临床资料比较
VSN组和无VSN组在年龄、性别、卒中类型和发病至首次头部MRI检查时间方面差异均无统计学意义(均P>0.05)。见表2。
2.2 各脑区皮质参数及AI比较
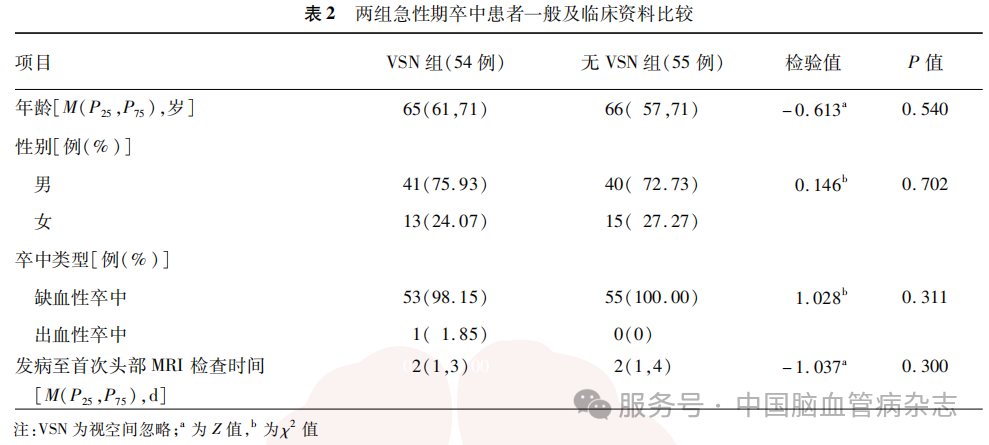
各脑区皮质参数比较结果显示,VSN组与无VSN组CA比较差异有统计学意义的脑区为右侧岛叶[2466.50(2143.75, 2662.50)mm2比212800(1961.00, 2479.00)mm2, P=0.037]。见图2a。其他各脑区各皮质参数两组间差异均无统计学意义(均P>0.05)。与无VSN组相比,VSN组CT在右侧扣带回峡部[-0.01(-0.05,0.03)比002(-0.01,0.06), P=0.028]和中央后回[-0.02 (-0.04,0.00)比0.00(-0.02,0.02), P=0.026]的AI更低。见图2b。两组间其他各脑区皮质参数的AI差异均无统计学意义(均P>0.05)。
2.3 皮质结构协变网络全局和局部指标比较
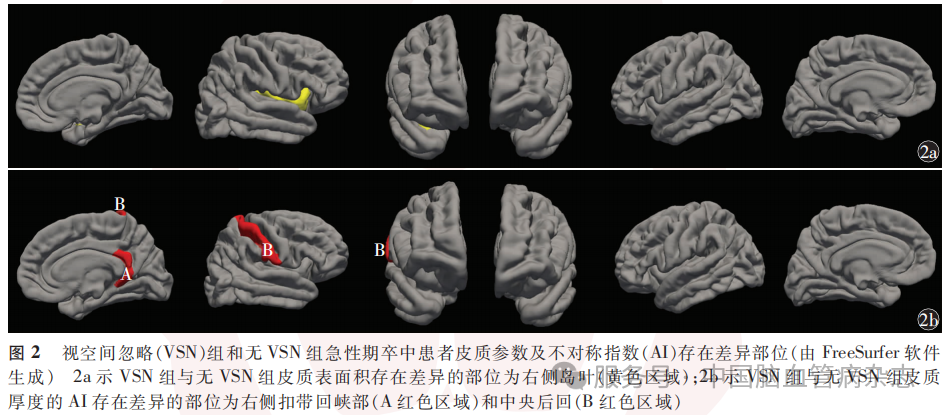
VSN组与无VSN组基于CA、CC、CT及CV4项皮质参数分别生成皮质结构协变网络(图3)。全局指标方面,在CA协变网络中,VSN组的Sigma值在不同稀疏度和平均稀疏度(P<0.01)上均高于无VSN组;在CT协变网络中,VSN组的Lambda值在大多数稀疏度和平均稀疏度(P=0.004)上均高于无VSN组;在CC协变网络中,VSN组的聚类系数和平均局部效率在大多数稀疏度和平均稀疏度(P<0.01)上均低于无VSN组;两组间CV协变网络的全局指标在大多数稀疏度和平均稀疏度上差异无统计学意义。见图4,表3。
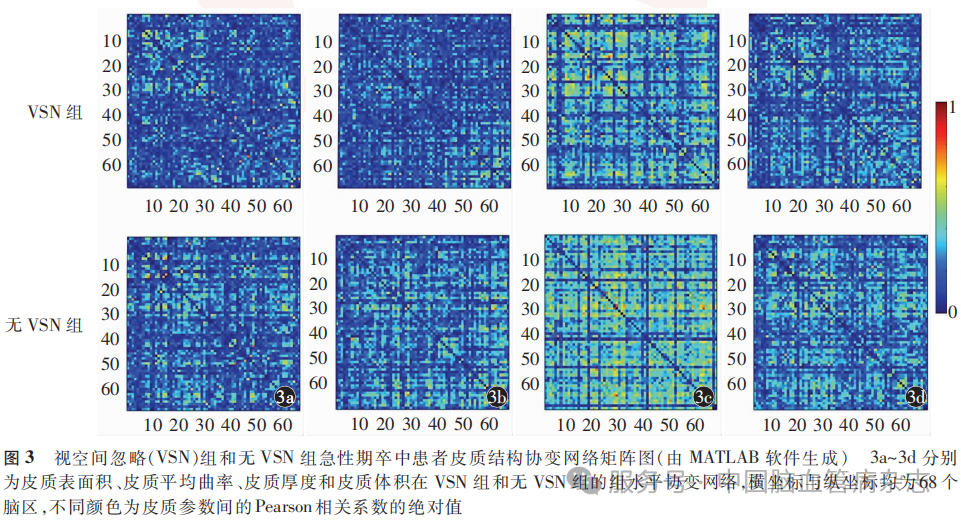
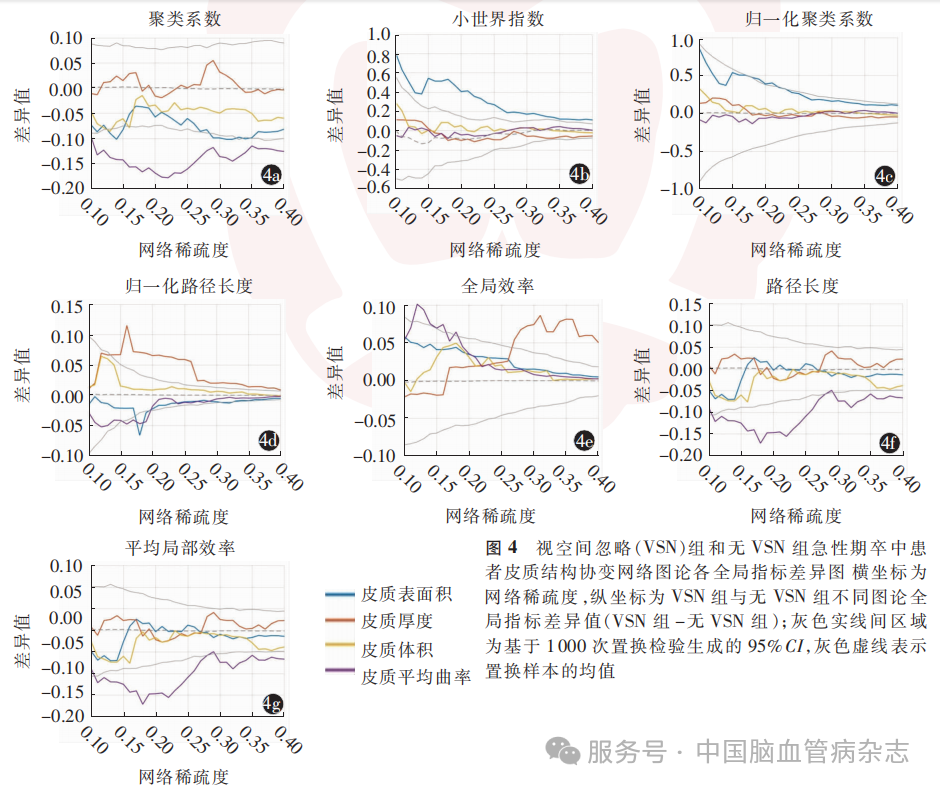
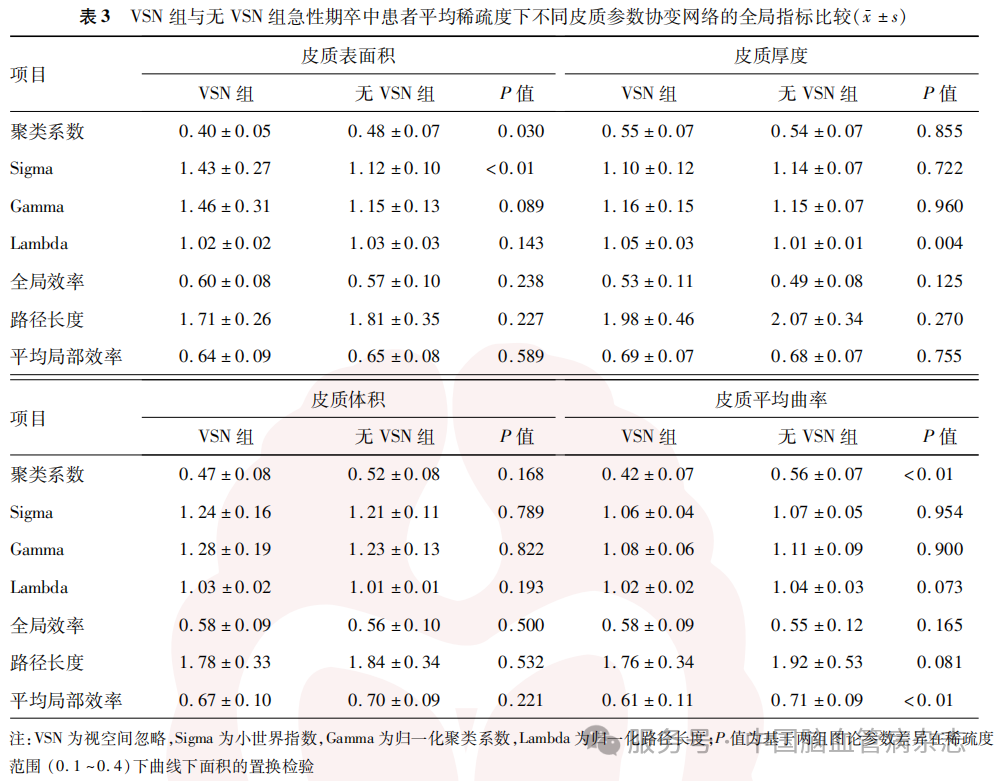
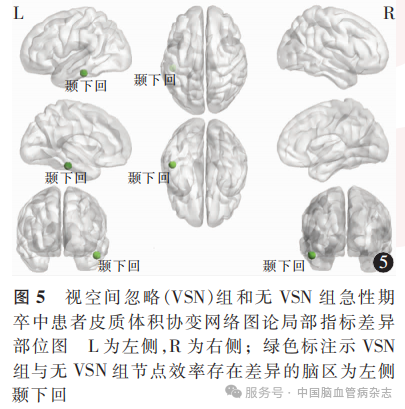
局部指标方面,CV协变网络中VSN组在左侧颞下回的节点效率在大多数稀疏度上低于无VSN组(图5),平均稀疏度上也低于无VSN组[0.35(0.29,0.50)比0.65(0.51, 0.72),P<001]。两组间其他皮质参数协变网络局部指标在大多数稀疏度和平均稀疏度上差异无统计学意义。
3 讨论
3.1 VSN相关的皮质损伤机制
本研究结果显示,右侧大脑半球卒中VSN患者在皮质形态和皮质结构协变网络方面存在异常,可能提示VSN相关的损伤机制。首先,VSN组患者右侧岛叶的CA大于无VSN组,提示岛叶结构与VSN症状可能有关。岛叶作为多模态感觉整合和注意觉醒的中枢,在认知控制和注意力调节中发挥着关键作用,其损伤可能导致患者对外界刺激的察觉能力下降[39-40]。考虑到本研究纳入的是急性期卒中患者,时间窗口较短,结构性代偿尚难以发生,因此右侧岛叶CA的增大可能并非源于重建性代偿,推测该变化可能源于以下两方面因素:(1)急性期局部脑组织的病理性肿胀或水肿反应,在卒中发病后数天内,梗死或出血灶周围的脑组织常因血-脑屏障破坏、水分潴留或神经胶质反应出现局部肿胀,该类变化可导致短期内CA增大,既往研究认为,岛叶受累与大脑中动脉供血区大面积梗死、近端大脑中动脉闭塞及卒中严重程度增加相关[41],且VSN患者通常伴随较大的脑损伤面积,进而可能导致更明显的脑组织局部肿胀反应[42];(2)岛叶结构可能在卒中发生前即存在差异,这可能反映出一种“结构易感性”,即岛叶结构更大者可能拥有不同的注意网络组织基础,在卒中后对右侧大脑半球损伤的“失衡”更为敏感,大脑注意网络的个体变异,尤其右侧突显网络结构的差异,可影响突发性注意转换与空间觉察的能力[43],而岛叶是突显网络的重要组成之一[44],因此,若该区域在卒中前承载较大的功能负荷,其突发受损后可能引发更剧烈的注意偏移,从而更易发生VSN[45]。目前关于VSN的相关脑区仍存在较大争议,其中右侧颞上回中部、内侧颞叶、右侧后顶叶区域均可能是VSN的重要结构基础[46-47]。本研究表明,岛叶在VSN患者中呈现结构性异常,提示其可能在VSN的发生与维持过程中发挥作用。未来可进一步结合功能成像与纵向追踪,探索岛叶在VSN发生、维持及恢复过程中的动态作用。
本研究结果显示,VSN组的CT在右侧扣带回峡部的偏侧化明显强于无VSN组,而右侧扣带回峡部为默认模式网络(default mode network,DMN)的核心节点[46]。CT相对稳定,其变化可在卒中后几周至几年内发生[47]。因此本研究中观察到的CT偏侧化可能为卒中前已有的DMN结构侧化特征,而非卒中后的继发性改变。既往研究显示,在执行需要注意的认知任务时,通常可观察到两种相反的反应,即额、顶叶皮质的活动增加[48],而后扣带回、内侧和外侧顶叶以及内侧前额叶皮质的活动减少[49-50]。前者大致对应于涉及外部注意的注意网络(如背侧注意网络、腹侧注意网络),后者则构成了DMN,这两大网络在功能上存在互相竞争和动态交替的关系,是维持外部注意资源分配的重要机制[51]。VSN的核心特征为右侧大脑半球注意网络(如背侧注意网络及额顶注意网络)功能受损[52-53],在卒中引起右侧大脑半球相关结构破坏的情况下,注意资源的调配与目标导向性激活将受到严重干扰。与此同时,若DMN未能有效受到功能性抑制,反而因其在结构上呈现出右侧偏侧化优势而保持持续活动,可能导致认知资源的异常占用,进而抑制背侧注意网络或额顶注意网络的功能恢复与激活[54]。这种“去抑制”的DMN活动状态,可能干扰外部注意的正常分配,削弱注意网络对空间信息的处理能力,构成VSN发生的重要神经机制之一[55]。
除皮质结构的改变以外,本研究中VSN组患者的皮质结构协变网络表现为整体整合效率下降和局部关联减弱。在CC协变网络中,VSN组的聚类系数和平均局部效率在大多数稀疏度和平均稀疏度上均低于无VSN组,提示相邻脑区之间的信息交互效率降低,信息整合能力受损[56-57]。健康大脑的结构网络呈模块化运作形式[58],具有高效的局部聚合能力和较短的全局路径[59-60],从而实现功能的有效整合与分离[61]。而VSN患者较低的聚类系数和平均局部效率提示其可能存在神经通路中断,各功能区之间的通信受限,从而影响网络的大规模整合[36,62]。这种局部效率的下降在一定程度上可能与认知负荷的增加有关[63],表明VSN患者可能需要花费更多的精力作出决策。一项基于fMRI的研究表明,VSN患者(11例)的大脑网络通常呈现较低的模块化状态,网络内耦合性较弱,网络间相互作用稀疏[64]。此外,一项基于功能近红外光谱的研究进一步表明,VSN患者(21例)相较于非VSN患者(12例)的大脑网络全局效率较低(P<0.01),路径长度延长(P<0.01)[65]。本研究中尽管VSN组和无VSN组在皮质参数上仅右侧岛叶CA存在差异,但在皮质结构协变网络指标上VSN组存在多项异常。这些异常反映了大脑网络的功能性变化,提示VSN的发生可能与大规模脑网络的整体失调密切相关,而非单一脑区损伤所致。VSN组在大脑网络的全局效率、局部连接性等多个指标上下降表明其大规模网络的信息传递的效率减缓和功能整合能力受损。
3.2 VSN的潜在代偿机制与连接重构
本研究中尽管VSN患者的脑网络存在整体整合效率的异常,但大脑可能同时启动了一定的代偿机制,试图通过网络重组减轻损伤。VSN组在CA协变网络中Sigma值升高,在CT协变网络中Lambda值增加,提示小世界性增强。小世界性增强通常表明脑网络趋向于划分成多个高度连接的子模块,以保持一定的整体连接性[36]。因此尽管整体网络连接在卒中后受损,但大脑可能通过新的间接连接或神经回路进行网络重组,实现部分功能代偿[66-67]。有研究通过功能网络分析发现,卒中患者损伤的直接连接可能由新的间接通路所代偿,这些新增的连接与患者的康复程度直接相关[68]。同时,一项基于脑电图的研究也显示,急性卒中患者(30例)在α2波段的小世界指数呈双侧升高,提示局部连接减弱的同时,大脑半球内整合增强,表明脑网络通过增强不同大脑半球之间的相互作用来代偿功能缺失[69]。尽管本研究采用的T1加权成像对网络可塑性与代偿性连接变化的反映存在一定限制,不能明确其发生的具体网络位置,但本研究结果再次验证了人脑的强大鲁棒性,即受损脑区的功能可以通过周围区域或其他具有类似功能的神经结构进行代偿[70]。但小世界性增强并不总是有利的。过度的模块化可能限制不同功能系统之间的信息流动,进而影响大脑的灵活性与适应性,即小世界指数过高提示网络高度分割,各子模块内部连接紧密但彼此交流减少,可能导致功能刚性化[71]。未来研究可以进一步探讨小世界性特征的变化是否与功能代偿相关,特别是在康复过程中探索这一特性是否会趋向正常化[72]。此外,着眼于探索功能性网络连接的变化,尤其是不同功能网络之间的相互作用,或将有助于揭示大脑在遭受损伤后的适应机制,并进一步了解如何通过促进不同网络之间的优化连接来改善康复效果。
除整体网络拓扑变化外,本研究还观察了可能与卒中后早期代偿相关的区域性网络特征改变。在皮质体积协变网络中,VSN组在左侧颞下回的节点效率低于无VSN组。左侧颞下回位于视觉腹侧通路的下游,是视觉、听觉和边缘系统信息整合的交汇枢纽,在将单模态知觉转化为多模态概念方面发挥关键作用[73]。已有研究指出,左侧颞下回在语义加工、面孔识别及内感受状态等社会知觉过程中具有重要作用[74],也是下行听觉-视觉整合路径中的高级异模态整合中心[75]。解剖上,颞下回可通过下纵束、下额枕束等主要白质束与前额叶皮质和边缘系统形成广泛连接[76],这些通路使颞下回成为感觉-认知转换的枢纽,在VSN及视觉工作记忆功能中发挥关键作用[77]。节点效率的下降提示该区域在VSN急性期可能处于连接弱化或整合能力下降的状态,其在结构网络中的枢纽作用暂时性减弱[78-79]。VSN的核心特征为右侧空间注意网络的功能障碍[80],其或可解释为跨大脑半球的代偿机制,即左侧视觉腹侧通路可能主动抑制其自身的活动,减少对认知资源的占用,将更多的神经处理资源和优先级让渡给右侧半球的注意网络,以维持对空间信息的处理,提示了大脑卒中后可能存在一种潜在的功能重新分配和代偿机制[81]。本研究为横断面设计,无法确定皮质体积协变网络中,VSN组在左侧颞下回的节点效率低于无VSN组是否为卒中后快速诱发的代偿性重构,未来研究或可结合纵向影像学随访、白质纤维连接及功能网络活动等多模态指标,进一步阐明该区域在卒中后注意资源动态调配与网络适应性重组中的作用机制。
本研究存在一定的局限性。(1)本研究样本量相对较小,且未纳入健康对照组,限制了对疾病特异性脑网络变化的系统比较,也在一定程度上影响了研究结论的普适性。(2)在脑区划分过程中,本研究采用了Desikan-Killiany分区,虽然其具有较好的通用性和可重复性,但未能充分考虑VSN患者病灶分布的个体差异以及其特有的病理机制。未来研究可进一步结合空间注意网络相关脑区,尝试基于个体病灶特征进行更具针对性的脑区划分,或引入病灶掩膜等技术,以提升图论分析的解剖学特异性与解释力。(3)本研究仅聚焦于卒中急性期患者,尚未涉及康复过程中的其他关键阶段,因而难以揭示脑网络随恢复进程的动态演变特征。未来可收集不同恢复阶段的纵向数据,对脑网络变化进行持续跟踪,以更加全面、深入地理解VSN的神经机制及其可塑性过程。(4)本研究中对VSN的评估主要基于近空间任务(线段等分、线段划消与星形划消),因此所得结果主要反映近空间VSN的脑网络特征。未来研究可进一步区分近空间与远空间忽略类型,或结合多种空间层级的任务范式,以更全面地揭示不同空间维度的忽略现象在卒中后大脑网络功能连接中的作用机制。


