食管癌患者术后呼吸衰竭的危险因素及其预测模型构建
时间:2025-09-07 12:10:04 热度:37.1℃ 作者:网络
摘 要
目的 探索食管癌患者术后呼吸衰竭(respiratory failure,RF)的危险因素,构建基于最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)-logistic回归的预测模型,并对所建模型进行可视化处理。方法 回顾性纳入2020—2023年在中山大学附属肿瘤医院甘肃医院胸外科接受手术治疗的食管癌患者,根据术后是否发生RF,将患者分为RF组和非RF(non-respiratory failure,NRF)组。收集两组患者的临床资料,应用LASSO-logistic回归优化模型的特征选择,构建预测模型。基于Bootstrap法重复抽样1000次对模型进行内部验证。结果 共纳入217例患者,其中RF组24例,男22例、女2例,平均年龄(63.33±9.10)岁;NRF组193例,男161例、女32例,平均年龄(62.14±8.44)岁。LASSO-logistic回归分析显示,一秒率(forced expiratory volume in one second/forced vital capacity,FEV1/FVC)占预计值的百分比(percentage of FEV1/FVC to predicated value,FEV1/FVC%pred)[OR=0.944,95%CI(0.897,0.993),P=0.026]、术后吻合口瘘[OR=4.106,95%CI(1.457,11.575),P=0.008]、术后肺部感染[OR=3.776,95%CI(1.373,10.388),P=0.010]是食管癌术后RF的危险因素。根据上述危险因素构建预测模型,受试者工作特征曲线下面积为0.819[95%CI(0.737,0.901)]。校准曲线Hosmer-Lemeshow检验表明该模型具有良好的拟合优度(P=0.527)。决策曲线显示阈值概率在5%~50%时模型具有良好的临床净收益。结论 FEV1/FVC%pred、术后吻合口瘘、术后肺部感染是食管癌患者术后RF的危险因素,基于LASSO-logistic回归分析法构建的预测模型有望帮助医务人员筛选出高危患者,以便进行早期个体化干预。
正 文
食管癌是全球第11大最常见癌症和第7大癌症死亡原因[1]。在中国,食管癌的总发病率和死亡率分别居第7位和第5位,大约70%的食管癌患者为男性,其中90%以上是食管鳞状细胞癌(鳞癌)[2]。食管癌的治疗方法多种多样,包括内镜治疗、手术、放疗、化疗、免疫治疗等,其中手术仍然是食管癌患者治愈性治疗的主要方式[3]。但食管癌手术风险高、操作复杂、损伤大、术后并发症复杂,被认为是胸外科最具挑战性的手术之一[4]。
呼吸衰竭(respiratory failure,RF)是食管癌术后一种严重的并发症,发生率2.4%~15.3%不等[5-8]。RF的发生不仅增加了死亡率,还削弱了抗肿瘤治疗效果,是患者不良临床结局的主要影响因素[8]。因此,提早发现RF患者的危险因素,建立模型预测RF风险可以优化个体化治疗策略,对于改善患者预后至关重要。既往已有学者进行相关研究,但大多数研究的变量筛选过程都是基于单变量和多变量分析,在处理变量间的多重共线性方面存在一定局限性。采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归进行变量筛选,可以降低模型的复杂性,防止过拟合,进而选择最相关的特征[9]。本研究将LASSO回归与logistic回归相结合,建立新的可视化预测模型,可以早期筛选高风险个体,制定干预方案,实现精准医疗。
1 资料与方法
1.1 临床资料和分组
回顾性分析2020—2023年在中山大学附属肿瘤医院甘肃医院胸外科接受手术治疗的食管癌患者。纳入标准:(1)术前经内镜活检病理确诊为食管鳞癌或腺癌;(2)接受食管癌根治手术。排除标准:(1)合并其他恶性肿瘤病史;(2)行姑息性手术;(3)临床数据不全;(4)围手术期因RF外的其他原因死亡。根据术后是否发生RF(包括Ⅰ型和Ⅱ型),将患者分为RF组和非RF(non-respiratory failure,NRF)组。
1.2 观察指标
通过全面查阅相关文献和临床判断详细收集患者的临床资料,包括年龄、性别、体重指数、吸烟史、饮酒史、新辅助治疗史、合并症、家族肿瘤史、肺功能一秒量(forced expiratory volume in one second,FEV1)、一秒率(forced expiratory volume in one second/forced vital capacity,FEV1/FVC)占预计值的百分比(percentage of FEV1/FVC to predicated value,FEV1/FVC%pred)、最大通气量(maximal ventilation volume,MVV)、一氧化碳弥散量(diffusing capacity of carbon monoxide,DLCO)占预计值的百分比(percentage of DLCO to predicated value,DLCO%pred)、肿瘤位置、手术方式[微创(胸腹腔镜联合三切口或两切口食管癌根治术)、开放(两切口或一切口食管癌根治术)]、手术资料(手术时间、术中补液、淋巴结清扫个数)、肿瘤病理分期、术后并发症(吻合口瘘、肺部感染、心房颤动、低蛋白血症等)。
1.3 诊断标准
术后RF[10]:患者术后2周内,根据动脉血气分析结果,RF分为Ⅰ型:动脉血氧分压(arterial oxygen pressure,PaO2)<60 mm Hg(1 mm Hg=0.133 kPa),二氧化碳分压(arterial oxygen carbon dioxide pressure,PaCO2)降低或正常;Ⅱ型:PaO2<60 mm Hg,PaCO2>50 mm Hg。术后低蛋白血症:血清白蛋白<30 g/L。
1.4 统计学分析
采用SPSS 26.0软件进行数据分析。计数资料以例数和百分比表示,组间比较采用Pearson χ2检验或Fisher确切概率法。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位数间距)[M(IQR)]表示,组间比较采用非参数秩和检验。
为选择潜在的预测特征,将最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归模型中选择的特征进行多变量logistic回归分析,以确定具有统计学意义的预测因子,利用这些预测因子构建预测模型。这些特征以比值比(odds ratio,OR)、95%置信区间(confidence interval,CI)和P值描述。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),绘制校准曲线,同时行Hosmer-Lemeshow检验,以评估列线图的整体判别能力和校准性。采用决策曲线分析衡量队列中不同阈值概率的净效益。LASSO-logistic回归使用R4.3.2软件开发。双侧检验,P≤0.05为差异有统计学意义。
1.5 伦理审查
本研究已通过中山大学附属肿瘤医院甘肃医院伦理委员会批准,批准号:P-LW202407160006。
2 结果
2.1 患者一般临床资料
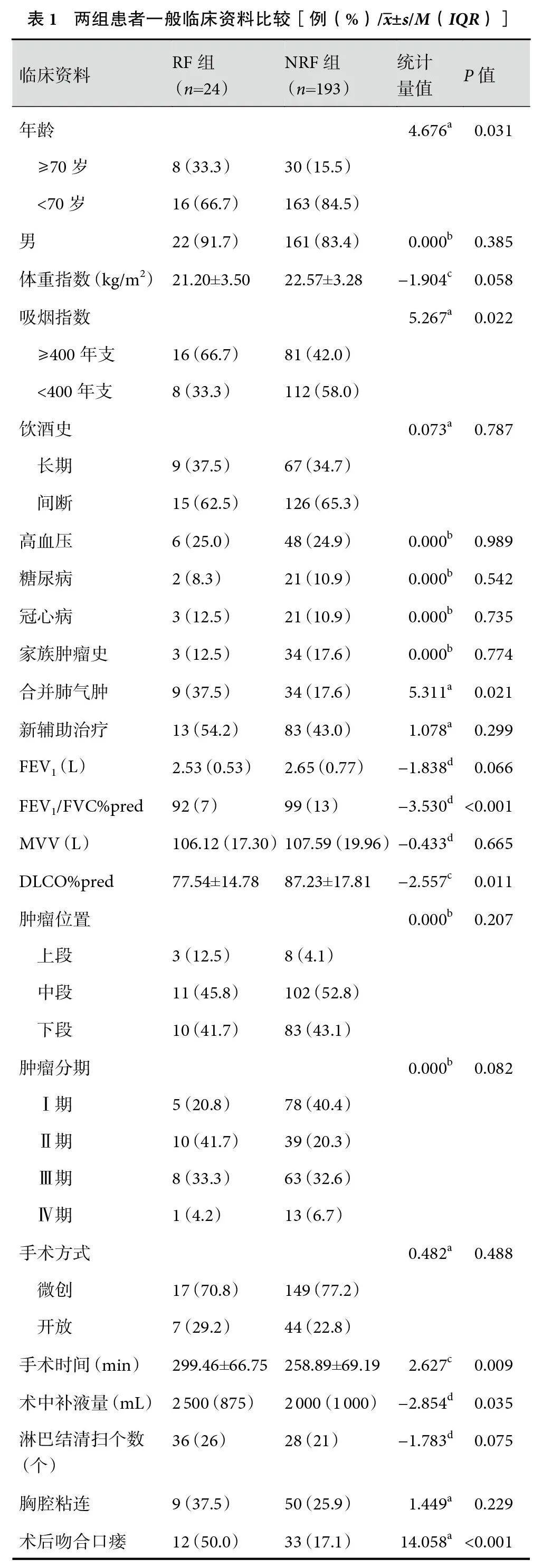
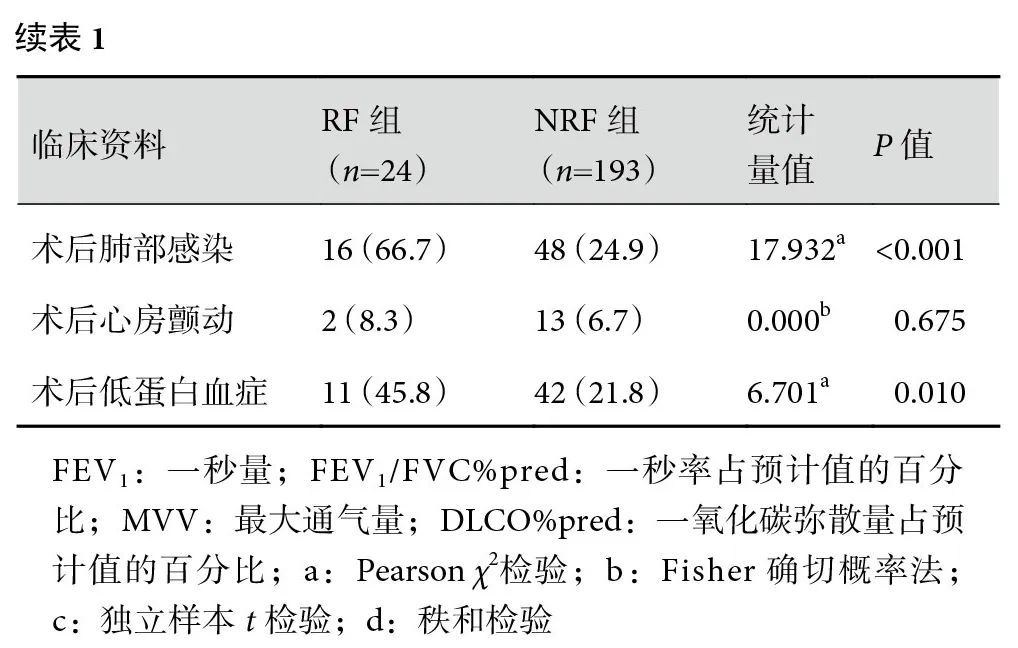
共纳入符合条件的食管癌患者217例,RF组24例,其中男22例、女2例,平均年龄(63.33±9.10)岁;NRF组193例,男161例、女32例,平均年龄(62.14±8.44)岁。RF发生率11.1%。两组患者的一般临床资料:年龄≥70岁、吸烟指数≥400年支、术前合并肺气肿、FEV1/FVC%pred、DLCO%pred、手术时间、术中补液量、术后吻合口瘘、术后肺部感染、术后低蛋白血症差异均有统计学意义(P<0.05);见表1。
2.2 预测模型变量的筛选
为减少变量间的多重共线性问题,本研究使用LASSO回归进行变量筛选,通过交叉验证选择最佳λ值(选取lambda.1se作为最佳λ值),在保证拟合度的同时纳入最少变量,以得到最精简的预测模型;见图1。
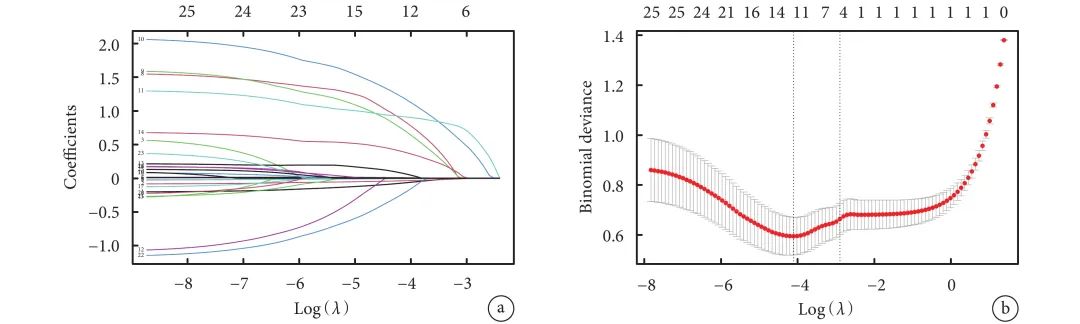
图1 使用LASSO回归模型进行特征选择
a:26个变量的LASSO回归系数路径图;b:LASSO回归交叉验证曲线,使用lambda.lse作为最终筛选标准;LASSO:最小绝对收缩和选择算子
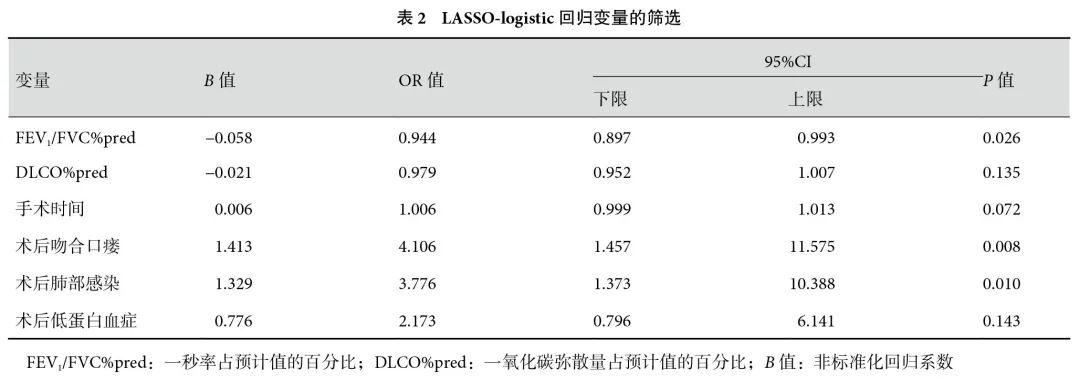
根据LASSO回归分析计算出的非零系数筛选出6个变量,包括FEV1/FVC%pred、DLCO%pred、手术时间、术后吻合口瘘、术后肺部感染、术后低蛋白血症。将上述特征纳入多元logistic回归分析,结果显示:FEV1/FVC%pred[OR=0.944,95%CI(0.897,0.993),P=0.026]、术后吻合口瘘[OR=4.106,95%CI(1.457,11.575),P=0.008]、术后肺部感染[OR=3.776,95%CI(1.373,10.388),P=0.010]是食管癌术后RF的主要危险因素;见表2。
2.3 构建预测模型
根据LASSO-logistic回归分析结果,纳入FEV1/FVC%pred、术后吻合口瘘、术后肺部感染3个危险因素,构建食管癌患者术后RF的列线图。通过将各危险因素对应至列线图评分标尺进行垂直投影,可获得各因素的单项评分,然后通过统计总分值,得到术后RF发生率;见图2。
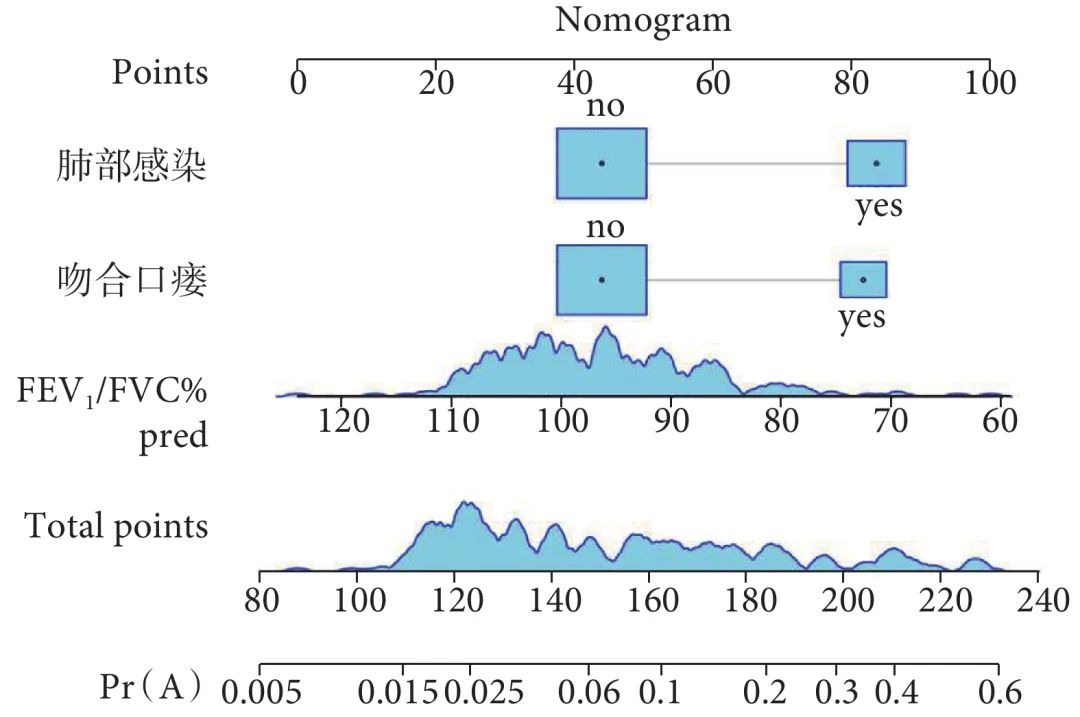
图2 预测食管癌患者术后呼吸衰竭的列线图
FEV1/FVC%pred:一秒率占预计值的百分比
2.4 预测模型的验证及应用
本研究采用自举法(Bootstrap法)对列线图模型进行内部验证1000次,AUC=0.819[95%CI(0.737,0.901)];见图3a。校准曲线显示出良好的一致性(Hosmer-Lemeshow检验,P=0.527),表明该模型具有良好的拟合优度;见图3b。绘制预测模型的决策曲线,结果显示阈值概率在5%~50%时模型具有良好的临床净收益;见图4。
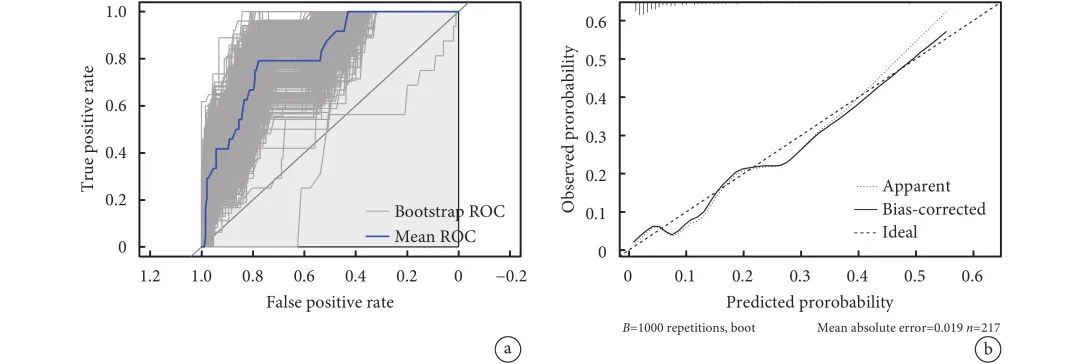
图3 预测食管癌患者术后呼吸衰竭的ROC曲线和校准曲线
a:预测食管癌患者术后呼吸衰竭的ROC曲线;b:预测食管癌患者术后呼吸衰竭的校准曲线;ROC:受试者工作特征
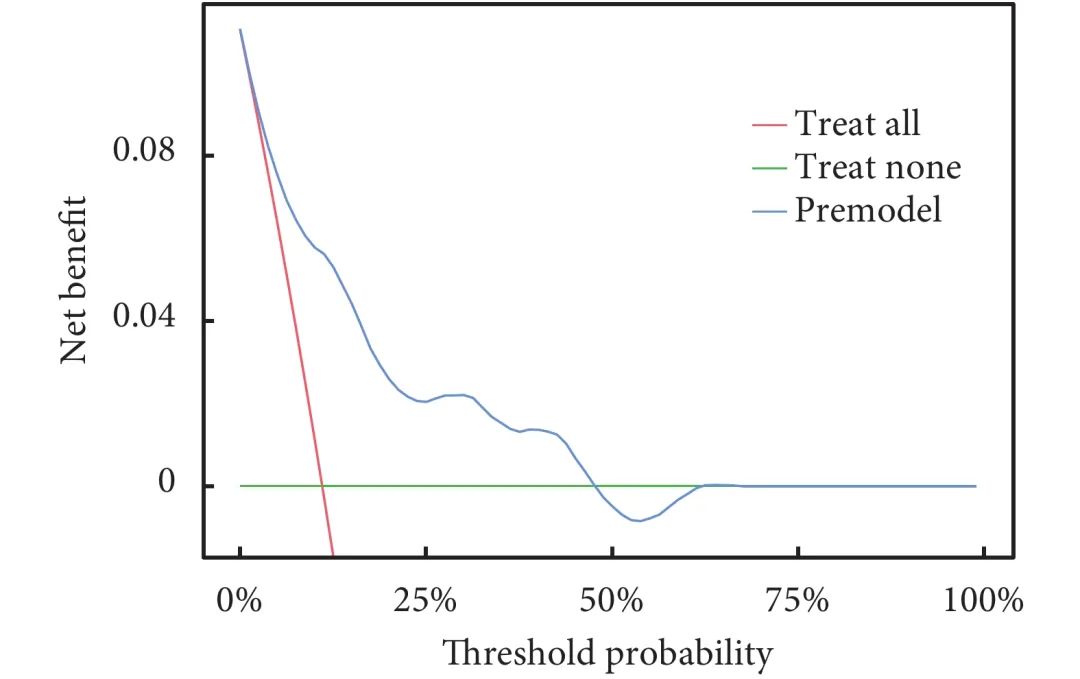
图4 预测食管癌患者术后呼吸衰竭的决策曲线
3 讨论
食管癌根治术是高侵袭性手术,会触发全身炎症反应,导致炎症细胞因子的过度产生、内皮功能障碍、内皮细胞损伤和中性粒细胞的激活,从而可能导致组织、器官损伤和器官衰竭,尤其是RF[5,11]。RF的主要特点是在术后出现血气交换障碍,在食管癌术后所有并发症中最具破坏性,不但延长住院时间、增加死亡率,还会严重影响手术疗效及远期预后[10]。因此,构建食管癌患者术后RF预测模型是必要的,可帮助医护人员早期识别高危患者,进行早期预防与治疗。
RF的发生由患者的健康状况、围手术期相关因素共同决定。此前,Yu等[8]的研究纳入2386例患者,57例(2.4%)患者发生术后RF;该研究对19个临床特征分析显示:年龄、体重指数、心血管疾病、糖尿病、DLCO%pred、肿瘤部位和胸部手术时间≥101.5 min是术后RF的危险因素,构建的预测模型AUC=0.755。王开旺等[12]的研究纳入216例患者,34例(13%)患者发生术后RF,对14个临床特征分析显示:年龄、术中补液量、术后低蛋白血症、吻合口瘘、胸腔广泛粘连是食管癌术后RF发生的危险因素,预测模型AUC=0.848。虽然以上研究模型诊断价值良好,但纳入相关变量可能不太全面,且都采用先单因素后多因素分析的方法,在处理变量间的多重共线性方面存在一定局限性。
本研究纳入食管癌术后患者217例,其中RF患者24例,发生率11.1%。应用LASSO-logistic回归分析患者26个相关临床特征,最终筛选出3个影响食管癌患者术后RF的危险因素构建预测模型:FEV1/FVC%pred、术后吻合口瘘、术后肺部感染。内部验证结果显示,该模型在预测食管癌患者术后RF风险方面表现良好,AUC=0.819[95%CI(0.737,0.901)],模型预测效能与既往研究相当。但我们的研究采用LASSO回归进行变量筛选,降低了模型的复杂性,防止过度拟合,进而选择最相关的特征变量。
随着人口老龄化和慢性阻塞性肺疾病患病率的总体增加,肺功能评估是胸外科手术前的常规检查项目,既能预测围手术期患者的并发症风险,也能为手术决策提供客观依据[13]。FEV1、FEV1/FVC%pred、MVV、DLCO%pred是我国主要的肺功能评价指标[14]。与既往研究[15-18]结果一致,本研究同样发现FEV1/FVC%pred下降是食管癌术后RF的危险因素。FEV1/FVC%pred主要反映肺通气功能,而肺通气功能的下降导致肺泡通气量不足、肺泡氧分压下降、二氧化碳分压上升,进而发生RF[16]。此外,Kim等[18]和Goense等[19]发现,在单因素分析中FEV1/FVC%pred和DLCO%pred都与食管切除术后的肺部并发症相关,但在多因素分析中DLCO%pred是主要危险因素。而本研究结果正好相反,单因素分析中DLCO%pred是危险因素,但在多因素分析中这种显著性并不成立。可能的原因是肺通气功能受呼吸力学、慢性炎症和全身性疾病等多种因素影响[17,20]。此外,回顾RF患者的术前影像,我们观察到大部分患者都合并肺气肿,这或许也会影响患者的通气功能。因此,通过术前呼吸锻炼(包括运动干预和戒烟)改善患者肺功能是必要的。
吻合口瘘是食管癌术后最常见且最严重的并发症,发生率为10%~21.2%[21-23]。吻合口瘘一般发生在术后7~14 d,并伴随着局部或全身性炎症反应[23]。吻合口瘘的临床表现从无明显体征到暴发性脓毒血症,且许多因素都会影响临床表现,如瘘口位置、缺损大小等[24]。颈部吻合口瘘可出现颈部切口红肿、硬结以及明显的脓液排出。吻合口瘘可以选择充分引流、换药、控制感染等保守治疗,患者通常无需更进一步的处理即可完全恢复[25]。而胸腔内的吻合口瘘一旦发生,胸腔负压可能促使脓液蔓延,引发胸膜、肺及纵隔感染,损害患者的呼吸功能进而引发RF[26]。其中,术中行颈部吻合但术后吻合口脓液流进胸膜腔会产生与胸内瘘同样的临床结局。因此,早期及时诊断吻合口瘘,避免脓液流进胸腔及纵隔,对预防潜在致命并发症的发生、缩短住院时间和改善预后至关重要。
食管癌手术虽然没有切除肺组织,但呼吸肌的完整性受到破坏,肺功能破坏严重,肺泡塌陷、肺水肿、肺防御机制减弱等病理生理机制易导致肺部感染[26]。一项Meta分析[27]结果显示,术后肺部感染发生率为12.8%~44.2%。此外,在一项包括284例患者的回顾性研究[28]中,术后肺部感染更易导致RF,使术后死亡率增加10%,5年总存活率降低12%。食管癌患者术后肺部感染的发生是多因素共同协作的结果,已知的危险因素包括原发性肺部疾病、年龄、吸烟、麻醉创伤和手术(切口疼痛、喉返神经损伤、吻合口瘘)等[27-29]。因此,有吸烟史的患者术前需要严格戒烟至少2周,高龄患者术前进行呼吸锻炼,围手术期使用硬膜外麻醉充分镇痛,选择敏感的抗生素,术后加强雾化吸入和拍背咳痰,防止误吸,必要时采取支气管镜吸痰等措施,可以有效减少肺部并发症[29-30]。
本研究也存在一定的局限性。首先,本研究为单中心回顾性研究,可能存在一定的选择偏倚。此外,本研究采用内部验证法,未来需要进行多中心试验以及外部验证来评估模型的准确性。
综上,本研究发现FEV1/FVC%pred、术后吻合口瘘、术后肺部感染是食管癌患者术后RF的危险因素,基于LASSO-logistic回归分析法构建的可视化预测模型性能良好,有望帮助医务人员早期筛选出高危患者,在围手术期进行早期干预治疗,改善患者预后,提高生活质量。
利益冲突:无。
作者贡献:杨博负责数据分析及论文撰写;白悦、孙大强负责论文设计与审校;朱公建负责内容指导;郎丽丽、曹群、庄雷云负责数据收集、整理。


