Gut:综合多模型分析肠道炎症揭示临床前和临床IBD的关键分子特征
时间:2025-09-16 12:25:52 热度:37.1℃ 作者:网络
炎症性肠病(IBD)是一类慢性、复杂的胃肠道炎症性疾病,主要包括克罗恩病(CD)和溃疡性结肠炎(UC)。尽管已有大量研究,其确切病因仍不完全清楚,普遍认为是由遗传易感性、免疫系统异常、肠道屏障功能受损以及微生物群失调等多种因素共同导致。近年来,全基因组关联研究(GWAS)已识别出超过280个与IBD相关的基因位点,但大多数基因变异与疾病之间的因果关系尚未明确,IBD更可能是一系列不同病理机制导致的临床表现相似的疾病谱。为深入理解IBD的发病机制,多种小鼠模型被开发用于模拟疾病的不同方面,这些模型大致可分为三类:肠道屏障损伤模型、免疫调节模型和感染模型。然而,现有的动物模型往往无法完全模拟人类IBD的复杂性,各模型间在免疫反应类型、细胞组成及分子通路激活等方面存在较大差异,限制了其转化应用的价值。因此,系统比较不同模型与人类疾病的分子相似性与差异,对选择合适的模型以研究特定病理机制及开发靶向治疗策略具有重要意义。

本研究通过整合转录组学分析,对13种常用的小鼠肠道炎症模型进行了系统研究,并与多个人类IBD队列进行对比,旨在揭示临床前模型与临床疾病间保守的分子特征与通路。研究人员在C57BL/6J小鼠中建立了包括急性与慢性DSS结肠炎、Casp8基因上皮特异性缺失所致回肠炎与结肠炎、TNBS诱导的急慢性结肠炎、Oxazolone结肠炎、T细胞转移模型、肿瘤坏死因子(TNF)AU-rich元件缺失所致回肠与结肠炎症,以及三种感染模型(E. vermiformis, H. hepaticus, C. rodentium)。通过结肠镜检、活体成像、粪便菌群负荷及组织学分析筛选出处于充分炎症状态的小鼠,收取发炎组织及相应对照组样本进行批量RNA测序,构建了炎症转录组数据库(SEPIA),并开发了交互式网络平台供数据探索与分析。此外,研究还借鉴了近期提出的分子炎症评分(bMIS)策略,建立了适用于小鼠的肠道分子炎症评分(mMIS),用于客观量化黏膜炎症水平,并通过已发表的DSS结肠炎时间序列数据对其有效性进行了验证。
结果显示,除Casp8缺失回肠炎模型外,其余所有模型均表现出mMIS显著升高,表明广泛的分子水平炎症激活。利用单细胞RNA测序数据及反卷积算法对批量转录组进行细胞组成分析发现,炎症模型中免疫细胞比例普遍上升,但各模型在巨噬细胞、中性粒细胞浸润、结肠上皮亚型丢失及间质细胞变化等方面存在显著差异,与组织学和内镜下观察到的上皮侵蚀、增生及颗粒性改变一致。
令人意外的是,部分模型中还检测到鳞状上皮样细胞的出现(如cDSS和Casp8缺失结肠炎)、肌样细胞减少(如Casp8缺失结肠炎、AcTNBS、Hhepa及Crode感染)以及B细胞特征升高(如AcDSS、cDSS和AcTNBS)。通过标志基因表达验证进一步发现,部分细胞类型如肠道神经胶质细胞在反卷积中代表性不足,而其他一些发现如分泌性杯状细胞在AcDSS、AcTNBS、Hhepa和Crode中的丢失,以及Hhepa、Crode和cTNBS中增殖性过渡放大(TA)细胞标志物的升高,与观察到的上皮增生现象相关。此外,研究还发现肠道神经元标志物在感染模型与AcDSS和OxC模型间存在强烈对比,B细胞与TA细胞标志物间呈负相关,肠道神经元与TA细胞标志物间也呈现类似趋势,这些发现在蛋白水平得到进一步验证。
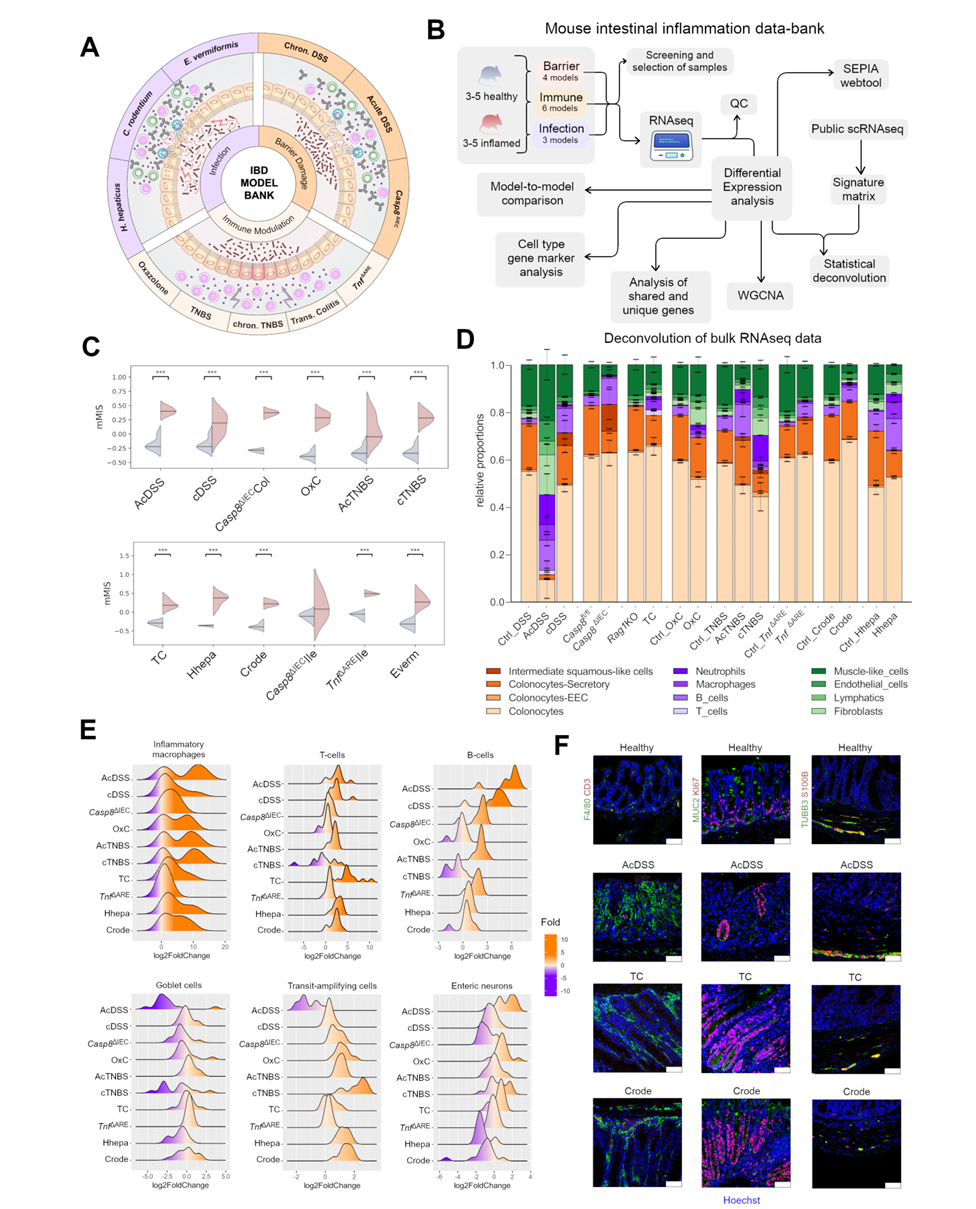
图1 IBD小鼠模型中组织细胞组成的变化
基因共表达网络分析(WGCNA)识别出结肠和回肠模型中多个共表达模块,其中一些模块在两类组织中均存在且与免疫调节相关。例如,结肠模块ME6和回肠模块ME4均富集于“炎症反应”相关生物学过程,并包含如Nox2、Nfkbia、Il1b、Il18r1等关键免疫调节基因。另一方面,结肠模块ME2和回肠模块ME6则与羧酸代谢过程相关,其中包含Nr5a2(编码LRH-1,参与皮质类固醇生成)、Cyp系列基因(调控胆固醇分解)以及Acsm3、Acss2等与免疫代谢调节相关的基因。此外,组织及模型特异性模块也被识别,例如回肠模型中的ME2模块显示与RNA处理相关的基因(如Wdr36、Dck1等)上调,这些基因在p53应激反应中发挥作用。
与人类IBD数据的比较显示,小鼠模型与患者在炎症相关通路上存在显著的保守性,包括趋化因子信号、细胞因子受体相互作用、JAK-STAT通路及TNF信号等。这些通路在多个模型-队列配对中相关性较高,尤其是感染性结肠炎模型在谷胱甘肽代谢、细胞黏附和抗原呈递等通路上与人类数据高度一致。细胞因子表达分析发现,人类UC中以OSM、IL17A、IL6和IL11为主导,而TNF表达较低;小鼠模型中细胞因子表达则存在较大差异,例如感染模型高表达Ifng和Il17a,Casp8缺失回肠炎中以Il17a为主,而Osm表达占优势的模型(如cDSS、Casp8缺失结肠炎、TNBS和OxC)则缺乏Ifng表达,这与先前报道的中性粒细胞来源的OSM抑制T细胞IFN-γ产生的现象一致。对IBD相关GWAS基因的分析进一步揭示,多数基因在模型和患者中均呈现保守的上调或下调,如炎症相关基因NOX2、LCN2、IL6、OSM和REG3A普遍上调,而上皮运输与屏障功能相关基因如ABCB1、SLC44A4、PCK1和AQP8则一致下调。
通过整合单细胞转录组数据,研究发现某些保守的生物学过程在IBD患者的特定细胞簇中表达,例如在UC患者中,TA细胞、干细胞、未成熟肠细胞以及M细胞均高表达与炎症调节相关的基因;一类新型浆细胞亚群则高表达与血管生成相关的基因;炎症成纤维细胞和内皮细胞簇中羧酸代谢通路相关基因表达升高,与小鼠和人类批量转录组中该通路下调的现象形成对比,提示基质细胞在炎症中可能通过代谢重编程参与免疫调节。此外,研究还验证了上皮微绒毛和线粒体等亚细胞结构在IBD中的损伤,发现微绒毛结构和线粒体功能相关基因在部分小鼠模型(如TNBS、感染模型)和人类CD及UC中均出现下调,电镜观察进一步证实了这些超微结构改变的存在。
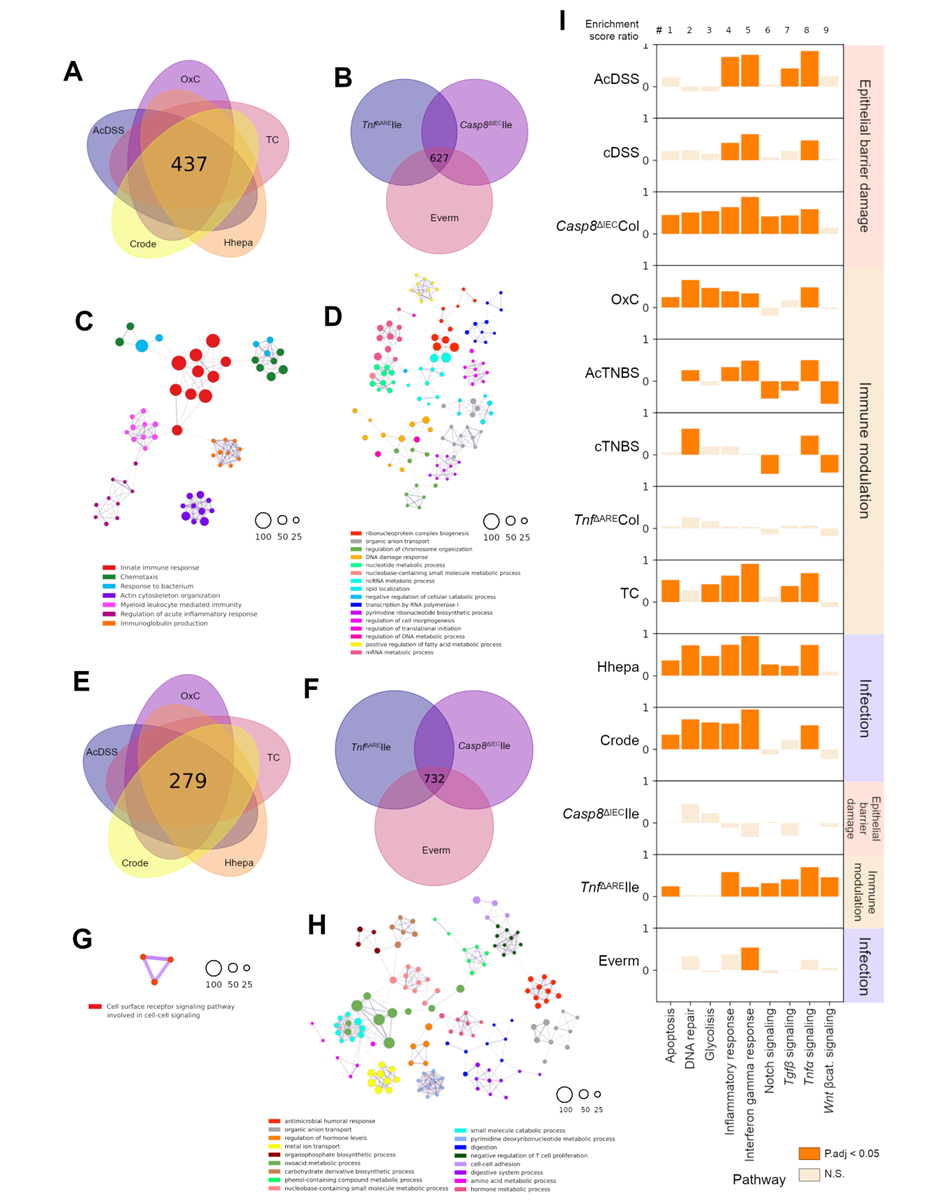
图2 小鼠模型间的调控共性与差异
本研究通过建立多模型转录组资源与交互分析平台,系统揭示了小鼠IBD模型与人类疾病在分子、细胞及亚细胞水平的保守性与差异性,为选择最适模型研究特定疾病机制提供了重要依据。研究发现,尽管各模型在免疫激活通路上与人类疾病具有较高一致性,但在代谢失调、上皮屏障功能等领域存在较大差异,提示在 targeting 这些病理过程时需谨慎选择模型。此外,研究还提示炎症中基质细胞通过代谢重编程可能发挥免疫调节作用,这为未来研究提供了新的方向。通过公开的SEPIA平台,研究者可快速比对和选择模型,加速IBD转化研究的进展。
原始出处:
Gonzalez-Acera M, Patankar JV, Erkert L, et al. Integrated multimodel analysis of intestinal inflammation exposes key molecular features of preclinical and clinical IBD. Gut. 2025;74:1602-1615. doi:10.1136/gutjnl-2024-333729
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。


