上海交大凌代舜、李方园Angew:光热纳米开关实现肿瘤选择性Wnt信号超激活,开辟癌症治疗新途径
时间:2025-09-16 12:25:54 热度:37.1℃ 作者:网络
Wnt/β-catenin信号通路在癌症中扮演着双重角色:适度激活可促进肿瘤发生,而过度激活却能诱导凋亡并抑制肿瘤生长。然而,当前针对该通路的调控策略,如小分子药物、抗体或光遗传学手段,均存在特异性不足、控制精度差或组织穿透性有限等问题。尤其是Wnt蛋白本身的疏水性和翻译后修饰复杂性,限制了其直接应用。因此,开发一种能够实现时空精确控制、具有高选择性的Wnt信号调控平台,成为当前研究的迫切需求。
近日,上海交通大学凌代舜教授、李方园研究员课题组提出了一种基于金纳米棒的光热纳米开关(Au-PEG/Wif1/Wnt),通过近红外(NIR)光控释放Wnt配体,实现在肿瘤细胞中选择性超激活Wnt通路,从而诱导凋亡并抑制肿瘤生长,同时避免对正常细胞的损伤。该平台利用Wnt抑制因子Wif1与Wnt之间的温度敏感性结合,在NIR照射下发生局部热释放,触发Wnt信号通路的时空特异性激活,为Wnt相关疾病的精准治疗提供了新策略。相关论文以“A Photothermal Nano-Switch for Tumor-Selective Wnt Hyperactivation in Vivo”为题,发表在《Angewandte Chemie International Edition》,第一作者为Fang Chunyan和Liu Yamin。

研究人员首先合成了Au-PEG/Wif1/Wnt纳米系统,并对其进行了系统表征。透射电镜和原子力显微镜图像显示纳米棒呈均匀分散的棒状结构,长度约50 nm,宽度约10 nm,表面可见蛋白质修饰所致的突起。FT-IR和Zeta电位分析进一步证实了Wif1和Wnt的成功修饰。紫外-可见吸收光谱表明,纳米棒在808 nm处具有明显的等离子共振吸收峰,显示出良好的光热性能。在808 nm激光照射下,该纳米系统表现出优异的光热稳定性和升温能力,为后续光控释放奠定了基础。
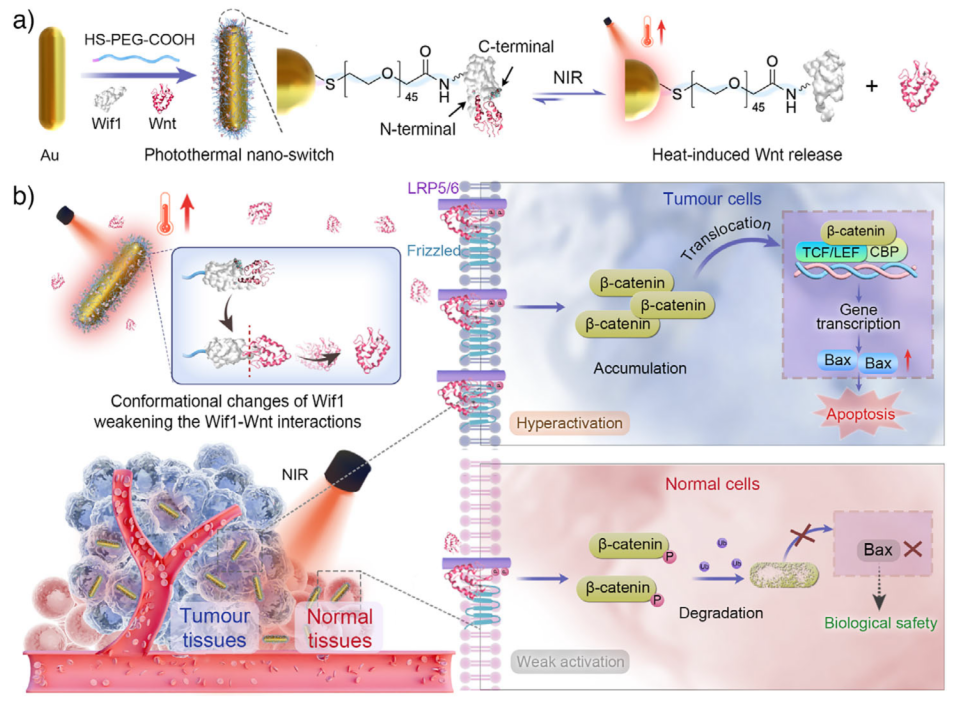
图1. 图示Au-PEG/Wif1/Wnt光热纳米开关的设计及其在体内通过近红外触发Wnt配体释放与温和光热加热实现肿瘤选择性Wnt/β-catenin信号激活的机制。a) Au-PEG/Wif1/Wnt合成过程及NIR照射诱导Wnt释放示意图;b) 通过释放的Wnt配体和温和光热加热在体内实现Wnt/β-catenin信号选择性超激活用于癌症治疗的示意图。
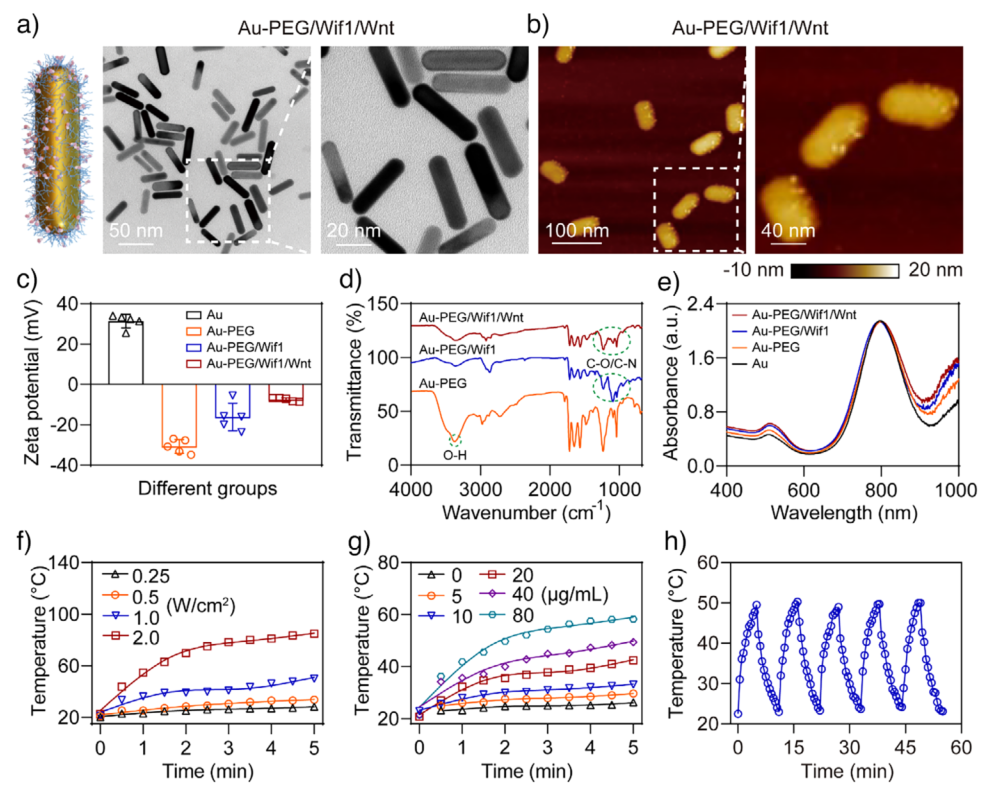
图2. Au辅助光热纳米开关的合成与表征。a), b) Au-PEG/Wif1/Wnt NRs的透射电镜图像a)和原子力显微镜图像b);c), d) 各组Zeta电位c)和FT-IR光谱d);e) 各组的紫外-可见吸收光谱;f) 不同功率密度808 nm激光照射下Au-PEG/Wif1/Wnt NRs的温度变化;g) 不同浓度纳米棒在808 nm激光(1 W/cm²)照射下的温度变化;h) 五次激光开关循环中纳米棒的温度变化曲线。
在NIR照射下,该纳米开关可实现Wnt蛋白的可控释放。实验表明,照射3.5分钟后Wnt释放率高达94.06%,且释放的Wnt蛋白保持其结构完整性和生物活性。分子动力学模拟揭示,温度升高导致Wif1与Wnt之间的结合能显著下降,从而促进了解离过程。在43°C时,Wif1的构象发生明显变化,进一步验证了光热触发释放的机制。
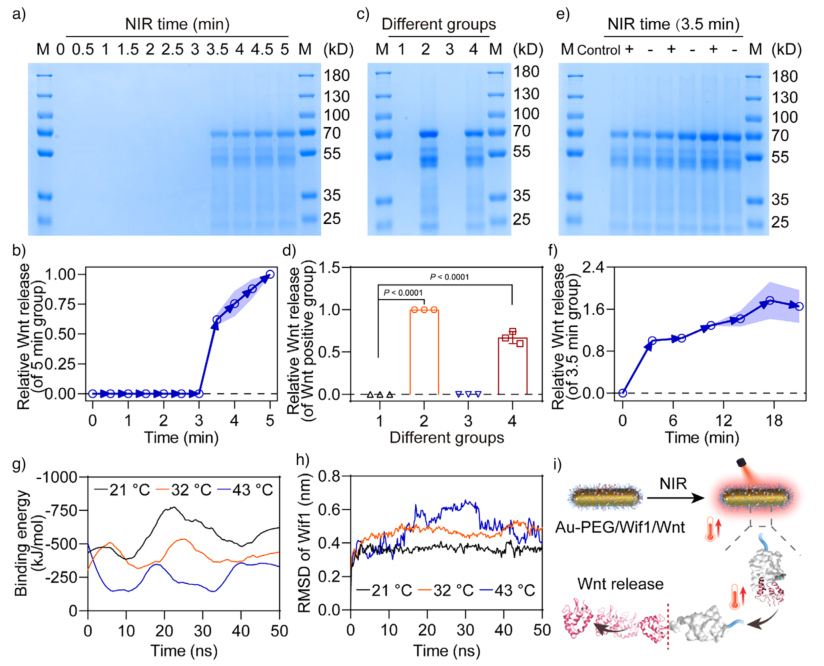
图3. 近红外光触发Wnt从Au辅助光热纳米开关中释放。a) SDS-PAGE检测40 µg/mL Au-PEG/Wif1/Wnt在808 nm激光照射下的Wnt信号;b) ImageJ定量分析a)中Wnt信号;c) 不同组在NIR照射下的SDS-PAGE结果;d) c)中Wnt信号的定量分析;e) NIR开关控制下的Wnt释放;f) e)中Wnt信号的定量分析;g) 分子动力学模拟得到的不同温度下Wif1与Wnt的结合能变化;h) 不同温度下Wif1的RMSD变化;i) NIR触发Wnt从纳米棒释放的示意图。
在细胞实验中,该纳米系统在NIR照射下显著激活了4T1肿瘤细胞中的Wnt/β-catenin通路,表现为β-catenin和p-DVL表达上调,p-β-catenin水平下降。下游靶基因c-Myc和Fgf2的mRNA表达也显著升高。此外,细胞发生上皮-间质转化(EMT),E-cadherin表达下降,N-cadherin上升。这些变化最终导致细胞凋亡标志物cleaved PARP和Bax表达显著增加,细胞活力下降,而使用Wnt抑制剂IWR-1可逆转这一效应。
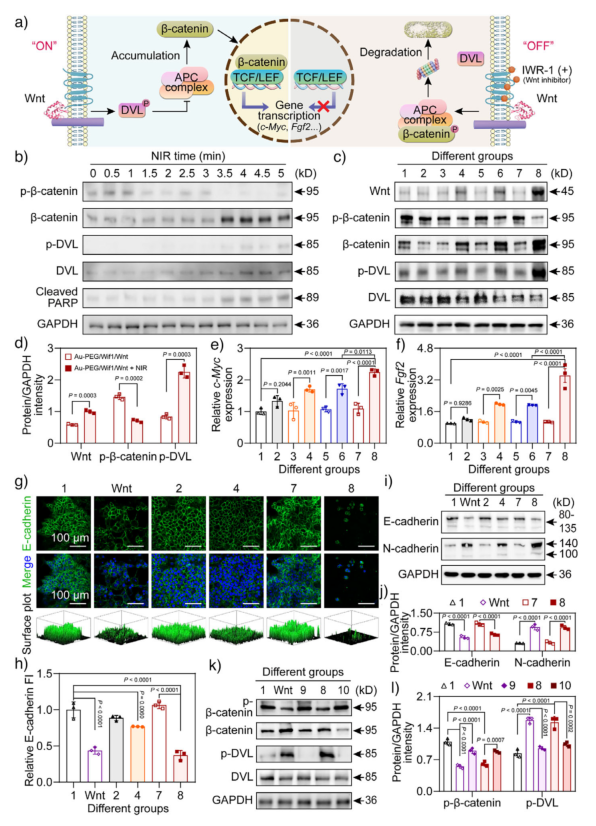
图4. 体外近红外调控Wnt释放激活Wnt/β-catenin信号通路。a) Wnt信号通路“开/关”状态示意图;b) 不同NIR照射时间下4T1细胞中相关蛋白表达;c) 不同处理组在NIR照射下的蛋白表达;d) Wnt、p-β-catenin和p-DVL蛋白相对强度;e), f) c-Myc和Fgf2 mRNA表达水平;g) E-cadherin免疫荧光染色;h) E-cadherin荧光强度相对值;i) E-cadherin和N-cadherin蛋白表达;j) 其相对强度;k) 使用IWR-1抑制剂后的蛋白表达;l) 其相对强度。
值得注意的是,该纳米系统对正常293T细胞无明显毒性,凋亡标志物未见升高,表明其具有高度的肿瘤选择性。Western blot分析显示,肿瘤细胞中p-β-catenin水平显著下降,而正常细胞中则保持稳定,进一步说明Wnt信号仅在肿瘤细胞中被超激活。
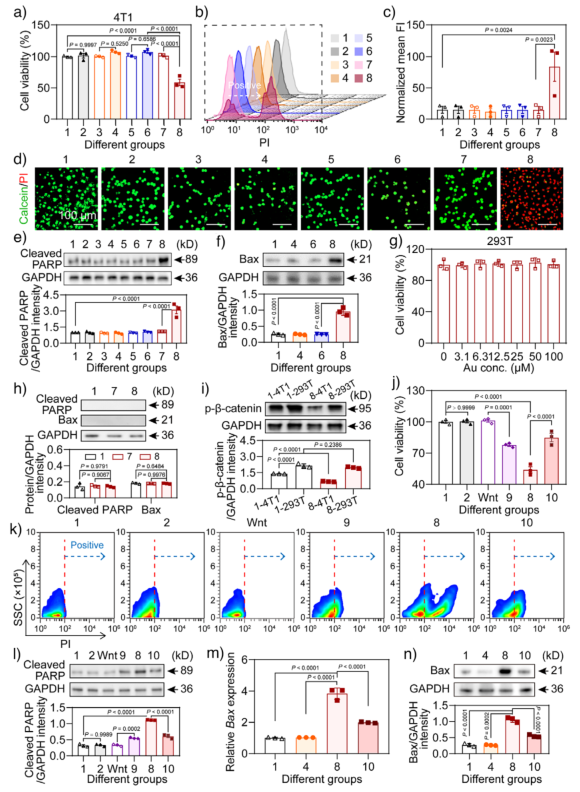
图5. 光热纳米开关通过Wnt/β-catenin信号超激活抑制肿瘤细胞增殖。a) 4T1细胞活力;b) 流式细胞术3D图;c) 流式平均荧光强度;d) Calcein/PI染色显示活/死细胞;e) cleaved PARP蛋白表达;f) Bax蛋白表达;g) 293T细胞活力;h) 293T细胞中凋亡蛋白表达;i) 4T1与293T细胞中p-β-catenin表达对比;j) IWR-1处理后的细胞活力;k) 流式检测IWR-1效果;l) cleaved PARP表达;m) Bax mRNA表达;n) Bax蛋白表达。
在4T1乳腺癌小鼠模型中,该纳米系统在NIR照射下使肿瘤局部温度升至44.5°C,并显著抑制肿瘤生长,抑制率达54.39%。肿瘤组织中cleaved PARP表达上升,Ki67阳性细胞减少,表明凋亡发生且增殖受到抑制。同时,主要器官未见明显病理损伤,血液生化指标正常,显示出良好的生物相容性。免疫荧光和Western blot结果进一步证实肿瘤组织中β-catenin核转位增加,Fgf2表达上调,c-Myc和Fgf2 mRNA水平显著升高,表明Wnt通路在体内被成功超激活。
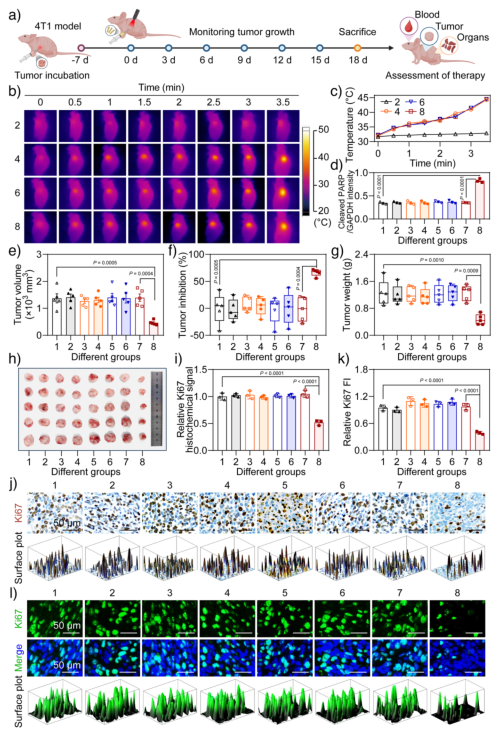
图6. 体内光热纳米开关通过Wnt信号超激活实现癌症治疗。a) 乳腺癌小鼠模型建立与治疗流程;b) 不同处理下小鼠肿瘤部位红外热像图;c) 温度变化曲线;d) 肿瘤组织中cleaved PARP表达;e) 肿瘤体积变化;f) 肿瘤抑制率;g) 肿瘤重量;h) 肿瘤组织照片;i), j) Ki67免疫组化染色与信号强度;k), l) Ki67免疫荧光染色与荧光强度。
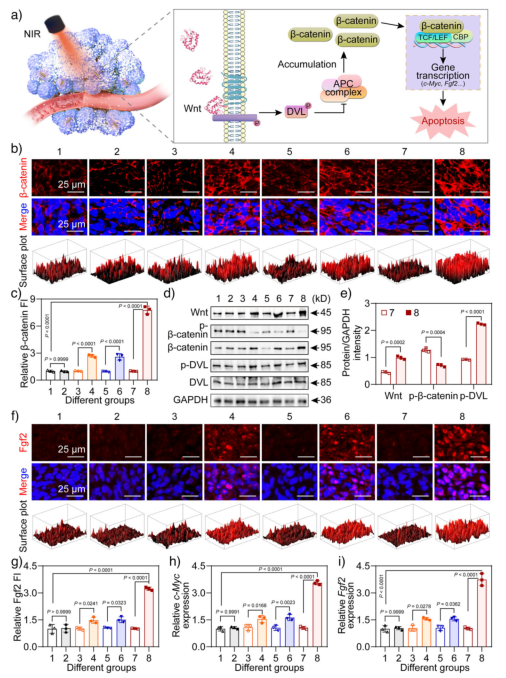
图7. 肿瘤组织中Wnt/β-catenin信号的超激活。a) NIR触发Wnt释放及信号通路激活示意图;b) β-catenin免疫荧光染色;c) 其荧光强度;d) 肿瘤组织中相关蛋白Western blot结果;e) 蛋白相对强度;f) Fgf2免疫荧光染色;g) 其荧光强度;h), i) c-Myc和Fgf2 mRNA表达水平。
该研究成功开发了一种光热纳米开关平台,实现了对Wnt/β-catenin信号通路的高精度、高选择性调控,为癌症治疗提供了新思路。该策略不仅克服了现有Wnt调控方法的局限性,还展现出良好的临床转化潜力。未来,这一平台有望拓展至其他Wnt失调相关疾病,如纤维化或神经退行性疾病,并可与其他治疗模式(如免疫治疗或靶向给药)相结合,进一步推动精准医疗的发展。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202506666


