欧洲骨髓瘤网络(EMN)关于功能性高危多发性骨髓瘤的共识声明
时间:2025-09-17 12:15:01 热度:37.1℃ 作者:网络
多发性骨髓瘤 (MM) 是一种以克隆性骨髓浆细胞增多、高钙血症、肾衰竭、贫血和溶骨性骨病为特征的无法治愈的血液肿瘤。约20%的 NDMM 患者在诊断时未预测为高危疾病,尽管进行了最佳诱导 +/-ASCT和来那度胺维持治疗,但仍早期进展,随后归类为功能性高风险 (FHR) 。标准化风险分层模型纳入了肿瘤负荷、存在高危细胞遗传学、存在/不存在浆细胞白血病/髓外疾病的生物标志物,以将诊断时的高危归因于高危;但尚未确定新药诱导治疗 (NA-IND) 的缓解深度/持续时间作为疾病风险的动态标志物。然而,无论诊断时的风险分层如何,对NA-IND的反应可能是识别具有FHR生物学特征、预示总生存期(OS)极短的患者的最有效方法。
《American Journal of Hematology》近日发表欧洲骨髓瘤网络(EMN)共识声明,将 FHR-MM 定义为在无高危细胞遗传学的情况下,一线治疗开始后18个月内疾病进展,并讨论了疾病生物学和改善这些患者预后的策略。

引言
2023年,国际骨髓瘤协会召集了一个专家小组,确立了高危MM的共识定义,即存在del(17p)(克隆比例cutoff>20%)和/或TP53突变;t(4;14)、t(14;16)、t(14;20),以及gain(1q21)和/或del(1p);单等位基因del(1p32)和gain(1q)或双等位基因del(1p32) 。抑或,正如英国医学研究委员会(MRC)骨髓瘤IX和XI试验以及最近一个接受标准治疗英国真实世界队列所示,同时存在≥2个高危细胞遗传学异常同样可将患者识别为超高危MM。骨髓瘤基因组计划描述了一个变体,即在国际分期系统(ISS)3期疾病背景下,TP53的双等位基因失活或CKS1B (1q21)的扩增仅有21个月的中位总生存期(OS)。然而,上述风险分层方法可能无法识别FHR-MM,最近对关键CASTOR和POLLUX试验的汇总数据进行的事后分析表明,在达雷妥尤单抗(D)的研究的患者中,一线治疗后18个月内复发的患者中很少有患者存在高危细胞遗传学(D组,24.1%;对照组24.6%)或ISS III期疾病(D组,11.7%;对照组,18.3%)。这部分NDMM患者的OS极短,并且只能通过动态临床评估对一线治疗的反应持续时间来可靠识别
因此,虽然疾病负荷标志物(高骨髓浆细胞百分比、血细胞减少、高钙血症、肾功能不全、高LDH)和晚期分期(ISS II/III期和R-ISS III期)与高危细胞遗传学异常和早期复发存在关联,但许多在诊断时定义为“标危”的患者仍会在一线治疗开始后18个月内复发。
此外,还有其他因素增加FHR疾病的复杂性。首先,目前没有可及的诊断检测方法能在诊断时可靠识别所有FHR病例,以实现风险适应性治疗策略(risk-adapted therapeutic approach)。其次,缺乏针对FHR疾病的临床数据,导致过于依赖从早期复发和/或难治性(RR)MM随机研究中得出的事后分析来指导治疗。虽然其中一些分析是根据提议的FHR定义进行的,但其他分析则没有,因此产生的数据无法外推用于指导这一高危亚组的管理,凸显了对统一的FHR共识定义的未满足需求。此外,在真实世界中,适合移植和不适合移植患者的标准化一线诱导治疗存在显著异质性,导致临床医生在FHR疾病发生时会面临对不同新药耐药的患者。
定义
虽然广义上讲,FHR疾病包括对治疗反应不佳和早期进展性疾病(包括原发性难治性疾病),但建议将术语FHR局限于预后最差的患者,因此根据现有数据,将表现出早期进展性疾病的患者最佳定义为任何一线治疗开始后18个月内复发。因此,这代表着最具年龄包容性的定义,可为研究FHR的潜在生物学和改善FHR患者预后的策略提供信息。虽然其他人将FHR疾病定义为大剂量化疗(HDT)预处理的一线ASCT后12-24个月内复发,但存在很大问题,因为它未能涵盖不适合移植(TIE)的NDMM患者(可能在现实中代表着FHR人群的大多数),也未涵盖那些由于在诱导治疗期间或完成后、但在一线ASCT之前出现原发耐药而表现出初始疾病控制不足、随后进行挽救治疗而放弃ASCT的适合移植(TE)NDMM患者。此外,鉴于常规一线ASCT通常在治疗开始后6个月内进行,因此ASCT后12个月内的复发在很大程度上属于治疗开始后18个月内。随着新疗法的引入,早期进展的定义很可能需要延长至18个月以上;然而,定义此MM亚型的疾病动力学(以早期治疗耐药为例)将保持不变。
作者提出的定义基于4项大型的真实世界和临床试验数据的landmark分析。第一项是来自澳大利亚和新西兰骨髓瘤及相关疾病登记组(MRDR)的1320例真实世界NDMM患者,其中早期进展定义为开始基于硼替佐米的一线诱导(V-IND)后12个月内进展。该研究中,8.9%(118/1320)的患者发生早期进展和显著更差的OS,与晚期进展(>12个月)相比,中位OS分别为20.2个月 vs. 60.7个月(p<0.001),同时也建立了早期进展、次优反应(p<0.001)(定义为2个诱导周期后<微小缓解[MR]或4个诱导周期后<部分缓解[PR])和原发难治性疾病(p<0.001)之间的联系。第二,Corre等人在一项对2474例NDMM患者的landmark分析中,确定早期进展≤18个月(n=496, 20%)与OS降低独立相关,即使接受强化的基于新药(NA)的诱导治疗(HR 4.40,p<0.0001),并且与MRDR分析一致,确定最佳缓解≥VGPR具有保护作用,早期进展风险较低(p<0.001)。第三,D'Agostino等人描述的对参加前瞻性观察性CoMMpass研究的926例NDMM患者的分析确定,早期进展≤18个月(n=191, 20.6%)与较低的ORR(p<0.001)、缓解深度(p<0.001)以及对PI(p<0.001)或PI和IMID(p<0.001)耐药相关。Landmark生存分析验证了18个月的cut-off时间点,显示早期进展患者的OS显著差于晚期进展患者(p=0.004)。最后,最近一项来自Harmony Alliance平台的9740例NDMM患者的landmark生存分析发现,20.2%(n=1970)的患者在MM诊断后18个月内出现早期疾病进展,其OS(48个月)显著低于无早期复发的患者(115个月),HR 3.32, p<0.0001;但也强调了与单独使用PI或IMID相比,PI-IMID联合治疗降低了FHR的发生率(OR 0.48, p<0.0001) 。类似地,最近一项使用18个月cutoff点对MRDR中2682例真实世界NDMM患者进行的更新分析显示,与VCD相比,使用VRd进行PI-IMID诱导后FHR的发生率在统计学上显著降低,分别为23% vs. 28%(p=0.0011),FHR患者的中位OS约为3年(MRDR,未发表数据)。与这些发现一致,对HONEUR网络中3932例NDMM患者的一项分析显示,FHR(n=1022, 26%)的发生率存在差异(同样定义为一线治疗开始后18个月内早期进展),具体取决于诱导方案:VCD/VMP后为32%,IMID+PI联合治疗后为24%(p<0.00001),基于D的诱导治疗后为13%。FHR组和对照组的中位OS分别为34.0个月和73.5个月(p<0.0001) 。
尽管长期生存数据尚未公布,但PERSEUS研究(比较D-VRd与VRd诱导治疗NDMM)的初步分析也表明,早期疾病进展/FHR的发生率可能降低,预计D-VRd和VRd的48个月PFS率分别为84.3%和67.7%(p < 0.0001)。结合真实世界数据,这些结果支持一种观点,即一线CD38单抗-PI-IMID四药联合方案(如果可用)可能会延迟FHR患者的首次至进展时间。
FHR疾病的当前现状
尽管使用18个月cut-off时FHR在所有NDMM中的发生率约为20%,但只有少数临床试验前瞻性评估了这些患者的治疗选择(表1)。相反,几项随机研究(即FIRST、CASTOR、POLLUX和CANDOR)的事后分析描述了仅有1线既往治疗(1LOT)且在诱导开始后18-24个月内复发的患者的结局,而其他分析则包括了更异质的患者群体(表2)。ENDEAVOR、ASPIRE、IKEMA的亚组分析将早期复发定义为最近一次治疗线后12个月内,但并未限制为仅1线LOT的患者,而包括了1-3线既往治疗的人群。此文提议的FHR NDMM共识定义旨在确保这些亚组分析采用一致的方法,使数据能够外推到真实世界。
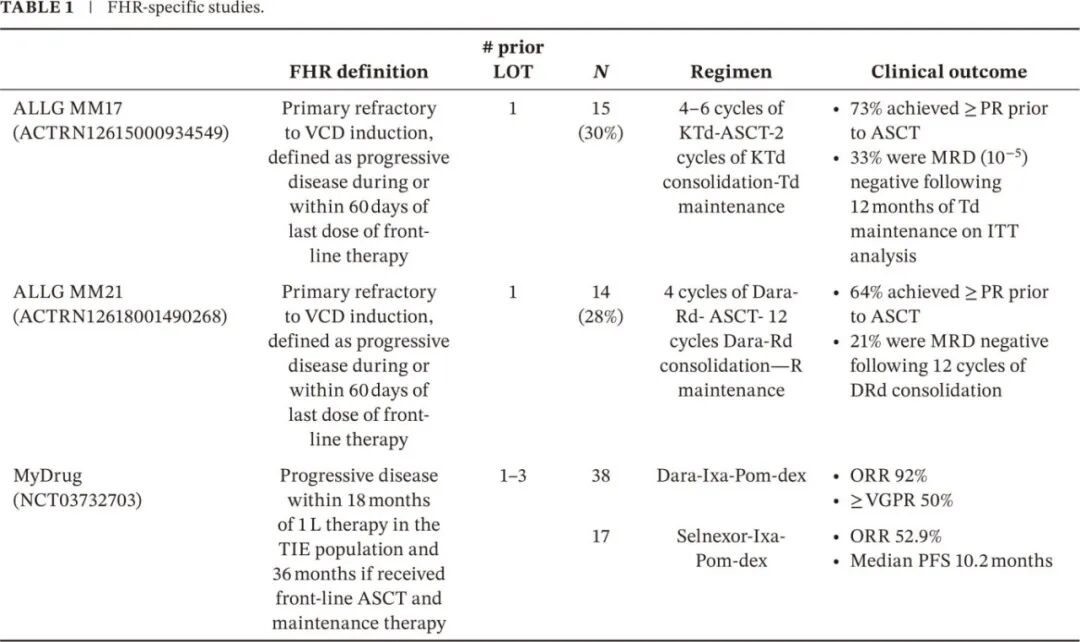
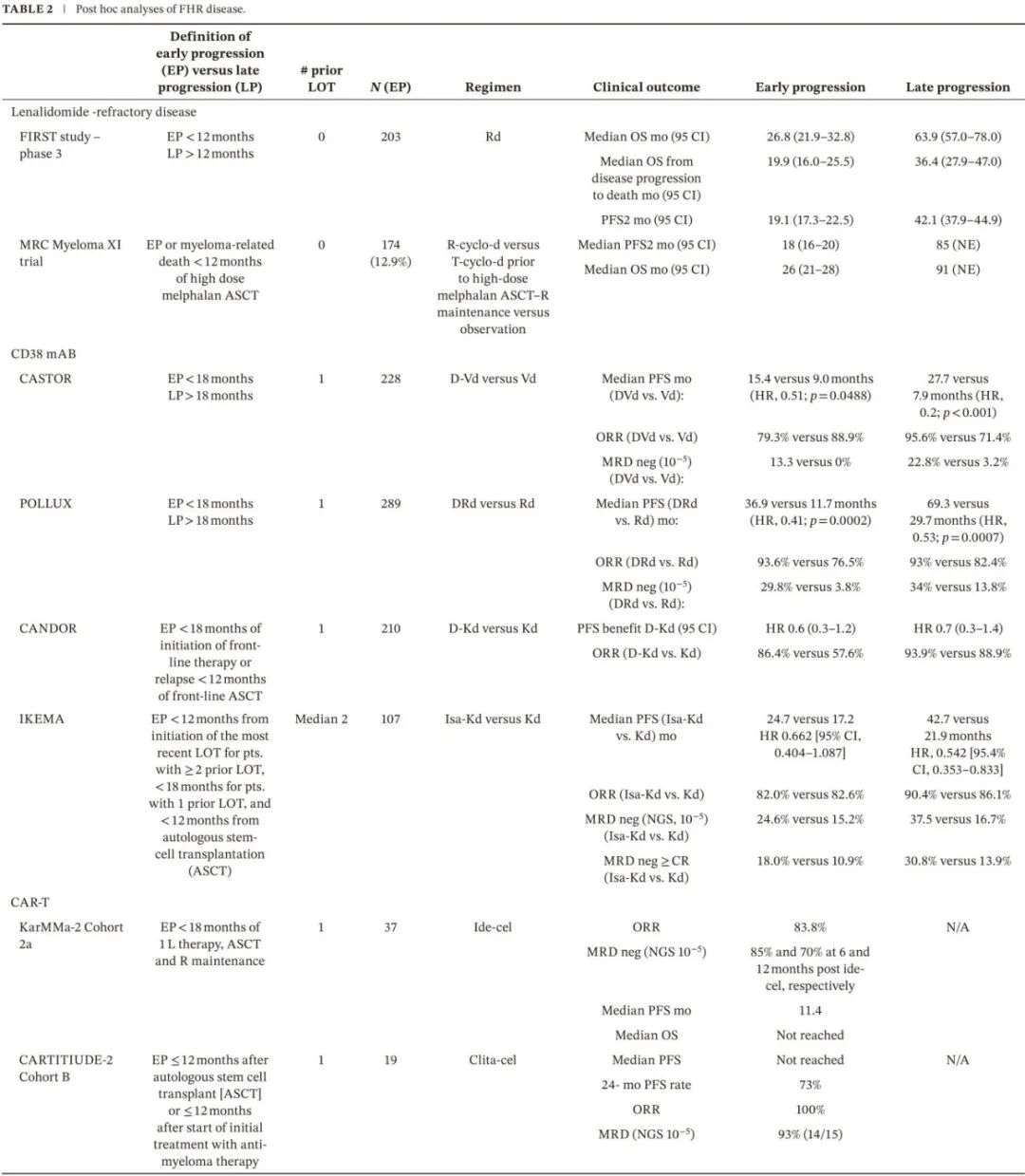
FHR疾病的事后分析
来那度胺难治性FHR疾病
来那度胺(LEN)难治性疾病(定义为在接受LEN治疗期间或停用LEN后60天内出现疾病进展)在真实世界MM管理中日益普遍。IFM 2005-02、DETERMINATION、SWOG S0777和FIRST试验推动了LEN在ASCT前作为基于硼替佐米-来那度胺-地塞米松(VRd)诱导的一部分、ASCT后维持治疗、以及作为TIE-NDMM患者VRd或来那度胺-地塞米松(Rd)一线治疗的一部分,然而尚缺乏指导LEN难治性FHR疾病管理的数据。2014年发表的3期FIRST研究确立了Rd作为TIE-NDMM诱导治疗的标准方案。该研究比较了持续Rd、有限期Rd(18个周期)和美法仑-泼尼松-沙利度胺(MPT)在1623例患者中的疗效。最近一项对经历早期进展(定义为治疗开始后<12个月,n=203)与晚期复发(n=186)的Rd患者进行的事后分析显示,早期进展患者的结局较差,中位OS分别为26.8个月和63.9个月,从疾病进展到死亡的中位OS分别为19.9个月和36.4个月,从随机分组到第二次进展的中位PFS(PFS2)分别为19.1个月和42.1个月。
MRC Myeloma XI试验是一项针对3894例NDMM患者的3期反应适应性(response adaptive)试验,对174例(12.9%)在大剂量美法仑预处理ASCT后12个月内复发的患者进行的事后分析显示,其生存结局显著较差,其特征为即使接受了基于NA的二线治疗仍无法挽救,中位PFS2仅为18个月,OS为26个月,而未经历早期进展的患者PFS2为85个月,OS为91个月。重要的是,64.4%的早期进展患者对诱导治疗达到≥VGPR。根据患者是否接受基于沙利度胺或来那度胺的诱导+/-V的巩固治疗(硼替佐米-环磷酰胺-地塞米松),后续结局(早期与晚期复发)无差异,表明 FHR 的结局可能与接受的 PI-IMID 诱导治疗类型无关。
CD38单克隆抗体
事后分析表明,使用CD38靶向单克隆抗体对FHR疾病具有PFS获益。对CASTOR(N=228)和POLLUX(N=289)试验的事后分析评估了仅接受过1线LOT的患者根据从一线诱导开始复发的时间(早期[<24个月]或晚期[>24个月])的结局;还使用18个月cutoff进行了次要分析。在CASTOR中,早期进展亚组(<24个月)中,达雷妥尤单抗-Vd(DVd)对比Vd的中位PFS为21.2 vs. 7.3个月(HR, 0.32; p<0.0001),晚期复发亚组中为33.2 vs. 8.0个月(HR, 0.20; p<0.0001)。在POLLUX中,早期进展亚组中,D-LEN-地塞米松(D-Rd)对比Rd的中位PFS为43.7 vs. 11.8个月(HR, 0.37; p<0.0001),晚期复发亚组中为66.0 vs. 35.5个月(HR, 0.64; p=0.0351)。使用18个月cutoff的次要分析与使用24个月cutoff的分析相似。因此,虽然与对照组相比,使用D联合V或LEN改善了PFS,但与晚期复发相比,它并未克服早期进展与缩短PFS的不良关联;此外,应注意POLLUX试验排除了LEN难治性疾病患者,而CASTOR试验中此类患者仅占少数。
3期CANDOR研究评估了D-卡非佐米-地塞米松(D-Kd)对比Kd在1-3线既往治疗的RRMM(n=466)中的疗效;大多数患者曾接受过V(D-Kd组92%,Kd组87%),许多也接受过LEN(D-Kd组39%,Kd组48%),约三分之一为LEN难治(D-Kd组32%;Kd组36%)。事后分析评估了早期进展患者的结局,在1线LOT患者(n=210)中定义为一线治疗开始后18个月内或一线ASCT后12个月内复发。在1线LOT亚组中,早期进展患者D-Kd vs. Kd的ORR为86.4% vs. 57.6%,无早期进展患者为93.9% vs. 88.9%。D-Kd在1线LOT患者中的PFS改善在早期和晚期复发亚组中一致,HR分别为0.6(95% CI 0.3–1.2)和0.7(95% CI 0.3–1.4),支持D-Kd挽救治疗作为一线未接受抗CD38治疗的FHR患者的可性选择。
3期IKEMA研究评估了艾沙妥昔单抗-Kd(Isa-Kd)对比Kd在RRMM(n=302)中的疗效。事后亚组分析评估了异质性患者群体的结局,这些患者表现出早期进展,在1性LOT患者中定义为一线治疗开始后<18个月或一线ASCT后<12个月复发,但也包括>1线既往治疗且从最近一次治疗开始<12个月内复发的患者。在1线LOT患者中,Isa-Kd在早期和晚期进展者中达到了相似的MRD阴性(<10-5)CR率,分别为30.0% vs. 34.5%。此外,无论复发时间如何,Isa-Kd带来的缓解深度获益在对IMID或PI难治的患者中是一致的。尽管未报告Isa-Kd在1线LOT FHR患者中的疗效的具体分析(可能由于数量不足),但考虑到缓解深度(特别是MRD阴性)与改善PFS和OS相关,该方案在LEN难治性FHR患者中值得进一步考虑。
嵌合抗原受体T细胞疗法(CAR-T)
3期CARTITUDE-4研究比较了BCMA CAR-T ciltacabtagene autoleucel(cilia-cel)与标准治疗(SOC)方案D-泊马度胺-地塞米松(D-Pd)或泊马度胺-硼替佐米-地塞米松(PVd),用于1-3线既往治疗的来那度胺难治患者。在2024年美国临床肿瘤学会年会(ASCO)上公布了仅接受过1线既往治疗患者(n=13,包括68例cilia-cel和68例SOC患者)的事后亚组分析,其中58%(79/136)为FHR(定义为ASCT后18个月内或在未接受ASCT的患者诱导开始后18个月内早期进展)。接受cilia-cel的患者表现出优异的ORR(87.5% vs. 79.5%(p=0.01)、MRD阴性率(65% vs. 10.3%(p<0.001p)、中位PFS(未达到 vs. 11.79个月;HR 0.27,p=0.0006)和12个月PFS率(77% vs. 49.1%)。此外,在接受cilia-cel的1线LOT患者亚组(n=60)中,无论是否表现出FHR,ORR、中位PFS、12个月PFS率(无FHR vs. FHR分别为88.1 vs. 88.0个月)均无差异,但显然需要更长的随访时间。
FHR疾病的前瞻性研究
CAR-T
CARTITUDE-2是一项cilia-cel的2期多队列研究,B队列纳入接受过PI-IMID三药一线诱导并经历早期进展的RRMM患者,早期进展定义为ASCT后≤12个月或未接受ASCT者诱导治疗开始后≤12个月。中位随访约29个月时,19例患者接受cilia-cel,其中79%对末线治疗难治,16%为三药难治,79%曾接受ASCT。尽管如此,cilia-cel仍实现深度且持久的缓解,93%的患者达到10-5的MRD阴性,其中53%持续≥6个月。中位PFS未达到,24个月PFS率为73%。
KarMMa-2研究队列2a报告了类似结果,这是一项针对BCMA CAR-T细胞疗法idecabtagene vicleucel(ide-cel)的多队列2期试验,评估了在一线治疗开始后<18个月复发的患者(N=37)的疗效。中位随访21.5个月时,ORR为83.8%,12个月时MRD阴性率为70%。这些患者中,71%维持MRD阴性≥18个月。中位PFS为11.4个月,中位OS未达到,细胞因子释放综合征和神经毒性的发生率与更晚期接受ide-cel治疗的患者相似。
双特异性抗体/T细胞衔接器抗体
目前尚无评估双特异性抗体/T细胞衔接器在FHR MM中的前瞻性研究或事后分析。
其他FHR研究
ALLG MM17试验(ACTRN12615000934549)评估了50例原发难治或反应不佳(定义为VCD诱导2周期后<MR或4周期后<PR)患者的序贯治疗:4至6周期卡非佐米-沙利度胺-地塞米松(KTd)挽救、ASCT、2周期KTd巩固和12个月Td维持。意向治疗(ITT)人群的ORR为78%,Euro-flow MRD阴性(10-5)率为34%,可评估人群在12个月Td维持治疗后为65%。仅对原发难治性患者进行进一步分析,N=15(30%),定义为在 1 L 治疗期间或末次给药后60天内PD,从而满足作者提出的 FHR 定义,证实 ITT 分析中73%的患者在 ASCT 前达到≥PR,33%的患者在 Td 维持治疗12个月后为 MRD 阴性。
类似地,ALLG MM21试验评估了50例对VCD诱导原发难治或反应不佳患者,治疗危4周期D-LEN-地塞米松(D-Rd)挽救,随后ASCT,12周期D-Rd巩固,随后R维持。ITT人群的ORR为72%,Euro-flow MRD阴性(10-5)率为46%,12周期D-Rd巩固后为79%。仅对原发性难治患者(N=14, 28%)的进一步分析显示,64%在ASCT前达到≥PR, 21%在12周期D-Rd巩固后达到MRD阴性。
MyDrug是一项开放标签、基因组指导的平台研究,评估了一个异质患者群体,包括接受过1-3线既往治疗的患者。早期进展定义为TIE-NDMM人群中一线治疗后18个月内进展,如果接受过一线ASCT和维持治疗则为36个月内。该研究正在评估在伊沙佐米-泊马度胺-地塞米松(IPd)骨架方案基础上加用分子靶向药物,并针对通过二代测序(NGS)在骨髓中检测到可靶向突变的患者:KRAS/NRAS/BRAF(cobimetinib)、FGFR3((enasidenib)、IDH2 (erdafitinib)、CDKN2C(abemaciclib)或t(11;14)(维奈克拉)。无可靶向突变或突变等位基因负荷<25%的患者随机分配到“不可靶向”组之一,其中Y1(达雷妥尤单抗-IxaPd)和Y3(塞利尼索-IPd)已报道结果,Y1(n=38)实现92.1%的ORR,50%达到VGPR ;Y3(n=17)显示ORR为52.9%,中位PFS为10.2个月。第一个针对KRAS/NRAS/BRAF突变的可操作队列有6例可评估患者,报告cobimetinib -IPd在该人群中是安全的。
最近报道一项关于BCMA CAR-T Trovocabtagene autoleucal(trovo-cel, C-CAR088, NCT05632380)作为巩固治疗的I期研究,在ASCT后第3天输注,在超高危RRMM患者中显示出良好的疗效和安全性,此处超高危定义为:(1) 遗传学超高危:del(17p) ≥ 60%;或≥2个高危细胞遗传学异常,_且_一线标准PI-IMID三药诱导4周期后<CR;(2) ‘原发性难治’但符合次优反应定义:一线标准诱导2周期后<MR或4周期后<PR;(3) 早期复发:标准一线治疗后6个月内疾病进展;(4) 原发性浆细胞白血病,且_一线治疗4周期后<CR。已经招募的12例患者中有50%是反应不佳者,16.7%表现出早期复发。ORR为100%,11例(91.7%)患者达到MRD阴性CR,分别有2例和4例患者在ASCT后18个月和12个月时维持缓解。自ASCT期中位随访9.5个月,中位PFS和OS均未达到。
疾病生物学
基因组特征
虽然通过经过验证的检测方法(GEP70/UAM70, EMC92/SKY92)识别出高危基因表达谱与较高的早期进展风险相关,但这些检测单独使用时无法可靠地检测FHR疾病。最近一项对参加OPTIMUM/MUKnine (NCT03188172) 试验的超高危NDMM患者的探索性分析报告称,具有t(4;14)、t(14;16)、t(14;20)、gain(1q)、del(1p)、del(17p) 中≥3个异常的患者,即使接受了D-环磷酰胺-RVd的强化诱导,仍与较高早期进展风险(定义为治疗开始后18个月内)相关。
与之相反,对来自多发性骨髓瘤研究基金会CoMMpass数据集的NDMM患者(N=512)的一项分析,利用一组已确立的高危疾病基因表达谱(EMC92, HMCL17, IFM15, UAMS70和UAMS80),发现大多数FHR患者并未表现出高危表达谱。该分析首先将患者分为3组:(1) 基因组高危(GHR):t(4;14) 或 t(14;16) 或 TP53功能完全丧失(TP53双等位基因缺失或17p13单等位基因缺失(del17p13)伴TP53突变)或1q21获得且ISS 3期;(2) FHR:对诱导治疗难治或12个月内早期进展但无基因组高危标志物;(3) 不符合GHR或FHR标准的标危组。SR和FHR之间,以及GHR和FHR之间的基因表达谱没有显著差异。然而,FHR患者确实普遍表现出更高的染色体不稳定性指数(来自肉瘤研究CINSARC的染色体不稳定性指数、中心体指数CI和CIN70)和肿瘤侵袭性(增殖指数和PR,一个与增殖基因相关的基因表达谱)。此外,转录组学、突变特征、拷贝数和体细胞突变分析并未识别出区分FHR与GHR和SR的特定基因组“指纹”,这可能暗示外部因素,如免疫微环境失调,在FHR疾病中很重要。然而,突变分析确实发现影响IL-6/ JAK/STAT3通路的突变(与异常有丝分裂和DNA损伤反应相关)在FHR中显著富集。对3组中前200个差异表达基因的比较RNA测序发现,FHR富集了与有丝分裂细胞周期和DNA复制、C2H2锌指和DNA修复相关的基因。
一项研究纳入了41例接受含硼替佐米诱导方案(49%为VCD,17%为VTD/VCDT,22%为RVD,5%为VD-PACE)后未能缓解或在18个月内早期进展的新诊断多发性骨髓瘤(NDMM)患者,采用纵向单细胞RNA测序分析,识别出一种独特的分子耐药特征(称为原发性难治性MM,PRMM),其特征包括缺氧耐受、蛋白折叠和线粒体呼吸功能相关基因表达,该特征具有极高的临床预测价值,并随后在CoMMpass数据库中得到验证。高表达的基因包括与线粒体应激相关的COX6C和COX7A2,与内质网及未折叠蛋白应激反应(UPR)通路相关的PPIA和STMN1,与氧化应激相关的SOD1和TXN,以及蛋白酶体机制相关基因PSMB4和PSMA2。在CoMMpass数据库中进行的生存分析显示,高表达该PRMM分子特征的患者相比其他人群,风险比(HR)为3.9(95% CI:2.22–6.87),p值为4.57 × 10-17。需要注意的是,尽管PRMM特征可预测早期进展,但在低PRMM特征表达的患者中,仍有41%出现了早期进展。随后,研究者进一步分析了D-KRD挽救治疗中的应答者与非应答者,识别出133个差异表达基因,形成两个主要聚类。有趣的是,CD38表达下调,而蛋白酶体相关基因PSMD4和PSMB4表达上调,这可能与蛋白酶体抑制剂(PI)耐药有关;同时,线粒体应激相关基因也上调,提示线粒体呼吸功能的紊乱可能促进恶性浆细胞的存活。。
虽然这些发现为了解FHR的潜在生物学和未来研究的潜在治疗靶点提供了重要见解,但这些检测方法仍然不可用。需要一种可及的、商业化的方法来及时可靠地识别所有FHR疾病。
免疫细胞生物学
几个研究小组已经确定了ASCT后的免疫重建与首次复发时间之间的关联。Porrata等人在2014年对267例MM患者的研究中,首次将回输的自体移植物中的绝对淋巴细胞含量(A-ALC)与移植后较高的循环淋巴细胞计数和改善的结局联系起来。A-ALC ≥ 0.5 × 10^9/kg vs. < 0.5 × 10^9/kg可预测更长的移植后中位OS和至进展时间,分别为58 vs. 30个月(p=0.00022) 和 22 vs. 15个月(p < 0.00012)。随后发现,自然杀伤(NK)细胞重建可预测改善的PFS(特别是发生在移植后早期的NK细胞重建)。Rueff等人对114例接受ASCT的MM患者的CD4+ B、CD8+ T和NK淋巴细胞亚群恢复进行了回顾性流式细胞术分析,发现ASCT后1个月NK细胞恢复与PFS显著相关,但与OS无关。NK细胞计数低于100 cells/μL vs. 100–200 cells/μL的患者中位PFS为2.7个月vs 15.8个月,而>200 cells/μL的患者为10.8个月(p<0.001)。
免疫抑制性调节性T细胞(T-reg)的扩增和CD8+ T效应细胞耗竭/衰老(由抑制性受体TIGIT、PD-1、LAG-3、TIM-3的表达和DNAM-1的下调定义)是免疫逃逸、MM复发和ASCT后PFS的主要决定因素;然而只有少数分析专注于FHR患者。一项对79例患者的研究评估了在4个时间点(大剂量化疗前、植入时、ASCT后6个月和12个月)通过流式细胞术检测循环CD4 + FOXP3 + T-reg细胞的变化。与未进展者(n = 50)相比,在ASCT后12个月内出现疾病进展的患者(n=10)在植入时免疫抑制性CD4 + FOXP3 + T-reg细胞增加,分别为6.7% vs. 4.9%(p = 0.026)。Chung等人对55例在ASCT前接受硼替佐米和/或LEN诱导以及移植后LEN维持的MM患者的免疫重建进行了回顾性分析。与ASCT后12个月保持持续CR的患者相比,对于达到CR但随后在ASCT后早期复发的患者,在复发时,甚至在临床复发前的3个月时间点,耗竭/衰老T细胞的百分比显著更高。耗竭/衰老T细胞的特征为共刺激标志物CD28下调,表明低增殖能力的CD57上调,以及PD-1表达增加。此外,与ASCT后+12个月未复发患者相比,复发时Tregs的倍数变化显著更大,分别为1.65 +/-0.25 vs. 0.94 + 0.13 (p < 0.05)。Lee等人将PFS(定义为从ASCT到复发的时间)与ASCT后D+ 100天时特定T细胞亚群的变化或免疫调节、激活和增殖标志物(PD-1、LAG-3、ICOS、CTLA-4、GzmB和Ki-67)在T细胞亚群上的表达相关联。骨髓中含有较高频率Tregs、CD4效应细胞上PD-1表达更高、以及CD4效应细胞、CD8和Treg细胞上LAG-3表达更高的患者早期复发风险最大(p = 0.031)。CD4PD-1high vs. CD4PD-1low的中位PFS为18 vs. 36个月(p = 0.0042);CD4LAG-3high vs. CD4LAG-3low 为18 vs. 53个月(p = 0.003);CD8LAG-3high vs. CD8LAG-3low为20 vs. 53个月。
有研究对58例患者ASCT后+60天和+100天的骨髓进行飞行时间质谱流式细胞术(CyTOF),发现一部分患者在免疫重建时,其T细胞亚群富含幼稚和终末分化的T细胞,且TIGIT低水平表达(表明T细胞耗竭),其OS和从ASCT算起的进展时间较差,与高危FISH无关。处于分化谱两端的T细胞的存在可能表明这些T细胞无法响应大剂量化疗后释放的MM抗原而参与和扩增,从而促进疾病复发。总之,这些结果表明,早在ASCT后D+ 100天的免疫重建模式就可能为早期复发提供预测性生物标志物,而与传统的风险分层无关。需要更多研究来阐明新的生物标志物,以识别FHR疾病,增强风险分层,并在诊断时实现风险适应性治疗策略。
真实世界中的诱导方案
NDMM的最佳诱导方案仍在不断发展。基于3期PERSEUS试验的结果,预计D-VRd将在部分地区取代VRd作为首选诱导方案,这也加剧了全球真实世界NDMM患者治疗标准的日益分化。因此,寻求为FHR患者提供最佳二线治疗的临床医生也面临着难题,那就是如何解读来自接受异质性一线方案治疗患者的数据。
对已发表真实世界数据的分析突显了全球诱导治疗趋势的极端异质性;此外,虽然一线VRd诱导的使用在北美、西欧和澳大利亚不断增加,但并非同质化。在监管层面,诸如欧洲药品管理局(EMA)、美国食品药品监督管理局(FDA)和澳大利亚治疗商品管理局(TGA)等组织确保其管辖范围内的可用治疗既安全又有效。然而,获得包含蛋白酶体抑制剂(PIs)、免疫调节剂(IMIDs)以及CD38单抗的基于新药的诱导治疗,很大程度上受到成本和医保的限制。在全球范围内,一项硼替佐米联合环磷酰胺(VCD)或沙利度胺(VTD)仍然是TE-NDMM最常用的处方方案。需要进行系统的真实世界分析来评估PI-IMID三药诱导以及现在D-PI-IMID四药诱导的影响(如果有的话),以确定其对FHR疾病发生率和临床结局的影响。此外,尚不清楚在一线基于D的诱导治疗后,基于CD38单抗的方案是否仍有作用。
FHR患者的管理
量化早期复发风险的评分系统
已提出了四种评分系统来识别早期进展高风险患者。细胞治疗与骨髓移植研究中心(CIBMTR)评分系统、简化多发性骨髓瘤早期复发(S-ERMM)评分、动态S-ERMM(DS-ERMM)评分和欧洲骨髓移植学会早期复发(EBMT)评分系统总结在表3。

在确定这些模型对临床实践的适用性时,需要考虑重要的注意事项。首先,虽然部分模型是在对真实世界登记数据集进行回顾性分析后建立的,但其他模型则利用了临床试验的数据,这些患者在FHR发生前接受了不同的诱导治疗,并总结在表4中。第二,每个评分系统考虑不同的临床和疾病相关变量来量化早期复发风险,使用各种相当差异化的临床终点,包括3年PFS和3年OS、中位OS和PFS-2,以及ASCT后12个月PFS的百分比估计。最后,也许是最重要的,其中两个评分系统完全来源于接受ASCT作为一线治疗一部分的患者,因此可能对大多数NDMM患者的适用性有限。CIBMTR和S-ERMM结合生化标志物、高危细胞遗传学以及ASCT前骨髓浆细胞负荷(BMPC)≥10%(CIBMTR)和诊断时BMPC>60%(S-ERMM),但没有衡量对治疗的反应。动态S-ERMM(DS-ERMM)将S-ERMM评分与达到≥VGPR相结合。2023年发表的EBMT评分结合了ASCT时的疾病状态、ISS和Karnofsky体能状态评分。

CIBMTR旨在预测ASCT后的结局,但并非专门为识别FHR患者而设计,尽管证明CIBMTR评分与3年PFS和OS之间存在正相关。CIBMTR内部验证队列确定低危、中危和高危患者的中位PFS分别为42 vs. 35 vs. 14个月(p<0.001),3年PFS为68% vs. 49% vs. 31%(p<0.001),高危组的死亡HR为3.13(p=0.0001),中位OS为49个月(p<0.001)。CIBMTR评分在一个313例患者的队列中进行了外部验证,其中仅12例(3.8%)归类为高危,其1年(41.7% vs. 18.2% vs. 10.5%, p=0.0043)、2年(58.3% vs. 38.2% vs. 17.8%, p=0.0001)和3年(66.7% vs. 50.9% vs. 25.7%, p<0.0001)复发风险分别高于中危和低危组,中位PFS为14.1个月。
S-ERMM估计了早期复发(定义为一线治疗后18个月内)的优势比(OR),高危 vs. 低危,在训练集和验证集中分别为5.59(p<0.001)和4.87(p=0.001)。S-ERMM高危患者的中位PFS为13.2个月,中位PFS-2为19.8个月,中位OS为31.5个月。然而当应用于外部验证CoMMpass数据集(N=476N=476)时,S-ERMM对早期进展的预测并不优于ISS、R-ISS和R2-ISS。
2023年发表的EBMT评分系统利用基于点(point-based)的评分系统来预测早期进展(一线ASCT后≤12个月),基于ASCT时的疾病状态、诊断时的ISS和Karnofsky评分≤70,现已在纳入5个MM移植登记处的大型患者队列中得到外部验证。高危患者在大型真实世界训练Mel200 ASCT队列中的12个月PFS率为57.1%(N=195/7228),在第二个接受Mel140 ASCT的验证队列中为56.2%。
尽管存在相关局限性,特别是在缺乏简单诊断检测方法的情况下,这些评分系统仍具有吸引力。然而,在实践中,利用常规血清学方法和影像学评估进行性溶骨性或髓外病变,对反应速度、深度和持续时间的临床评估仍然是唯一可靠的、识别所有FHR患者的方法。目前也没有临床风险评估工具可以预测功能性高危疾病。
临床试验
将新识别的患者纳入专门针对FHR疾病的临床试验是最佳实践,然而专注于FHR的试验选择有限。澳大利亚骨髓瘤研究联盟(AMARC)赞助的IBIS研究(ACTRN12621001037897)将CELMOD药物Iberdomide(IB)、CD38单抗艾沙妥昔单抗(IS)和地塞米松作为挽救治疗,用于初始1L开始后≤18个月复发的患者,并将于2025年年中完成招募。IBIS是FHR-MM集中化平台(ZEPFHR-MM)的先驱,这是一个采用贝叶斯统计设计的多领域研究,能够在任何给定层完成第4周期时快速读出反应。ZEPFHR将评估许多新药组合,包括双特异性T细胞衔接器,并将于2025年初开放,同样针对初始1L开始后18个月内复发的患者。相关性分析将能够评估FHR MM中的基因组、免疫学、蛋白质组学和转录组学特征,以阐明新的生物标志物以及该疾病的治疗靶点。这是第一个前瞻性评估双特异性抗体在FHR疾病中作用的研究。
最近对ClinicalTrials.gov的在线搜索未发现更多的FHR-MM研究。在没有合适的FHR临床试验的情况下,临床医生应考虑基于CD38单抗-IMID的方案或CAR-T细胞疗法(如果可用)。
结论
随着新疗法的出现,很可能需要修改本文中定义FHR的方式。具体来说,早期进展的定义需要推延到更晚的时间点,因为无论使用何种诱导治疗,那些较早而非较晚进展的患者几乎肯定表现出更短的OS。此外,无论驱动FHR的潜在生物学是什么,它都可能或多或少地对现在可用的治疗药物类别产生拮抗作用。本文提出了一个简单且适用于所有NDMM患者的FHR疾病定义,该共识定义将为专注于FHR-MM患者的临床试验提供信息,以确定改善临床结局的最佳治疗策略,同时提供一个相关性平台,以推进对FHR疾病背后不良生物学的理解。迄今为止,可用于指导FHR最佳管理的数据非常有限;然而有证据表明,虽然基于CD38单抗的方法提供了获益,但并不能完全抵消FHR疾病生物学的影响,即使对于那些在早期进展时未使用过CD38单抗的患者也是如此。参加专门针对FHR疾病的临床试验仍然是最佳实践。
参考文献
S.-l. Lim, M. Engelhardt, E. Terpos, et al., “ European Myeloma Network Consensus Statement on Functional High-Risk Multiple Myeloma,” American Journal of Hematology (2025): 1–13, https://doi.org/10.1002/ajh.70070.


