原发性胃鳞状细胞癌年轻患者未能获益免疫联合化疗,或与PTEN/ATM致病性变异有关
时间:2025-09-25 15:53:18 热度:37.1℃ 作者:网络
原发性胃鳞状细胞癌(GSCC)是一种罕见且侵袭性强的恶性肿瘤,占所有胃癌的比例不足 0.1%。由于缺乏标准化治疗方案且对其分子特征的了解有限,其临床表现和治疗管理仍具有挑战性。本文报告 1 例 33 岁男性患者,表现为明显体重下降、严重反酸和进行性皮下肿块。影像学检查和活检证实为IV期GSCC,无其他潜在转移来源的证据。基因检测显示磷酸酶及张力蛋白同源基因(PTEN)、共济失调毛细血管扩张突变基因(ATM)和范可尼贫血互补组M基因(FANCM)存在致病性变异,同时伴有中等肿瘤突变负荷(TMB)。患者接受了亚叶酸钙、氟尿嘧啶和奥沙利铂(FOLFOX)联合化疗及纳武利尤单抗治疗。尽管接受积极治疗,患者仍出现疾病快速进展和严重血小板减少症,其原因可能为多因素,包括严重脓毒症、肝功能不全、化疗影响、肿瘤进展以及可能的免疫检查点抑制剂相关血小板减少症(irTCP)。严重并发症导致患者在姑息性拔管后死亡。本病例凸显了GSCC诊断和治疗管理的复杂性,尤其是在年轻患者中。识别基因变异为了解该疾病的分子特征提供了有价值的见解。需要进一步研究以制定针对这一罕见恶性肿瘤的有效且标准化的治疗策略。
背 景
原发性鳞状细胞癌(SCC)罕见。在全球范围内,原发性胃鳞状细胞癌(GSCC)的发病率仅为 0.04%-0.09%,占所有原发性胃癌的比例仅为 0.2%。由于其罕见性,诊断原发性GSCC通常需要排除其他潜在的鳞状细胞癌转移来源,如肺、乳腺或肝脏来源,这给诊断过程带来了重大挑战。既往病例报告提供了有价值的见解,指导了其复杂临床病程的临床管理。其他回顾性研究总结了GSCC的特征,但未能制定出处理并发症和疾病快速进展的策略。
胃癌的分子检测和遗传学特征目前已较为明确,包括不同亚型中的基因突变、差异基因表达和体细胞拷贝数变异(SCNAs)。然而,由于GSCC发病率低且起源不明,其分子检测和遗传学特征尚未得到充分记录。GSCC的起源仍不清楚,目前已提出几种可能的理论。这些理论包括可能起源于能够分化为任何细胞类型的“全能干细胞”、预先存在的非肿瘤性腺上皮的鳞状上皮化生、异位鳞状细胞巢、腺癌的鳞状分化、血管内皮,或Epstein-Barr病毒(EBV)或人乳头瘤病毒(HPV)感染。
GSCC的预后通常较差,中位总生存期为 7-8.9 个月。与相同分期的其他胃癌相比,GSCC的总生存期通常更低。其确诊时多为晚期,且常见于 60 岁以上人群。目前,GSCC尚无公认的生物标志物或预后标志物,预后主要基于确诊时的分期。此外,目前尚无指导其治疗的指南,这给患者管理带来了挑战,凸显了进一步明确其临床病理学、发病机制、疾病进展和治疗方法的必要性。本文报告 1 例 33 岁男性原发性GSCC患者,因疾病进展及亚叶酸钙、氟尿嘧啶和奥沙利铂(FOLFOX)联合化疗与纳武利尤单抗治疗的并发症,出现临床状况快速恶化。这些并发症包括梗阻性肝病和严重血小板减少症。
病 例
患者男,33 岁,既往体健,因发现质地坚硬的肿块数周、伴食欲下降、难以耐受经口进食、非自愿体重下降约 20-30 磅、严重反酸及腹痛就诊于肿瘤科门诊。患者数周内于上肢触及一质地坚硬肿块,后逐渐扩散至双臂、躯干及背部。初步体格检查发现遍布整个躯干、手臂及背部的质地坚硬、隆起的皮下结节,未发现浅表皮肤病变。初步实验室检查显示轻度全血细胞减少[白细胞计数(WBC)4.97×10⁹/L,血红蛋白(Hb)9.9 g/dL,血小板计数(PLT)142×10⁹/L]。肝功能检查(LFTs)在正常范围内,丙氨酸转氨酶(ALT)7 U/L,天冬氨酸转氨酶(AST)21 U/L,碱性磷酸酶(ALP)42 U/L,总胆红素(T.bil)0.5 mg/dL。肿瘤标志物CA19-9升高,为 75.37 U/mL。人类免疫缺陷病毒(HIV)检测阴性。胸部、腹部及盆腔计算机断层扫描(CT)显示胃窦壁不对称环形增厚,提示可能为感染性或炎症性病变。可见非特异性胃周及腹膜后淋巴结肿大,以及纵隔、双侧肺门及锁骨上淋巴结肿大。正电子发射断层扫描(PET)/CT进一步显示无数显著高代谢活性病灶,定位于中轴骨和四肢骨、躯干肌肉组织、双侧上肢及双侧近端下肢,以及颈部、胸部、腹部和盆腔淋巴结,还有双侧肺,符合广泛转移性疾病(图1)。患者在另一家机构接受了食管胃十二指肠镜检查(EGD),书面报告显示幽门管内可见一环形、质脆、梗阻性、恶性外观肿块,导致内镜无法通过。未见可疑食管恶性病变。随后为缓解胃出口梗阻,进行了内镜超声(EUS)引导下胃空肠吻合术及lumen-apposing金属支架(LAMS)置入术。
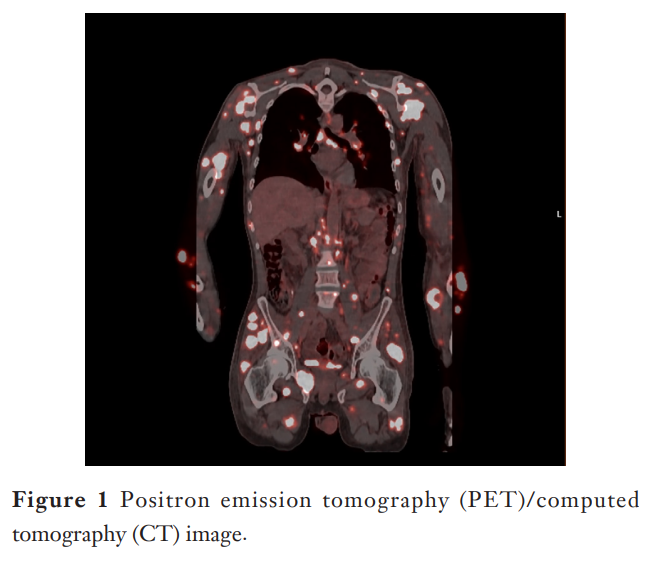
▲图1 PET-CT影像
活检显示中分化浸润性鳞状细胞癌(图2)。随后行右腋窝皮下肿块切除活检,提示转移性中分化鳞状细胞癌,形成 2.7 cm肿块,累及软组织和骨骼肌。免疫组化染色显示p63、CK5/6和CK7弥漫阳性表达,CDX2和p16阴性。患者被诊断为IV期原发性胃鳞状细胞癌(GSCC)。治疗前血液检测结果显示存在PTEN致病性变异,以及ATM和FANCM基因变异。检测还显示中等肿瘤突变负荷(TMB),评分为 8,且微卫星稳定(MSS)。尽管最初计划进行进一步分子检测,但由于组织不足(QNS)或样本处理问题,HER2状态和PD-L1综合阳性评分未能报告。患者还被转诊至遗传咨询,但因后续临床病程未能进行。
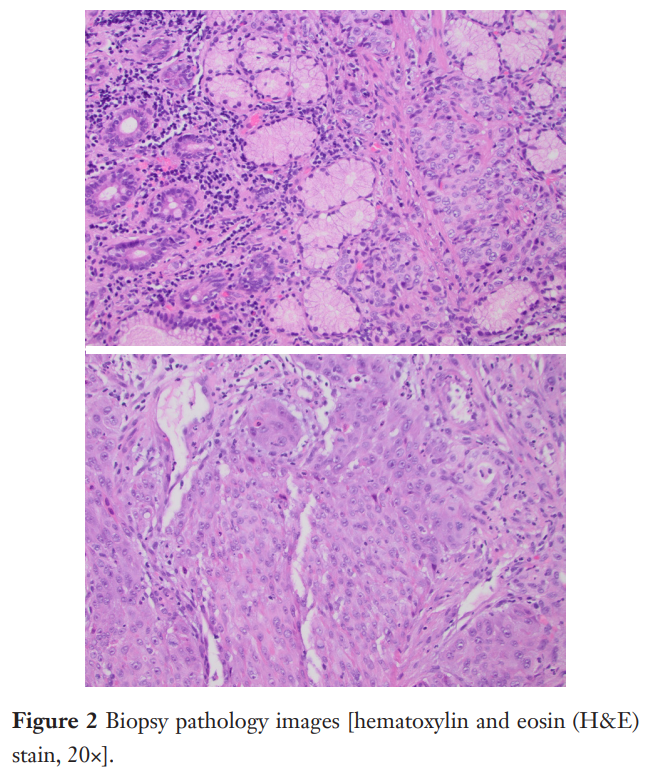
▲图2 活检病理影像
患者开始接受亚叶酸钙、氟尿嘧啶和奥沙利铂联合化疗(FOLFOX)及纳武利尤单抗治疗。第二个治疗周期左右,患者开始注意到皮下肿块快速增大,导致右臂明显肿胀和深静脉血栓形成。第三个周期随访时,发现肝功能急性恶化,丙氨酸转氨酶(ALT)489 U/L、天冬氨酸转氨酶(AST)477 U/L、碱性磷酸酶(ALP)1575 U/L、总胆红素(T.bil)3.8 mg/dL,血小板计数(PLT)50×10⁹/L。因此,患者因考虑免疫治疗相关肝毒性入院,并开始接受 1 mg/kg/天剂量的全身性类固醇激素治疗。其肝炎相关检查未见异常。磁共振胰胆管成像(MRCP)显示胃远端和十二指肠近端存在巨大肿块,阻塞胆总管,导致胆总管严重扩张及中度肝内胆管扩张。消化科医生因原发肿瘤位置原因不建议行内镜逆行胰胆管造影(ERCP),故置入经皮经肝胆管造影(PTC)引流管。引流管置入后,患者肝功能指标最初有所改善,因此停用全身性类固醇激素,因肝功能指标升高更可能由解剖性胆道梗阻导致。患者住院期间进一步并发持续性全血细胞减少,以显著血小板减少为突出表现,血小板计数在(20–30)×10⁹/L范围内。患者继发于大肠杆菌菌血症出现感染性休克,进而发生心血管衰竭,需紧急气管插管及最大剂量血管升压药支持。外周血涂片显示中度大细胞性贫血,伴罕见裂红细胞(<1%)及严重血小板减少症。弥散性血管内凝血(DIC)相关检查未见异常。无溶血证据。直接抗人球蛋白试验阴性。全血细胞减少被认为是多因素导致的,可能与免疫治疗相关再生障碍性贫血、骨髓恶性侵犯(考虑到疾病快速进展)及严重感染性休克相关。同样,严重血小板减少症可能由多种因素共同引起,包括严重脓毒症、肝功能不全、化疗影响、肿瘤进展以及可能的免疫检查点抑制剂相关血小板减少症(irTCP)。最初计划由血液科医生安排骨髓活检,但因患者临床血流动力学不稳定而未能实施。考虑到irTCP的可能性,患者接受了大剂量类固醇激素及艾曲泊帕治疗,但未使血小板计数恢复。在感染性休克和肝功能衰竭情况下,血小板持续严重降低,提示预后极差。插管一周后,家属决定不再进行积极治疗,患者在姑息性拔管后死亡。
讨 论
原发性胃鳞癌诊断
由于原发性胃鳞状细胞癌(GSCC)病例表现罕见,指导其诊断的文献有限。欧洲肿瘤内科学会(ESMO)和美国国家综合癌症网络(NCCN)均未制定诊断指南。20世纪60年代发表的少数文献定义了GSCC的组织学诊断标准,日本胃癌协会(JGCA)提出,原发性GSCC的诊断标准要求组织学上仅为鳞状细胞癌,无腺癌特征,且肿瘤位置不能靠近胃食管交界处(GEJ),同时排除身体其他部位存在鳞状细胞癌的证据。本例患者肿瘤位于幽门,组织学检查显示为鳞状细胞癌。体格检查和影像学检查未发现食管、肛门、头颈部、肺或皮肤等其他部位存在可能为转移灶的病变。尽管患者可触及病变,但病变位于皮下而非浅表皮肤病变。
免疫组织化学(IHC)结果有助于区分转移性癌与原发性GSCC。Kanthan等人近期的一项研究使用CK5、p63和p16等IHC蛋白标志物确诊了宫颈鳞状细胞癌转移至十二指肠的病例。本例患者p63和CK5呈弥漫阳性表达,提示该癌症为鳞状细胞癌性质。然而,IHC检查在区分原发性与转移性GSCC病变中的应用价值仍有限。此外,尽管p16常在人乳头瘤病毒(HPV)相关鳞状细胞癌中表达,但本例患者p16为阴性。原发性GSCC的诊断仍依赖肿瘤科医生基于患者临床表现的临床判断。
原发性胃鳞癌临床病理学
既往一项纳入 163 例患者的队列研究报告,患者平均年龄为 69.6 岁,男性多于女性(113:50)。此外,患者通常确诊时已处于晚期。本例患者与既往已知的原发性胃鳞状细胞癌(GSCC)特征的区别在于,其确诊年龄相对年轻,为 33 岁。
除传统患者一般特征外,本例患者的血液检测结果显示存在PTEN致病性变异,以及ATM和FANCM基因改变。肿瘤被发现具有中等肿瘤突变负荷(TMB),评分为 8,且微卫星稳定(MSS)。Cho等人的研究表明,高肿瘤突变负荷(TMB)与显著的肿瘤、更强的宿主免疫反应、更早的癌症分期和良好的预后相关。在胃癌中,PD-L1表达与微卫星高度不稳定(MSI-H)、更强的宿主免疫反应和高肿瘤突变负荷(TMB)显著相关。其他研究显示,中国患者中某些胃癌亚型因糖脂代谢通路异常而具有高肿瘤突变负荷(TMB)和不良预后,这可能促进肿瘤进展。肿瘤突变负荷(TMB)的影响具有情境依赖性,因此需要进一步研究以确定其在原发性胃鳞状细胞癌(GSCC)管理中的解释和应用。研究表明,PTEN的缺失或表达降低常见于胃癌的发生和进展中,并可能与疾病晚期相关。Lee等人近期的一项研究还显示,与无这些分子改变的患者相比,存在PTEN缺失和表皮生长因子受体(EGFR)过表达的患者生存结局更差。尽管预测原发性胃鳞状细胞癌(GSCC)的数据有限,但本例患者存在PTEN致病性变异,这可能是癌症快速进展的原因。此外,ATM基因变异是癌症中最常见的体细胞突变之一,通常与不良预后相关。这些变异还与显著更年轻的确诊年龄相关,这可能解释本例患者的早发诊断。值得注意的是,FANCM变异在胃癌病例中发生率为 2.8%,相对少见,但在本例患者中存在。本病例为现有文献提供了有意义的补充。进一步报告原发性胃鳞状细胞癌(GSCC)的基因谱对于加深对该疾病的理解至关重要。
治疗方案
目前原发性胃鳞状细胞癌(GSCC)尚无标准治疗方案。既往美国国家癌症数据库研究显示,患者接受了多种治疗策略,包括手术、化疗和放疗。一项综述指出,可切除GSCC患者的3年和5年总生存率分别为 62.2% 和 51.9%。另一项针对 9 例转移性GSCC的综述显示,临床医生决定采用铂类-氟尿嘧啶类或铂类-紫杉烷类双药化疗,总生存期范围为数月至三年。最新病例报告显示,患者接受了5-氟尿嘧啶联合顺铂、卡培他滨联合伊立替康及紫杉醇辅助化疗,以及帕博利珠单抗免疫治疗。本例中,研究人员决定将患者按食管鳞状细胞癌治疗,并基于美国国家综合癌症网络(NCCN)指南启动亚叶酸钙、氟尿嘧啶和奥沙利铂(FOLFOX)联合纳武利尤单抗治疗。患者肿瘤为微卫星稳定(MSS),因此未选择纳武利尤单抗联合伊匹木单抗等其他方案。遗憾的是,癌症进展迅速,且治疗引发了并发症。本病例表明,由于GSCC是一种罕见癌症,其管理具有挑战性。需要进一步研究以评估GSCC治疗的有效性和安全性。
血小板减少症
在患者临床病程后期,他出现了严重血小板减少症。除脓毒症、肝功能不全、化疗影响及肿瘤进展等可能原因外,还怀疑存在免疫检查点抑制剂相关血小板减少症(irTCP)。与其他免疫相关不良事件不同,irTCP与更差的总生存期相关,且在接受PD-1/PD-L1单药治疗的患者中发生率最低。本例患者接受化疗联合纳武利尤单抗治疗,随后出现全血细胞减少,血小板计数显著降低。血小板减少症病因复杂,如肝功能衰竭、严重脓毒症及irTCP等,提示预后不良和高死亡率。研究人员决定积极处理脓毒症及其他潜在促成因素,并启动irTCP治疗。本病例凸显了处理GSCC快速进展及其严重治疗并发症的挑战。
结 论
本病例报告展示了原发性胃鳞状细胞癌(GSCC)的罕见性和临床挑战,尤其是在一名疾病快速进展并出现严重并发症的年轻患者中。患者独特的基因谱以PTEN、ATM、FANCM基因变异及中等肿瘤突变负荷(TMB)为特征,为了解GSCC的本质及其分子特征提供了有价值的见解。鉴于GSCC的罕见性,其管理仍复杂且缺乏标准化,凸显了对更全面研究和治疗指南的需求。
肝功能不全、血小板减少症及其他并发症的发生意味着GSCC管理的复杂性,并强调了早期准确诊断以优化治疗策略的必要性。随着对GSCC的理解不断深入,持续研究基因谱和临床结局对于完善治疗方法和改善患者预后至关重要。未来研究应聚焦于开发靶向治疗和制定标准化治疗方案,以应对这一罕见恶性肿瘤带来的独特挑战。
参考文献:
Chen YH, Joung B, Castillo DR, Brar G. Primary gastric squamous cell carcinoma in a young adult with immunotherapy complications: a case report. J Gastrointest Oncol. 2025 Apr 30;16(2):743-749. doi: 10.21037/jgo-2024-884. Epub 2025 Apr 23. PMID: 40386611; PMCID: PMC12078808.


