基于CT影像预测肺结节生长规律的研究进展
时间:2025-09-03 12:12:06 热度:37.1℃ 作者:网络
摘 要
低剂量计算机断层扫描的广泛应用使得越来越多的肺部小结节被检出,准确预测肺结节的生长规律对于避免诊疗的过度或不足至关重要。本文综述了近年来国内外基于CT影像预测肺结节生长规律的研究进展,重点总结了与肺结节生长有关的因素,传统预测模型、基于影像组学的模型以及深度学习模型在肺结节生长预测中的应用现状和局限性。尽管现有研究在预测肺结节生长方面取得了一定成果,但仍面临样本量小、缺乏外部验证等局限。未来研究应致力于开发个性化、可视化的预测模型,并结合更大样本量的数据,以提高预测的准确性和临床应用的可行性。
正 文
近年来,随着低剂量计算机断层扫描(low-dose computed tomography,LDCT)被美国国家肺部筛查试验(national lung screening trial,NLST)等研究证明可以降低肺癌20% 的死亡率[1],LDCT 被广泛应用于用于癌症筛查[2-3],这使肺小结节的检出率显著提升[4]。为了优化肺结节管理策略,国内外相关指南及文献[5-8]均对筛查发现的肺结节提出了随访和干预措施建议。然而,尽管各指南对持续存在的肺结节可能提示早期肺腺癌或癌前病变达成共识,但在结节的分类标准、干预时机与随访策略方面仍存在显著差异。针对筛查发现的肺结节,当前临床实践面临的主要矛盾在于:一方面,手术切除被认为是肺结节有效的治疗方法[9],但过早干预切除结节也可能增加额外的手术风险并可能导致患者术后生活质量下降[10];另一方面,对于生长缓慢的肺结节,虽然采取观察随访的策略可以减少过度诊疗,但却可能存在延误治疗的风险。因此,亟需一种能够准确预测肺结节未来变化的方法,通过对肺结节进行精确的危险分层,预判最佳手术时机,在避免过度诊疗的同时,最大限度地减少对可能会快速生长的恶性结节的诊断和干预延误。本文总结了近5年来国内外基于CT影像对肺结节进行生长预测的研究,希望为相关研究者未来建立更完善的肺结节生长预测模型提供参考。
1 肺结节生长的相关因素
既往研究[11-14]表明,很多因素都可能与肺结节的生长有关。通过对肺结节的随访,多项研究发现结节初次被检出时的直径、最大周长、表面积、体积、质量、实性成分占比(consolidation tumor ratio, CTR)等指标是结节未来是否会出现生长的独立危险因素,与结节在未来继续生长的风险成正相关,且三维参数(如质量、体积等)较二维参数(如直径、面积等)的预测准确性更高。另外,Gao[15]等的研究指出,结节的平均CT衰减值(mean CT attenuation,m-CTA)有助于预测磨玻璃结节的自然生长,m-CTA>−650 HU的纯磨玻璃结节(pure ground-glass nodule,pGGN)在未来2年内出现生长的概率达68%,而具有更大m-CTA的亚实性结节(subsolid nodule,SSN)较pGGN更有可能在未来出现迅速增长,而He[16]的进一步研究表明, m-CTA (HR= 2.098,P=0.010)和圆度指数(roundness index,结节形状接近圆形的程度,计算公式为圆度=π×S/C², S为面积,C为周长,数值越大越接近圆;HR= 1.892,P=0.021)均为 pGGN 生长的独立危险因素,基线CT上具有较大m-CTA和较小圆度指数的pGGN在未来出现生长的风险更大。这一研究开创性地使用了“圆度指数”对结节的形状进行了定量描述,并发现了其在预测pGGN生长中的价值。除此之外,随着技术发展,一些影像组学特征也可以用来预测肺结节的生长。Borghesi等[17]发现,在多变量分析中,偏度(skewness)和线性质量密度(linear mass density,LMD)与非实性结节的生长显著相关,其中偏度是结节生长的最强预测因子,包含偏度(带或不带LMD)的两个预测模型都显示出预测非实性结节生长的能力,偏度值>0.90且LMD>19.16 mg/mm的结节在未来更有可能出现生长。此外,性别、年龄、吸烟史、肿瘤家族史等临床特征以及分叶征、毛刺征和胸膜牵拉征等CT形态学特征也是影响肺结节生长的因素[18],比如Qiu等[19]基于结节的CT 特征构建了两个诺莫图(nomograms)预测模型,结果显示,包含了肿瘤附近血管特征的模型可用于预测pGGN 的生长。未来将结节CT特征与患者临床特征、组织学特征等相结合,有望更准确地预测肺结节的生长。
除了上述结节固有特征外,随访期间结节特征的变化也可以用来预测肺结节的生长,其中最为广泛接受的指标就是体积倍增时间(volume doubling time,VDT)[20-21]。Tang 等[22]通过对132 例患者长达10 年的随访研究,发现无论基线临床特征和CT影像学特征如何,VDT都是预测SSN 生长和良恶性转变的关键因素,并且VDT ≤400 d 与结节未来的侵袭性生长行为显著正相关。He等[23]发现相比于测量结节大小的变化,随访期间密度增加的结节更有可能在早期即出现生长且生长速率更快,且在大小和密度都增长的结节中,实性成分VDT比结节总VDT更短,更进一步的分析显示实性成分VDT较结节VDT对恶性进展的预测敏感性高22%,这一研究提示临床医生需要密切关注那些随访期间出现新增实体成分的结节,无论这些结节体积是否发生变化。在另一项回顾性研究[24]中,研究者收集了2 523 例至少进行了2年随访的患者数据,总共分析了其中3 120个SSN,根据术后病理结果将结节分为癌组和非癌组,两组中结节的直径、体积和质量的倍增时间分别为711 d vs. 963 d (P=0.20)、552 d vs. 621 d(P=0.04)和488 d vs. 623 d (P<0.001),这表明质量增长速度比直径或体积增长速度更能敏感地反映与肺癌相关的SSN 生长。但也有研究[25]指出,临床实践中VDT对生长结节的鉴别诊断有一定局限性,因为良性结节的体积也快速增长,而许多恶性结节则可能生长缓慢或长期稳定,有20%的浸润性腺癌表现为VDT>600 d 的惰性生长。总之,VDT是评估肺结节恶性风险的重要量化指标,仍有局限性,需结合结节其他特征综合判断,且质量、密度或实性成分变化可能较体积更具恶性预警价值,需要进一步研究。
2 肺结节生长的预测模型研究
2.1 传统肺结节生长预测模型
基于影像学特征的传统肺结节生长预测模型主要是基于患者CT影像学特征构建,包括线性、二次、幂律和指数模型。其中指数生长模型基于早期肿瘤中癌细胞以恒定速率进行分裂的思路而建立[26-27]。在实体肺癌中,因为肿瘤细胞数量增长与肿瘤体积增长呈正相关,故指数模型可能更适合用来预测肺结节的生长[27-28]。比如de Margerie-Mellon等[29]通过对69 例患者的74 个肺腺癌结节的评估发现,表现为SSN的腺癌总体体积增长最适合用指数模型表示,这表明基于VDT的指数生长模型确实可用于预测此类结节的生长。但Qi等[12]通过对110例患者的110 个pGGN总共573次随访CT扫描进行分析后发现,pGGN在前35个月的随访中呈现近似恒定的体积增长速度,随后却有所减速。这一发现表明pGGN的生长模式具有阶段性特征:早期符合指数模型,后期则更符合Gompertzian 模型(月均降速0.8%)。Gompertzian模型是一种描述肿瘤生长模式的数学模型,由英国数学家Benjamin Gompertz在1825年提出,与指数模型相比,其更适用于描述肿瘤在后期阶段的生长行为[30],此模型认为肿瘤的生长速度在早期阶段较快,但随着肿瘤体积的增大,生长速度逐渐减慢,最终达到一个平台期。但该研究没有区分图像是否为增强CT,这可能对肺结节密度及其变化的测量产生影响。然而,现有传统肺结节生长预测模型仍存在一定局限性,上述模型纳入计算的样本量小或基于特定患者群体,虽然这些模型在特定人群中表现出较好的预测性能,但在不同人群中的诊断效能可能会有所下降,这限制了其临床应用价值。
2.2 基于影像组学的肺结节生长预测模型
影像组学作为一门新兴的交叉学科,融合了医学影像数据与人工智能技术。其核心在于将医学影像转化为可量化分析的高维数据,通过提取包括结节大小、形态特征及肿瘤时空异质性等在内的多维度信息,深入挖掘这些特征与疾病发生发展的内在关联,从而在疾病辅助诊断、疗效评估及预后预测等领域发挥重要作用[31-33]。近年来,影像组学技术在肺结节诊断[34-35]和生长预测方面的应用日益广泛。Gao等[36]开展了一项前瞻性研究,分析了85 例患者的110个GGN,随访时间均长于2年。研究采用最小冗余最大相关性(minimum redundancy - maximum relevance,mRMR)和最小绝对收缩和选择算子算法(least absolute shrinkage and selection operator,LASSO)进行影像组学特征筛选,由放射科医师对这些GGN进行手工分割,并利用Analysis Kit软件进行了量化分析。研究构建了临床特征模型、影像组学模型及联合预测模型用于预测GGN生长,通过受试者工作特征(receive operating characteristic,ROC)曲线评估模型性能。结果显示,联合模型的曲线下面积(area under curve, AUC)达到0.801,显著优于单一模型,充分展现了临床特征联合影像组学特征在GGN生长预测中的潜在价值,但该研究存在样本量有限、缺乏外部验证、仅评估二维生长趋势等局限性,其临床可重复性仍需进一步验证。Ma等[37]基于影像组学特征开发了SSN 生长速率预测模型,研究分析了273个生长中的SSN的共857次CT扫描数据,根据VDT将结节分为快速生长组(VDT≤400 d)和慢速生长组(VDT >400 d)。筛选出10个影像组学特征和3个影像学形态特征(结节密度、毛刺征、血管变化)构建预测模型,该模型在训练集和验证集中的AUC值分别达到0.928 和0.905,显著优于仅使用影像学形态特征(AUC=0.668 和AUC=0.689)和仅使用影像组学特征(AUC=0.888 和AUC=0.816)的模型。Xue等[38]也开发了一种整合影像组学特征和临床特征的预测模型,用于个体化预测CT上不确定性质的小肺结节(4~12 mm)的2年生长情况。该模型在训练集和验证集中分别取得了0.911 和0.843 的AUC值,具有良好的临床应用潜力。综上,目前已开发的影像组学模型大多结合了患者的临床特征和影像学特征的联合模型,较单一模型均展现出更好的预测性能,可用于精准预测GGN生长,但这些研究普遍受限于样本量有限、缺乏外部验证和手工分割结节的主观偏差等局限,其临床可重复性仍需进一步研究证实。
2.3 基于深度学习的肺结节生长预测模型
近年来,随着大数据与人工智能技术的飞速发展,基于深度学习的肺癌辅助诊断已成为该领域前沿研究方向之一。其中,基于CT影像的计算机辅助诊断技术在肺结节的检测与分类方面展现出重要的临床应用价值[39-41],国内外已有多个学者将其应用于预测肺结节未来的生长。Liao等[24]使用基于LUNA16和Lndb19数据集训练的深度学习模型,实现了对SSN的直径、体积和质量的自动测量,并在此基础上分别开发了深度学习模型与影像组学模型用于预测肺结节的生长。研究将SSN 生长定义为1年内质量增加25%,结果显示,深度学习模型在验证集和外部测试集中的预测性能显著优于影像组学模型(验证集中AUC分别为0.858和0.760,测试集中AUC分别为0.862和0.681)。
值得注意的是,该模型还能够仅使用首次发现结节时的CT数据预测SSN 的生长,在验证集和测试集的AUC分别达到0.855 和0.821,充分展现了深度学习在SSN 生长预测中的巨大潜力。Rafael-Palou等[42]则开发了一种基于3D 孪生神经网络(siamese neural networks,SNNs)的方法,无需图像配准即可实现对同一患者在不同时间点CT扫描中的肺结节进行自动识别与匹配。该模型之后被集成到一个自动流程中,可实现肺结节的自动化检测、匹配及生长预测,在预测肺结节生长时达到了92.0% 的灵敏度和88.4% 的准确度。Tang等[43]也构建了一种基于深度学习的分类模型(deep learning classification model,DLCM)用于预测pGGN的生长,该模型在内部验证队列中的AUC为0.79,在外部验证队列中为0.70,显示出良好的临床应用前景。然而,由于深度学习模型对数据量的高度依赖性,现有研究的训练集及验证集样本量普遍不足,尽管上述模型在预测肺结节生长时表现出较大的潜力,但其准确性仍难以满足临床需求,未来仍需要更大规模的研究来进一步提升预测性能。
随着人工智能技术的不断进步,肺结节生长预测的研究重点已经从只预测“是否生长”转向更为精确地预测“如何生长”。例如,Tao等[44] 开发了一个基于卷积神经网络(Convolutional Neural Network, CNN)的预测系统,能够根据基线CT图像和指定的时间间隔,预测肺结节在后续CT扫描中的生长模式,并给出未来任意时间点的三维影像。对该模型绘制的未来肺结节图像进行分析的结果显示,模型预测的CT值、直径、体积和质量与真实数据高度相关(相对误差分别为0.083 HU、 0.117 mm、0.351 mm³、0.293 mg),预测的VDT在区分生长与非生长结节时表现出较高的AUC(磨玻璃结节0.857,实性结节0.843),预测的CTR在对高风险结节进行分类时的AUC达0.892,并且模型生成的未来结节影像在形态和纹理上与真实影像接近。而Wang等[45]则提出了一个基于Wasserstein生成对抗网络(wasserstein generative adversarial network,WGAN)的生长预测模型(growth predictive- WGAN,GP-WGAN),使用该模型在包含450个结节的独立测试集上进行验证,生成的预测结节图像与真实的结节图像在肺癌诊断中的表现相当,AUC分别为0.827和0.862,两者差异无统计学意义(P=0.071),显示出该模型在肺癌早期诊断中的潜力。此外,Fang等[46]则通过将基线CT图像内容与Gompertze函数的参数相关联,开发了一个Gompertze函数引导的形态自编码器(Gompertze-guided morphological autoencoder,GM-AE)来预测肺结节的生长。该模型由形状感知分支和纹理感知分支组成,前者基于预测的体积生长速率生成未来结节的形状,后者则基于预测的质量生长速率合成未来结节的纹理,最终整合生成完整的肺结节图像。验证结果表明,该模型在肺结节生长的定量评估中展现出显著潜力,为临床决策提供了有力支持。以上研究均表明基于人工智能技术能够实现对肺结节未来图像进行绘制,并且图像可以达到很高精度,相比于预测肺结节未来的定量特征,直接给出结节未来特定时间点的图像可能更容易被临床医生接受并在实践中应用,这也标志着肺结节生长预测正朝着更精确、更个性化的方向发展。
3 总结与展望
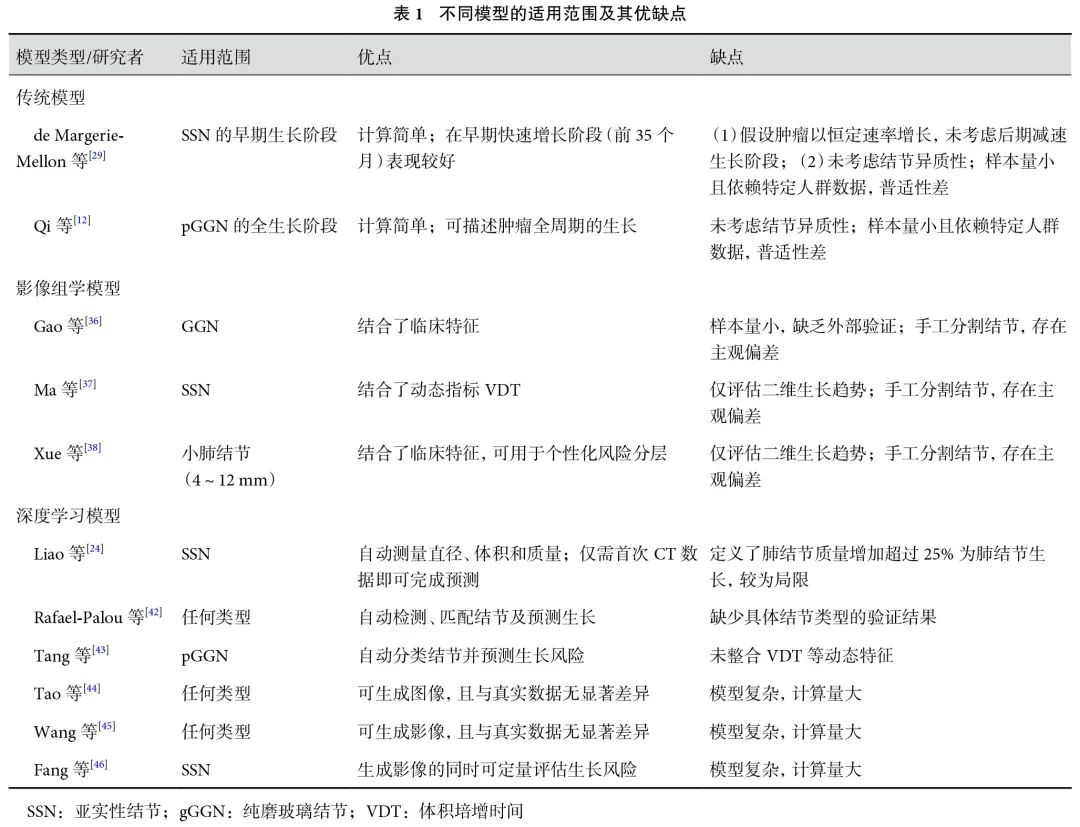
尽管近年来国内外的研究在肺结节生长预测领域已取得显著进展(不同模型的适应范围及其优缺点比较见表1),但现有研究仍存在诸多局限性,大多数研究受限于样本量不足、研究对象局限于特定人群以及缺乏独立的外部验证集等问题,导致模型的普适性和临床适用性受到限制。展望未来,肺结节生长预测模型的开发应重点关注以下几个方向:(1)加强个性化预测能力,充分考虑患者的个体差异,以提高预测的精准度,特别是近年来人工智能及深度学习技术在其他诸多领域蓬勃发展,如在病理组学领域,Wei 等[47]建立了一个深度学习模型来区分肺腺癌的病理亚型,该模型的性能与高年资病理科医生相当,表明其可在临床上用于帮助病理科医生对肺腺癌进行分类。在未来,将影像组学技术与病理组学、基因组学等联合起来,有望建立更高效能的预测模型;(2)探索可视化预测技术,通过直观的图像展示帮助临床医生更好地理解预测结果;(3)基于预测模型对肺结节进行风险分层,为临床决策提供更细致的参考依据。为实现这些目标,未来的研究需要扩大样本规模、开展多中心合作、建立高质量的外部验证集,并注重模型的临床转化。只有在确保预测效能的前提下,才能加速预测模型在临床实践中的应用,从而辅助临床医生制定更精准的肺结节管理策略,最终提高肺癌的早期诊断和治疗水平。
利益冲突:无。
作者贡献:薛文赫、陈楠参与本文的撰写与修改;刘伦旭对文章的相关内容进行指导与修正。


