以DEK::AFF2融合为特征的鼻窦癌易误诊,如何鉴别?有哪些新兴治疗策略?
时间:2025-09-25 15:47:34 热度:37.1℃ 作者:网络
DEK::AFF2融合相关鼻腔鼻窦癌极为罕见,全球报道病例不足 100 例,但可能未被充分认识。最近,世界卫生组织(WHO)将其归类为非角化型鳞状细胞癌的一种独特暂定亚型,这类肿瘤在诊断和治疗方面均面临重大挑战。其组织学上与内翻性乳头状瘤相似,且多数病例具有温和的组织学表现,常导致误诊,而其侵袭性行为则强调了个体化治疗方案的必要性。本文报告两例在德国萨尔兰大学医学中心诊治的DEK::AFF2融合相关癌病例。第一例为一名 46 岁女性,最初表现为复发性鼻道内翻性乳头状瘤,近十年来经多次手术干预确诊。2023年,重新评估及基因分析显示存在DEK::AFF2融合。患者接受三个周期的新辅助吉西他滨联合顺铂治疗后,应答显著,MRI再分期显示完全缓解。因此,治疗方案转为根治性放化疗,2024 年 7 月治疗后三个月的正电子发射断层扫描-计算机断层扫描(PET-CT)证实其持续无病状态。第二例为一名 66 岁女性,表现为累及鼻道和鼓室区域的复发性内翻性乳头状瘤。尽管接受了多次手术,仍发生恶性转化,发展为侵袭性鳞状细胞癌,并出现淋巴结转移和颅内扩散。随后采取了耳鼻咽喉科与神经外科联合手术方案,但疾病仍进展。患者于 2020 年 1 月去世,组织学回顾及基因检测证实为DEK::AFF2融合癌,其初始标本显示形态温和的乳头状瘤样表现,后期则出现高级别细胞学特征,提示生物学进展为低分化癌。这些病例强调了DEK::AFF2融合相关癌的侵袭性本质以及基因检测在诊断和管理中的关键作用。其中一例出现首次报道的对新辅助化疗的显著应答,这凸显了个体化治疗策略的潜力,值得进一步研究针对这一罕见恶性肿瘤的靶向治疗。
背 景
在鼻窦肿瘤中检测到DEK::AFF2基因融合极为罕见,全球报道病例不足 100 例。这种新型实体瘤现已被世界卫生组织(WHO)归类为鼻窦非角化型鳞状细胞癌(SCC)的一种独特暂定亚型,其组织学特征为单形性细胞的合胞体巢、乳头状生长模式、内翻性条索及模糊的外周栅栏状排列,酷似外生性和内生性(内翻性)乳头状瘤。DEK::AFF2融合相关癌由于其看似良性的组织学表现,最初常被误诊为鼻窦内翻性乳头状瘤。然而,它们表现出侵袭性行为,常发生局部复发、颈部淋巴结转移和远处转移,凸显其恶性潜能。值得注意的是,如既往一项个案报道所述,尽管PD-L1染色阴性且肿瘤突变负荷低,DEK::AFF2癌对抗PD-1免疫治疗仍表现出显著应答。DEK::AFF2融合相关鼻窦癌的独特分子特征伴随独特的临床挑战,尤其是由于缺乏标准化治疗方案。本病例报告详细介绍两例在萨尔兰大学医学中心接受治疗的患者,旨在拓展当前关于这一罕见恶性肿瘤的诊断方法和治疗策略的认知。通过阐明这些病例,研究人员旨在为这一肿瘤实体及其潜在治疗途径的不断发展的认知做出贡献。
研究材料和方法
组织标本用福尔马林固定,并常规处理用于组织病理学检查。为检测DEK::AFF2融合,从福尔马林固定石蜡包埋(FFPE)组织切片中提取RNA,分子分析采用TruSight RNA Fusion检测panel,以 500 ng RNA为输入量进行。每例样本reads >300 万,使用RNA-Seq Alignment workflow 2.0.1版对序列进行分析。分别使用Illumina和Arriba软件对RNA测序中的融合基因进行检测和可视化,如图1所示。
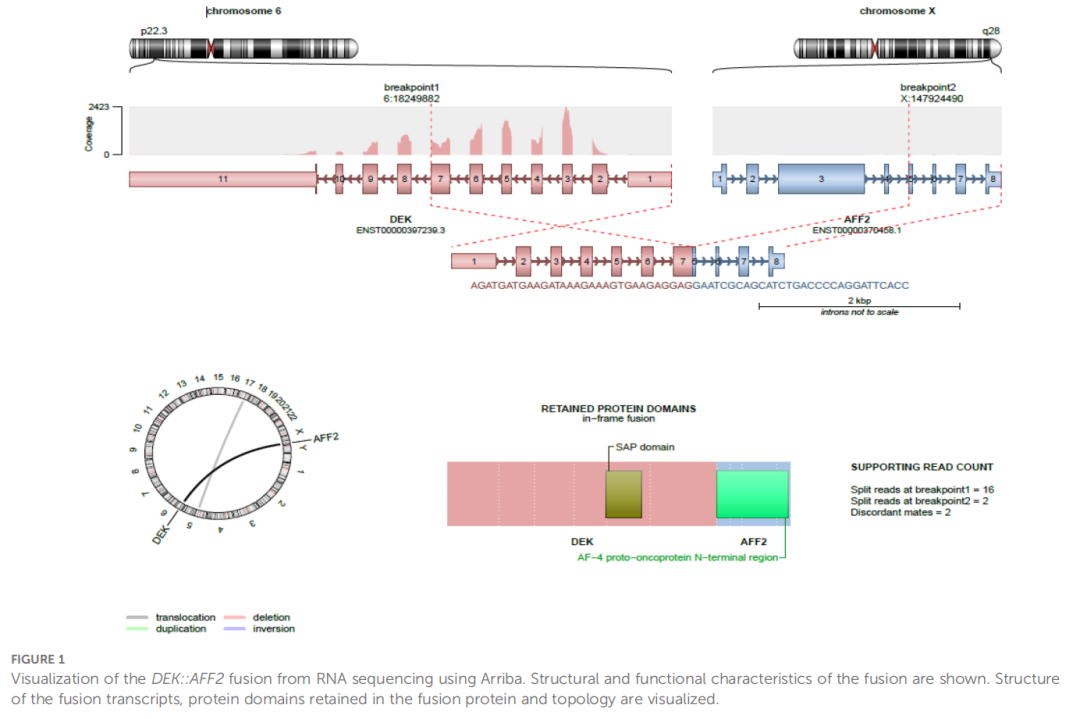
▲图1 使用Arriba软件对RNA测序结果中的DEK::AFF2融合蛋白进行可视化
病例1
患者女,46 岁,有外阴癌病史,无其他明显合并症,2014 年因其他原因接受头颅磁共振成像(MRI)检查,偶然发现符合慢性鼻窦炎的表现,累及蝶窦和筛窦,同时疑似额骨颅底糜烂。随后接受手术干预,组织病理学检查结果为内翻性乳头状瘤。初次手术后,患者出现症状复发及提示疾病持续存在的影像学表现,需要进一步干预。2014 年至 2016 年间,因形态学证据显示复发性乳头状瘤累及蝶窦和筛窦,且硬脑膜逐渐暴露,进一步行 3 次功能性鼻内镜鼻窦手术(FESS),包括病变基底部磨除。这些标本的组织病理学评估均证实为内翻性乳头状瘤(见图2A)。2017 年初,MRI检查结果再次提示疾病复发。患者在外院接受了另一次FESS手术,组织病理学分析再次证实为复发性内翻性乳头状瘤。疾病进一步进展,2018 年再次手术,随后直至 2019 年在外院又接受了 2 次FESS手术。2023 年,复查计算机断层扫描(CT)显示复发性内翻性乳头状瘤新发病灶,伴纸样板侵蚀并延伸至眼眶(图2B)。这种侵袭性行为促使在 2023 年 6 月最近一次手术干预后进行全面基因检测,发现DEK::AFF2融合,这是一种罕见基因变异,可能是患者难治性病程的潜在原因。
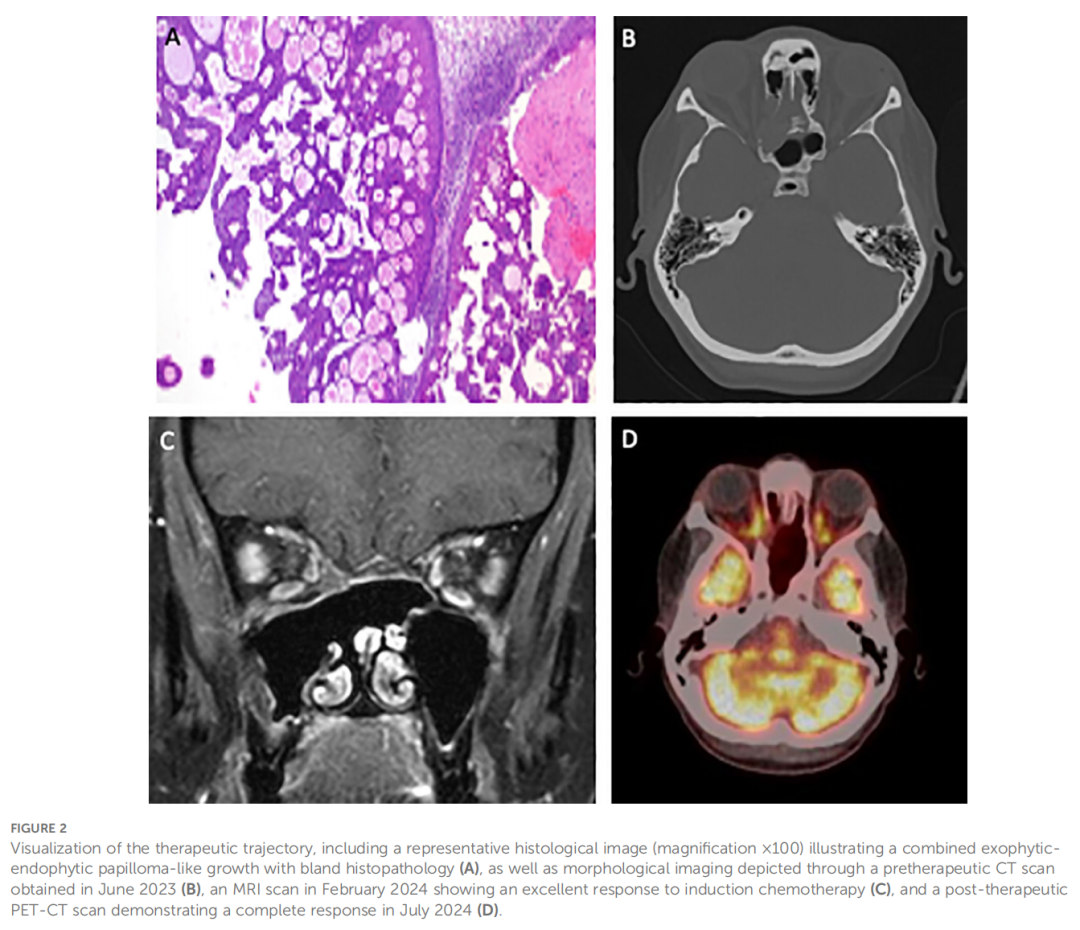
▲图2 治疗过程可视化
由于未检测到淋巴结受累或远处转移,多学科肿瘤委员会提出的初始治疗策略侧重于新辅助治疗。患者计划接受三个周期的吉西他滨联合顺铂治疗,旨在通过神经外科与耳鼻喉科联合手术方案实现R0切除。然而,2024 年 2 月,MRI再分期显示诱导化疗完全缓解(见图2C)。鉴于这一首次报道的显著应答,治疗方案调整为根治性初始放化疗(CRT)。该方案包括五个周期的顺铂联合靶向放疗,放疗范围包括鼻窦、部分眼眶受累区域及双侧II、III区淋巴引流区。2024 年 7 月的随访影像学检查(PET-CT,见图2D)显示DEK::AFF2融合相关鼻窦癌完全代谢缓解。此后,患者纳入定期肿瘤学监测,截至目前无疾病复发证据。
病例2
患者女,66 岁,最初表现为复发性血性鼻溢液和鼻腔内性质不明的肿块。患者其他方面健康,无已知肿瘤病史。计算机断层扫描(CT)显示累及左侧上颌窦、筛窦和额窦(见图3A)。行功能性鼻内镜鼻窦手术(FESS)后,组织病理学检查证实诊断为内翻性乳头状瘤。2017 年 5 月,即首次就诊后 6 个月,患者因进行性传导性听力损失复诊。CT显示一性质不明的肿块累及鼓室、左侧上颌窦和鼻中隔后部(见图3B)。患者接受了鼓室成形术联合耳内肿瘤切除术及修正性功能性鼻内镜鼻窦手术。组织病理学检查发现累及鼻道和鼓室区域的内翻性乳头状瘤。
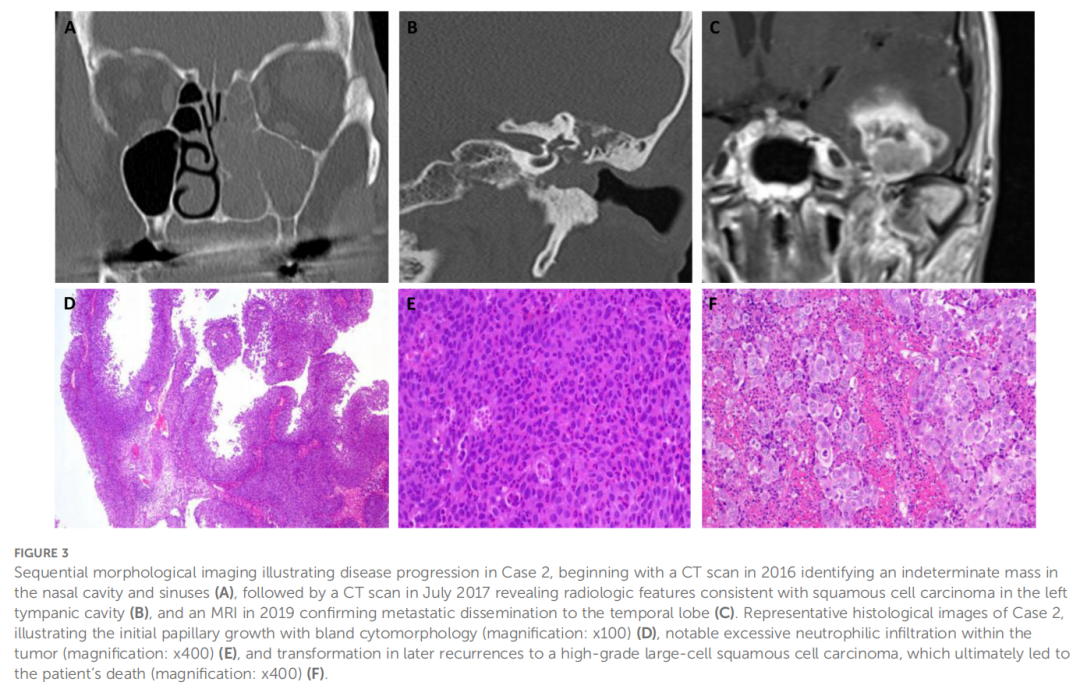
▲图3 连续CT成像提示病例疾病进展
由于鼓室病变切除不完整,遂采用耳内及耳后联合入路进行肿瘤减瘤术。尽管进行了此次干预,2017 年 8 月的常规耳镜随访发现左侧外耳道疑似内翻性乳头状瘤复发。此外,在修正性外耳道手术中发现腮腺区域有一可疑淋巴结,并将其切除。对切除组织的组织病理学评估证实存在侵袭性鳞状细胞癌(SCC)。这些发现提示左侧外耳道内翻性乳头状瘤发生恶性转化,同时伴有淋巴结转移(见图3D-F)。2017 年 12 月,患者接受了修正性鼻窦手术和修正性外耳道手术。组织病理学分析证实外耳道和鼻道均存在鳞状细胞癌。修正性手术后,患者于 2018 年 1 月至 3 月接受辅助放化疗,总剂量为 63 戈瑞,同步给予顺铂。治疗靶区包括左侧鼻腔、左侧上颌窦、左侧外耳道及同侧颈部淋巴结。2019 年 4 月,患者出现左侧乳突区持续性慢性疼痛,左侧外耳道及乳突区新发现可疑肿块,并新发面神经麻痹。这些发现促使决定进行修正性手术,组织病理学检查显示低分化非角化型鳞状细胞癌复发。MRI显示复发病灶及左侧颞叶新发病变(见图3C)——高度提示转移伴中线移位——促使决定采取耳鼻咽喉科与神经外科联合干预。2019 年 11 月,患者接受左侧腮腺切除术、舌下神经跨接吻合术及颞叶转移灶切除术。术后病程因并发海绵窦血栓形成而复杂化,需长期重症监护治疗。2020 年 1 月,患者因该病去世。对 2019 年 4 月手术中获取的福尔马林固定石蜡包埋(FFPE)组织样本进行分析,重新解读为符合DEK::AFF2癌,随后通过检测DEK-AFF2融合予以证实,强调其在疾病侵袭性进展中的作用。
讨 论
所呈现的病例强调了DEK::AFF2融合相关鼻窦癌带来的严峻临床挑战,其特征为侵袭性局部侵犯和高复发倾向。两例病例中,DEK::AFF2融合的诊断确认均显著延迟,主要原因是最初被误诊为内翻性乳头状瘤——鉴于两者重叠的形态学特征,这是一个常见的诊断陷阱。组织病理学评估显示,DEK::AFF2癌常表现出复杂结构,包括内生性和外生性生长,通常呈乳头状瘤样生长模式。肿瘤细胞表现为移行上皮,细胞质呈嗜酸性至双嗜性,无或极少角化,可见散在的致密角质珠,细胞核形态单一,并伴有明显的中性粒细胞或间质淋巴细胞浸润。与既往报道的发现一致,本报告中的两例病例均表现出内生性和外生性结构模式的组合,同时伴有局灶性角化亢进性鳞状上皮化生。
然而,其看似温和的组织学特征给仅基于形态学区分DEK::AFF2融合相关鼻道癌与鼻道内翻性乳头状瘤带来了重大挑战。免疫组化分析和基因检测,特别是评估EGFR和KRAS的突变状态,可能提供关键诊断线索。尽管这些突变是鼻窦乳头状瘤的特征,但在已报道的DEK::AFF2融合病例中持续缺失,强调其在鉴别诊断中的潜在价值。在此背景下,EGFR和KRAS突变的缺失可作为关键分子指标,提示需进一步检查基因融合事件(如DEK::AFF2),尤其是在表现出看似惰性组织学特征的临床侵袭性病变中。鉴于DEK::AFF2鼻道癌的诊断挑战,目前正在探索除广泛使用的RNA测序之外的替代检测策略,以提高诊断敏感性和特异性。值得注意的是,Kuo等人评估了一种针对AFF2 C端的免疫组化检测,该检测对DEK::AFF2鼻道癌显示出 100% 的敏感性和特异性。这些发现表明,AFF2免疫组化是一种高度敏感、特异且经济高效的辅助工具,可能有助于DEK::AFF2鼻道癌的诊断流程。
尽管如此,进行融合检测的决定——无论采用何种方法——都应在多学科框架指导下进行,整合组织病理学不确定性、临床进展模式和侵袭性行为的影像学证据。实施这种诊断流程可能促进DEK::AFF2融合相关癌的早期检测,并为及时、个体化的治疗策略提供依据。
鉴于DEK::AFF2融合相关癌的新颖性,目前缺乏标准化治疗方案。最佳治疗方法——无论是手术干预、全身治疗、放疗还是其组合——仍未明确。因此,此类病例报告对于为新兴治疗策略提供见解以及提高临床医生对这一罕见恶性肿瘤的认识具有重要价值。
在本报告中,研究人员证明新辅助吉西他滨联合顺铂治疗可产生显著应答,正如病例1。据研究人员所知,这是首次报道的DEK::AFF2融合相关癌对新辅助化疗产生完全影像学缓解病例。这一发现与Yang等人报道的结果形成对比,后者报道了一例DEK::AFF2融合癌伴肺转移病例,尽管PD-L1表达阴性,但对PD-1抑制剂治疗(帕博利珠单抗)表现出显著应答。值得注意的是,这一应答发生在既往接受含铂化疗联合5-氟尿嘧啶治疗后疾病进展的情况下,该治疗在一年后未能实现疾病控制。对免疫治疗产生显著应答的分子基础可能归因于基因融合相关新抗原,这些新抗原可增强肿瘤特异性T细胞活化。
除了Kou等人概述的辅助、放疗或联合放化疗策略以及Yang等人描述的免疫治疗方法外,目前尚无针对DEK::AFF2融合阳性癌的标准化或广泛接受的治疗流程。除本病例中采用的新辅助治疗外,现有文献中尚无其他替代治疗方式的报道。这凸显了对多中心协作登记研究、进一步的分子特征分析和前瞻性研究的迫切需求,以完善这一侵袭性肿瘤实体的诊断标准并制定循证治疗框架。
实体瘤1560基因融合RNA检测(NGS方法学)项目,可检测DEK::AFF2融合在内超过1560种已知融合和数百个基因相关的未知融合。
参考文献:
Knebel M, Agaimy A, Kühn JP, Körner S, Braun F, Brust L, Flockerzi V, Wemmert S, Balensiefer B, Schick B, Yilmaz U, Zaito M, Bozzato A and Linxweiler M (2025) Case Report: “DEK::AFF2 fusion associated sinonasal carcinomas: a novel oncogenic driver and emerging therapeutic strategies”. Front. Immunol. 16:1611790. doi: 10.3389/fimmu.2025.1611790


