PLAG1融合“解锁”新亚型!伴PLAG家族基因变异的中枢神经系统胚胎性肿瘤的第三种亚型
时间:2025-08-31 12:13:28 热度:37.1℃ 作者:网络
伴有PLAGL扩增的中枢神经系统(CNS)胚胎性肿瘤(ET, PLAGL)是近期被描述的一种肿瘤类型,其特征为PLAG家族基因(PLAGL1或PLAGL2)中任意一个基因发生扩增。此外,另有研究报道了一种发生于幕上、形似室管膜瘤且存在PLAG家族基因变异(即PLAGL1融合)的中枢神经系统肿瘤类型(NET_PLAGL1)。本研究结合DNA甲基化谱分析、拷贝数分析、RNA-seq及组织学分析,对一组新发现的携带PLAG1融合的中枢神经系统胚胎性肿瘤(n=12)进行特征分析与分类。
通过筛选,研究者发现了一个由12例中枢神经系统肿瘤组成的亚组,其表观遗传学特征与其他已知中枢神经系统肿瘤类型存在显著差异,但在t-SNE分析中,该亚组与ET, PLAGL中PLAGL1扩增型和PLAGL2扩增型亚型的聚类关系密切。拷贝数谱分析提示存在潜在的PLAG1融合,其中9/12例肿瘤的该结果得到证实(剩余3/12例未明确)。研究鉴定出多种5'端融合伴侣基因(包括ASAP1、ADGRG1、TMEM68、TCF4、CHD7、NCALD、HNRNPK、LOC105378102),这些伴侣基因通过“启动子劫持”机制上调野生型PLAG1的表达。表达分析显示,PLAG1以及IGF2、DLK1、结蛋白(Desmin)、CYP2W1和RET基因均存在表达上调,而这些基因在PLAGL1/2扩增型肿瘤中同样呈高表达。患者特征、生存数据及临床/影像学分析结果显示,该组肿瘤与PLAGL1/2扩增型肿瘤还存在其他相似性:确诊时的中位年龄为5岁,肿瘤可发生于整个神经轴,且初始组织学诊断结果具有异质性。该组肿瘤在形态学上同样表现出异质性,大多数肿瘤包含由原始小蓝细胞构成的密集细胞区,同时局部区域可见透明细胞形态、微囊样改变以及室管膜瘤样血管周围假菊形团。目前针对该类肿瘤的治疗方案尚未统一,但已观察到部分患者对治疗存在良好应答。
综上,本研究描述了PLAG家族基因变异的儿童中枢神经系统胚胎性肿瘤的第三种亚型,其特征为PLAG1融合,且该融合基因可导致PLAG1及其下游基因的表达上调。因此,研究者建议将原“伴有PLAGL扩增的中枢神经系统胚胎性肿瘤(ET, PLAGL)”更名为“伴有PLAG家族基因变异的中枢神经系统胚胎性肿瘤(ET, PLAG)”,并在命名中明确标注相应亚型(PLAG1融合型、PLAGL1扩增型或PLAGL2扩增型)。
研究背景
2021年版WHO中枢神经系统肿瘤分类首次在传统组织病理学基础上整合分子特征,形成了全新的肿瘤分类体系。该分类体系认可了分子分析(如NGS、基于DNA甲基化的分类)与形态学、免疫组织化学(IHC)联合应用的重要性。这一范式转变具有重要意义,尤其适用于那些组织学和形态学特征相似但分子特征不同、仅能通过分子分析可靠区分和分类的肿瘤类型——例如既往的原始神经外胚层肿瘤(PNET),以及不同亚型的室管膜瘤或髓母细胞瘤。此外,通过DNA甲基化谱分析,已有多种新的肿瘤类型被鉴定和表征(包括近期发表的关于PLAGL1融合型幕上神经上皮肿瘤(NET_PLAGL1)、PATZ1融合型神经上皮肿瘤(NET-PATZ1)、PLAGL扩增型中枢神经系统胚胎性肿瘤(ET, PLAGL)的研究),这些肿瘤类型有望被纳入下一版WHO分类。
当前WHO分类另一个新颖且重要的特点是,明确区分了儿童型与成人型中枢神经系统肿瘤——二者不仅在中枢神经系统肿瘤分类中的归属存在差异,且WHO单独为儿童肿瘤设立了一卷分类标准,充分体现了两类肿瘤的本质区别。在0-14岁儿童中,中枢神经系统肿瘤是第二大常见肿瘤类型,也是该年龄段癌症相关死亡的首要原因;其中胶质瘤是最常见的中枢神经系统恶性肿瘤(约占50%),胚胎性肿瘤约占所有中枢神经系统肿瘤的12.2%。排除相对高发的髓母细胞瘤和不典型畸胎瘤/横纹肌样瘤(ATRT)后,其他类型的胚胎性肿瘤较为罕见,在0-14岁儿童所有中枢神经系统肿瘤中占比约1.8%。
前文提及的ET, PLAGL由本研究团队首次报道,是一种罕见的原始胚胎样肿瘤,其特征为缺乏典型分化标志物的表达,但同时表达早期神经谱系基因。此外,该类肿瘤还存在印记基因失调,以及候选药物靶点RET和CYP2W1的过表达。根据表观遗传学特征,ET, PLAGL可进一步分为两个亚型:分别以PLAGL1(6q24.2)或PLAGL2(20q11.21)基因的扩增及后续过表达为标志,且两个亚型在典型发病年龄和临床行为上存在差异。近期有1例病例报告提及中枢神经系统肿瘤中另一种PLAG家族基因变异,即1例儿童和1例成人患者的中枢神经系统肿瘤携带PLAG1融合基因。然而,目前尚不清楚这些携带PLAG1融合基因的肿瘤是否属于一种新的独立肿瘤类型(如PLAGL1融合型室管膜瘤样肿瘤(NET_PLAGL1)),或是与ET, PLAGL已知的两个亚型存在关联。
本研究通过全基因组DNA甲基化分析、拷贝数分析、靶向二代DNA测序及RNA测序,进一步明确携带PLAG1融合基因的中枢神经系统肿瘤的生物学特征,并验证其是否为与既往报道的ET, PLAGL相关的第三种亚型。研究发现,多种融合伴侣基因通过“启动子劫持”机制,导致位于8号染色体q12.1区的野生型PLAG1基因表达上调。与PLAGL1/2扩增型肿瘤相比,PLAG1融合型肿瘤在基因表达上具有高度相似性,包括印记基因、RET及CYP2W1的表达上调。其临床表现与PLAGL2扩增型肿瘤最为接近,但要得出关于最佳治疗方案的可靠结论,仍需更多研究数据支持。
为准确反映各亚型的分子特征与临床差异,并将三种亚型纳入最适用的分类体系,研究者建议将原“PLAGL扩增型中枢神经系统胚胎性肿瘤(ET, PLAGL)”更名为“PLAG家族基因变异的中枢神经系统胚胎性肿瘤(ET, PLAG)”,同时在命名中明确标注相应亚型——即PLAG1融合型、PLAGL1扩增型或PLAGL2扩增型。
研究结果
PLAG1被鉴定为儿童CNS肿瘤中反复出现的3'端融合伴侣基因:
对儿童CNS肿瘤样本开展分子诊断(包括DNA甲基化谱分析、基于甲基化数据的拷贝数分析及RNA测序),发现部分肿瘤存在以PLAG家族基因PLAG1为3'端融合伴侣基因的基因融合事件。对这些肿瘤的甲基化分析表明,它们要么被海德堡脑肿瘤分类器(v12.8 版)归类为ET,PLAGL,要么通过对超过 14 万个儿童及成人肿瘤样本进行全基因组 DNA 甲基化数据的无监督可视化(t-SNE)而紧密聚集在这一最近描述的肿瘤类型附近(图1a)。因此,本研究旨在对这一尚未明确且可能为新型罕见肿瘤(亚)型开展更详细研究,并在143,827个样本中进一步筛选存在PLAG1变异的肿瘤。
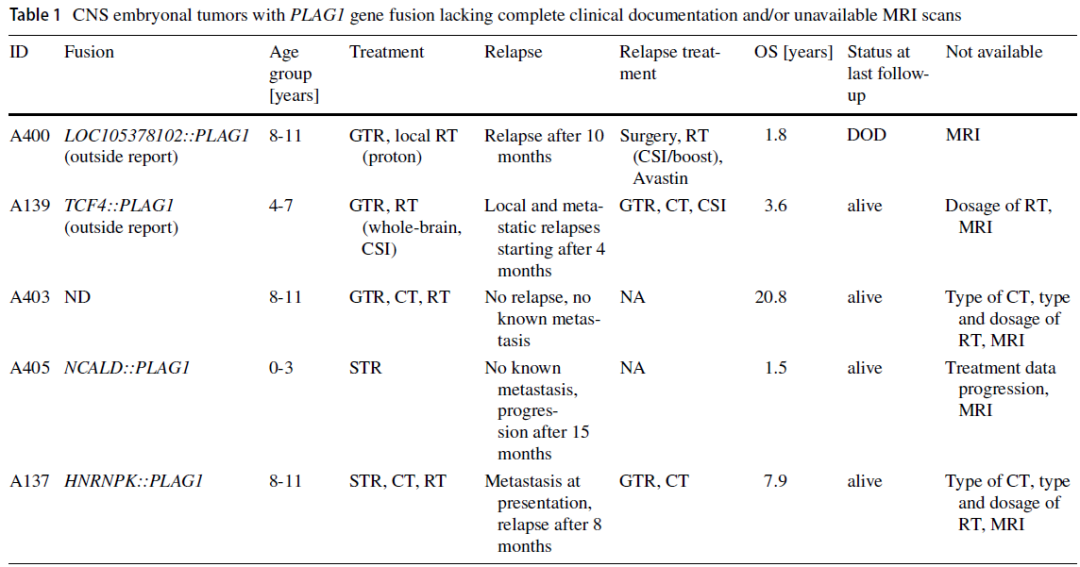
表1
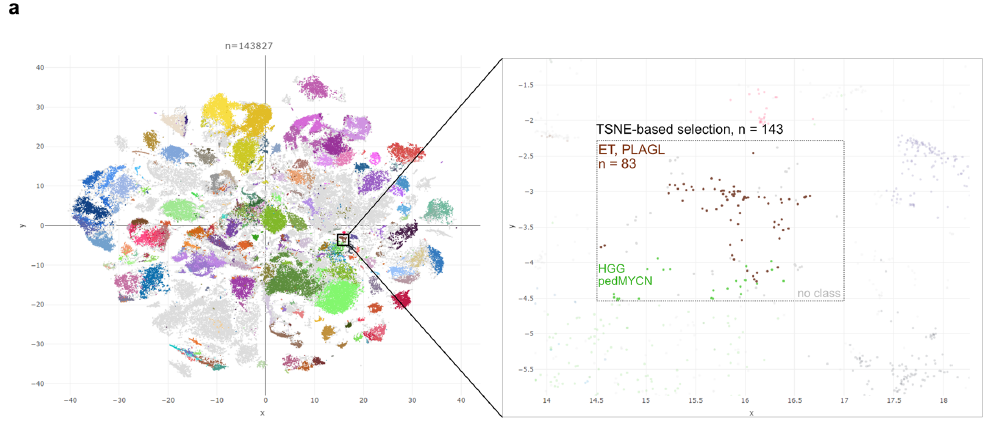
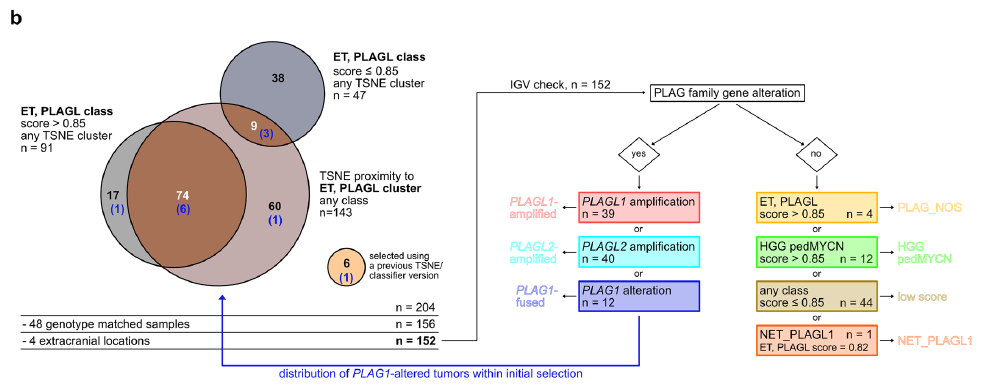
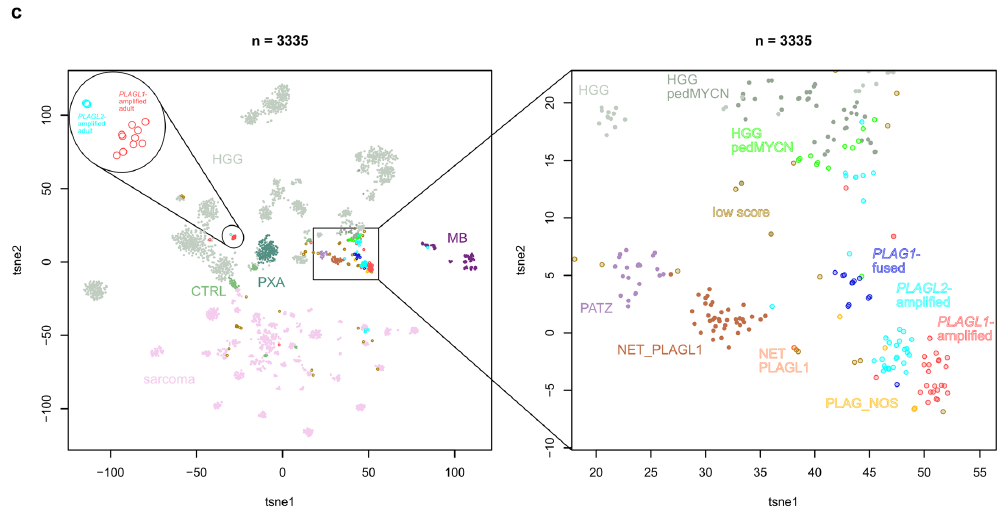

图1
全面筛选发现更多存在PLAG1变异的肿瘤:
研究首先通过t-SNE分析选取所有与ET, PLAGL聚类接近的样本(无论其分类结果,n=143),同时选取所有ET, PLAGL分类器评分最高的样本(无论其在t-SNE图中的位置,n=138),两类样本存在83个重叠样本(图1a、b)。此外,筛选中还纳入了6个通过早期版本t-SNE分析及分类器筛选出的样本。排除48个重复样本及4个已知位于颅外的样本后,对剩余152个样本采用整合基因组浏览器(IGV)可视化基于甲基化数据的拷贝数信息,分析其PLAG家族基因变异情况。结果显示,共鉴定出39个PLAGL1扩增样本和40个PLAGL2扩增样本,同时鉴定出12个样本存在拷贝数变异断点,且断点集中于8号染色体q12.1区的PLAG1基因座(图1b、2a)。在这12个样本中,7个被归类为ET, PLAGL(评分>0.9),3个样本的ET, PLAGL评分低于0.8(0.26-0.792),2个样本被归类为其他肿瘤类型(评分分别为0.315——脊髓MYCN型室管膜瘤、0.506——儿童MYCN型高级别胶质瘤)。所有12个存在PLAG1拷贝数断点的原发性颅内肿瘤样本均用于后续分析。剩余61个样本中,1个被证实存在EWSR1::PLAGL1融合基因,该样本此前已被报道为PLAGL1融合型幕上神经上皮肿瘤(NET_PLAGL1)(图1b);4个样本的ET, PLAGL评分>0.85,但未检测到任何PLAG家族基因变异,因此被命名为PLAG家族基因变异未明确型(PLAG_NOS)(图1b)。
精细化t-SNE分析显示PLAG1变异型肿瘤与PLAGL1/2扩增型肿瘤聚类接近:
将上述IGV筛选获得的PLAG家族基因变异状态信息纳入后续t-SNE分析,共可视化91个PLAG(L)变异型肿瘤、61个剩余肿瘤(PLAG_NOS、儿童MYCN型高级别胶质瘤、低评分肿瘤、NET_PLAGL1),并纳入3183个参考肿瘤样本(总计3335个样本)——参考队列包含多种不同类型肿瘤,包括各类高级别胶质瘤(成人及儿童型,n=1669)、肉瘤(n=1096)、胚胎性肿瘤(n=130),以及PLAGL1融合型幕上神经上皮肿瘤(NET_PLAGL1,n=39)和PATZ1融合型神经上皮肿瘤(HGNET_PATZ,n=23)(图1c)。如既往研究所述,PLAGL1扩增型和PLAGL2扩增型肿瘤在同一大类肿瘤(ET, PLAGL)中形成独立的亚聚类;此外,PLAG1融合型肿瘤形成了第三个独立亚聚类,与PLAGL1/2扩增型肿瘤的两个亚聚类相邻,且重叠程度极低。部分PLAGL1/2扩增型肿瘤形成了一个独立聚类,该聚类仅包含成人患者,且与儿童ET, PLAGL肿瘤的聚类位置不相邻。进一步的层次聚类分析也得出了类似的分组结果。
转录组分析鉴定出多种5'端融合伴侣基因,且显示PLAG1融合型肿瘤与PLAGL1/2扩增型肿瘤的基因表达存在相似性:
在12个PLAG1变异型样本中,有9个样本通过以下方式证实存在基因融合:6个样本获取FFPE肿瘤组织进行RNA测序,从合作机构获取2个样本的分子数据,从文献中获取1个样本的分子数据。结果显示,这些融合事件均以PLAG1的第4或第5外显子作为3'端伴侣,以其他多种基因(ASAP1、ADGRG1、TMEM68、NCALD、HNRNPK、CHD7、TCF4、LOC105378102)的5'端非翻译区(5' UTR)或起始5'端外显子作为5'端融合伴侣(图2a、b)。本研究内部分析检测到的融合断点如图2b所示,合作机构报告的断点(基于GRCh37/hg19基因组版本)如下:chr8:61,591,641(CHD7)::chr8:57,083,748(PLAG1)、chr6:164,340,946(LOC105378102)::chr8:57,080,945(PLAG1)、chr18:52,899,739(TCF4)::chr8:57,080,061(PLAG1)。除转录组分析检测到的融合事件外,基于靶向DNA测序(n=5)未发现其他反复出现的致癌性变异——例如,所有肿瘤均无不典型畸胎瘤/横纹肌样瘤(ATRT)特征性的SMARCB1或SMARCA4基因变异,无儿童弥漫性中线胶质瘤或半球胶质瘤特征性的组蛋白H3基因突变,也无多层菊形团胚胎性肿瘤(ETMR)特征性的C19MC扩增或DICER1基因突变。
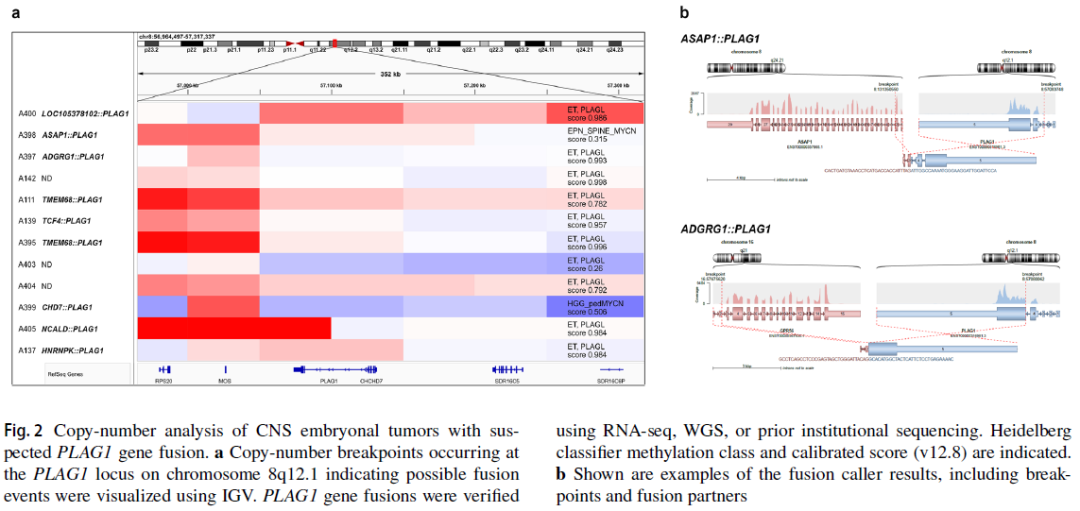
图2
此外,对6个样本中3个样本的冷冻组织进行RNA测序,并在R2基因组学分析与可视化平台上分析PLAG1融合型肿瘤的基因表达模式。结果显示,PLAG1融合型肿瘤中PLAG1表达上调(图3),而PLAG1在出生后正常脑及小脑组织中表达下调;同时,在胎儿脑及小脑组织中,PLAG1的表达水平低于PLAGL1或PLAGL2。采用包含294个其他中枢神经系统肿瘤及正常组织的参考队列[含H3 G34R/V或K27M突变型高级别胶质瘤、儿童RTK1/2型胶质母细胞瘤(n=92)、BRAF融合型毛细胞星形细胞瘤(n=25)、多形性黄色星形细胞瘤(n=25)、正常脑组织(n=36)、胚胎性肿瘤(如ATRT、ETMR、髓母细胞瘤,n=116)]进行比较基因表达分析,发现PLAG1融合型肿瘤中ET, PLAGL相关基因(如CYP2W1、RET、IGF2、DLK1、结蛋白)表达上调;其中,结蛋白在PLAG1融合型肿瘤中的表达水平高于PLAGL1扩增型肿瘤,与PLAGL2扩增型肿瘤相近。
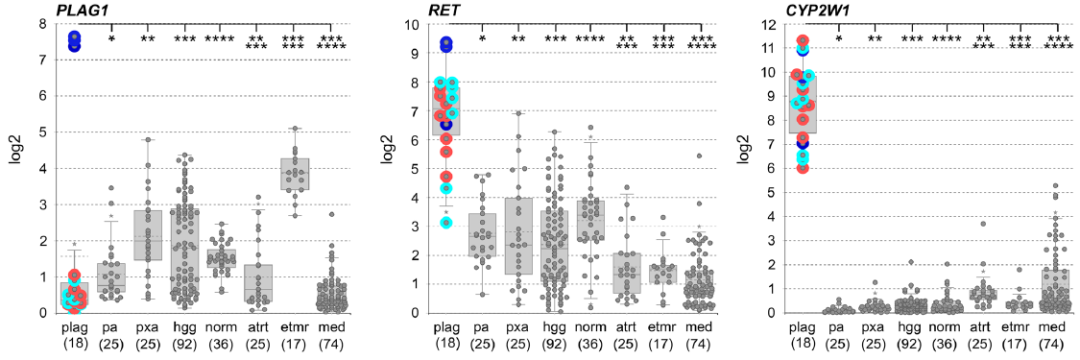
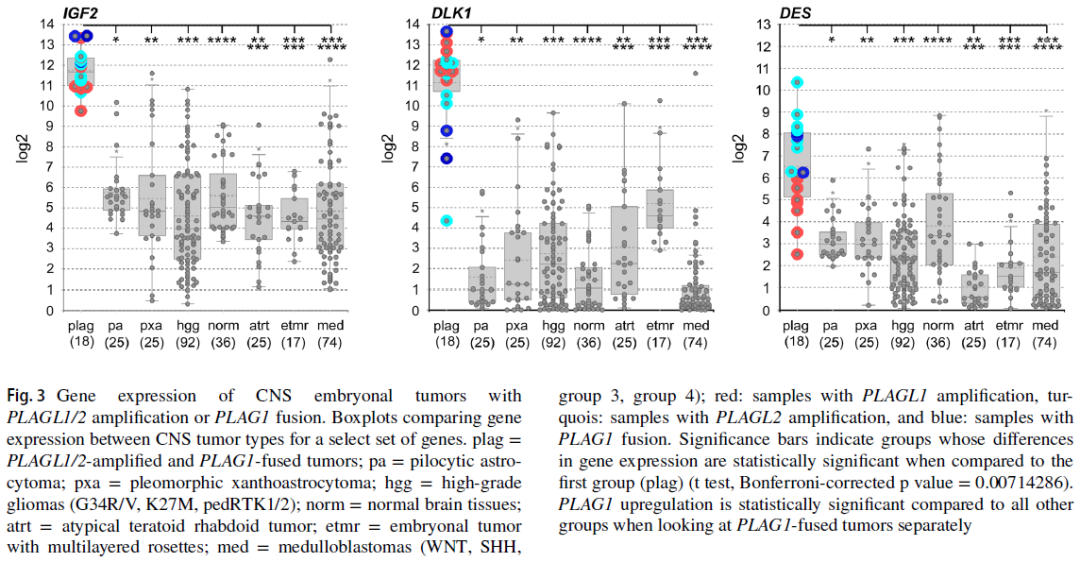
图3
为更好地理解PLAG家族三个成员的异同(尤其是本研究描述的融合事件相关特征及临床行为差异),汇总了文献中报道的部分结构异同,重点标注了已检测到的PLAG1融合事件中保留的结构域。融合断点导致PLAG1的完整编码区(第4、5外显子)或大部分编码区(仅第5外显子)得以保留,进而导致野生型PLAG1全长或部分截短形式过表达——两种情况分别保留了DNA结合结构域的全部锌指结构或第3-7号锌指结构。
PLAG1变异型CNS肿瘤的组织病理学特征:
对部分PLAG1融合型肿瘤(n=4)进行回顾性组织病理学分析,发现其具有显著的形态学异质性。所有肿瘤均以密集细胞区为主,部分区域由原始小圆形蓝细胞构成(图4a、b),但整体形态差异显著:3个肿瘤呈现室管膜瘤样结构,伴有血管周围假菊形团(图4a);2个肿瘤可见滤泡样结构,内含均质嗜酸性分泌物(图4b);2个病例中观察到透明细胞分化及微囊样改变(图4c、d);局部区域可见明显的核多形性,表现为核大小、形态及染色质分布不均(图4e);此外,1个肿瘤存在钙化,1个肿瘤存在坏死。肿瘤血管为薄壁血管或玻璃样变血管,无肾小球样微血管增生迹象。免疫组织化学分析结果显示:所有肿瘤均弥漫性表达胶质纤维酸性蛋白(GFAP)(图4f);2个病例表达S100蛋白;所有肿瘤均不表达少突胶质细胞谱系转录因子2(OLIG2)、上皮膜抗原(EMA)(图4g)及突触素(图4h);1个肿瘤表达CD99;所有肿瘤均不表达LIN28A;结蛋白仅在局部区域表达;Ki-67标记指数介于10%-20%之间。
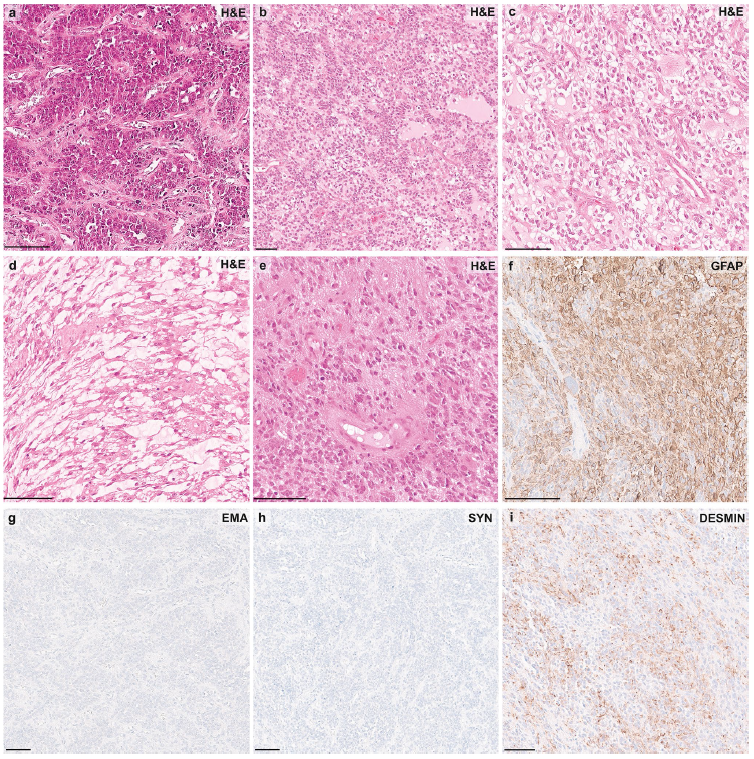

图4
患者特征和生存情况与PLAGL1/2扩增型肿瘤相似:
患者的可用临床特征如图5所示。在12例PLAG1融合型肿瘤患者中,7例为男性,5例为女性;5个肿瘤位于幕上区域(额叶、颞叶、顶叶、枕叶),4个肿瘤位于幕下区域(小脑、第四脑室)。初始组织病理学诊断包括低级别胶质瘤(LGG,n=1)、未明确类型胚胎性肿瘤(NOS,n=2)、PLAG1融合型高级别神经上皮肿瘤(HGNET,n=1)、原始神经外胚层肿瘤(PNET,n=1)、幕上室管膜瘤(n=4)、少突胶质细胞瘤(n=1)。11例患者有明确的初始确诊年龄,范围为1-11岁,中位年龄为5岁(图5a)。Dunn事后检验显示,PLAG1融合型肿瘤患者与PLAGL1扩增型、PLAGL2扩增型肿瘤患者的确诊年龄无显著差异(p值分别为0.7906、0.1198)。如既往研究报道,PLAGL1扩增型与PLAGL2扩增型肿瘤患者的确诊年龄存在显著差异,本研究纳入所有可用PLAGL1/2病例(PLAGL1扩增型患者n=10,PLAGL2扩增型患者n=15,均有确诊年龄数据)后,通过Kruskal–Wallis检验(p=0.0044)及Dunn事后检验(p=0.0042)再次证实了这一差异。10例PLAG1融合型肿瘤患者及既往发表队列中11/13例PLAGL1/2扩增型肿瘤患者有可用的临床预后数据。PLAG1融合型肿瘤患者的5年无进展生存期(PFS)和总生存期(OS)分别为30.0%和75.0%(图5b);PLAGL1扩增型肿瘤患者的5年PFS/OS分别为90.0%/75.8%;PLAGL2扩增型肿瘤患者的5年PFS/OS分别为34.6%/32.0%。
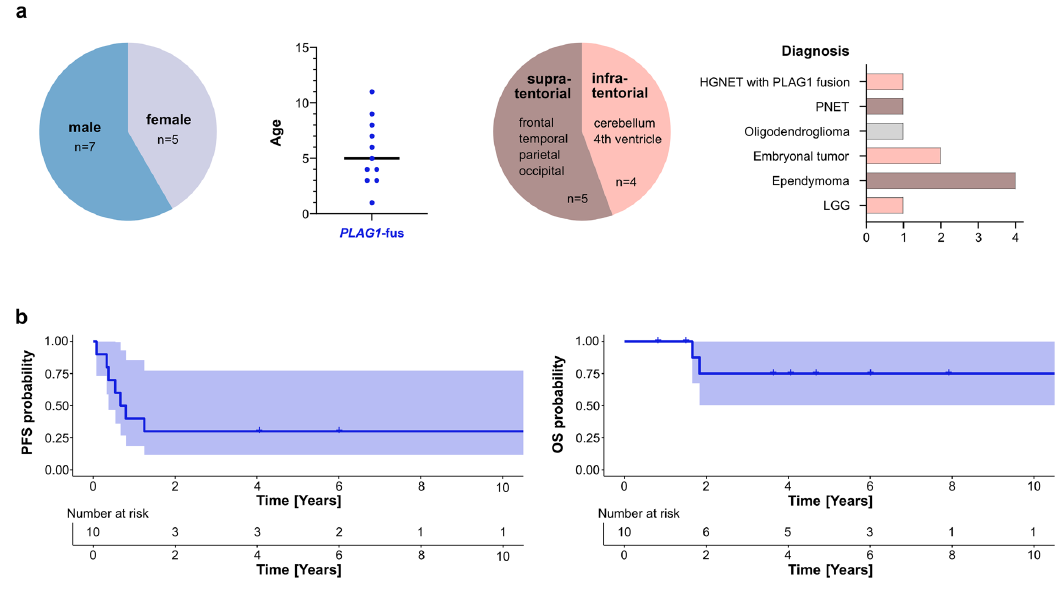
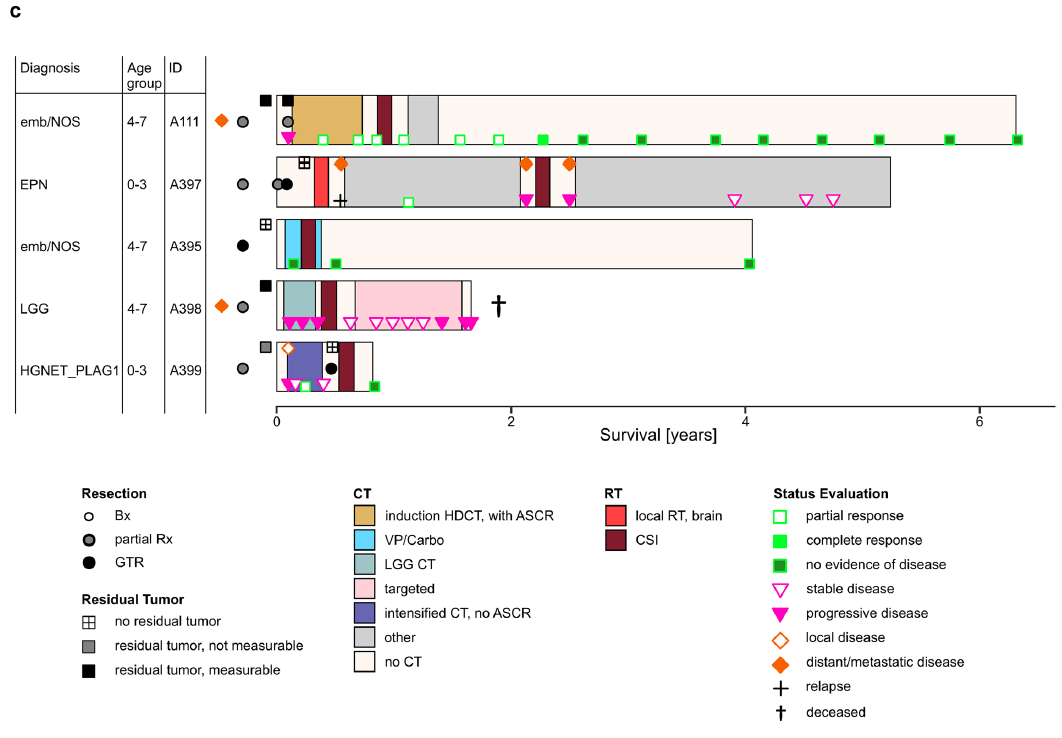

图5
磁共振成像特征:
5例患者有可用的磁共振成像(MRI)数据:4例患者的肿瘤位于后颅窝,1例位于左顶叶;2例后颅窝肿瘤在确诊时已发生播散,其中1例还侵犯至椎管;顶叶肿瘤在确诊后6个月出现幕上软脑膜转移,后续随访中进一步出现脊髓转移;其余2例后颅窝肿瘤在整个研究期间未发生播散。
这些肿瘤的MRI特征具有异质性,未观察到一致模式:肿瘤表现为实性或实性-囊性混合肿块,强化程度不等(从无强化到明显强化);T2加权成像上多呈高信号和/或等信号;4例患者有弥散加权成像数据,其中2例显示弥散受限;确诊时肿瘤体积为15-183 mL;3例患者的肿瘤存在出血和/或钙化。
治疗方案具有异质性,部分患者对化疗和放疗应答良好:
治疗方案因初始诊断及患者年龄存在显著差异(图5c)。除1例患者外,其余所有患者均接受化疗作为初始辅助治疗的一部分,具体方案包括:大剂量化疗联合自体干细胞移植(HDCT/ASCR,n=1)、强化诱导化疗(n=1)、卡铂/依托泊苷联合化疗(n=1)、低级别胶质瘤(LGG)个体化化疗(n=1)。2例患者在初始治疗阶段分别通过HDCT/ASCR和强化诱导化疗实现了单纯化疗的良好应答,1例患者在复发阶段通过替莫唑胺(TMZ)治疗实现良好应答;1例患者接受LGG个体化化疗期间出现肿瘤进展;1例初始诊断为室管膜瘤的患者在术后辅助治疗阶段未接受化疗。4例有详细治疗信息的患者在初始切除术后接受了辅助放疗(RT):3例接受颅脊髓照射联合局部加量(CSI/boost),1例接受肿瘤床局部放疗。2例患者初始表现为远处播散性疾病:1例在部分切除术后、辅助治疗开始前出现肿瘤进展,1例在接受LGG个体化化疗期间出现进展;另有1例局部病变患者在部分切除术后、辅助治疗开始前出现疾病进展。在5例有完整随访数据的患者中,3例在接受CSI/boost与化疗联合治疗后处于缓解状态(初始确诊后分别随访72、49、10个月);1例患者在接受多线治疗后仍存活且病情稳定(初始确诊后随访56个月);1例患者因疾病死亡(初始确诊后随访20个月)。
讨 论
本研究描述了一种罕见的新型儿童中枢神经系统胚胎性肿瘤亚型,其特征为特定的DNA甲基化特征,以及以PLAG1为3'端伴侣基因、多种其他基因为5'端伴侣基因的基因融合事件——该融合事件可导致PLAG1表达上调。融合事件涉及5'端伴侣基因的调控区域,且断裂位点位于PLAG1第4外显子前方的非翻译区(UTR),这提示“启动子劫持”是该类肿瘤中PLAG1表达上调的机制,与唾液腺多形性腺瘤中报道的机制相似。在这两种疾病场景中,PLAG1的全长或截短形式均会出现表达上调,且其特定的DNA结合结构域(即与G簇结合的第3号锌指,以及与核心基序结合的第6、7号锌指)均得以保留,这意味着PLAG1的功能可能也得到了保留。PLAG1融合型肿瘤中已知PLAG1靶基因(如IGF2)的转录水平上调,进一步支持了这一假设。
本研究对4个样本进行了组织学复查,发现其形态学具有异质性。尽管进行IHC分析的样本数量较少,无法得出普适性结论,但现有结果显示,与PLAGL1/2扩增型样本相比,该亚型的形态学特征存在细微差异:二者虽共享部分胚胎性特征(如原始小圆形蓝细胞),但在4个PLAG1融合型样本中,有3个呈现室管膜瘤样形态(伴有血管周围假菊形团),且所有4个样本均表达胶质纤维酸性蛋白(GFAP)——这两个特征在PLAGL1/2扩增型肿瘤中从未出现或极少出现。尽管存在这种形态学差异,但综合以下三方面特征,研究者仍认为将其归类为胚胎性肿瘤是最恰当的:组织学特征(小圆形蓝细胞)、甲基化分析结果(与PLAGL1/2扩增型肿瘤聚类接近),以及预后特征(5例具有完整临床和影像学数据的患者中,有4例出现早期进展或复发)。
研究者通过RNA测序进一步比较了PLAG1融合型肿瘤与PLAGL1/2扩增型肿瘤的基因表达模式。与PLAGL1/2扩增型肿瘤类似,PLAG1融合型肿瘤中不仅发生变异的PLAG家族基因表达上调,经证实的PLAGL1/2下游靶基因(如上述IGF2,以及DLK1、RET、CYP2W1、结蛋白)也均出现表达上调。这一特定基因集的过表达似乎是PLAGL1/2扩增型肿瘤独有的特征——在其他已研究的脑肿瘤类型中,均未观察到该基因组合的协同上调(尤其是CYP2W1的表达)。而PLAG1融合型肿瘤中该基因集同样呈高表达,这为将这三种亚型归为同一大类肿瘤提供了支持。PLAG1融合型与PLAGL2扩增型肿瘤中结蛋白表达水平相近,提示这两种亚型可能存在更深层次的生物学相似性,这也与文献中对PLAG家族基因的普遍描述一致:PLAG家族的三个成员(PLAG1、PLAGL1、PLAGL2)均为转录因子,其功能既有差异也有重叠。其中,PLAG1和PLAGL2已被证实为原癌基因;而PLAGL1的作用具有上下文依赖性——既可能作为抑癌基因,也可能如本研究团队及其他研究者近期报道的那样,在脑肿瘤背景下发挥原癌基因的作用。
对人类发育过程中脑及小脑组织内三种PLAG家族基因表达模式的分析显示:这些基因在胚胎期表达上调,出生后表达下调。尽管PLAGL1和PLAGL2的表达模式相似,但PLAG1的调控似乎更为严格——仅在妊娠前三个月表达。这一结果不仅凸显了三种PLAG家族基因在发育过程中的整体差异,也提示在肿瘤中,原本受抑制或低表达的PLAG家族基因出现上调,及其靶基因的表达失调,可能会产生功能性影响。此外,三种PLAG家族基因的转录激活结构域在一级序列上存在差异,但PLAG1与PLAGL2在基因转录激活能力上的相似性,高于二者与PLAGL1的相似性。已有研究报道三者在DNA结合能力上也存在差异:尽管它们的DNA结合结构域具有序列同源性,但结合DNA序列的方式各不相同——例如,PLAGL1无法像PLAG1和PLAGL2那样结合G簇。
通过对DNA甲基化谱进行t-SNE降维分析发现,PLAG1融合型肿瘤的甲基化模式与PLAGL1/2扩增型肿瘤的特征性甲基化模式密切相关,但在表观遗传学上与所有其他已报道的中枢神经系统肿瘤类型均存在显著差异。t-SNE分析中二者聚类位置接近,且在表观遗传和转录水平上具有整体相似性,这些证据支持将PLAG1变异型肿瘤归为ET, PLAG(L)的第三种亚型。在12个PLAG1融合型样本中,有7个经海德堡分类器(v12.8)判定,其“伴有PLAGL扩增的中枢神经系统胚胎性肿瘤(ET, PLAGL)”校准评分高于0.9,表明它们属于该肿瘤类型。12个样本中有3个的评分介于0.26-0.792之间,另有2个样本被归类为其他肿瘤类型(评分分别为0.506——儿童MYCN型高级别胶质瘤、0.315——脊髓MYCN型室管膜瘤),尽管在t-SNE分析中这2个样本与ET, PLAGL组聚类接近。通过RNA测序,研究者证实这2个样本存在PLAG1融合基因,且基于甲基化数据的拷贝数分析显示其无MYCN扩增(数据未展示)。PLAG1融合型肿瘤的分类器评分存在差异的原因尚待研究,但将该肿瘤组纳入未来版本的参考数据库,有望助力其前瞻性精准识别。需重点注意的是,目前使用海德堡分类器的当前版本时,即使甲基化分类器输出的ET, PLAGL评分较低或归为其他类别,只要t-SNE分析显示样本与ET, PLAGL聚类接近,就应考虑PLAG1融合型肿瘤的诊断可能性。若诊断存疑,可通过RNA测序证实PLAG1融合事件,或检测PLAG1的过表达及PLAG1靶点,以确保此类病例诊断的准确性。
与研究者此前报道的PLAGL1/2扩增型肿瘤类似,PLAG1融合型肿瘤患者的初始诊断结果和肿瘤位置具有多样性——既包括不同级别的高/低级别肿瘤,也涉及幕上、幕下不同部位,这导致治疗方案存在差异。PLAG1融合型肿瘤患者的确诊中位年龄为5.0岁,与PLAGL1扩增型(中位年龄10.5岁)和PLAGL2扩增型(中位年龄2.0岁)肿瘤患者的确诊年龄无显著差异。PLAG1融合型与PLAGL2扩增型病例的无进展生存期均较低,且观察到的临床行为相当。在5例具有完整临床数据的患者中,3例在确诊时(n=2)或复发时(n=1)出现转移;早期复发或进展发生在以下场景:辅助治疗开始前(n=2)、低级别胶质瘤个体化化疗期间(n=1),以及肿瘤全切联合局部放疗后(n=1)。相比之下,3例接受颅脊髓照射联合局部加量(CSI/boost)与化疗联合治疗的患者,在观察期内均未出现进展。需特别指出的是,本研究样本量极小,过度解读结果的风险较高。目前已报道的其他2例PLAG1融合型肿瘤病例(其中1例与本研究的A139病例重合),也均接受了CSI/boost治疗。鉴于该肿瘤具有胚胎样病理表现、特定基因表达谱及转移特征,这种治疗方案可能具有合理性,但仅凭本研究的数据无法得出确切结论。正如对PLAGL1/2扩增型肿瘤的讨论所述,将PLAG1融合型肿瘤归类为胚胎性肿瘤,不应自动等同于采用特定治疗方案。对于PLAG1融合型肿瘤,是否应采用针对其他胚胎性肿瘤的治疗方案(如强化化疗或CSI),仍是需进一步明确的问题;同样,本研究也无法回答“不适宜接受CSI治疗的低龄儿童,联合化疗与局部放疗是否能获益”这一问题。由于该疾病罕见且缺乏标准治疗方案,最理想的做法是收集所有患者的治疗及预后数据。只有通过广泛合作与数据整合,才能获得更可靠的证据,为未来的临床试验提供有意义的参考。
在既往关于ET, PLAGL的研究中,研究者曾报道3个无明显PLAG家族基因变异(尤其是无扩增)的样本,根据其在t-SNE图中的位置,将其命名为PLAGL1样(n=2)和PLAGL2样(n=1)。本研究重新分析了这3个样本基于甲基化数据的拷贝数信息,并对其中1个样本进行RNA测序后分析融合基因检测结果(数据未展示),仍未发现任何PLAG家族基因变异(包括PLAG1融合),这提示存在其他不同的分子事件,驱动这些肿瘤在表观遗传谱上呈现PLAG(L)样特征。
值得注意的是,需明确区分“PLAG家族基因变异的中枢神经系统胚胎性肿瘤”与“PLAGL1融合型幕上神经上皮肿瘤(NET_PLAGL1)”,后者在表观遗传学上可与ET, PLAGL区分并且更接近室管膜瘤,且其临床行为尚未见报道。
综上,这些数据支持将PLAG1融合型肿瘤归为ET, PLAGL的第三种独立亚型,与此前已明确的PLAGL1扩增型和PLAGL2扩增型亚型并列。为在命名中涵盖这三种亚型,研究者建议将“ET, PLAGL”更名为“ET, PLAG(伴有PLAG家族基因变异的中枢神经系统胚胎性肿瘤)”;尤其考虑到各亚型在生存期及推荐治疗方案上的差异,研究者主张在命名中进一步明确标注具体亚型,即如图6所示,分为PLAG1融合型、PLAGL1扩增型和PLAGL2扩增型。
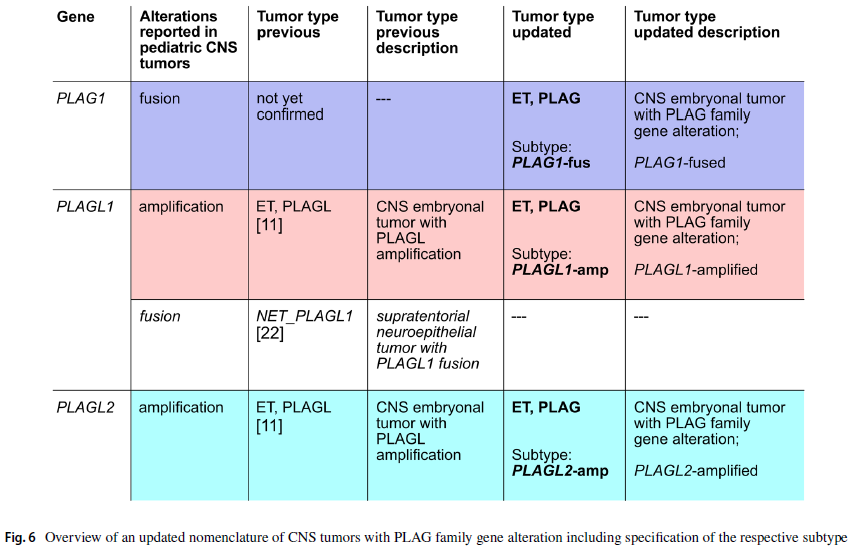
图6
本研究描述了一种以PLAG1基因融合为特征的新型中枢神经系统胚胎性肿瘤亚型:通过启动子劫持机制,野生型PLAG1表达上调并随后过表达,最终驱动肿瘤发生。该亚型在表观遗传学上与所有其他已知脑肿瘤亚型均存在差异,但在生物学上与此前报道的“PLAGL扩增型中枢神经系统胚胎性肿瘤”相关。与PLAGL1/2扩增型肿瘤类似,PLAG1融合型肿瘤也表现出典型PLAG家族下游基因高表达、印记基因失调,以及候选药物靶点RET和CYP2W1过表达的特征。因此,研究者建议将此前仅包含PLAGL1/2扩增型肿瘤的“PLAGL扩增型中枢神经系统胚胎性肿瘤(ET, PLAGL)”,更名为“伴有PLAG家族基因变异的中枢神经系统胚胎性肿瘤(ET, PLAG)”,并进一步明确其三个亚型:PLAGL1扩增型、PLAGL2扩增型和PLAG1融合型。对PLAG1融合型肿瘤临床行为的初步分析显示,其与PLAGL2扩增型肿瘤存在一定相似性,但由于当前样本量有限,无法得出可靠结论,这一关联仍需在更大规模队列中进一步验证。
“实体瘤1560基因融合RNA检测”项目,基于RNA-based NGS测序+杂交捕获建库技术,检测PLAG1融合在内超过1560种已知融合和数百个基因相关的未知融合;“脑肿瘤460基因检测”项目,面向胶质瘤、脑膜瘤、髓母细胞瘤、室管膜瘤等原发性中枢神经系统肿瘤患者,检测460个基因变异,包括PLAGL1和PLAGL2的CDS区,用于辅助分子分型,预后评估,预测可能获益的靶向、免疫(包括MSI和TMB)、化疗药物,提示肿瘤遗传风险。“中枢神经系统肿瘤全基因组甲基化检测”项目,覆盖了CpG岛、启动子、编码区及增强子区域共约100万个CpG位点,筛选样本中的DNA甲基化位点,并与数据库中已知样本信息进行比较聚类分析,辅助中枢神经系统肿瘤的精准诊断及分子分型,同时包括了染色体拷贝数变异分析。
参考文献:
Keck MK, Al-Hussaini M, Amayiri N, et al. PLAG1 fusions define a third subtype of CNS embryonal tumor with PLAG family gene alteration. Acta Neuropathol. 2025;150(1):12. Published 2025 Aug 2. doi:10.1007/s00401-025-02917-z


