哈尔滨工程大学杨飘萍教授团队《AM》:Fe3+掺杂枝状介孔有机硅纳米复合物作为新型铁死亡诱导剂用于肿瘤免疫治疗
时间:2025-08-31 12:13:31 热度:37.1℃ 作者:网络
铁死亡是一种新型的非凋亡性程序性细胞死亡途径,与细胞坏死和自噬不同。它不受常见的肿瘤相关突变因素(如抗凋亡蛋白上调或促凋亡蛋白下调)的影响。此外,铁死亡可诱导肿瘤细胞发生免疫原性细胞死亡,从而激活抗肿瘤免疫反应。然而,目前包括氧化铁在内的大多数铁基纳米材料难以在肿瘤部位特异性聚集,生物相容性相对较差,且容易对正常组织造成“脱靶”毒性。因此,设计在肿瘤微环境(TME)中具有特异响应能力的铁基纳米制剂至关重要。
树枝状介孔有机硅(DMOS)纳米粒子具有较大的孔体积和孔径。更重要的是,它们具备显著的孔隙开口、出色的生物降解性和良好的生物相容性。这些特性使它们非常适合用于药物、蛋白质或小纳米粒子的负载和递送。此外,在合成过程中可以直接引入功能基团,如二硒键、二硫键和四硫键,赋予它们在谷胱甘肽(GSH)作用下迅速降解的能力,并能有效消耗肿瘤细胞中过量表达的GSH。然而,目前DMOS纳米粒子在肿瘤治疗中的应用仅限于用途相对单一的纳米载体,而关于将DMOS纳米粒子本身用作治疗试剂的研究则较少。
近期,哈尔滨工程大学杨飘萍教授团队在《Advanced Materials》杂志在线发表了题为“Tumor Microenvironment-Activated Fe3+-Doped Dendritic Mesoporous Organosilica Nanocomposites as Ferroptosis Inducers for Enhanced Immunotherapy”的工作。该研究合成了Fe3+掺杂枝状介孔有机硅(Fe-DMOS)纳米粒子作为新型铁死亡诱导剂,阐明了其在透明质酸修饰的小颗粒过氧化钙(CaO2-HA)纳米粒子及免疫检查点抑制剂的联合作用下诱导肿瘤细胞铁死亡,激活抗肿瘤免疫响应,以及抑制肿瘤生长、转移及复发的作用和机制。

文章要点
在这项研究中,作者利用Fe3+与模板剂十六烷基三甲基对甲苯磺酸铵(CTAT)中磺酸基的强配位作用合成了二硫键连接的具有明显枝状介孔形貌的Fe-DMOS纳米粒子,粒径约为120 nm,孔径约为15 nm。因此,合成的Fe-DMOS纳米粒子可以有效担载合成的小颗粒CaO2-HA纳米粒子形成均匀的Fe-DMOS@CaO2-HA纳米复合物(图1)。由于Fe3+与二硫键共存,Fe-DMOS纳米颗粒能够迅速响应酸及GSH而降解,释放大量Fe3+的同时明显降低GSH含量。在负载了CaO2-HA纳米颗粒后,Fe-DMOS@CaO2-HA复合纳米颗粒在酸响应作用下释放出大量的Ca2+和过氧化氢(H2O2)。随后,通过邻苯二胺(OPD)、四甲基联苯胺(TMB)显色实验及电子自旋共振(ESR)谱图充分证明Fe3+可以通过芬顿反应催化H2O2生成大量的·OH(图2)。
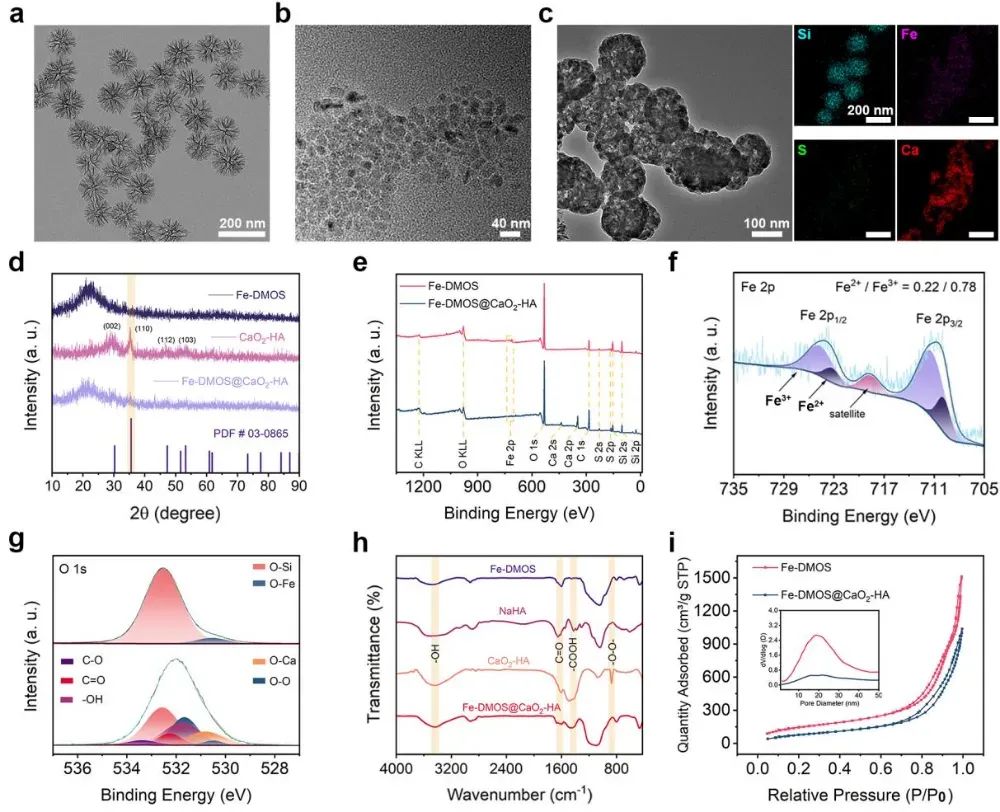
图1Fe-DMOS@CaO2-HA纳米复合物的合成与表征
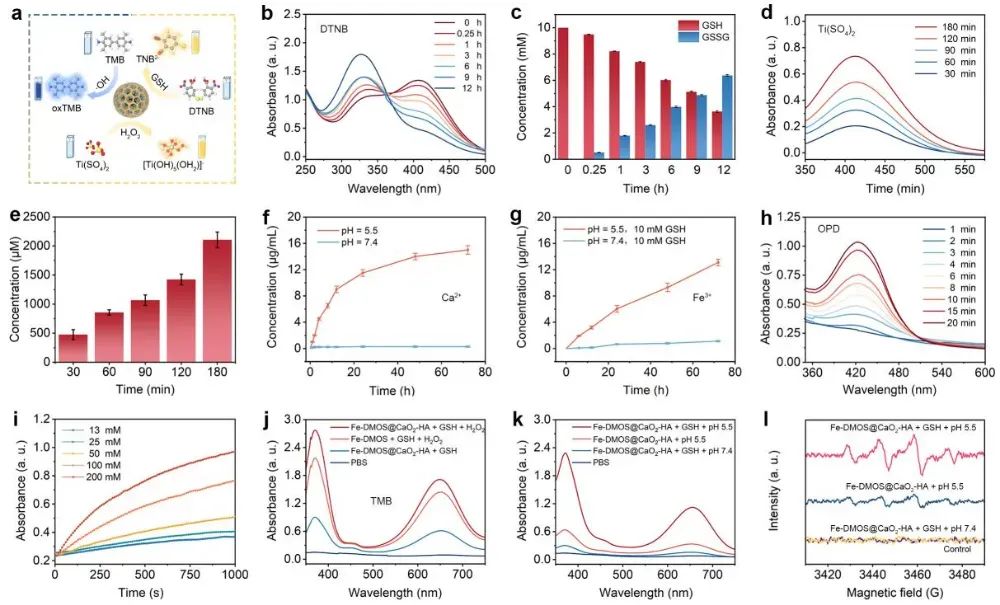
图2 Fe-DMOS@CaO2-HA纳米复合物酸及GSH双响应降解、GSH消耗、H2O2自补偿及·OH生成等性能测试
为了验证Fe-DMOS@CaO2-HA纳米复合物的治疗效果,作者进行了各种体外细胞实验。首先,作者发现由于透明质酸的修饰,Fe-DMOS@CaO2-HA纳米复合物可以有效靶向肿瘤细胞并被其吞噬。通过MTT实验初步证明该纳米复合物可以引起肿瘤细胞死亡,但对正常组织细胞杀伤能力并不明显。为了探索该纳米复合物引起肿瘤细胞死亡的具体机制,作者通过多种荧光染色数据发现Fe-DMOS@CaO2-HA纳米复合物在被肿瘤细胞吞噬后,会在肿瘤细胞内释放大量的Fe3+,Ca2+,并生成大量H2O2。同时,在Fe3+与H2O2之间的芬顿反应作用下,肿瘤细胞内会生成大量的·OH。在Ca2+过载及·OH的作用下,肿瘤细胞内线粒体发生明显损伤,继而严重影响三磷酸腺苷(ATP)的形成。通过活死细胞染色及流式细胞术进一步证明Fe-DMOS@CaO2-HA纳米复合物可以明显杀伤肿瘤细胞(图3)。此外,作者发现由于Fe-DMOS@CaO2-HA纳米复合物中Fe3+及二硫键的存在,有效降低了肿瘤细胞内高表达的GSH并明显下调了谷胱甘肽过氧化物酶4(GPX4)的表达。因此,在多重作用下,Fe-DMOS@CaO2-HA纳米复合物可以显著提高肿瘤细胞内脂质过氧化物的积累,最终造成肿瘤细胞铁死亡。重要的是,作者还发现Fe-DMOS介导的铁死亡并非传统“静默死亡”,而是会引发肿瘤细胞的免疫原性死亡(ICD)—随着肿瘤细胞死亡,其表面会暴露钙网蛋白(CRT),同时释放高迁移率族蛋白1(HMGB1)及胞内ATP(图4)。这些“危险信号分子”会被树突状细胞(DCs)识别,促使DCs成熟(成熟DC比例可达38.1 %)。伴随着DCs成熟,可分泌大量包括肿瘤坏死因子α(TNF-α)及白介素6(IL-6)在内的细胞因子(分泌量分别是空白对照组的12.8及68.4倍)。基于以上实验数据,说明Fe-DMOS@CaO2-HA纳米复合物不仅可以有效诱导肿瘤细胞铁死亡,还可以通过引发肿瘤细胞ICD激活抗肿瘤免疫响应。
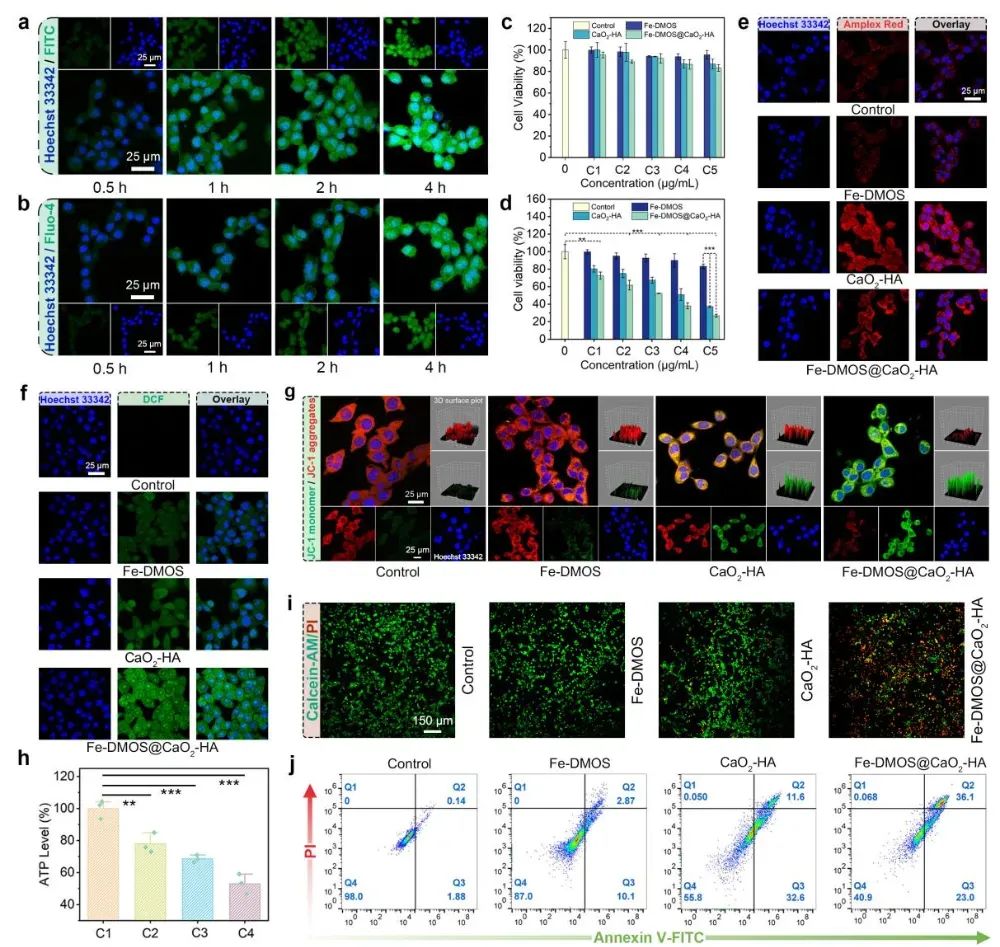
图3 Fe-DMOS@CaO2-HA纳米复合物可杀伤肿瘤细胞
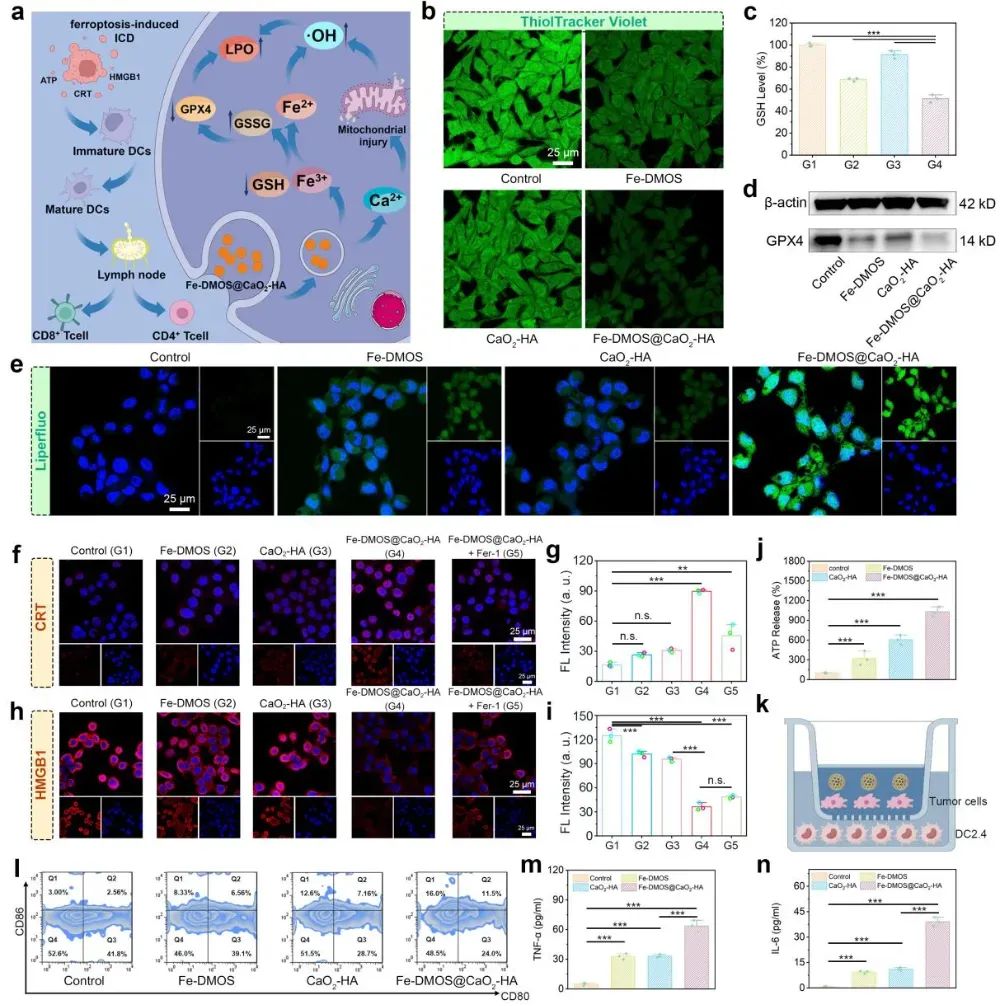
图4 Fe-DMOS@CaO2-HA纳米复合物诱导肿瘤细胞铁死亡并引发免疫原性死亡
此外,为了进一步验证Fe-DMOS@CaO2-HA纳米复合物诱导肿瘤细胞铁死亡并激活抗肿瘤免疫响应的效果,作者通过构建双侧小鼠荷瘤模型进行充分的体内实验。首先,发现Fe-DMOS@CaO2-HA纳米复合物静脉注射后可在肿瘤部位有效积累,同时具备良好的生物相容性。然后,通过对瘤径及瘤重的观察发现Fe-DMOS@CaO2-HA纳米复合物治疗后荷瘤小鼠的原发瘤及远端瘤的生长都受到了明显抑制,在进一步联合免疫检查点抑制剂(anti-PD-1)后,肿瘤抑制效果最为明显,最终有效延长了荷瘤小鼠的生存周期。此外,由于Ca2+的过载效应导致肿瘤细胞发生钙化,因此计算机断层扫描(CT)图像中肿瘤部位表现出明显的成像效果。肿瘤组织切片染色结果说明Fe-DMOS@CaO2-HA纳米复合物联合anti-PD-1后,可以有效诱导肿瘤细胞铁死亡,同时提高CD8+ T细胞在肿瘤部位的浸润(图5)。此外,作者通过流式细胞仪及酶联免疫吸附测定(ELISA)试剂盒分析测定Fe-DMOS@CaO2-HA纳米复合物联合anti-PD-1治疗后,脾脏及淋巴结中DCs成熟度明显提高(分别达到38.1 %和31.3 %)。成熟的DCs会将肿瘤抗原呈递给CD8+ T细胞和CD4+ T细胞,激活特异性抗肿瘤免疫响应。而联合免疫检查点抑制剂(anti-PD-1)能打破肿瘤细胞的免疫逃逸—肿瘤细胞常通过表达PD-L1与T细胞的PD-1结合,抑制T细胞活性,anti-PD-1可阻断这一结合,让激活的T细胞持续攻击肿瘤细胞。实验显示,联合治疗后,肿瘤部位CD8+ T细胞和CD4+ T细胞积累量分别达24.1%和40.2%,同时记忆T细胞比例达43.6%,有效防止肿瘤转移与复发,肺转移模型中未观察到明显转移灶(图6)。
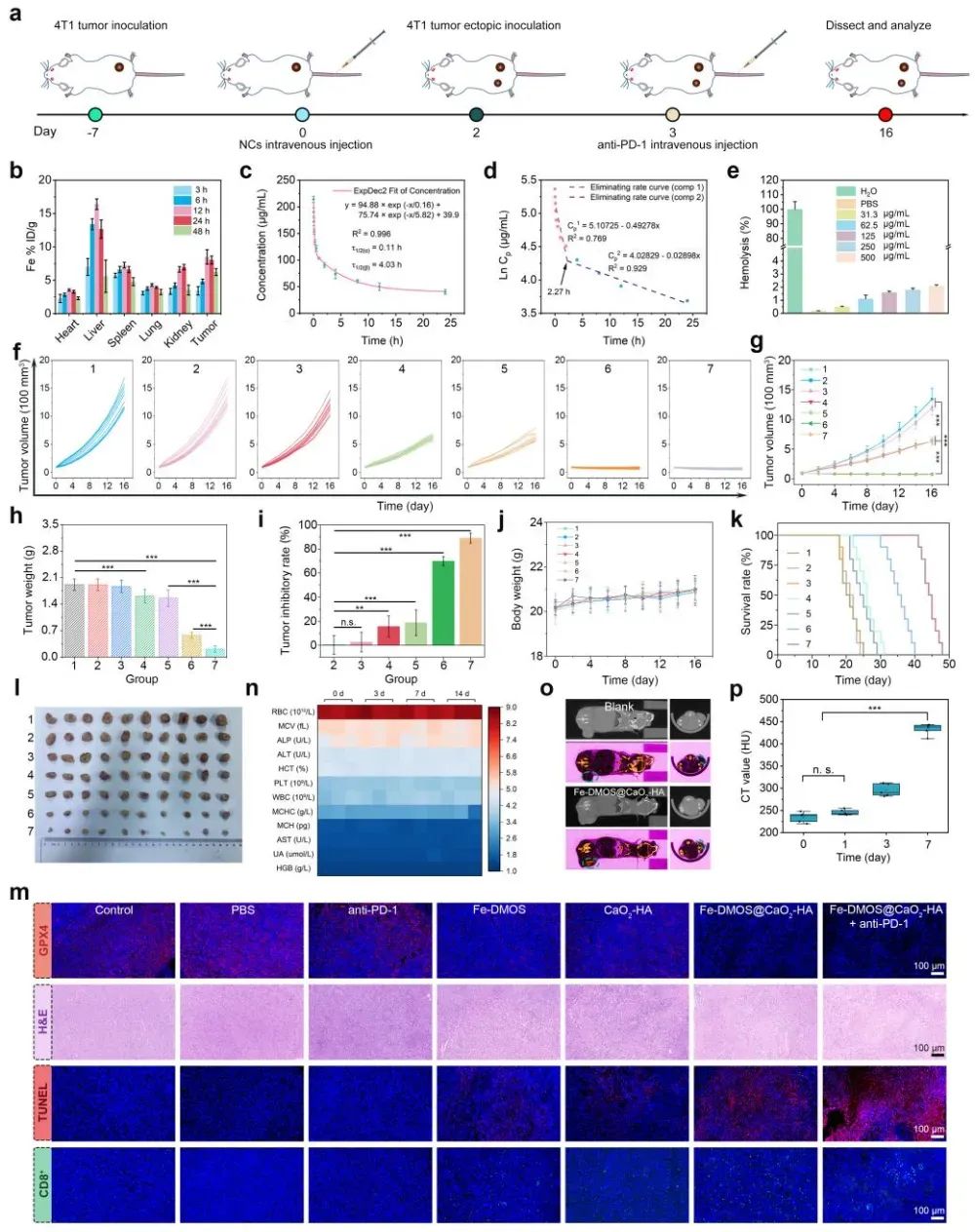
图5 Fe-DMOS@CaO2-HA纳米复合物联合anti-PD-1抑制肿瘤生长

图6 Fe-DMOS@CaO2-HA纳米复合物联合anti-PD-1抑制肿瘤转移
结论与展望
综上所述,作者合成了一种新型Fe-DMOS纳米铁死亡诱导剂并运载小颗粒CaO2-HA纳米粒子,形成的均匀的纳米复合物。研究表明,这种纳米复合物可有效诱导肿瘤细胞铁死亡,进而引发肿瘤细胞ICD。在anti-PD-1的联合作用下,明显能够抑制肿瘤的生长、转移及复发,这不仅突破了硅基纳米材料仅作为载体的局限,同时为纳米材料在肿瘤长期免疫治疗领域的应用提供了参考。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202510010


