【Blood】当代治疗背景下多发性骨髓瘤的新预后系统
时间:2025-09-29 12:11:17 热度:37.1℃ 作者:网络
澳大利亚Alfred Health-Monash 大学Andrew Spencer 教授近日发表文章,探讨了在当代治疗背景下多发性骨髓瘤(MM)的新预后系统。文章指出,尽管近期临床试验显示三联和四联药物组合在新诊断的 MM 患者中取得了前所未有的疗效,但两项新研究重新定义了高危(HR)患者,发现相当一部分患者可能从这些新疗法中获益甚微。这些新预后系统为开发急需的风险分层临床试验提供了基于证据的框架。文章详细讨论了国际分期系统(ISS)及其修订版在患者分类和预后分层中的作用,并强调了在真实世界实践中应用这些模型的挑战和潜力。

2005 年发布的国际分期系统(ISS)是初诊多发性骨髓瘤(NDMM)患者分类和分层的一个里程碑。ISS 基于来自不同地理区域的广泛中心的数据,易于应用,并且适用于适合移植(TE)和不适合移植(TIE)的患者。它突出了 NDMM 在疾病结果方面的显著异质性,并且在多药一线治疗方案的时代仍然具有预后意义。随后的 ISS 版本,即修订版 ISS(R-ISS)和最近的 ISS 第二版修订(R2-ISS),纳入了额外的、主要是通过荧光原位杂交(FISH)得出的染色体异常,因为这些异常的预后相关性得到了更好的理解。R-ISS 和 R2-ISS 都是从临床试验队列中得出的,由于这两种模型的多参数性质以及它们对非临床试验真实世界 NDMM 患者的适用性,它们在真实世界实践中的效用可能在某种程度上受到限制。尽管存在这些限制,但两种模型都能够识别出生存时间最短的 NDMM 患者,理论上为根据风险调整治疗的临床试验提供了一个框架,可以解决一个重大的未满足需求领域,即真正高危(HR)NDMM 患者的生存时间仍极短。然而,到目前为止,系统地探索这一 HR 人群中的新策略的机会尚未实现。
两篇新文献(International Myeloma Society/International Myeloma Working Group Consensus Recommendations on the Definition of High-Risk Multiple Myeloma和Kaiser等,Co-Occurrence of Cytogenetic Abnormalities and High-Risk Disease in Newly Diagnosed and Relapsed/Refractory Multiple Myeloma)在诊断基因组学的更深入理解和利用以及向三联/四联诱导治疗的转变的背景下,重新审视了 HR,包括纳入 CD38 靶向治疗的方法。这两项研究采用不同的方法论策略,并得出了相似但有些不同的结论。IMS/IMWG 是来自一次专家共识会议,会议重新审视了历史上的高危细胞遗传学异常(HRCA)的当代意义,并将其与使用已发表和未发表的独立分析个体数据集的新数据相结合,开发了共识基因分期(Consensus Genomic Staging,CGS),目标是定义大约 20% 的 NDMM 患者中临床结局最差的人群。另一项研究纳入 20 年时间框架内的随机试验数据,学术团体和行业合作者被邀请对试验数据集进行联合分析,这些数据集中有相当比例的患者存在 HRCA,包括 t(4;14)、t(14;16)、del(17p) 和 gain(1q)。使用预定的用于确定无进展生存期(PFS)和总生存期(OS)的方法,并根据单打击(1 个 HRCA)或双打击(≥2 个 HRCA)疾病的出现来定义。然后利用这些数据进行荟萃分析,以确定 PFS 和 OS 的风险比(HR)。这种联合方法使研究人员能够避开一些日益增加的在不同地区之间共享临床数据的困难。利用这种方法识别了 24 项试验,纳入近 14000 名注册患者,并且重要的是,研究者能够研究单打击和双打击 HRCA 对适合移植和不适合移植的 NDMM 以及复发和/或难治性 MM(RRMM)的影响。他们的目标是证明 HRCA 共存与 NDMM 或 RRMM 患者不良预后之间的关联。
不出所料,两篇文章都证明了 HRCA 共存的不利影响。IMS/IMWG 共识指定了主要但不完全是共存的 HRCA 的特定组(表 1),可以被解释为可能降低了染色体 14 易位——t(14;16) 和 t(14;20) 的重要性;这两种情况都相对不常见,还有 t(4;14)。前者当与其它 CA 共存时,最常见的是 1q+、del(17p) 或 del(1p32),被认为是 HR,但当单独存在时则不是。同样,t(4;14) 代表着异质性人群,超过 50% 的 t(4;14) 患者在临床上并不表现为 HR,主要是与 1q+ 的共存确定了t(4;14) 患者有不良的临床结局。因此,IMS/IMWG 分析建议,只有在与 1q+ 或 del(1p32) 共存的背景下,t(14;16)、t(14;20) 或 t(4;14) 才应被视为 HR。虽然没有具体说明涉及的 HRCA,但联合分析按定义同样要求 t(4;14) 和 t(14;16) 与 1q+ 或 del(17p) 共存,作为临床结局最差的双打击队列的一部分。

IMS/IMWG 建议中最具创新性的方面或许在于将 del(1p32) 纳入风险分层系统。数据表明 del(1p32) 常与 1q+ 共存,并与不良预后相关,而单独出现任一异常时则不然。此外,尽管基于有限的已发表数据,双等位基因 del(1p32) 的显著影响现已被认识到,它导致PFS和OS缩短,在大约 20% 的 del(1p32) 患者中出现。1q+ 也许是 MM 疾病演变中最常见的继发事件,但在大约 40% 的 NDMM 中也存在,并且常与其他 HRCA 共存。关于 1q+ 单独出现与与其他 HRCA 共存时的预后影响尚不完全清楚,一些已发表的分析表明 1q+ 是不良预后的独立预测因子,而另一些则强调与其他 HRCA 共存的重要性。或许最贴切的描述来自 Kaiser 等人:孤立性 1q+ 的预后劣于无HRCA的患者,但不如共存额外 HRCA(≥2 个 HRCA;双打击)时影响大。尽管也存在一些争议,但建议将双等位基因 del(1p32) 以及 1q 扩增和 1q 获得一同考虑,并且只有在与其他病变共存或与单等位基因 del(1p32) 共存时,才定义为 HR。
在 MM 中,del(17p) 伴随 TP532 丢失一直被公认为不良特征。然而,对于单等位基因与双等位基因 TP53 丢失(通过 del(17p) 和/或 TP53 功能缺失突变)的作用,以及影响预后的 del(17p) 受影响癌细胞分数(CCF)的阈值,尚未达成一致。这在一定程度上可能是因为 TP53 丢失常呈亚克隆性质,且 MM 存在广泛的异质性,这可能会使利用单部位骨髓活检的分析结果产生偏差,因为单部位骨髓活检可能无法正确识别 del(17p) 的存在。鉴于 ctDNA 分析数据显示(尽管是在复发疾病中),TP53 突变的频率可能比同时期骨髓评估所认识到的高出达 3 倍,或许有必要在未来重新评估如何标注以及如何将 TP53 丢失纳入预后系统。基于来自多个独立临床试验数据集的数据,IMS/IMWG 建议将孤立 del(17p) 视为 HR 特征。重要的是,建议在分析 CD138 纯化细胞时,将 CCF≥20% 作为将 del(17p) 纳入 HR 特征的标准,同时应认识到CCF 最好被视为一个连续变量;CCF 越高,预后越差。此外,尽管基于 NDMM 的有限已发表数据,但仍可建议将通过 NGS 方法检测到的孤立性TP53 突变视为 HR 特征。这从直觉上讲是有道理的,但从全球角度来看,实际上很少有患者在初次疾病评估时能够获得这项技术。
在 Kaiser 等人的研究中,TP53 丢失作为预后因素的地位有所不同,但这种差异与两项研究之间的方法学差异有关。作者承认孤立性 TP53 丢失具有显著的预后影响,但他们的研究重点是定义 HRCA 共存的影响,而非单一病变。需要注意的是,在大多数评估的试验中,尽管单打击疾病的影响小于双打击疾病,但与无 HRCA 病变的患者相比,单打击的预后结果并不令人意外地较差。Kaiser 研究也没有涉及 β2-微球蛋白(β2M),令人惊讶的是它被保留在了以遗传学为重点的 IMS/IMWG 预后系统中。将 β2M 纳入其中的证据有限,但在来自 COMPASSSM/MMRF 和 FORTE 试验数据集的 2 项未发表分析中是一致的,即在肾功能正常的情况下,β2M>5.5 mg/dL 的患者,无论是否存在 IMS/IMWG 定义的 HR 基因组因素共存,其 PFS 和 OS 均劣于 β2M 未升高的患者。这应被视为可表明,尽管在没有 IMS/IMWG HR 基因组因素的情况下,高 β2M 是一个不良预后因素,但它很可能会与其他与高肿瘤负荷和不良预后相关的基因组异常相关。随着 HR 基因组因素的识别范围扩大,未来预后系统可能不再包括 β2M。
Kaiser 研究的一个重要优势在于对不同患者群体的双打击状态进行了评估,所有 3 个队列(TE NDMM、TIE NDMM 和 RRMM)的荟萃分析均显示双打击的显著不利影响(表 2)。
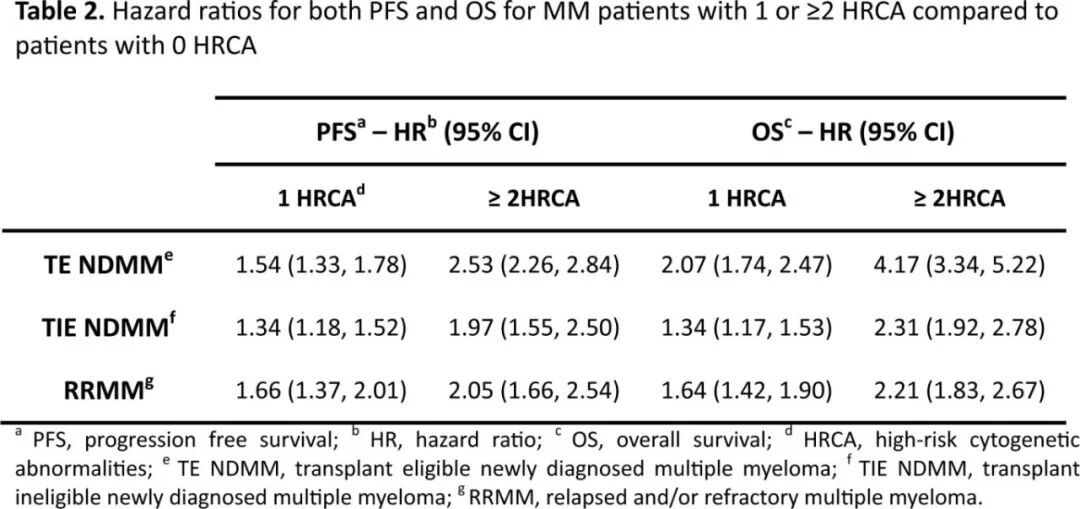
然而,仔细审查表明,后者对 TIE NDMM 人群的影响并不明显。这一观察结果与先前的研究一致,即随着患者年龄的增长,遗传因素对OS的影响逐渐减弱,患者的特征而非疾病的特征可能在决定生存方面起主导作用,这反映出个体患者耐受并因此继续接受初始诱导治疗的能力。同样,在 RRMM 人群中,获得性继发驱动突变和额外结构异常可能成为决定疾病行为的主要因素。该研究的相对简单性也极为重要,其主要基于 del(17p)、1q 获得/扩增和 t(4;14) 的存在与否。在许多地区,这些病变的 FISH 检测相对容易获取,因此在真实世界实践中确定(或不确定)双打击状态的能力将极大地有助于与新诊断患者讨论预后。此外,制药行业通常会发布事后次要分析,声称新疗法对高危疾病有益,如果将高危定义为≥2 个HRCA,而不是像通常那样将高危定义为 del(17p) 或 t(4;14) 或 t(14;16),那么这些说法在未来可能会更有说服力。
那么,现实地来看,这些更有力地定义高危疾病的方法可能会产生什么影响呢?IMS/IMWG 专家小组正确地指出,高危疾病的预后并没有像非高危疾病那样随着新疗法的出现而逐步改善。Kaiser 等人的研究证实了这一点,即在 NDMM 的最新试验中,≥2 个 HRCA 的不利影响仍然非常显著。因此,这些互补且最新的高危疾病定义的发布,应该能够使独立研究人员和制药行业重新专注于开展高危分层研究,其价值已在 OPTIMUM MUK 9 试验的结果中得到证实。此外,也许应该在这些高危患者中探索高活性但昂贵且有毒的新兴免疫疗法的治疗效果,而不是继续采用越来越不可持续的、适用于所有人的多药方案,这种方案一直主导着制药行业驱动的 MM 药物开发。那么,对于那些处于风险谱另一端的患者呢?十年前的数据表明,当时被认为次优的疗法,对于 ISS 1 期和 SKY92 标危的 40% 的患者来说,预后良好,大约 70% 的年龄 >65 岁的患者在中位随访 72 个月后仍然存活。应该为这些患者,特别是如果根据这些新标准属于标危且真正不适合移植的患者,提供最近被描述为新的四联标准治疗方案,还是可以考虑一种更细致的方法,专注于可交付性并避免高成本和潜在毒性呢?目前,在个性化 MM 治疗方面,一个合理的起点是利用这些新模型在试验和真实世界实践中进行风险分层,同时认识到我们对高危不同亚集(例如功能性高危和髓外疾病)生物学的理解仍然非常不完整,需要进一步研究。
参考文献
Andrew Spencer; New prognostic systems for multiple myeloma in the context of contemporary therapies. Blood 2025; blood.2024023841. doi: https://doi.org/10.1182/blood.2024023841


