Adv Sci 段军超/杨毅/刘倩教授团队发现NCOA4介导的铁自噬在PM2.5诱发心肌纤维化中的作用机制
时间:2025-09-25 15:38:59 热度:37.1℃ 作者:网络
人群流行病学研究表明,大气细颗粒物(PM2.5)暴露与心血管疾病风险呈正相关。近年来,越来越多的研究发现,PM2.5中的金属组分,尤其是富铁颗粒,可通过呼吸系统进入体内并在循环系统中累积,从而影响心血管功能造成潜在危害。然而,PM2.5中含铁颗粒如何影响铁稳态、诱发心血管毒性的确切分子机制尚未阐明。
细胞内铁稳态的失衡与心血管疾病的发生发展密切相关。铁主要以铁蛋白的形式储存于细胞中,而铁自噬则是一种选择性自噬过程,主要由核受体共激活因子4 (Nuclear receptor coactivator 4, NCOA4)介导,用于将铁蛋白运输至溶酶体降解并释放铁离子。新近研究发现,铁超载可能调控内皮间质转化(EndMT)过程,而EndMT在心肌纤维化中具有重要作用。但NCOA4介导的铁自噬在PM2.5诱导EndMT和心肌纤维化中的作用尚不清楚。
2025年9月15日,首都医科大学段军超教授、华东师范大学杨毅教授和中国科学院生态环境研究中心刘倩研究员在Advanced Science发表了题为“PM2.5 Induce Endothelial-Mesenchymal Transition and Cardiac Fibrosis via the NCOA4-Mediated Ferritinophagy”的研究论文,该研究揭示了PM2.5中的磁性含铁颗粒引起心肌纤维化的分子机制,阐明了铁自噬和EndMT在其中的重要作用,为理解空气污染诱发心血管疾病提供了新的理论依据。

本研究从PM2.5颗粒化学成分、金属单颗粒表征、分子动力学模拟和体内/体外毒性评价4个方面进行探讨。研究发现,从PM2.5中提取的磁性含铁颗粒主要以磁铁矿(Fe3O4)、赤铁矿和钛铁矿等形式存在,其中磁铁矿颗粒的检出率最高。随后将小鼠暴露于PM2.5在线浓缩暴露系统,利用单粒子电感耦合等离子体质谱(spICP-TOF-MS)等技术,发现PM2.5中的磁铁矿颗粒作为主要的铁载体,首先在肺中大量滞留,部分颗粒通过血液循环系统向心脏迁移,而粒径较小且富含铁的金属单颗粒更容易在心脏中富集。
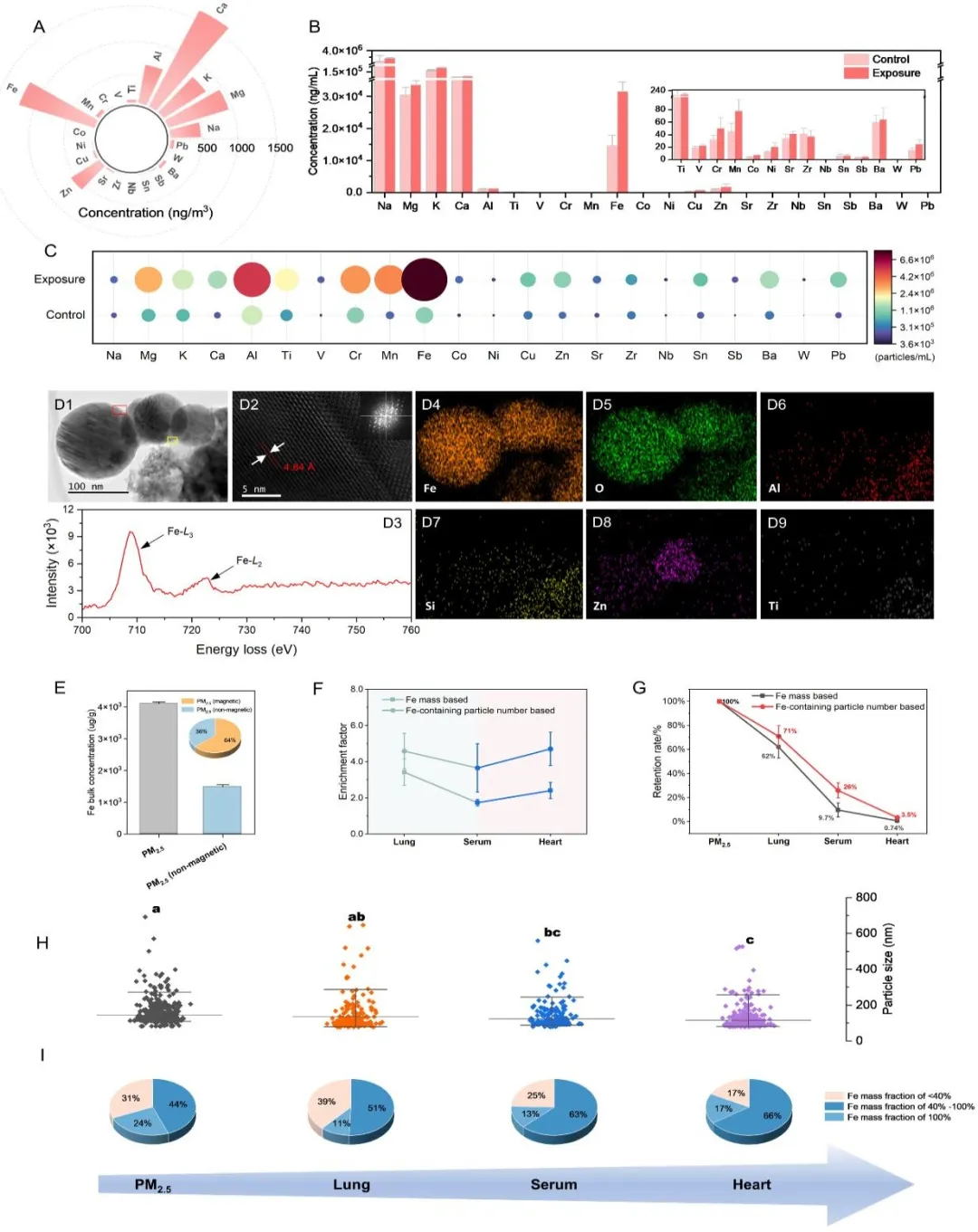
分子动力学模拟表明,PM2.5来源的Fe3O4颗粒可与铁自噬关键蛋白NCOA4直接相互作用并诱导其构象变化。循环系统中的血管内皮细胞是PM2.5经血液转运至心脏组织的首要屏障。研究人员发现,PM2.5可导致内皮细胞(HAECs)铁超载和Fenton反应,并激活细胞铁自噬。随后,利用循环磁提取(CME)技术从PM2.5中分离出磁性含铁颗粒和非磁性颗粒,证实了磁性含铁颗粒在PM2.5诱导铁自噬中的重要作用。进一步发现,PM2.5诱导的铁自噬激活了内皮细胞EndMT,同时采用条件培养基共培养方法检测到PM2.5可促进HAECs分泌促纤维化因子TGF-β1,并以旁分泌方式引发心脏成纤维细胞(HEH)的纤维化表型转化,形成“内皮损伤-成纤维细胞活化”的细胞间信号串扰。
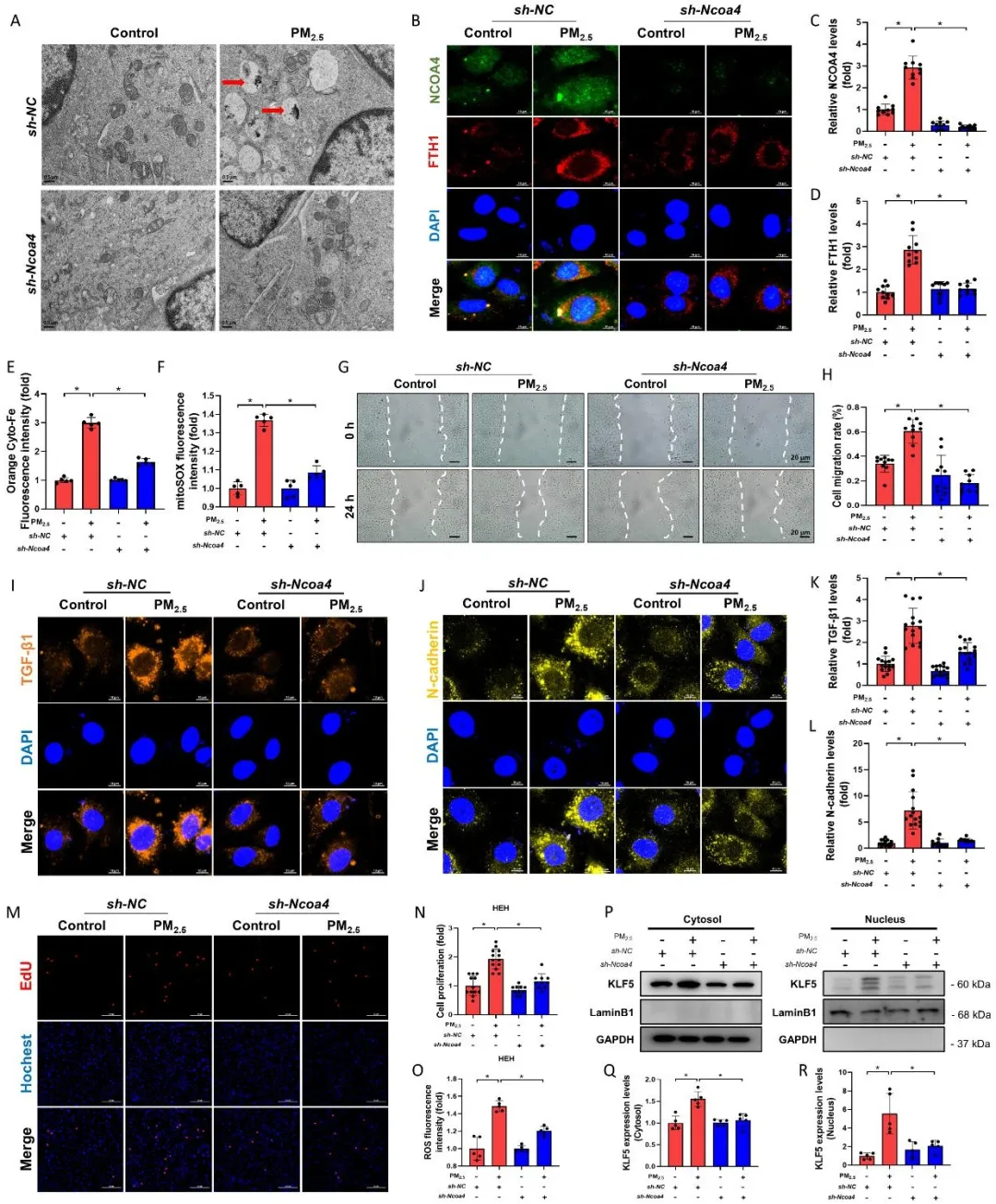
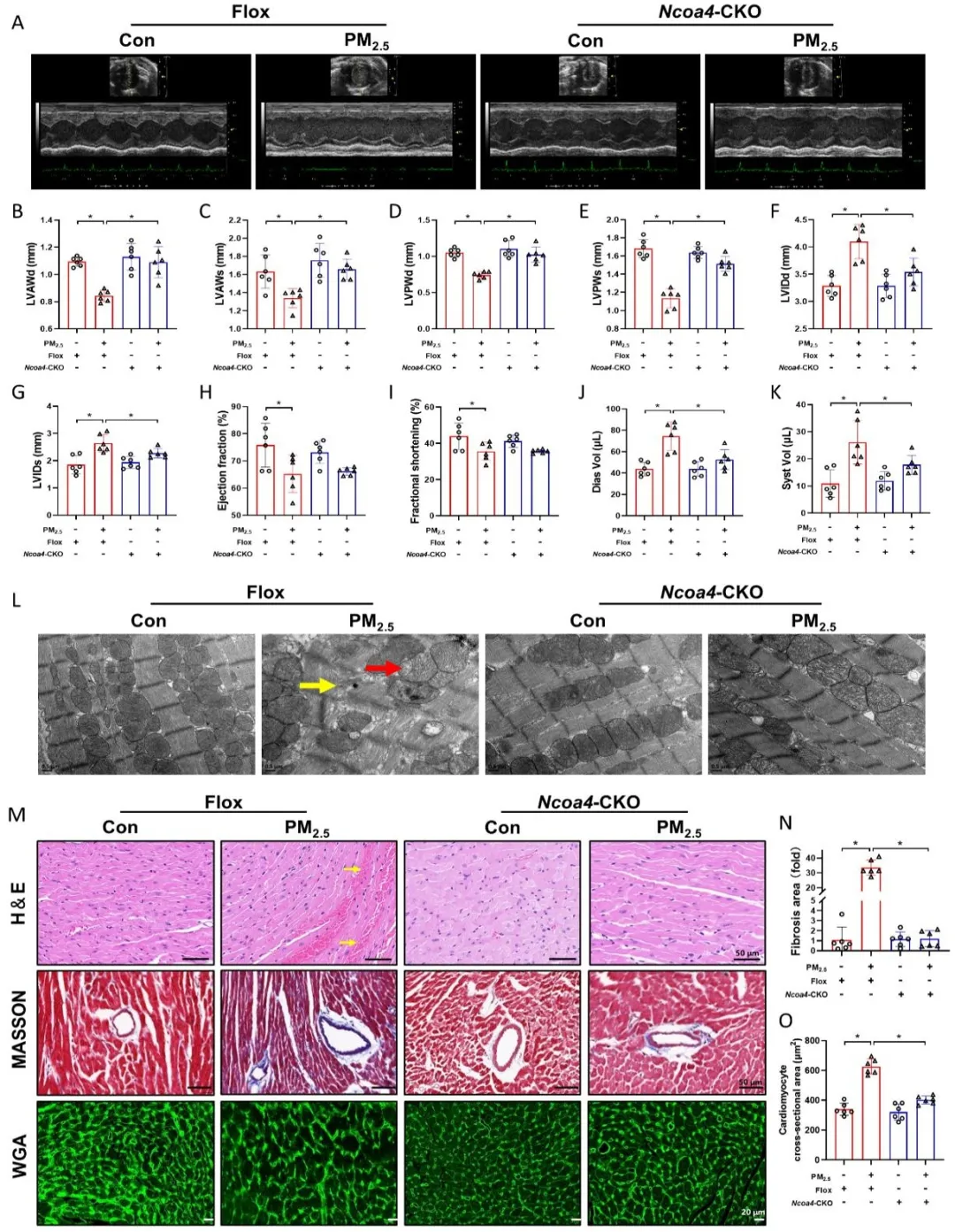
在分子调控层面,研究者发现PM2.5可通过NCOA4依赖性铁自噬激活KLF5的核转位过程,促进KLF5结合TGF-β1启动子区,从而驱动EndMT并诱发心肌纤维化进程。当NCOA4/KLF5信号通路受到抑制时,PM2.5引起的EndMT和心肌纤维化显著缓解。在整体动物模型层面,研究者构建了内皮细胞条件性敲除Ncoa4基因小鼠,发现PM2.5暴露可引起小鼠左心室舒缩功能减退、心肌超微结构破坏、EndMT及心肌纤维化,而内皮细胞特异性敲除Ncoa4可显著减轻上述效应,表明NCOA4介导的铁自噬在PM2.5诱导心肌纤维化中具有关键调控作用。
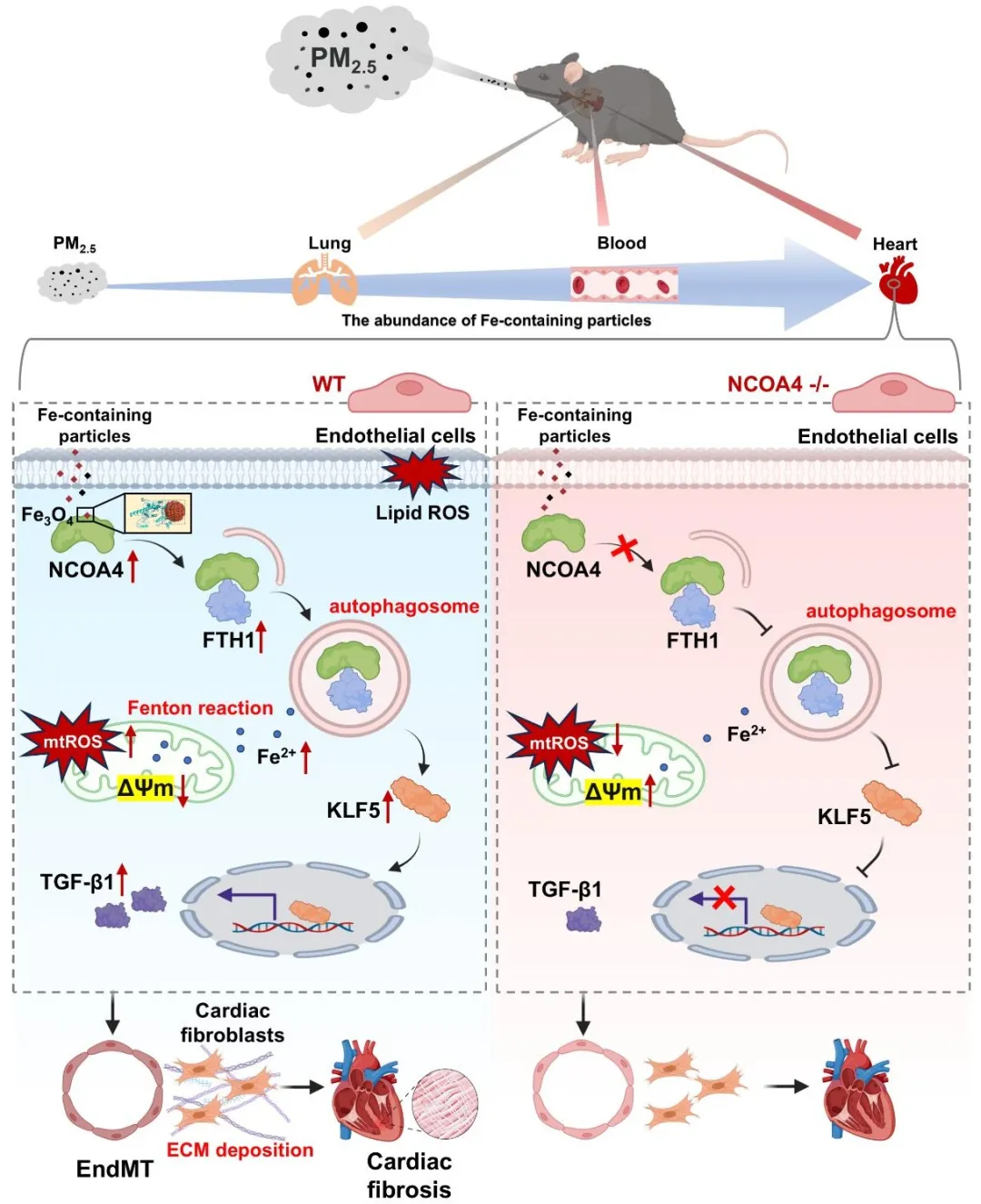
综上所述,该研究揭示了PM2.5中的磁性含铁颗粒通过结合NCOA4介导内皮细胞铁自噬,引发铁过载和Fenton反应,激活KLF5核转位并促进TGF-β1分泌,驱动EndMT及心脏成纤维细胞活化,最终导致心肌纤维化。上述结果提示,靶向铁自噬和EndMT过程可能是减轻大气颗粒物致心血管损伤的潜在途径。
该研究由是首都医科大学段军超教授、华东师范大学杨毅教授和中国科学院生态环境研究中心刘倩研究员合作完成。首都医科大学孙清琳博士和华东师范大学王梦圆博士为本文共同第一作者。该工作得到国家重点研发计划、国家自然科学基金、中国科学院基础研究青年科学家项目资助。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202507536


