【柳叶刀血液病学】成熟T细胞和NK细胞淋巴瘤的新兴治疗策略
时间:2025-09-25 15:45:43 热度:37.1℃ 作者:网络
成熟T细胞和自然杀伤(NK)细胞肿瘤是一组异质性的罕见淋巴瘤,传统细胞毒性化疗的效果欠佳,治疗结果不尽人意。随着疾病生物学研究的深入,近年来治疗方面也取得相当大的进展。针对T细胞淋巴瘤表面抗原的单克隆抗体或抗体-药物偶联物已获批,包括用于治疗CD30阳性结节性和皮肤T细胞淋巴瘤的维布妥昔单抗 (brentuximab vedotin),以及用于治疗蕈样肉芽肿和成人T细胞白血病/淋巴瘤的mogamulizumab。此外,免疫检查点阻断在蕈样肉芽肿和结外NK/T细胞淋巴瘤的治疗中也显示出前景。表观遗传失调常见于成熟T细胞和NK细胞淋巴瘤;因此,作用于表观遗传调节剂的治疗药物(如组蛋白去乙酰化酶抑制剂)已在临床试验中进行评估并显示出有希望的结果。包括细胞疗法和过继性免疫疗法在内的新方法也正在评估中。
《The Lancet Haematology》近日发表综述,讨论了传统治疗方案的局限性以及新兴疗法在成熟T细胞和NK细胞淋巴瘤中的应用。

引言
成熟T细胞和NK细胞淋巴样肿瘤是一组异质性的、来源于T细胞和NK细胞的淋巴瘤。根据最新的2022年WHO分类,此类淋巴样肿瘤包含34种不同的病理亚型。临床上,可根据主要受累部位对其进行分类(见panel))。

总体而言,成熟T细胞和NK细胞淋巴瘤的发病率低于B细胞淋巴瘤,但在某些病例中观察到特定的地理分布优势。由于相对罕见,与B细胞淋巴瘤相比,成熟T细胞和NK细胞淋巴瘤的治疗方案很少在随机临床研究中得到检验。因此,许多治疗方法都来来源B细胞淋巴瘤的疗法,但效果较差。下表讨论了最常见亚型的成熟T细胞和NK细胞淋巴瘤治疗方法的最新进展。许多新疗法是基于对淋巴瘤细胞疾病生物学及其与肿瘤微环境相互作用的表征而开发的。
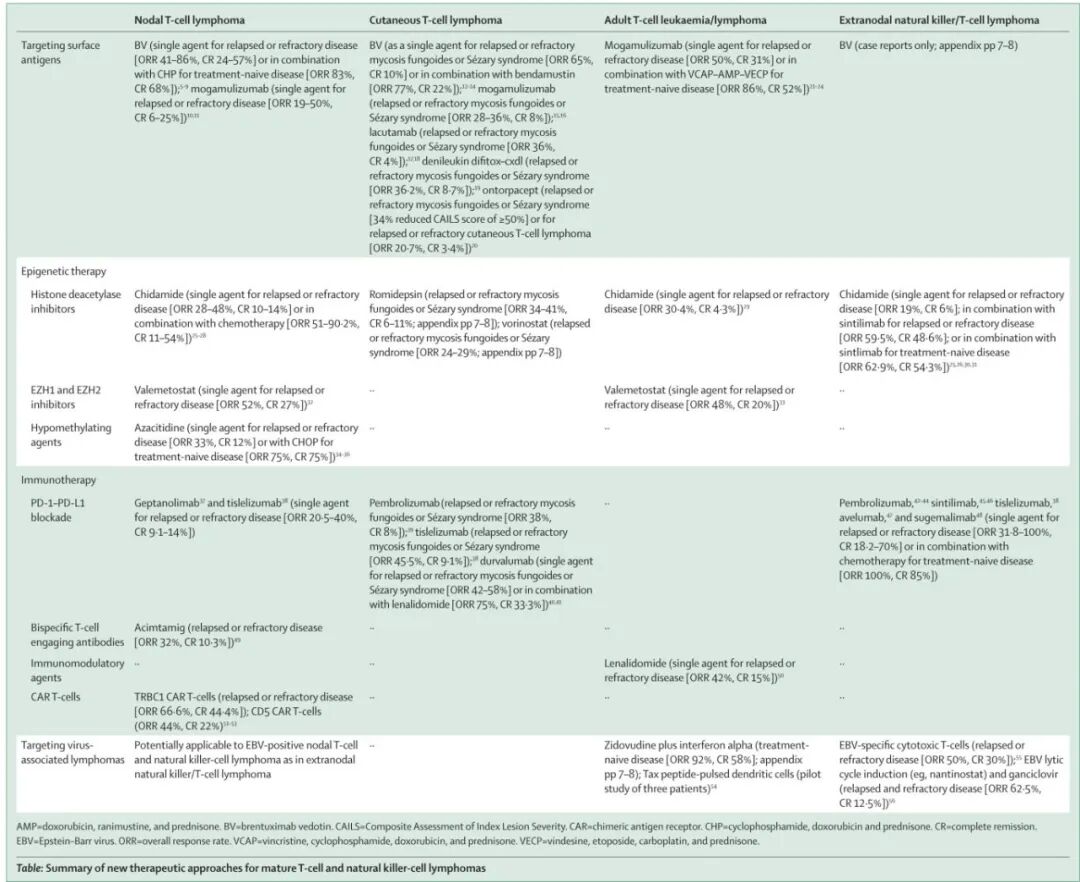
作为结外NK/T细胞淋巴瘤的系列文章,第一篇论文讨论了各种成熟T细胞和NK细胞肿瘤的流行病学以及全球发病率的差异,第二篇论文讨论了分子发病机制及其对临床转化的影响,第三篇论文讨论了最常见亚型的成熟T细胞和NK细胞淋巴瘤治疗方法的最新进展(见上表)。
结节性成熟T细胞淋巴瘤治疗的最新进展
单克隆抗体
CD30在间变性大T细胞淋巴瘤中普遍表达,在外周T细胞淋巴瘤-非特指型中约50%表达,在其他成熟T细胞淋巴瘤中高达30%表达。在复发或难治性情况下,抗CD30抗体药物偶联物BV(维布妥昔单抗)在超过80%的间变性大T细胞淋巴瘤和30-50%的其他类型T细胞淋巴瘤中可诱导反应。在一线治疗中,BV联合CHP(环磷酰胺、多柔比星和泼尼松,省略长春新碱以降低神经毒性)与CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松)相比,中位无进展生存期显著改善(48.2个月 vs 20.8个月;p=0.0110)。长期随访显示BV-CHP组仍有显著的5年无进展生存期获益(风险比 [HR] 0.70, 95% CI 0.53–0.91; p=0.0077)和总生存期获益(HR 0.72, 0.53–0.99; p=0.04)。尽管BV-CHP组大多数患者(约70%)为间变性大T细胞淋巴瘤,其他成熟T细胞淋巴瘤代表性不足,但仍获批用于成熟T细胞淋巴瘤的一线治疗。其他成熟T细胞淋巴瘤中需要多少CD30表达量才能使BV-CHP达到最佳反应尚不清楚。BV-CHP的不良事件可控,BV相关的神经毒性大多可逆。52%(226人中的117人)的患者出现周围神经病变,其中72%(117人中的84人)随时间推移缓解或改善。在47名持续存在周围神经病变的患者中,仅1人为3级。与CHOP相比,BV-CHP组的3级或4级中性粒细胞减少症(35% [223人中的77人])没有显著增加。
趋化因子受体CCR4在30-65%的结节性T细胞淋巴瘤中表达,主要在ALK阴性间变性大T细胞淋巴瘤中,并在外周T细胞淋巴瘤-非特指型中异质性表达。mogamulizumab是一种人源化抗CCR4抗体,具有去岩藻糖基化的Fc区以增强抗体依赖性细胞毒性。在复发性结节性T细胞淋巴瘤中,mogamulizumab诱导的总缓解率(ORR)为19-50%。反应主要是部分缓解且短暂,中位无进展生存期约2个月。不良事件可控,包括血细胞减少(19% [37人中的7人] 出现3级或4级中性粒细胞减少)和皮肤毒性(约50%的患者中出现3级或4级皮肤毒性 [37人中的4人,11%])。在一项日本的回顾性研究中,对6年间接受mogamulizumab治疗的103例结节性T细胞淋巴瘤患者进行分析,ORR为47.6%(103人中的49人),但未说明缓解类型。由于其疗效一般,mogamulizumab尚未在其他国家的结节性T细胞淋巴瘤中得到广泛评估。
表观遗传治疗
表观基因组的异常在结节性T滤泡辅助细胞淋巴瘤中尤其突出。在结节性T细胞淋巴瘤,特别是血管免疫母细胞性T细胞淋巴瘤中,发现了IDH2、TET2、RHOA和DNMT3A的频繁突变,表明表观遗传调节剂是潜在的治疗靶点。
Romidepsin是首个报道对结节性T细胞淋巴瘤有效的组蛋白去乙酰化酶抑制剂,诱导ORR为25%(130人中的33人),中位缓解持续时间(DOR)为17个月(范围 <0.1–34)。因此,Romidepsin被临时批准用于治疗复发或难治性外周T细胞淋巴瘤。然而,后来一项研究Romidepsin-CHOP对比CHOP用于外周T细胞淋巴瘤一线治疗的研究显示,Romidepsin-CHOP并未改善无进展生存期、总缓解率或总生存期,反而增加≥3级不良事件。尽管后续的随访分析显示Romidepsin-CHOP可能使结节性T滤泡辅助细胞淋巴瘤的无进展生存期更长,但由于在该3期试验中添加Romidepsin未显示临床获益,其生产商已撤回Romidepsin用于外周T细胞淋巴瘤的适应症。⁶⁸
Belinostat在一项针对复发或难治性外周T细胞淋巴瘤的2期研究中进行了评估,诱导的总缓解率为25.8%(120人中的31人),中位缓解持续时间为13.6个月(95% CI 4.5–29.4)。然而中位无进展生存期仅为1.6个月(95% CI 1.4–2.7),总生存期为7.9个月(95% CI 6.1–13.9)。⁷⁰ 由于其活性较低,Belinostat后续未得到广泛研究。
迄今为止,西达本胺(Chidamide,亦称Tucidinostat)在外周T细胞淋巴瘤中拥有最丰富的数据。在一项针对79例接受西达本胺治疗的外周T细胞淋巴瘤患者的研究中,总缓解率为28%(79人中的22人),中位无进展生存期为2.1个月(范围1天至44.9个月),总生存期为21.4个月(范围0.3–50.1);血管免疫母细胞性T细胞淋巴瘤患者的总缓解率更高,为50%(10人中的5人)。在随后一份关于256例外周T细胞淋巴瘤患者真实世界数据的报告中,总缓解率为39.1%(256人中的100人)。大多数不良事件低于2级,10%的患者出现≥3级不良事件,主要是血细胞减少。这些结果在2023年的一项多中心研究中得到重复。在46例接受西达本胺治疗的外周T细胞淋巴瘤患者中,总缓解率为46%(46人中的21人)。在血管免疫母细胞性T细胞淋巴瘤患者中,总缓解率为88%(8人中的7人)。中位无进展生存期为5.6个月(95% CI 2.9–13.4),中位缓解持续时间为11.5个月(95% CI 5.4 至未达到 [NR]),总生存期为22.8个月(95% CI 12.6–NR)。超过20%的患者出现的≥3级不良事件包括血小板减少症(51%;55人中的28人)、中性粒细胞减少症(36%;55人中的20人)、淋巴细胞减少症(22%;55人中的12人)和白细胞减少症(20%;55人中的11人)。基于这些结果,西达本胺在中国被批准用于治疗复发或难治性外周T细胞淋巴瘤。
西达本胺作为单一疗法的成功引发了大量联合治疗的研究。专门针对血管免疫母细胞性T细胞淋巴瘤的一项2022年51例新诊断患者的研究表明,西达本胺联合依托泊苷、沙利度胺和泼尼松导致总缓解率达到90.2%(51人中的46人),2年无进展生存率为66.5%,总生存率为82.2%。作为唯一口服有效的组蛋白去乙酰化酶抑制剂,西达本胺显示出良好的结果和安全性,具有长期治疗作为维持策略的潜力。
EZH1或EZH2介导的组蛋白H3赖氨酸27甲基化是另一个治疗靶点。口服有效的EZH1和EZH2抑制剂Valemetostat已在复发或难治性外周T细胞淋巴瘤中进行了评估。在119例患者中,经CT评估,Valemetostat治疗的总缓解率为44%(119人中的52人),经PET评估为52%(119人中的62人),中位缓解持续时间为11.9个月(95% CI 7.8-NE)。³² 中位无进展生存期仅为5.5个月(95% CI 3.5-8.3)。不良事件相当多,导致50%(133人中的66人)的患者需要中断治疗,10%(133人中的13人)的患者需要停药。最常见的≥3级不良事件为血细胞减少,发生在17-23%的患者中。基于这些结果,Valemetostat在日本被批准用于治疗复发或难治性外周T细胞淋巴瘤。
去甲基化药物阿扎胞苷最初被报道在一小群复发或难治性血管免疫母细胞性T细胞淋巴瘤患者中具有活性,诱导的总缓解率为75%(12人中的9人)。然而,在随后一项口服阿扎胞苷对比研究者选择的复发或难治性结节性T滤泡辅助细胞淋巴瘤的试验中,接受阿扎胞苷治疗的患者的中位无进展生存期(5.6个月,95% CI 2.7-8.1)与对照组(2.8个月,95% CI 1.9-4.8; p=0.084)无统计学差异。然而,口服阿扎胞苷联合CHOP用于结节性T细胞淋巴瘤一线治疗的2期研究结果令人鼓舞,完全缓解率为75%(20人中的15人),2年无进展生存率为65%(95% CI 43.4-88.1),总生存率为68%(95% CI 47.3-89.4)。在结节性T滤泡辅助细胞淋巴瘤中观察到改善的反应(完全缓解率88%;17人中的15人)。一项进一步研究阿扎胞苷-CHOP用于结节性T细胞淋巴瘤一线治疗的3期临床试验正在进行中。
靶向通路的治疗
在间变性大细胞淋巴瘤和外周T细胞淋巴瘤-非特指型中,常发现PI3K和JAK-STAT通路激活,使得这些通路成为合理的靶点。PI3K-δγ抑制剂Duvelisib抑制PI3K的初步结果在16例复发或难治性T细胞淋巴瘤患者中显示总缓解率为50%(16人中的8人)。毒性包括转氨酶升高(40%为3-4级)和血细胞减少(18%为3级或4级中性粒细胞减少)相当大,导致停药率为37.5%(16人中的6人)。在最近一项使用口服PI3K-δ抑制剂林Linperlisib的研究中,39例结节性T细胞淋巴瘤患者接受了治疗,总缓解率为59%(39人中的23人),完全缓解率为35.8%(39人中的14人);反应在血管免疫母细胞性T细胞淋巴瘤中最好,总缓解率为81%(16人中的13人),完全缓解率为50%(16人中的8人)。安全性特征似乎更有利,约20%的患者报告≥3级不良事件(主要是中性粒细胞减少)。由于PI3K-mTOR通路是RAS的下游,抑制RAS法尼基化是一种潜在策略,口服法尼基转移酶抑制剂替吡法尼在65例外周T细胞淋巴瘤患者中进行了测试。总缓解率为39.7%(58人中的23人),在血管免疫母细胞性T细胞淋巴瘤中更高,为56.3%(32人中的18人),中位无进展生存期为3.5个月(95% CI 2.1-4.4),中位缓解持续时间为3.7个月(95% CI 2.0-15.3);血管免疫母细胞性T细胞淋巴瘤的缓解持续时间更长,为7.8个月(95% CI 2.0-16.3)。66.2%(65人中的43人)的外周T细胞淋巴瘤患者发生≥3级不良事件,其中56.9%(65人中的37人)与血细胞减少相关。
靶向JAK-STAT通路的尝试也在进行。在一项JAK1/2抑制剂鲁可替尼 (Ruxolitinib) 用于45例成熟T细胞淋巴瘤患者的研究中,总缓解加疾病稳定率为38%(45人中的17人)。在一项更大规模的研究中,使用口服选择性JAK1抑制剂戈利昔替尼 (Golidocitinib) 评估了JAK-STAT抑制在外周T细胞淋巴瘤中的应用。在一项单臂多国2期研究中,88例复发或难治性结节性T细胞淋巴瘤患者接受了治疗。中位随访13.3个月(IQR 4.9-18.4)时,经CT评估的总缓解率为44.3%(88人中的39人),完全缓解率为24%(88人中的21人)。中位缓解持续时间为20.7个月(95% CI 17.6-NE),总生存期为19.4个月(95% CI 13.1-NE)。尽管JAK-STAT激活在间变性大细胞淋巴瘤中很重要,但该队列中间变性大细胞淋巴瘤的总缓解率最低(10%;10人中的1人),而血管免疫母细胞性T细胞淋巴瘤(56.3%;16人中的9人)和外周T细胞淋巴瘤-非特指型(46%;50人中的23人)的总缓解率较高。59%(104人中的61人)的患者发生≥3级不良事件,血细胞减少最常见。有三例治疗相关死亡。
免疫治疗
已批准用于治疗其他血液系统恶性肿瘤的抗PD-1抗体纳武利尤单抗和帕博利珠单抗,仅在少数结节性T细胞淋巴瘤患者中进行评估。抗PD-1抗体geptanolimab在52例复发或难治性结节性外周T细胞淋巴瘤患者中进行了评估,总缓解率为32.7%(52人中的17人),间变性大细胞淋巴瘤(总缓解率50%;20人中的10人)和血管免疫母细胞性T细胞淋巴瘤(总缓解率50%;4人中的2人)的反应优于外周T细胞淋巴瘤-非特指型(总缓解率17.9%;28人中的5人)。25.5%(102人中的26人)的患者发生≥3级不良事件,主要是PD-1阻断相关的免疫相关不良事件,如转氨酶升高和肺炎。另一种抗PD-1抗体替雷利珠单抗在44例结节性T细胞淋巴瘤患者中进行了评估,总缓解率为20.5%(44人中的9人),完全缓解率为9.1%(44人中的4人)。外周T细胞淋巴瘤-非特指型、血管免疫母细胞性T细胞淋巴瘤和间变性大细胞淋巴瘤的反应相似。22.7%(44人中的10人)的患者发生≥3级不良事件。因此,PD-1阻断的总体疗效一般。先前关于成熟T细胞淋巴瘤的小型研究报告称,抗PD-1抗体治疗后可能罕见地发生快速肿瘤进展,然而在更大的研究中未观察到这种现象。
在T细胞淋巴瘤中设计双特异性T细胞衔接抗体很困难,因为正常和淋巴瘤T细胞共享许多共同抗原,但设计了双特异性NK细胞衔接抗体。双特异性CD30–CD16a抗体Acimtamig最近在97例复发或难治性CD30阳性结节性T细胞淋巴瘤患者中进行了评估,总缓解率为32%(97人中的31人),完全缓解率为10.3%(97人中的10人)。血管免疫母细胞性T细胞淋巴瘤的反应最好,总缓解率为53.3%(30人中的16人),完全缓解率为26.7%(30人中的8人)。但中位缓解持续时间仅为2.3个月(95% CI 1.9-6.5)。53.7%(108人中的58人)的患者发生≥3级不良事件,主要是输注反应和血细胞减少;未观察到细胞因子释放综合症。
用于T细胞恶性肿瘤的嵌合抗原受体(CAR)T细胞疗法的设计充满挑战,例如自相残杀 (fratricide) 和T细胞发育不全 (aplasia)。T细胞受体β链恒定区(TRBC)由两个互斥的基因TRBC1和TRBC2编码。因此,识别TRBC1的CAR构建体将特异性靶向表达TRBC1的T细胞淋巴瘤,同时保留具有免疫活性的TRBC2阳性正常T细胞。在9例复发或难治性表达TCRB1的T细胞淋巴瘤患者中,观察到总缓解率为66.6%(9人中的6人),完全缓解率为44.4%(9人中的4人)。患者数量太少,无法确定哪种淋巴瘤效果最好,但15个月和18个月后达到完全缓解的两名(22.2%)患者患有血管免疫母细胞性T细胞淋巴瘤。4名(44.4%)患者发生细胞因子释放综合征,其中1人为3级。靶向其他表面抗原如CD5和CD7的CAR T细胞产品也已在早期临床研究中进行了测试。最近一项研究CD5 CAR T细胞的1期研究在9例复发或难治性T细胞淋巴瘤患者中显示出有希望的总缓解率44%(9人中的4人)和完全缓解率22%(9人中的2人)。44%(9人中的4人)的患者观察到细胞因子释放综合征,均为1级或2级。因此,经过适当设计的CAR T细胞可能有效治疗T细胞淋巴瘤。
其他新方法和联合方法
当前治疗复发或难治性结节性T细胞淋巴瘤的策略仅导致总缓解率30-50%,完全缓解率不超过20-30%,因此已尝试多种方法来改善结局。Darinaparsin是一种新型静脉注射有机砷剂,由二甲基化砷与谷胱甘肽结合组成。在一项针对57例复发或难治性结节性T细胞淋巴瘤患者的2期研究中,基于中心评估的总缓解率为19.3%(57人中的11人),完全缓解率为8.8%(57人中的5人)。外周T细胞淋巴瘤-非特指型的总缓解率为16.2%(37人中的6人),血管免疫母细胞性T细胞淋巴瘤为29.4%(17人中的5人)。1.5-15.4%的患者观察到≥3级不良事件(主要是血细胞减少)。基于这些结果,Darinaparsin在日本获批用于治疗复发或难治性外周T细胞淋巴瘤。另一种方法是开发新型组蛋白去乙酰化酶抑制剂分子。此外,还开发了抑制组蛋白去乙酰化酶和其他靶点(包括BET、JAK、PI3K、STAT3和NAMPT)的双重作用分子。
在这些分子得到充分测试和批准之前,联合使用两种或多种疗法是另一种选择。最近报道了一项Romidepsin加Duvelisib的研究。添加Romidepsin部分减轻了Duvelisib的毒性。在41例接受Romidepsin加Duvelisib治疗的结节性T细胞淋巴瘤患者中,总缓解率为63.4%(41人中的26人),完全缓解率为46.3%(41人中的19人)。毒性仍然相当大,结果是否显著优于单独使用Duvelisib尚不确定。
将新药与化疗联合是另一个反复出现的主题。最近一项研究将西达本胺与阿扎胞苷和化疗(GEMOX;吉西他滨-奥沙利铂)联合用于复发或难治性外周T细胞淋巴瘤。总缓解率为53.3%(30人中的16人),中位无进展生存期为7.1个月,中位总生存期为8.7个月。血管免疫母细胞性T细胞淋巴瘤的结果最好,总缓解率为91.7%(12人中的11人),完全缓解率为66.7%(12人中的8人),中位无进展生存期为17.2个月,中位总生存期为38.8个月。新型药物与化疗的类似组合,如Belinostat和普拉曲沙联合CHOP,目前正在前瞻性临床试验中进行评价。涉及新型药物、免疫治疗和化疗的组合方法可能是最佳方法,因为单药治疗可能已达到疗效的僵局。成功的关键是在机制上联合不同的靶点,而不增加毒性。
皮肤 T 细胞淋巴瘤治疗的最新进展
单克隆抗体
在蕈样肉芽肿和 Sézary 综合征的皮肤切片中,平均 14% 的淋巴瘤细胞 CD30 染色呈阳性。在一项 3 期试验中,131 名复发或难治性 CD30 阳性蕈样肉芽肿或原发性皮肤间变性大 T 细胞淋巴瘤患者被随机分配接受维布妥昔单抗 (BV) 或对照治疗(根据医生判断使用甲氨蝶呤或bexarotene)。经过中位 23 个月的随访后,BV 组的总缓解率为 65%(48 名患者中的 31 名),而对照组为 10%(49 名患者中的 5 名)。周围神经病变是最常见的不良事件,在 BV 组 67%(66 名患者中的 44 名)和对照组 6%(62 名患者中的 4 名)的患者中观察到。BV 也在与苯达莫司汀联合治疗转化的蕈样肉芽肿或 Sézary 综合征中具有活性。
CCR4 在皮肤 T 细胞淋巴瘤中高表达,提供了另一个有吸引力的治疗靶点。在一项mogamulizumab治疗复发或难治性皮肤 T 细胞淋巴瘤的 1/2 期研究中,Sézary 综合征患者的总缓解率为 47.1%(17 名患者中的 8 名),蕈样肉芽肿患者为 28.6%(21 名患者中的 6 名)。然而反应与 CCR4 表达无关。在一项随机、多中心、开放标签的 3 期试验中,比较了mogamulizumab与vorinostat在 372 名复发或难治性皮肤 T 细胞淋巴瘤患者中的疗效,mogamulizumab在总缓解率(mogamulizumab为 28% [186 名患者中的 52 名] vs vorinostat为 5% [186 名患者中的 9 名])和无进展生存期(7.7 个月 vs 3.1 个月)方面优于伏立诺他。因此,mogamulizumab被美国食品药品监督管理局 (FDA) 批准用于治疗复发或难治性皮肤 T 细胞淋巴瘤。最常见的不良事件是 1 级或 2 级皮疹(20%;184 名患者中的 36 名)、疲劳(22%;184 名患者中的 36 名)和腹泻(23%;184 名患者中的 42 名)。mogamulizumab相关的皮疹和皮肤反应很复杂,可能在临床上模拟皮肤 T 细胞淋巴瘤病变,并且在有反应的患者中更常见,因此与更高的总缓解率和完全缓解率相关。
杀伤细胞免疫球蛋白样受体 (KIR) 3DL2 在 90% 的 Sézary 综合征和 50% 的蕈样肉芽肿(包括大细胞转化)中表达。Lacutamab (IPH4102) 是一种抗 KIR3DL2 单克隆抗体 (mAb),通过抗体依赖性细胞毒性和吞噬作用清除表达 KIR3DL2 的细胞。在一项 Lacutamab 治疗 44 名复发或难治性蕈样肉芽肿或 Sézary 综合征患者的 1 期研究中,总缓解率为 36%(44 名患者中的 16 名)。最常见的不良事件是 1 级或 2 级周围性水肿(27%;44 名患者中的 12 名)和疲劳(20%;44 名患者中的 9 名),7%(44 名患者中的 3 名)的患者出现 3 级淋巴细胞减少。两名患者出现 ≥3 级肝毒性,其中一名在停用 Lacutamab 6 周后出现致命的暴发性肝炎。一项开放标签、多队列的 2 期试验招募了 107 名复发或难治性蕈样肉芽肿或 Sézary 综合征患者,接受 Lacutamab 治疗直至疾病进展或出现不可接受的毒性。该研究中的队列 1 包括 56 名 Sézary 综合征患者。该队列的总缓解率为 37.5%(皮肤缓解率为 46% [56 名患者中的 26 名],血液缓解率为 48% [56 名患者中的 27 名])。中位缓解时间为 2.8 个月(范围 1-9),中位无进展生存期为 8.0 个月。17.9%(56 名患者中的 10 名)的患者观察到≥ 3 级不良事件,7.1%(54 名患者中的 4 名)出现严重不良事件(输注相关不良事件和毛细血管渗漏综合征),导致 5.4%(56 名患者中的 3 名)的患者停药。最常见的 1 级或 2 级不良事件是疲劳(11.2%)、恶心(11.2%)、乏力(10.3%)和关节痛(10.3%)。基于这些结果,Lacutamab 于 2025 年获得 FDA 针对复发或难治性 Sézary 综合征的突破性疗法认定。
靶向特定表面标志物的重组融合蛋白
Denileukin diftitox是一种重组蛋白,将 IL-2 中结合 IL-2 受体 (IL-2R) 的部分与白喉毒素融合。通过与淋巴瘤 T 细胞上的中等亲和力(β 链和 γ 链)和高亲和力 IL-2R(α 链、β 链和 γ 链)结合,Denileukin diftitox将白喉毒素递送至细胞内部诱导细胞凋亡。然而,Denileukin diftitox后来因生产问题自愿撤出市场。一项 3 期研究在 69 名复发或难治性皮肤 T 细胞淋巴瘤患者中检验了纯度更高、生物活性更强的Denileukin diftitox,即diftitox–cxdl,总缓解率为 36.2%(69 名患者中的 25 名),完全缓解率为 8.7%(69 名患者中的 6 名)。中位缓解时间为 1.4 个月(范围 0.7–2.1),中位缓解持续时间为 8.9 个月(95% CI 5.0–NE)。总计 84.4%(64 名患者中的 54 名)的患者皮肤肿瘤负荷减少,其中 48.4%(64 名患者中的 31 名)的患者减少超过 50%。最常见的不良事件是恶心(43.5%;69 名患者中的 30 名)、疲劳(31.9%;69 名患者中的 22 名)、转氨酶升高(27.5%;69 名患者中的 19 名)、寒战(27.5%;69 名患者中的 19 名)和周围性水肿(27.5%;69 名患者中的 19 名)。5.8%(69 名患者中的 4 名)的患者发生≥3 级毛细血管渗漏综合征和输注反应。Denileukin diftitox–cxdl 于 2024 年获得 FDA 批准。
Ontorpacept (TTI-621; Pfizer) 是一种重组可溶性融合蛋白,由人 SIRPα 的 CD47 结合域与人 IgG1 的 Fc 区域连接而成。Ontorpacept 是一种 CD47 阻断性检查点抑制剂,通过(与 IgG1 结合 Fcy 受体)结合巨噬细胞来促进吞噬作用和抗肿瘤活性。一项 1 期研究评估了病灶内注射 Ontorpacept 在 29 名复发或难治性蕈样肉芽肿患者中的安全性和活性。26 名(90%)患者皮肤评分改善,其中 10 名(34%)患者减少超过 50%。Ontorpacept 的病灶内应用可能导致邻近或远端非注射病灶出现反应,提示存在全身性和局部区域的远隔效应。最常见的不良事件是寒战(29%;35 名患者中的 10 名)、注射部位疼痛(26%;35 名患者中的 9 名)和疲劳(23%;35 名患者中的 8 名)。未观察到≥ 3 级不良事件。静脉给药可能更适合晚期全身性疾病,但在临床 1 期试验中显示出较低的反应率,29 名蕈样肉芽肿或 Sézary 综合征患者中有 6 名(20.7%)观察到总体反应,但仅 1 名(3.4%)患者达到完全缓解。
免疫疗法
皮肤 T 细胞淋巴瘤细胞通过表达免疫检查点蛋白(如 PD-L1)逃避免疫监视。肿瘤微环境的修饰,例如使用度伐利尤单抗(抗 PD-L1 单抗)、来那度胺和 Ontopacept 治疗,可以重编程免疫细胞和吞噬细胞,以增强针对皮肤 T 细胞淋巴瘤细胞的抗肿瘤功能。在一项帕博利珠单抗治疗 24 名晚期蕈样肉芽肿或 Sézary 综合征患者的 2 期临床研究中,总缓解率为 38%(24 名患者中的 9 名),完全缓解率为 8%(24 名患者中的 2 名)。六名部分缓解患者的改良严重程度加权评估工具评分改善了 90%。最常见的免疫相关不良事件是皮疹或皮肤潮红,停药后消退。在 Sézary 综合征患者中,53%(15 名患者中的 8 名)出现短暂的红斑、瘙痒和周围性水肿加重。另一种抗 PD-1 抗体替雷利珠单抗已在 11 名复发或难治性皮肤 T 细胞淋巴瘤患者中进行评估。中位随访 16.6 个月后,总缓解率为 45.5%(11 名患者中的 5 名),完全缓解率为 9.1%(11 名患者中的 1 名)。中位缓解持续时间为 11.3 个月(95% CI 2.7–NE),中位无进展生存期为 16.8 个月(95% CI 2.6–16.8)。在一项 1/2 期研究中,度伐利尤单抗联合或不联合免疫调节剂来那度胺在 1 期阶段对 13 名复发或难治性皮肤 T 细胞淋巴瘤患者进行了测试。该组合的总缓解率为 53.8%(13 名患者中的 7 名),中位缓解持续时间为 25.5 个月(范围 8–36.5)。最常见的不良事件是肿瘤flare、疲劳、中性粒细胞减少和白细胞减少。在 2 期阶段,度伐利尤单抗-来那度胺在总缓解率(度伐利尤单抗-来那度胺为 75% [12 名患者中的 9 名] vs 单药度伐利尤单抗为 42% [12 名患者中的 5 名])、完全缓解率(33.3% [12 名患者中的 4 名] vs 0% [0 of 12 名患者])和 12 个月无进展生存率(75% [95% CI 38–91] vs 36% [11–63])方面优于单药度伐利尤单抗。
成人 T 细胞白血病/淋巴瘤治疗的最新进展
单克隆抗体
CCR4 在几乎所有成人 T 细胞白血病/淋巴瘤的肿瘤细胞上表达。mogamulizumab联合化疗或作为单药已在日本被批准用于治疗初治或复发/难治性成人 T 细胞白血病/淋巴瘤。在一项比较 VCAP(长春新碱、环磷酰胺、多柔比星和泼尼松)、AMP(多柔比星、雷莫司汀和泼尼松)和 VECP(长春地辛、依托泊苷、卡铂和泼尼松)联合或不联合mogamulizumab的随机 2 期试验中,纳入 53 名初治成人 T 细胞白血病/淋巴瘤患者,加入mogamulizumab提高了完全缓解率(VCAP–AMP–VECP 加mogamulizumab为 52% [29 名患者中的 15 名] vs 单用 VCAP–AMP–VECP 为 33% [24 名患者中的 8 名]),尽管无进展生存期和总生存期未得到改善。一项针对 39 名不适合移植的成人 T 细胞白血病/淋巴瘤患者的回顾性研究表明,含mogamulizumab的治疗方案达到了比单纯化疗(20.6% [95% CI 6.5–40.2] 的患者)更好的 4 年总生存率(46.3% [95% CI 20.5–68.8] 的患者)。
一项 2 期试验的初步数据显示,在年龄较大(>65 岁)或不适合移植的成人 T 细胞白血病/淋巴瘤患者中,接受mogamulizumab联合 CHOP 方案治疗也显示出高达 64.6%(48 名患者中的 31 名)的完全缓解率。中位随访 1.6 年(范围 0.7–2.4),1 年总生存率为 66%(95% CI 50.6–77.6)。mogamulizumab也靶向表达 CCR4 的调节性 T 细胞,从而可能调节免疫抑制性肿瘤微环境并增强治疗效果。mogamulizumab可能通过抑制调节性 T 细胞引起免疫相关不良事件,包括中毒性表皮坏死松解症和 Stevens-Johnson 综合征。
关于mogamulizumab用于成人 T 细胞白血病/淋巴瘤的回顾性研究表明,mogamulizumab诱导的皮疹和 CCR4 突变可能预示着更有利的生存。然而,在异基因造血干细胞移植 (HSCT) 前使用mogamulizumab会增加严重且对皮质类固醇难治的急性移植物抗宿主病的风险,通常不建议在计划进行异基因 HSCT 的患者中使用。
表观遗传疗法
在一项西达本胺治疗 23 名对化疗和mogamulizumab无反应的成人 T 细胞白血病/淋巴瘤患者的 2 期研究中,达到总缓解率 30.4%(23 名患者中的 7 名)、完全缓解率 4.3%(23 名患者中的 1 名)、中位缓解持续时间 9.2 个月(95% CI 2.6–NR)、中位无进展生存期 1.7 个月(95% CI 0.8–7.4)和中位总生存期 7.9 个月(95% CI 2.3–18)。尽管 78%(23 名患者中的 18 名)的患者发生了 ≥3 级不良事件,但大多可以通过支持性管理和剂量调整来控制。 39%(23 名患者中的 9 名)的患者观察到 3 级或 4 级中性粒细胞减少,13%(23 名患者中的 3 名)的患者观察到 3 级或 4 级血小板减少。西达本胺目前在日本被批准用于复发或难治性成人 T 细胞白血病/淋巴瘤。
全局组蛋白 H3 赖氨酸 27 甲基化在成人 T 细胞白血病/淋巴瘤中经常被检测到。在一项 valemetostat 治疗 25 名复发或难治性成人 T 细胞白血病/淋巴瘤患者的 2 期研究中,达到总缓解率 48%(25 名患者中的 12 名)和完全缓解率 20%(25 名患者中的 5 名),中位缓解持续时间尚未达到。不良事件大多可控,12%(25 名患者中的 3 名)的患者发生 3 级或 4 级中性粒细胞减少,32%(25 名患者中的 8 名)的患者发生 3 级或 4 级血小板减少。因此,valemetostat 在日本被批准用于复发或难治性成人 T 细胞白血病/淋巴瘤。因此,表观遗传药物对复发或难治性成人 T 细胞白血病/淋巴瘤具有活性,值得进一步研究。
免疫疗法
纳武利尤单抗已在成人 T 细胞白血病/淋巴瘤患者中进行了评估,但仅有初步结果可用,并且有报道称纳武利尤单抗治疗可能导致疾病快速进展。在一项来那度胺治疗 26 名复发或难治性成人 T 细胞白血病/淋巴瘤患者的 2 期研究中,报告的总缓解率为 42%(26 名患者中的 11 名),完全缓解率为 15.4%(26 名患者中的 4 名),中位无进展生存期为 3.8 个月(95% CI 1.9–NE),中位总生存期为 20.3 个月(95% CI: 9.1–NE)。最常见的 3 级或 4 级不良事件是中性粒细胞减少(65%;26 名患者中的 17 名)、淋巴细胞减少(38%;26 名患者中的 10 名)和血小板减少(23%;26 名患者中的 6 名)。
靶向人类 T 细胞白血病病毒 1 的药物
抗逆转录病毒药物齐多夫定具有人类 T 细胞白血病病毒 1 (HTLV1) 抑制活性,其与干扰素的联合已被推荐用于治疗成人 T 细胞白血病淋巴瘤。Tax 是由 HTLV1 在成人 T 细胞白血病/淋巴瘤细胞中编码的一种致癌蛋白,一种负载 Tax 肽的树突状细胞治疗性癌症疫苗通过激活 Tax 特异性细胞毒性 T 细胞反应起作用,并已在一项初步研究中进行了评估,该研究纳入三名化疗后达到部分缓解或疾病稳定的成人 T 细胞白血病/淋巴瘤患者,两名患者获得了进一步的反应,其中一名随后获得了超过 19 个月的完全缓解。报告的仅有不良事件为 1 级或 2 级发热和皮疹。一项将负载 Tax 肽的树突状细胞作为成人 T 细胞白血病/淋巴瘤化疗后维持治疗的 2 期研究正在进行中。
结外NK/T 细胞淋巴瘤治疗的最新进展
免疫疗法
PD-1 免疫检查点阻断在结外NK/T 细胞淋巴瘤中的疗效已在多项研究中得到证实。对帕博利珠单抗治疗复发或难治性结外NK/T 细胞淋巴瘤的回顾性分析显示,总缓解率高达 60-100%,完全缓解率为 30-70%。一项针对 16 名复发或难治性疾病患者的帕博利珠单抗前瞻性 2 期研究显示,总缓解率为 62.5%(16 名患者中的 10 名),完全缓解率为 44%(16 名患者中的 7 名)。中位随访 24 个月,中位总生存期为 25 个月。不良事件与帕博利珠单抗在霍奇金淋巴瘤中的相似,31%(16 名患者中的 5 名)的患者观察到 1 级或 2 级免疫相关不良事件。
其他抗 PD-1 单抗也已研究用于治疗复发或难治性结外NK/T 细胞淋巴瘤。在一项纳入 28 名患者的研究中,使用信迪利单抗的总缓解率为 67.9%(28 名患者中的 19 名),2 年总生存率为 78.6%(95% CI 58.4–89.8)。大多数不良事件为 1 级或 2 级,淋巴细胞减少最常见(50%;28 名患者中的 14 名)。然而,在一项使用替雷利珠单抗治疗 22 名患者的 2 期研究中,总缓解率为 31.8%(22 名患者中的 7 名),完全缓解率为 18.2%(22 名患者中的 4 名)。中位随访 20 个月,中位无进展生存期为 2.7 个月(95% CI 1.5–5.3),总生存期为 8.8 个月(95% CI 3.3–NE)。这些结果可能反映了患者选择的差异,而非真正的疗效差。
抗 PD-L1 单抗也被研究。在一项纳入 21 名患者的 2 期研究中测试了Avelumab。总缓解率为 38%(21 名患者中的 8 名),完全缓解率为 24%(21 名患者中的 5 名)。对 80 名患者研究了Sugemalimab。总缓解率为 45%(78 名患者中的 35 名),完全缓解率为 36%(78 名患者中的 28 名),12 个月缓解持续率为 82.5%(95% CI 62–92.6)。40%(80 名患者中的 32 名)的患者发生≥ 3 级不良事件。在不同研究中,PD-L1 表达与反应之间的相关性分析结果存在矛盾。
鉴于 PD-1 免疫阻断疗法在复发或难治性环境中的安全性和有效性,其与化疗联合使用在一线治疗结外NK/T 细胞淋巴瘤中也得到了评估。在一项 2 期研究中,信迪利单抗与 P-GEMOX(培门冬酶、吉西他滨和奥沙利铂)联合用于 34 名初治晚期结外NK/T 细胞淋巴瘤患者。总缓解率为 100%(34 名患者中的 34 名),完全缓解率为 85%(34 名患者中的 29 名)。中位随访 21 个月(IQR 13-32),2 年无进展生存率为 64%(95% CI 48–86),3 年总生存率为 76%(95% CI 52–100)。与单用信迪利单抗或 P-GEMOX 相比,未观察到新的安全信号。50%(34 名患者中的 17 名)的患者观察到 3 级或 4 级中性粒细胞减少,53%(34 名患者中的 18 名)的患者发生作为免疫相关不良事件的甲状腺功能减退。
表观遗传疗法
在一项 2 期研究中,对 16 名复发或难治性结外NK/T 细胞淋巴瘤患者队列使用西达本胺治疗,获得了 19%(16 名患者中的 3 名)的总缓解率和 6%(16 名患者中的 1 名)的完全缓解率。11% 的患者观察到 3 级或 4 级中性粒细胞减少。在另一项关于西达本胺治疗复发或难治性结外NK/T 细胞淋巴瘤的回顾性分析中也获得了类似的结果。在一项涉及 38 名复发或难治性结外NK/T 细胞淋巴瘤患者的 1b/2 期试验中,西达本胺联合信迪利单抗治疗导致总缓解率为 59.5%(37 名患者中的 22 名),完全缓解率为 48.6%(37 名患者中的 18 名)。29%(38 名患者中的 11 名)的患者出现 3 级或 4 级中性粒细胞减少,11%(38 名患者中的 4 名)的患者出现 3 级或 4 级血小板减少。47%(38 名患者中的 18 名)的患者观察到 3 级或 4 级免疫相关不良事件。缓解率高于其他研究中任一单药的缓解率,这与体外观察到的两种药物之间的协同效应一致。3 年无进展生存率为 38.8%(95% CI 24.2–55.2),总生存率为 47.4%(95% CI 32–63.4)。一项关于西达本胺联合信迪利单抗一线治疗结外NK/T 细胞淋巴瘤的回顾性研究也显示了该组合的高活性,总缓解率为 62.9%(35 名患者中的 22 名),完全缓解率为 54.3%(35 名患者中的 19 名)。
靶向 Epstein-Barr 病毒 (EBV) 的药物
在 EBV 相关的移植后淋巴增殖性疾病中,使用 EBV 特异性 T 细胞非常有效。鉴于移植后淋巴增殖性疾病具有 III 型 EBV 潜伏程序(所有潜伏期 EBV 抗原均表达),移植后淋巴增殖性疾病的免疫原性最强,且适合采用 EBV 特异性 T 细胞治疗。相比之下,由于 II 型 EBV 潜伏程序,结外NK/T 细胞淋巴瘤仅表达 LMP1、LMP2 和 EBNA1,使得肿瘤细胞相较于具有 III 型 EBV 潜伏程序的细胞更不易受到免疫监视。在一项 2 期研究中,32 名复发或难治性结外NK/T 细胞淋巴瘤患者接受了自体 EBV 特异性 T 细胞治疗。总缓解率为 50%(10 名患者中的 5 名),完全缓解率为 30%(10 名患者中的 3 名),中位无进展生存期为 12.3 个月。未观察到 3 级或 4 级不良事件。然而,制备失败率高达 32%,制备时间长约 4 周,极大地限制了这种治疗方法的临床应用。
另一种靶向 EBV 的方法是诱导淋巴瘤细胞中潜伏状态的 EBV 进入裂解周期,导致病毒编码的胸苷激酶表达。加入更昔洛韦后,EBV 编码的胸苷激酶磷酸化更昔洛韦,抑制淋巴瘤细胞 DNA 聚合酶,导致癌细胞死亡。在一项 2 期研究中,8 名复发或难治性结外NK/T 细胞淋巴瘤患者接受了缬更昔洛韦(更昔洛韦的口服前药)联合nanatinostat(口服组蛋白去乙酰化酶 1-3 抑制剂,作为 EBV 裂解周期的诱导剂)治疗。总缓解率为 62.5%(8 名患者中的 5 名),完全缓解率为 12.5%(8 名患者中的 1 名)。20–30% 的患者观察到 3 级或 4 级血细胞减少。需要进一步的临床研究来评估这些靶向 EBV 的方法在结外NK/T 细胞淋巴瘤中的有效性。
结论
成功引入新颖有效的治疗方法,包括用于 B 细胞淋巴瘤的双特异性 T 细胞衔接器和 CAR T 细胞,尚未在成熟 T 细胞和NK细胞淋巴瘤中复制。对这些淋巴瘤生物学的更好理解导致了针对不同肿瘤内在病理过程和外在免疫系统(包括肿瘤微环境)的新药开发,以更好地控制疾病。早期临床研究已显示这些新治疗方法在许多成熟 T 细胞和NK细胞淋巴瘤中的疗效,如本系列文件所述。这些新药与其他常规疗法的组合通常显示出比单药更好的疗效。尽管许多最初的临床研究集中于这些药物在复发或难治性疾病中的应用,但它们在一线治疗中也显示出优于常规治疗的效果。然而,出现化疗通常未见的不良反应,如细胞因子释放综合征和免疫相关不良事件,使得保持警惕变得至关重要。这些新药的长期安全性也有待确认。鉴于这类淋巴瘤的异质性,“一刀切”的方法不太可能有效。预测性生物标志物的识别将有助于为个体生物学上不同的亚组开发量身定制的疗法。
参考文献
Lancet Haematol . 2025 Sep 14:S2352-3026(25)00228-5. doi: 10.1016/S2352-3026(25)00228-5


