深度学习在左心室肥厚辅助诊断和预后评估中的应用进展
时间:2025-09-25 15:46:06 热度:37.1℃ 作者:网络
摘 要
左心室肥厚是多种心血管疾病的中间表型,早期诊断有助于及时干预,防止病情恶化,减少心力衰竭、心律失常等严重并发症,从而改善预后。深度学习在左心室肥厚的早期诊断和病因识别中取得初步进展。本文介绍左心室肥厚的病理生理学、病因及诊断标准,探讨深度学习在超声心动图、心脏磁共振成像和心电图等诊断方法中的应用优势与局限性,分析其在预后评估中的应用,并总结现有成果和提出未来研究方向。
正 文
根据《左心室肥厚诊断和治疗临床路径中国专家共识2023》[1],左心室肥厚(left ventricular hypertrophy,LVH)的特征是左心室壁厚度增加,通常是由心脏长期承受过高压力或容量负荷所致,同时LVH可导致严重并发症,如心力衰竭[2]、心律失常[3]、心肌缺血[4]等,因此早期诊断至关重要。此外,LVH的病因复杂,根据其病因和病理机制可以分为以下几类:压力负荷相关LVH,如高血压性心脏病(hypertensive heart disease,HHD)、主动脉瓣狭窄等;浸润性疾病相关LVH,如心脏淀粉样变(cardiac amyloidosis,CA)、法布雷病(Anderson-Fabry disease,AFD)等;遗传性心肌病相关LVH,如肥厚型心肌病(hypertrophic cardiomyopathy,HCM)、Danon病等;药物及运动相关LVH,如长期使用类固醇激素或高强度运动导致的LVH等[5]。
LVH的早期诊断标准经历了多次技术迭代。最初,心电图(electrocardiogram,ECG)作为主要筛查工具,依赖于电压标准(如Sokolow-Lyon指数:SV1+RV5/RV6男性≥3.5 mV,女性≥3.0 mV;Cornell电压标准:RaVL+SV3男性≥2.8 mV,女性≥2.0 mV[6])和波形形态判断LVH。然而,该方法特异性较低。随后,超声心动图(echocardiogram,Echo)的出现使定量结构评估成为可能,将左心室壁厚度(舒张末期男性≥12 mm或女性≥11 mm)确立为诊断的金标准[7]。此外,由Echo计算得到的左心室质量指数(男性≥115 g/m2或女性≥95 g/m2)进一步完善了LVH评估标准。随着多模态成像技术越发成熟,心脏磁共振成像(cardiac magnetic resonance imaging,CMR)等高分辨率技术改善了局灶性肥大(如室间隔基底段≥15 mm提示肥厚型心肌病[8])的检测,并且3D-Echo减少了与2D平面限制相关的测量误差[9]。然而以上诊断都依赖于经验丰富的医师,其手动解读过程耗时且容易出错,因此,基于深度学习的LVH辅助诊断开始涌现。
近年来,人工智能(artificial intelligence,AI)飞速发展,深度学习逐渐应用于心血管医学领域,如心脏瓣膜病[10]、心力衰竭[11]、冠心病[12]等疾病的诊断中,并凭借出色的特征提取能力对临床上揭示病理的多模态医学影像,如胸部X线(chest X-ray,CXR)、Echo、计算机断层扫描(computed tomography,CT)、CMR、冠状动脉造影等,以及基于时间序列的医学数据,如ECG、心音图(phonocardiogram,PCG)、心脏收缩期-舒张期的影像等,进行自动特征提取以实现心血管疾病的诊断。如今,与LVH相关的基于深度学习的辅助诊断方法已经得到广泛应用,本文对最近几年提出的方法进行综述,探讨各种方法的优势及局限,并为后续研究扩宽视野。
1 左心室肥厚概述
LVH是心脏长期高压导致的心肌增厚和结构异常,常见于多种心血管疾病。其核心机制包括心肌细胞增大、排列紊乱及纤维化,进而使心脏舒张功能受损,最终可能引发心力衰竭。早期无明显症状,后期可能出现气促、胸痛、心悸和晕厥。严重LVH会显著增加心律失常(如心房颤动、室性心动过速)和猝死风险。研究[13]表明,LVH患者的心力衰竭风险比正常人高3~5倍,且与全因死亡率显著相关。
在当前基于深度学习的LVH诊断研究中,Echo通常被用作提供训练标签的临床金标准。于是,研究人员开始将Echo作为金标准,并尝试与患者同期CMR、ECG、CXR以及人口统计学特征进行配对,寻求更加经济便利的方式来诊断LVH。
2 深度学习在左心室肥厚辅助诊断中的应用
深度学习作为机器学习的重要分支,其核心技术在于通过多层人工神经网络架构实现特征的自适应分层提取,突破了传统算法依赖人工设计特征的局限性[14]。该技术自2017年起在医学领域快速渗透,尤其在处理高维度、非线性医学数据方面展现出显著优势[15]。其核心价值体现在通过端到端的学习机制解析多模态医学数据间的复杂关联,例如在CT图像中自动识别肺结节形态特征[16],或对糖尿病视网膜病变血管进行分割和重建[17]等。同样,深度学习通过结合Echo、CMR、ECG、CXR等在早期诊断LVH中也发挥着重要作用[18]。
2.1 联合超声心动图在左心室肥厚诊断中的应用
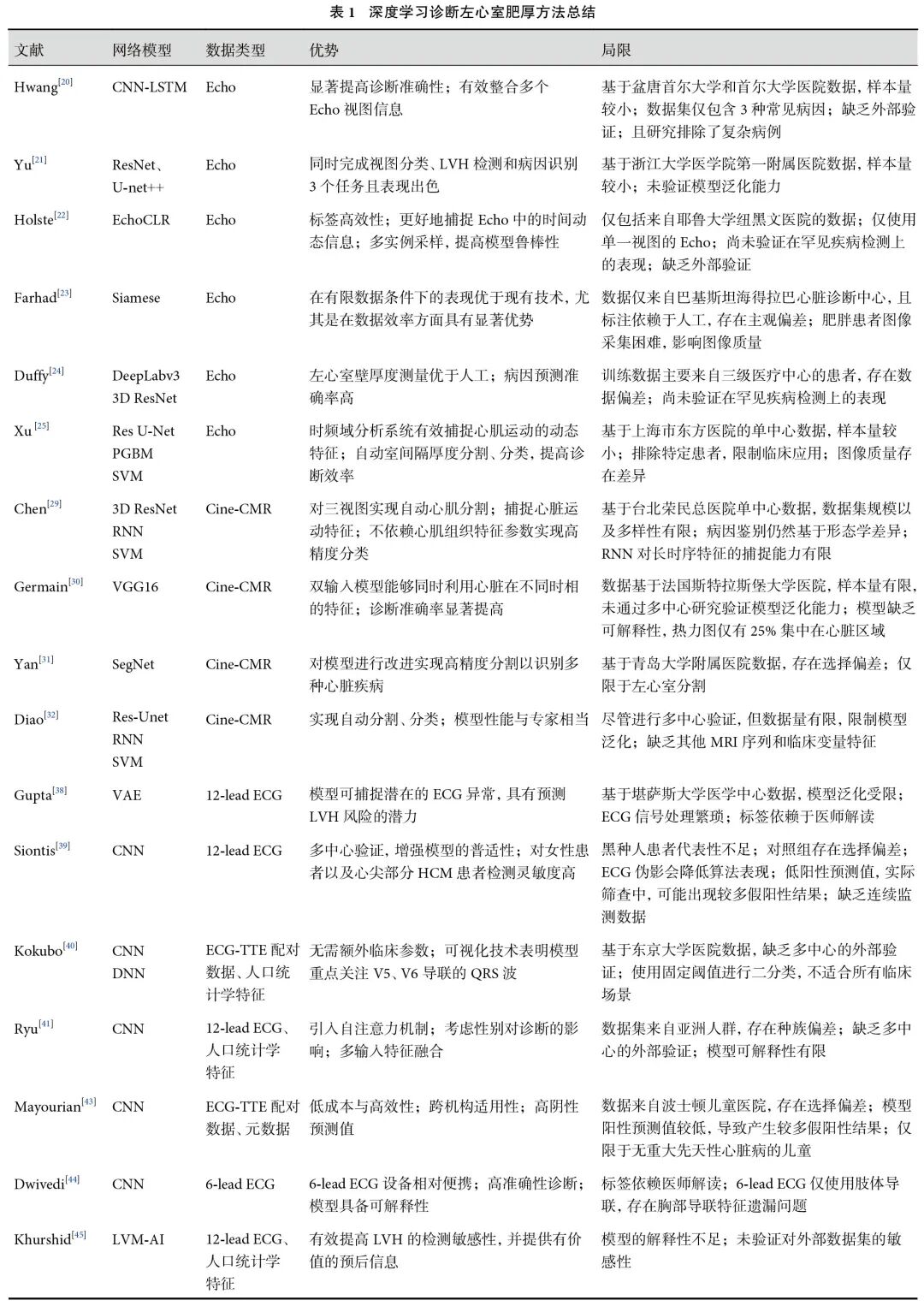
Echo是一种安全、无创的诊断方式,通过二维成像结合M型超声精准评估左心室壁厚度,诊断LVH的敏感性显著高于ECG和CXR,是目前诊断的金标准[19]。然而,其诊断结果依赖于医师经验,对于普通医师,诊断仍然存在困难。因此,开发辅助诊断系统来帮助医师识别LVH至关重要,Hwang等[20]提出的卷积神经网络(convolutional neural network,CNN)-长短期记忆网络(long-short term memory,LSTM)模型通过整合Echo的5个视图(PLAX、PSAX、A4C、A2C和A3C),结合CNN提取图像空间特征和LSTM捕捉心动周期的时间序列信息,实现了对HHD、HCM和心脏轻链型淀粉样变性的高效鉴别,测试集平均曲线下面积(area under the curve,AUC)分别达0.962、0.982和0.996,总体诊断准确率达到92.3%,显著超越专家80%的准确率。此类多模态数据整合策略在Yu等[21]的多任务框架中进一步优化,其基于ResNet和U-net++的模型通过融合PLAX与A4C视图特征,同步完成视图分类、LVH检测及病因识别3个任务,且AUC分别达到1.0、0.98和0.91。此外,Grad-CAM显示模型重点关注A4C视图中的心室区域,PLAX视图中的室间隔区域。针对数据标注成本高的挑战,Holste等[22]开发了自监督学习框架Echo CLR,通过对比学习和帧重排序任务预训练模型,利用无标注超声视频提取时序特征,微调后在LVH分类任务中AUC达0.723。同样在数据受限条件下,Farhad等[23]提出的Siamese网络则创新性地结合零样本学习与少样本学习,通过距离阈值分类策略,将诊断精度提升8%~11%,显著优化了医疗数据稀缺场景下的模型表现。在解剖学特征量化方面,Duffy等[24]利用临床医师标注的室间隔厚度、左心室内径等关键参数在PLAX图像上训练改进的DeepLabv3架构,结合3D Resnet-18分析A4C视频,预测CA和HCM的AUC分别达0.83和0.98。Xu等[25]首次引入心肌时频域分析,采用Res U-Net分割室间隔并提取静态和动态放射组学特征,通过逐点门控玻尔兹曼机(PGBM)融合时频域特征后,采用支持向量机(support vector machine,SVM)进行分类,模型在HCM与尿毒症性心肌病诊断中的AUC达0.91,揭示了心肌运动频域特征对病因鉴别的独特价值。
虽然深度学习在Echo辅助诊断LVH进展显著,但由于Echo结果依赖于医师经验以及设备性能,易导致数据偏差;其次,对于特殊患者群体的适用性受限,如肥胖、慢性阻塞性肺疾病或胸廓畸形的患者;再者,Echo检查成本高致使临床数据稀缺,公开数据匮乏,且现有多数研究基于单中心数据,使得模型泛化能力难以得到充分验证。未来需通过多中心数据整合扩大样本量,或融合其他临床数据特征来提升模型泛化能力。
2.2 联合心脏磁共振成像在左心室肥厚诊断中的应用
准确诊断LVH的难点在于区分HCM、AFD、CA等病因。Echo对心肌微观病变的敏感性有限,难以区分各种病因的特异性改变。相比之下,CMR能通过心肌组织参数来区分LVH[26],如T1 mapping[27]和细胞外容积(extracellular volume,ECV)mapping[28],其中AFD的T1值降低,CA的T1值和ECV会显著升高。但CMR在全球普及率低,且不同设备参数标准不一。因此,研究人员探索基于Cine-CMR的深度学习方案以弥补不足。Chen等[29]首次提出一种基于3D ResNet18架构的深度学习模型,该模型通过分析SAX视图的Cine-CMR动态序列,实现无需心肌组织参数的分类。首先,采用3D卷积核捕获心肌运动在时空维度上的动态特征;其次,通过多阶段训练策略优化模型对LVH形态学差异的敏感性;最后,结合注意力机制强化对心肌基底段特征的学习,在区分AFD与HCM时AUC值达到0.92,但该研究缺乏其他视图的特征信息。为有效融合多视图信息,Germain等[30]基于VGG16网络构建双通道输入框架,以Cine-CMR 3种视图2CH、4CH、SAX的舒张期和收缩期作为输入,通过CNN提取心脏动态运动的空间特征,并融合双分支特征进行二元分类。该设计突破了传统单时间点分析的局限,提高了对心肌收缩-舒张周期特征的捕捉能力。同时,模型准确率与AUC分别提升至82.5%和0.895。
对心脏结构进行有效分割,有助于诊断LVH并区分病因。Yan等[31]在传统SegNet基础上使用深度可分离卷积替代普通卷积,并引入金字塔池化增强模型对全局信息的感知能力,实现对SAX图像中心脏结构的高精度分割,以分类LVH、心肌梗死、心力衰竭。改进SegNet模型的灵敏度和特异度分别为0.889、0.965,Dice系数为0.878。此外,显著性映射表明模型识别区域为左心室边界和心肌区域,与临床医师经验一致,增强了模型的可解释性。在基于Cine-CMR的自动化诊断研究中,针对CA、HCM及HHD的诊断技术已取得阶段性进展,但仍面临3D空间信息与动态特征融合的挑战。Diao等[32]提出多通道全自动心肌分割和病因诊断框架,采用Res-Unet网络对CMR 3个视图2CH、4CH、SAX的感兴趣区域(ROI)进行全自动心肌分割,Dice系数达0.945,验证了模型对解剖结构的高效解析能力。在此基础上,通过循环神经网络(recurrent neural networks,RNN)提取心肌运动的时空形态特征,捕捉舒张期至收缩期的动态变化规律,从而模拟临床医师对心脏功能时序演变的评估逻辑。最后利用SVM整合结果,在外部测试集中总体分类准确率达77.4%,AUC达0.983。
当前深度学习通过CMR诊断LVH时,3D空间信息与动态时间序列的融合仍面临效率与精度不足的问题,未来应开发更高效的时空融合架构,如Transformer结合3D CNN[33],Transformer与RNN、LSTM相比,其在处理时间序列数据时具有更高的灵活性和准确性[34]。此外,对于不同设备的参数差异导致模型性能波动,可以开发基于域自适应[35]或联邦学习[36]算法,减少设备间差异对模型的影响。
2.3 联合心电图在左心室肥厚诊断中的应用
ECG作为一种安全、经济且便捷的筛查工具,在LVH诊断中具有广泛的应用前景。然而,传统的ECG诊断标准在实际应用中与真实LVH的匹配率较低,因此研究人员希望通过深度学习探索新的标准来提高诊断准确性[37]。首先,Gupta等[38]通过变分自编码器提取ECG特征,结合多种机器学习模型,显著提高LVH的诊断准确性。其中,基于ECG特征和变分自编码器潜在编码的LGBM模型表现最佳,AUC达0.790,表明基于机器学习的模型优于传统ECG诊断标准。Siontis等[39]在国际队列中检测HCM,使用CNN搭建AI-ECG模型,将10 s的12-lead ECG转换为12×5 000的矩阵,并通过CNN提取特征,输出ECG属于HCM患者的概率,模型AUC为0.922,表明模型能够有效区分HCM与其他病因引起的LVH。
针对单一ECG特征的表征局限性,Kokubo等[40]采用双分支模型集成多模态数据,CNN提取12-lead ECG时序特征,DNN整合患者人口统计学参数,并通过集成神经网络融合双分支特征,诊断LVD和LVH的AUC分别达到0.810和0.784,优于机器学习方法及传统ECG诊断标准。此外,Grad-CAM表明模型关注V5和V6导联的QRS波。Ryu等[41]同样将12-lead ECG特征与人口统计学参数进行多模态融合,提出名为CoAt-Mixer的架构,该架构融合自注意力机制与CNN的优势,构建多模态特征分析系统。研究显示不同性别群体在LVH预测模型中的响应特征存在显著统计学差异,为个性化诊断提供了新的技术路径。
此外,在个性化诊断领域,儿童ECG因右心室优势、QRS波群时限较窄、胸导联电压高等年龄依赖性特征[42],导致成人模型直接迁移时性能受限。Mayourian等[43]基于波士顿儿童医院92 377对ECG-Echo数据,构建了12-lead CNN模型。该模型在儿童LVH检测中的测试集平均AUC达0.86,阴性预测值均超过99%,表明其在高危病例筛查中具备临床实用性。对ECG特征分析显示,模型主要关注心前区QRS波和T波特征,其中外侧T波倒置(左心室功能障碍)、V1/V2深S波与V6高R波(LVH)、V4-V6高R波(左心室扩张)被识别为高危标志。
传统的LVH诊断依赖于12-lead ECG,而6-lead ECG在便携式设备中更为常见,具有更高的临床应用潜力。Dwivedi等[44]将6-lead ECG的中值搏动信号输入到DNN模型,通过CNN和ResNet自动提取ECG特征,最终AUC达0.92,接近12-lead DNN模型的表现。此外,ECG特征分析表明模型在检测任务中主要依赖于R波振幅和QRS波,与临床诊断标准一致,但相对而言,存在胸导联特征遗漏问题。
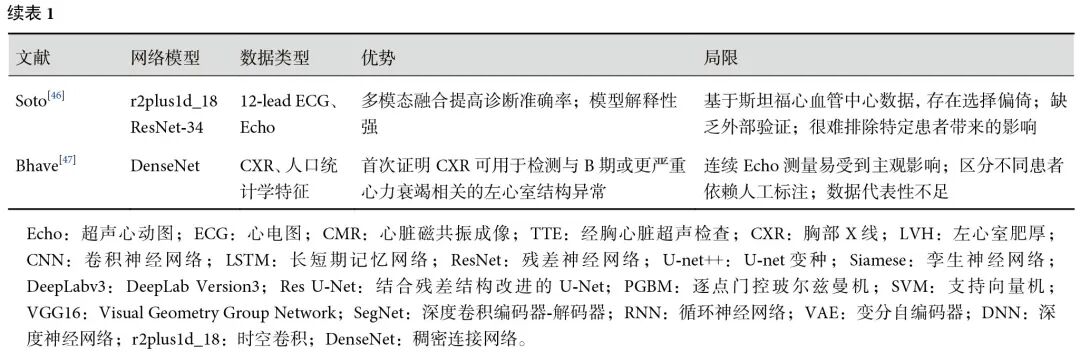
传统ECG诊断依赖医师标注,存在主观偏差,Khurshid等[45]使用CMR作为诊断的金标准,通过计算左心室质量指数为模型提供高质量标签。模型在UK Biobank测试集中揭示V5导联对LVH预测贡献度达97.4%,其关注区域与QRS波早期电活动高度相关。而Soto等[46]则使用电子健康记录(EHR)中的临床血压测量数据和HCM中心的诊断共识作为训练标签,避免医师标注的主观偏差。构建了双通道模型,使用ResNet-34提取ECG电生理特征,r2plus1d_18提取Echo形态学特征,通过晚期特征融合策略,模型特异性达到0.96。此外,SHAP可解释性分析进一步表明,模型决策依赖于ECG中V3导联及T波倒置、Echo中的室间隔厚度。
虽然ECG获取相对简单,但多数模型依赖CMR或Echo等金标准标注,患者需要满足同期内做过ECG和Echo或CMR检查才能作为训练样本,使得此类数据获取成本高且存在机构间差异,制约模型的泛化能力。
2.4 联合胸部X线在左心室肥厚诊断中的应用
最近的研究表明,深度学习可以通过Echo、CMR和ECG诊断LVH。然而,使用CXR检测心脏病理的方法有限。于是,Bhave等[47]开发了基于CXR的自动化检测工具,以检测与B期或更严重心力衰竭相关的LVH以及左心室扩张。同样使用Echo作为金标准,并与同期内的CXR配对,以生成高质量训练标签。模型使用DenseNet-121提取CXR图像特征,并在最后一层加入患者性别和年龄组合产生的单个数据向量,模型输出Echo测量值,包括室间隔舒张末期厚度、左心室舒张末期内径、左心室后壁舒张末期厚度,并基于测量值计算左心室肥厚、左心室扩张和复合标签的概率,其中平均AUC分别为0.79、0.80、0.80,实现了71%的灵敏度,模型性能优于放射科医师的表现。此外,LayerCAM表明模型的较浅层网络对心脏轮廓和左心室结构敏感,而较深层网络对心脏整体轮廓敏感。由此可知,探索CXR在LVH诊断中的应用同样具有临床意义。LVH诊断方法总结见表1。
3 深度学习在左心室肥厚预后中的应用
在LVH的预后中,深度学习通过整合多维度临床特征与影像参数,展现出精准风险分层的潜力。现有研究[48]表明,通过无监督聚类分析可识别不同临床表型,并对患者结局进行预测。其中,Loutati等[49]将左心室质量增加患者分为4类,与不同的临床结局显著相关。研究揭示了性别与合并症对预后的影响,合并症少的女性预后优于合并症多的男性。Allegra等[50]将包括AL型、ATTRv型、ATTRwt型以及未明确诊断为CA的患者队列分为7个聚类:聚类1主要包含AL-CA患者,其特征为低整体纵向应变和左心室射血分数以及低电压,预后较差;聚类2~4主要为ATTRwt型患者,具有不同的心血管风险因素和生化功能参数,预后差异显著,其中聚类2的患者预后最差,生存率仅为20%;ATTRv型患者均匀分布在聚类2~4和聚类6中,反映了不同TTR变体的表型差异;非CA患者则主要分布在聚类5~7中,其中聚类7的患者具有代谢性心脏病的特征,4年死亡率为31%。结果表明,LVH预后与CA类型、心血管风险因素和生化功能参数密切相关,不同聚类之间的预后差异显著。
Hwang等[51]使用AI自动测量ECV来改善预后,在AL-CA患者中显示出显著的预后能力。研究[52]表明,ECV≥40%的患者发生心血管死亡和心力衰竭住院的风险显著增加(校正HR=4.247,P=0.024)。即使使用重新修订的Mayo分期,ECV的预后价值仍然显著(校正HR=6.324,P=0.004)。同时,将ECV与Mayo分期系统结合,能够显著改善AL-CA患者的风险分层。ECV≥40%且处于Mayo分期Ⅳ期的患者预后最差,而ECV<40%且处于Mayo分期Ⅲ期的患者预后最好。
对于异质性较大的患者群体,未来可以继续探索机器学习在心血管疾病风险分层中的应用,同时引入深度学习技术来改善预后,推动个体化预后模型的构建。
4 总结与展望
深度学习逐渐应用到LVH辅助诊断和预后中,并展现出显著优势,不仅提升了诊断的准确性和效率,而且为个性化治疗和风险分层提供了新的工具。然而,其广泛应用仍面临数据质量、模型泛化能力、临床验证和计算资源等挑战。未来的研究应重点放在:(1)多中心数据集的构建:为有效解决数据匮乏、模型泛化能力差的问题,应该促进医院、研究机构之间的数据共享,构建多中心的LVH数据集,可以结合区块链技术[53]来创建和管理患者的各项临床数据,同时确保数据的准确性、完整性和隐私性,这对于LVH患者的长期管理和跟踪至关重要。并通过联邦学习技术,在保护患者隐私的前提下,利用多中心数据训练模型,提高模型的泛化能力。
(2)融合多模态数据特征:影像数据、基因组数据和临床数据等多模态信息在LVH诊断中提供丰富的特征,涵盖心脏结构、功能、遗传背景和临床表型等多个方面[54]。通过整合这些多模态信息,可以显著提高LVH的诊断准确性、病因鉴别能力和预后评估水平,为患者提供更精准的个性化诊疗方案。未来,随着深度学习技术的发展,多模态数据的融合将进一步推动LVH的早期筛查和精准医疗[55]。
(3)应用于实际生活:单导联ECG设备结合深度学习算法已展现出在可穿戴设备中筛查LVH的潜力。Sato等[56]证实此类模型能有效识别早期心脏结构异常,为动态监测提供新路径。同步采集PCG与ECG的可穿戴设备可全面评估心脏电机械活动,吴丹等[57]通过logistic回归分析发现,经心动周期校正的电-机械耦联时间和第四心音是LVH的独立预测因子,这一发现为可穿戴设备的无创风险评估提供了定量化参数支持。
(4)革新LVH的研究范式:将深度学习与全基因组关联研究(GWAS)进行有效结合,用以解析复杂心血管表型。Yuan等[58]采用全卷积神经网络分割CMR的SAX图像,量化心尖部和室间隔质量,实现大规模图像的高通量分析,解决了传统方法难以精准量化区域性肥厚的问题。通过对总LVH、心尖部质量、室间隔质量分别进行GWAS及多基因风险评分,最终揭示心尖肥厚的独特遗传机制,未来可探索潜在的LVH相关基因。
总之,推动深度学习在LVH中的进一步研究,可以提高早期筛查效率与准确性;优化多模态数据整合,有利于LVH病因鉴别,同时改善风险分层与预后评估。此外,将深度学习应用于可穿戴设备可实现LVH无创风险评估以及动态检测。另外,未来可以将深度学习与基因分析相结合,揭示LVH潜在病理基因。


