中医现代化典范!西北大学重磅发现:人参皂苷Rk1三管齐下,同时降脂肪、抗氧化、抑炎症,逆转NAFLD!
时间:2025-09-25 15:49:21 热度:37.1℃ 作者:网络
非酒精性脂肪性肝病(NAFLD)已从“富贵病”跃升为全球最常见的慢性肝病。中国成人患病率在十余年间由18%飙升至29%,预计2030年患者规模将突破3.14亿,届时NAFLD极可能取代酒精性肝病成为肝移植的首位病因。与肥胖、胰岛素抵抗、2型糖尿病互为因果的NAFLD,其核心病理环节是肝脏脂滴过度沉积、氧化应激爆发及慢性炎症持续放大。当前,美国FDA仅批准甲状腺激素受体-β激动剂resmetirom用于中晚期NASH,但腹泻、瘙痒等不良反应限制了长期应用;生活方式干预虽被指南视为基石,却面临“减重易、守成难”的现实困境。
中医药历来强调“治未病”与“整体调态”,人参皂苷Rk1作为红参在蒸制过程中产生的稀有皂苷,已被证实具有抗炎、抗氧化、降血糖、调血脂等多重活性,却尚未被系统评估对NAFLD的干预价值。
西北大学范代娣、屈琳琳团队新近发表于《Food Research International》的研究,首次揭示Rk1通过靶向脂肪酸转位酶CD36,继而重塑AMPK信号网络,可在西方饮食诱导的小鼠模型中显著阻断NAFLD进程,为临床提供了一条“天然、多靶、安全”的新思路。

图1 论文首图
Rk1对西方饮食诱导的小鼠非酒精性脂肪性肝病(NAFLD)的影响
研究采用与人类饮食模式高度吻合的西式高脂高糖果粮(WD)喂养C57BL/6雄性小鼠16周,于第8周开始每日灌胃Rk1(60 mg/kg·d或120 mg/kg·d)。结果令人振奋:Rk1显著抑制WD引起的体重飙升,高剂量组小鼠16周末体重较模型组下降约12%,BMI、肝脏指数及附睾脂肪系数同步回落;糖耐量与胰岛素耐量曲线面积分别缩小28%与33%,提示全身胰岛素敏感性得到快速修复。与此同时,血清ALT、AST水平下降40%以上,提示肝细胞损伤明显减轻;肝脏TG、TC、游离脂肪酸含量分别下降47%、38%与31%,直观印证了Rk1对“肝肥”现象的遏制效能。更可喜的是,Rk1未引起食欲下降或精神萎靡,提示其在整体代谢稳态的维护上具有良好安全性。
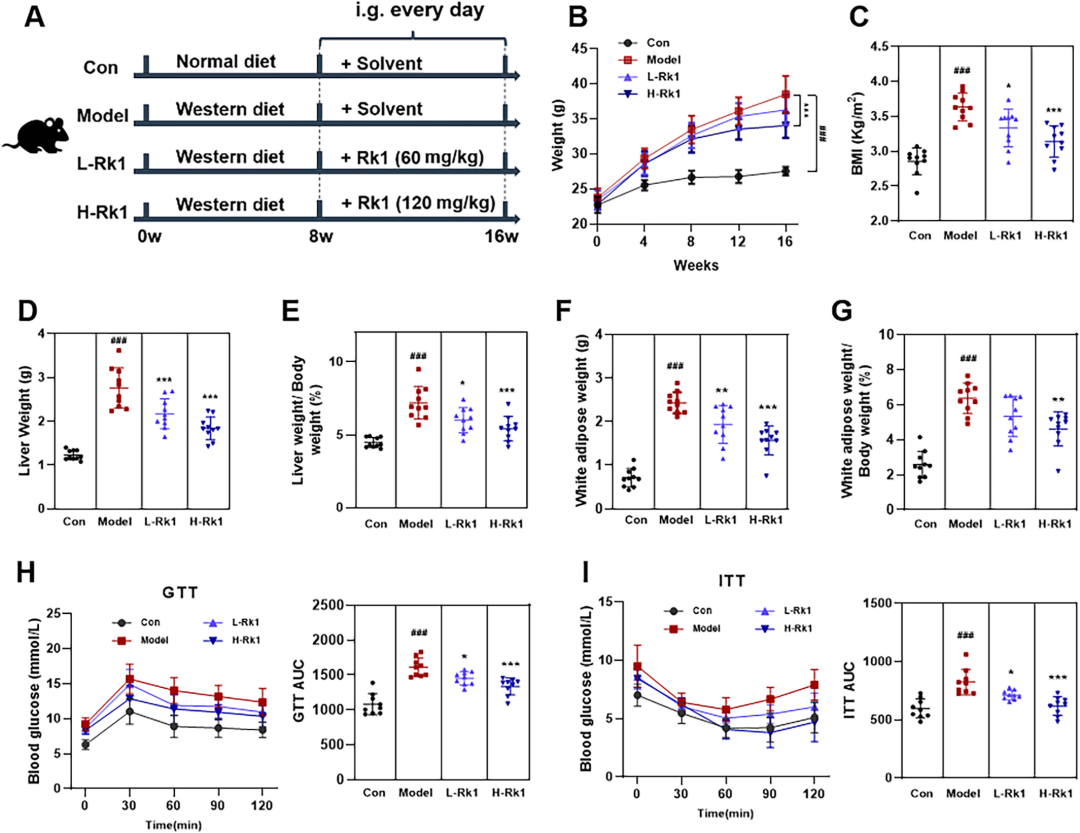
图2 Rk1对西方饮食诱导的小鼠非酒精性脂肪性肝病(NAFLD)的影响
Rk1减轻NAFLD小鼠的肝损伤和脂质积累
病理层面,模型组H&E染色可见大量脂滴空泡、小叶内炎症灶及气球样变;油红O染色提示脂滴占肝面积超过45%。Rk1干预后脂滴面积骤降至15%以下,炎症灶几近消失,肝小叶结构恢复清晰。免疫组化及ELISA进一步证实,Rk1使IL-1β、TNF-α、IL-6等促炎细胞因子的蛋白与mRNA水平平均下降50%以上。透射电镜下,模型组线粒体肿胀、嵴断裂,而Rk1组线粒体形态趋于正常,提示脂质过载与氧化损伤被同步遏制。上述结果从组织、细胞、亚细胞三个维度共同说明:Rk1不仅能“减肥”,更能“保肝”。
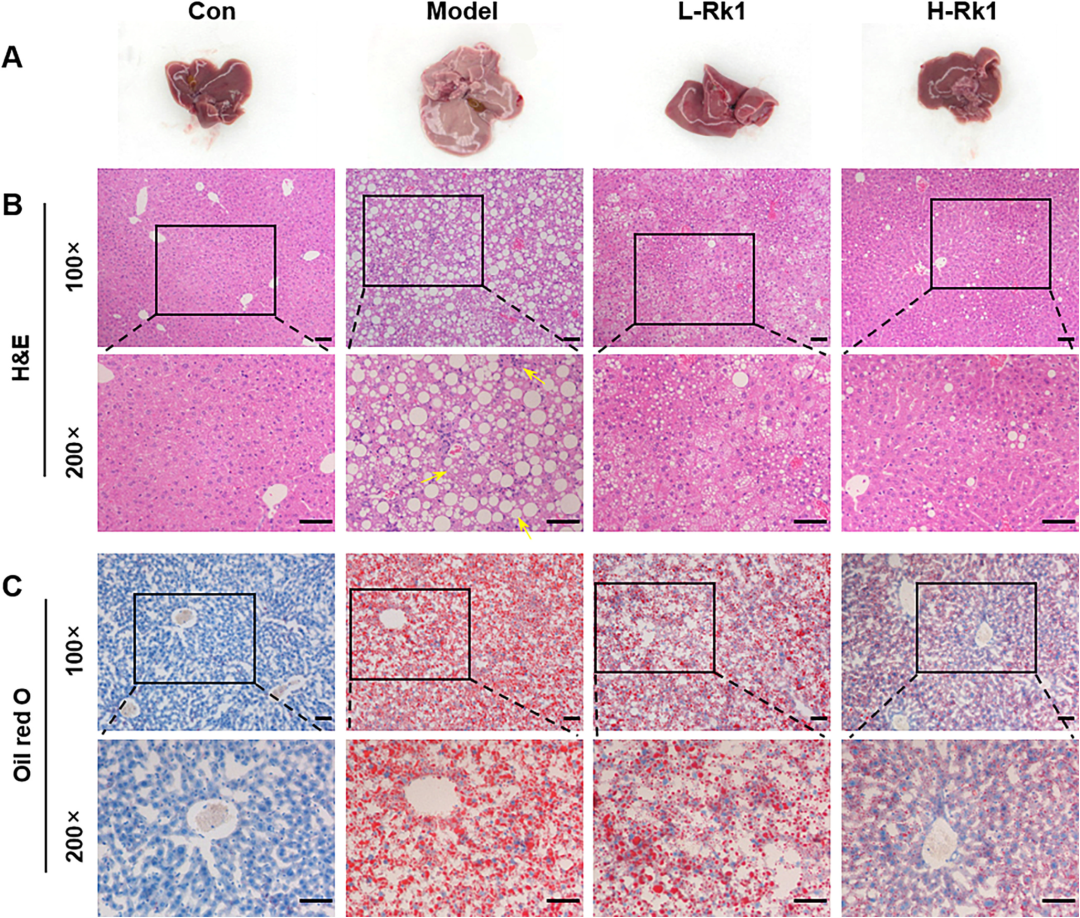
图3 Rk1减轻NAFLD小鼠的肝损伤和脂质积累
Rk1缓解NAFLD的关键靶点的转录组分析
为探明Rk1作用的分子地图,作者对肝脏样本进行高通量RNA-seq。与模型组相比,Rk1组共筛选出351个显著差异表达基因(DEGs),其中271个下调、80个上调。GO与KEGG富集分析显示,这些基因密集分布于“脂肪酸代谢”“PPAR信号通路”“TNF-α信号”“趋化因子-受体互作”等条目。蛋白互作网络(PPI)拓扑分析锁定CD36、PPARγ、CCL2等10个关键节点。尤为重要的是,CD36在NAFLD患者肝组织中呈高表达,并被证实是AMPK上游的“门户”分子,其过度活化会促进脂肪酸内流、抑制AMPK磷酸化,进而激活NF-κB、SREBP1c等下游通路。转录组结果提示Rk1可能通过“擒贼先擒王”式地抑制CD36,从而重塑整个脂质-炎症-氧化应激网络。
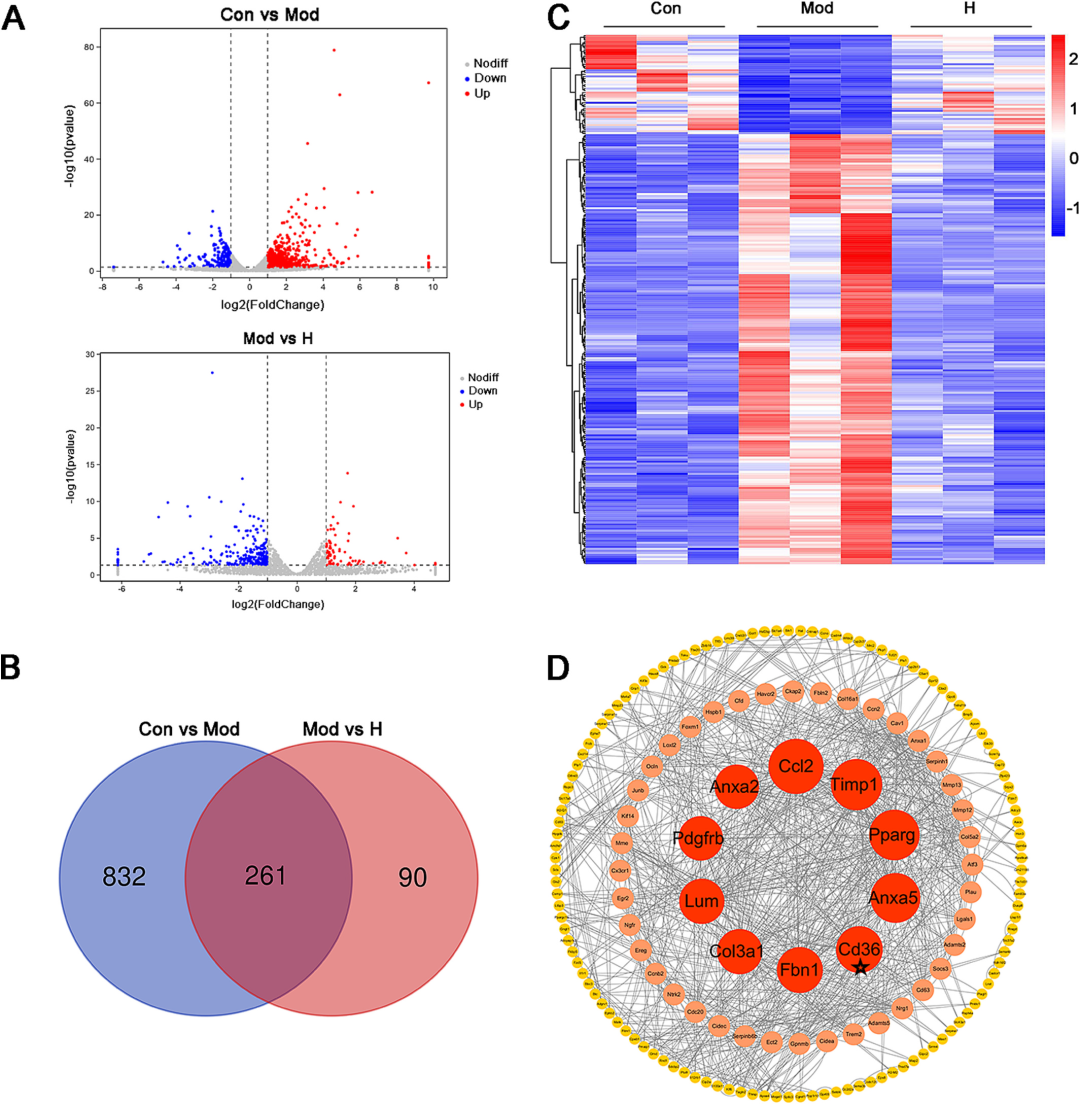
图4 Rk1缓解NAFLD的关键靶点的转录组分析
Rk1通过CD36/AMPK信号通路缓解NAFLD
随后,多重实验验证了“CD36-AMPK轴”假说。免疫荧光共定位显示,模型组CD36绿色荧光显著增强,伴随p-AMPK红色信号明显减弱;Rk1则逆转这一失衡,使两者荧光强度回归正常比例。Western blot定量结果同步证实:Rk1以剂量依赖方式抑制CD36蛋白表达,同时恢复AMPK Thr172位点磷酸化水平。下游分子方面,Rk1显著降低mTORC1、SREBP1c、FASN、ACC1、SCD1等脂质合成关键蛋白表达,上调FOXO1、SIRT1等抗氧化/抗炎因子水平,提示AMPK重新掌控肝脏能量代谢与炎症平衡。分子对接进一步显示,Rk1可与CD36胞外结构域Cys333、Glu335等残基形成氢键与疏水口袋,结合能低至-8.2 kcal/mol,说明二者可稳定结合,从而阻断CD36对脂肪酸的过量摄取,从源头上解除AMPK抑制。
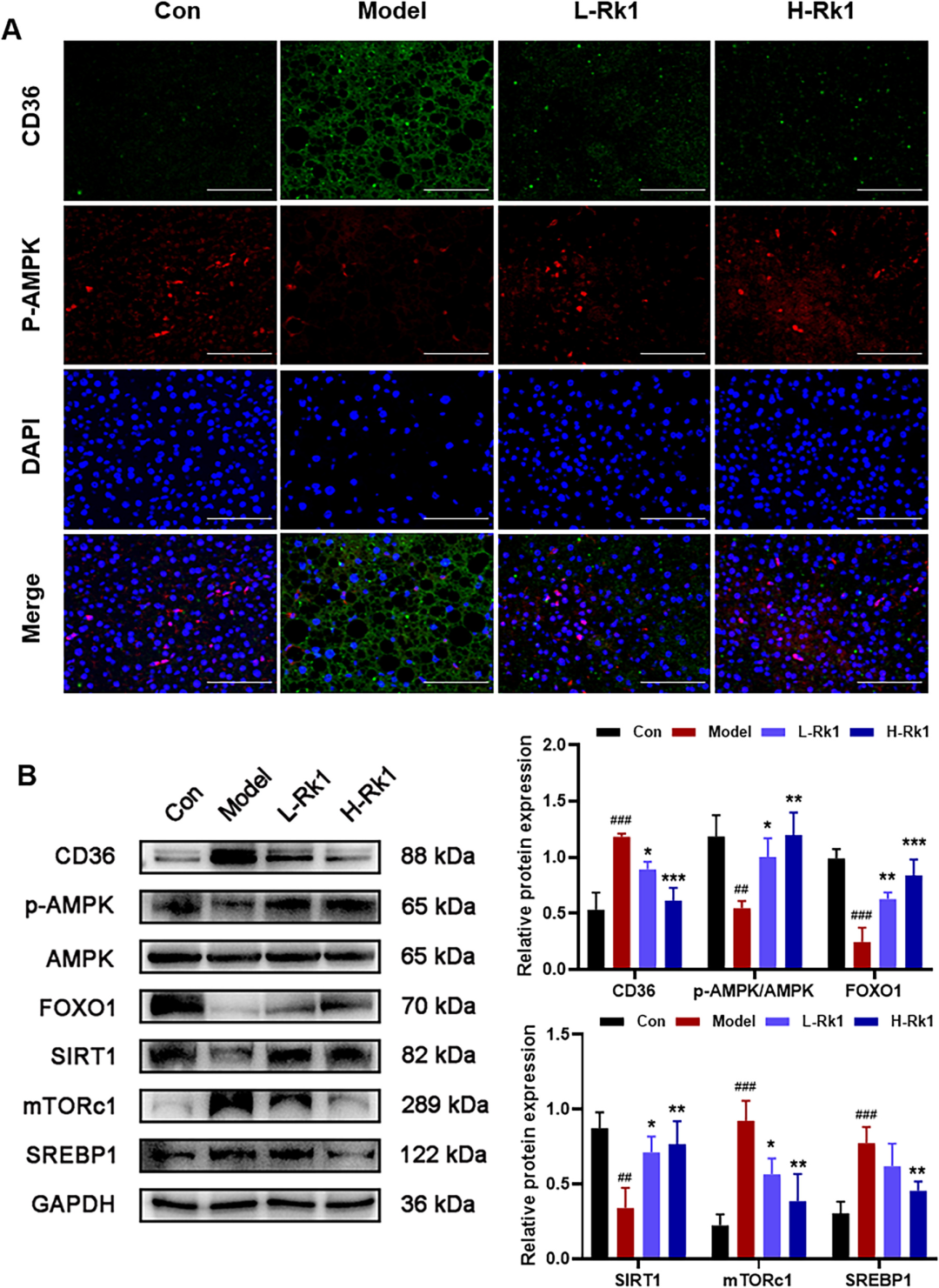
图5 Rk1通过CD36/AMPK信号通路缓解NAFLD
Rk1减少NAFLD诱导的小鼠肝脏炎症和氧化应激
慢性炎症是NAFLD向NASH乃至纤维化的“点火器”。研究证实,Rk1显著下调NF-κB经典通路中的p-IKKβ、p-p65,上调抑制蛋白IκBα,从而阻断炎症级联。实时荧光定量PCR及ELISA结果同步显示,Rk1使趋化因子CCL2、CCL5、CXCL2、CXCL10表达降低40%~60%,血清及肝组织IL-6、TNF-α、IL-1β同步回落。免疫组化图片直观可见IL-1β、TNF-α阳性区域由片状浓染变为散在淡染,提示炎症细胞浸润被显著遏制。此外,Rk1对巨噬细胞极化亦有调节:M1型标志iNOS下降、M2型标志Arg-1升高,提示肝脏免疫微环境由“促炎”向“抗炎”转变。
氧化应激是脂质过载后的“二次打击”。DHE荧光探针显示,模型组ROS荧光强度较对照组增加3倍,而Rk1处理使其降至1.4倍。抗氧化系统方面,Rk1显著提升SOD、CAT、GSH活性,降低脂质过氧化产物MDA及氧化型谷胱甘肽GSSG水平,同时抑制CYP2E1过表达。Nrf2/HO-1通路检测亦发现,Rk1促进Nrf2核转位并上调HO-1、NQO1等下游基因,提示其激活细胞自身抗氧化防御网,从而阻断ROS对肝细胞DNA、线粒体及细胞膜的进一步损伤。
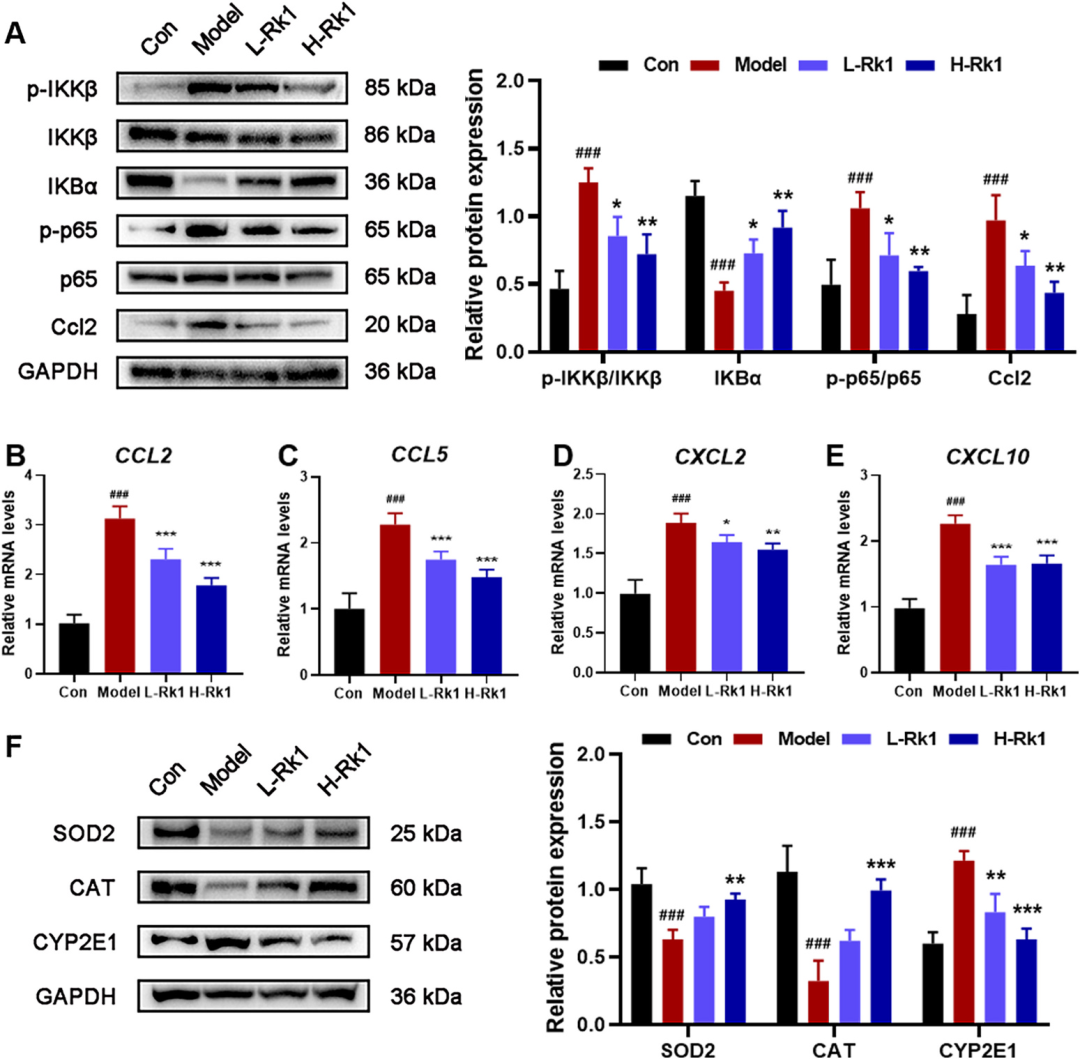
图6Rk1减少NAFLD诱导的小鼠肝脏炎症
Rk1调控NAFLD小鼠肝脏的脂质代谢
脂质代谢重编程是NAFLD的核心特征。Rk1显著下调PPARγ、SREBP1c及其靶基因FASN、ACC1、SCD1,抑制新生脂肪合成;同时上调脂肪酸β-氧化关键基因ACADL、ACADM、CPT1A,促进脂滴分解。油红O染色与生化指标相互印证:Rk1组肝脏TG、TC、游离脂肪酸全面回落,血清酮体水平升高,提示“进少出多”的脂质代谢新平衡得以建立。有趣的是,Rk1对胆固醇代谢亦有调节:HMGCR表达下降伴随胆汁酸合成限速酶CYP7A1上升,提示肝脏胆固醇向胆汁酸转化加速,有利于“脂毒”排出。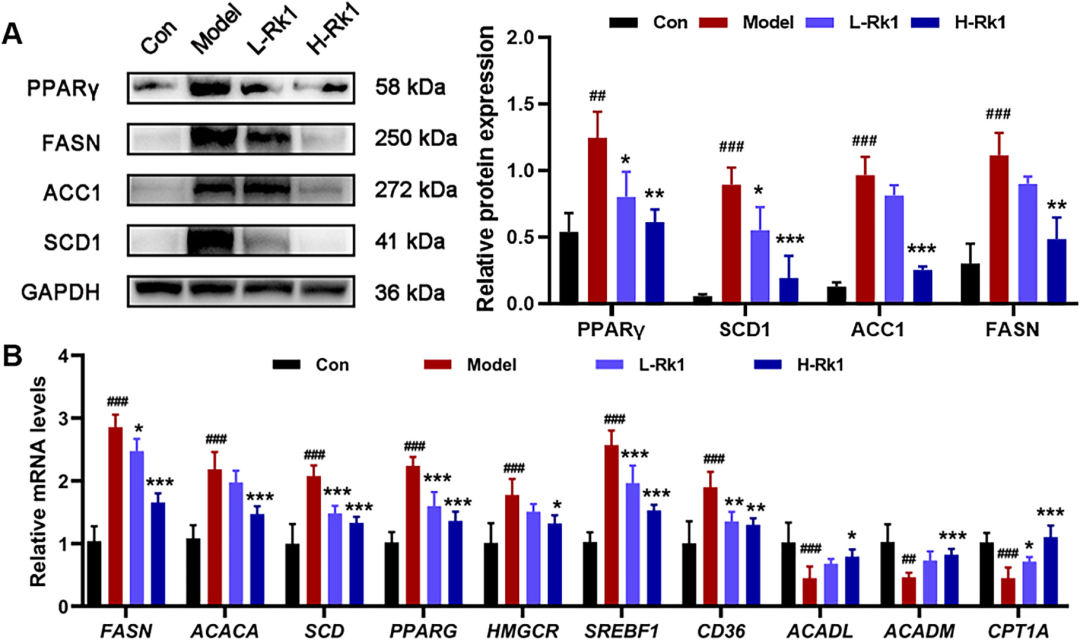
图7 Rk1调控NAFLD小鼠肝脏的脂质代谢
Rk1靶向CD36以调控脂质积累细胞模型中p-AMPK的水平
为进一步验证“CD36-AMPK”轴的细胞学意义,作者在棕榈酸诱导的HepG2脂肪变性模型中开展救援实验。结果显示,0.4 mM PA刺激使CD36表达升高2.5倍,p-AMPK降低60%,脂质沉积明显;Rk1(20~40 μM)可剂量依赖性地逆转上述变化。当使用siRNA敲低CD36后,即使无Rk1,p-AMPK亦显著回升,提示CD36对AMPK具有负向调控作用;而Rk1与CD36 siRNA联合处理组p-AMPK水平最高,表明二者可协同增效。分子对接再次佐证,Rk1与CD36的结合位点恰是脂肪酸结合口袋,阻断底物进入,从而解除CD36对AMPK的抑制。该细胞实验不仅复现了动物水平结论,也为后续临床转化提供了体外药效学依据。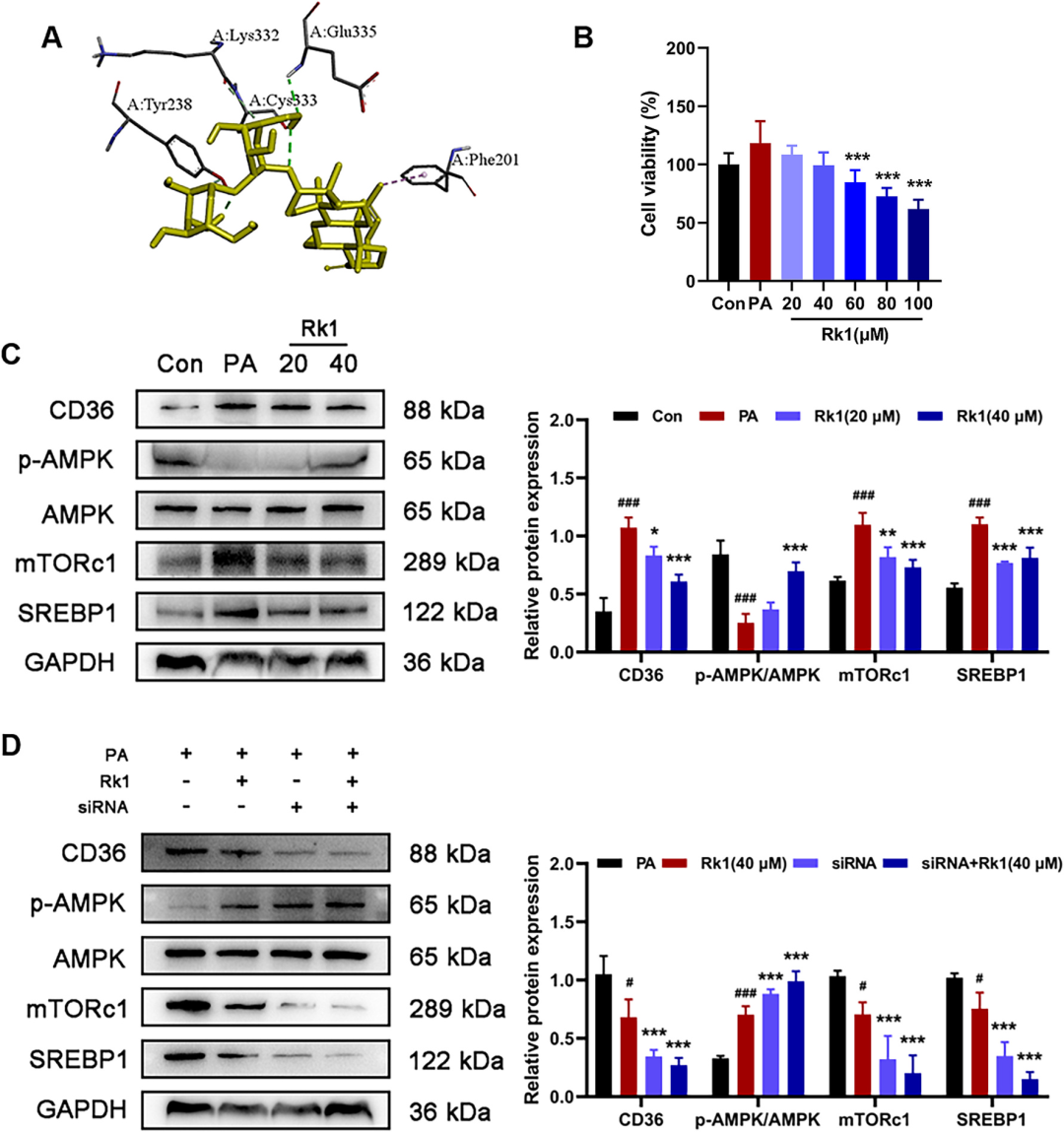
图8 Rk1靶向CD36以调控脂质积累细胞模型中p-AMPK的水平
小结
综上所述,人参皂苷Rk1以“擒王-通络-复衡”的三步策略,靶向CD36/AMPK轴,同步干预脂质沉积、炎症风暴与氧化应激三大病理环节,在西方饮食诱导的小鼠NAFLD模型中展现出显著且安全的防治潜力。相较于现有化学药物,Rk1来源于药食同源的红参,长期服用安全窗宽;其多靶协同特性亦契合中医“整体观”与“治未病”理念。未来,团队将进一步开展临床前毒理、药代动力学及早期临床试验,以期为日益庞大的NAFLD人群提供一条“源自本草、守正创新”的新路径。
参考文献:
Wu Y, Duan Z, Qu L, Liu Y, Ma X, Fan D. Ginsenoside Rk1 Ameliorates Non-Alcoholic Fatty Liver Disease by Targeting CD36 to Modulate the AMPK Signaling Pathway. Food Res Int. 2025 Jun;211:116426. doi: 10.1016/j.foodres.2025.116426. Epub 2025 Apr 17. PMID: 40356178.


