吉林大学口腔医院王林教授《Biomaterials》:三重响应纳米酶+益生菌,实现牙周炎精准抗菌
时间:2025-09-26 12:11:16 热度:37.1℃ 作者:网络
牙周炎是一种高发的口腔慢性疾病,不仅导致牙龈红肿、牙齿松动,还可能危及全身健康。传统抗菌疗法往往受限于复杂的口腔微环境:细菌生物膜层层保护,药物难以有效渗透,且纳米酶在体内pH和温度条件下催化效率低,难以发挥理想作用。
针对这一挑战,吉林大学口腔医院王林教授团队联合中科院上海药物研究所程震研究员提出了一种全新的三重响应纳米酶平台(AgAu–CeO₂与益生菌复合体系,简称 AgAu C-L)。研究成果以“A triple-responsive nanozyme platform of AgAu–CeO₂ heterojunction integrated with probiotics for precision antibacterial therapy in periodontitis”为题,发表在最新一期《Biomaterials》上,第一作者为吉林大学博士研究生李美琪,高丽大学博士研究生丁启航为共同一作。

三重调控:让纳米酶“活”起来
AgAu C-L平台通过三种机制显著增强纳米酶活性:
光热调控:银-金纳米笼在近红外光照射下快速升温,提升CeO₂酶催化效率;
电子转移:AgAu–CeO₂异质结促进电荷高效分离,加速Ce³⁺/Ce⁴⁺循环;
益生菌pH优化:乳酸杆菌代谢产酸,主动调节局部环境酸度,使酶活性保持在最佳范围。
这种“三管齐下”的策略使纳米酶在体内复杂环境中依然高效发挥作用。
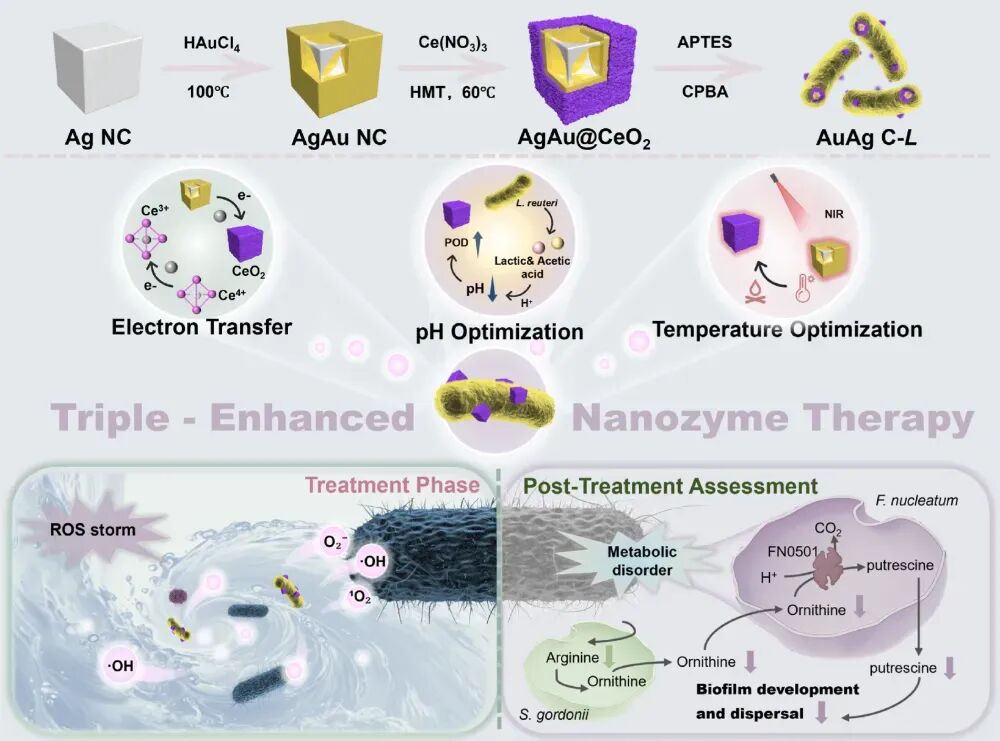
图 1 | AgAu C-L的设计思路:光热调控 + 电子转移 + 益生菌pH优化,三重协同提升纳米酶活性
“ROS风暴”:精准打击牙周致病菌
三重增强下的纳米酶催化活性显著提升,能够在炎症部位瞬时爆发ROS(活性氧风暴)。
ROS可破坏细菌代谢通路,瓦解生物膜;
特别针对牙周炎“关键桥梁菌”——Fusobacterium nucleatum,AgAu C-L有效抑制其代谢网络,阻断多菌群协同;
最终实现精准、持久的抗菌效果。
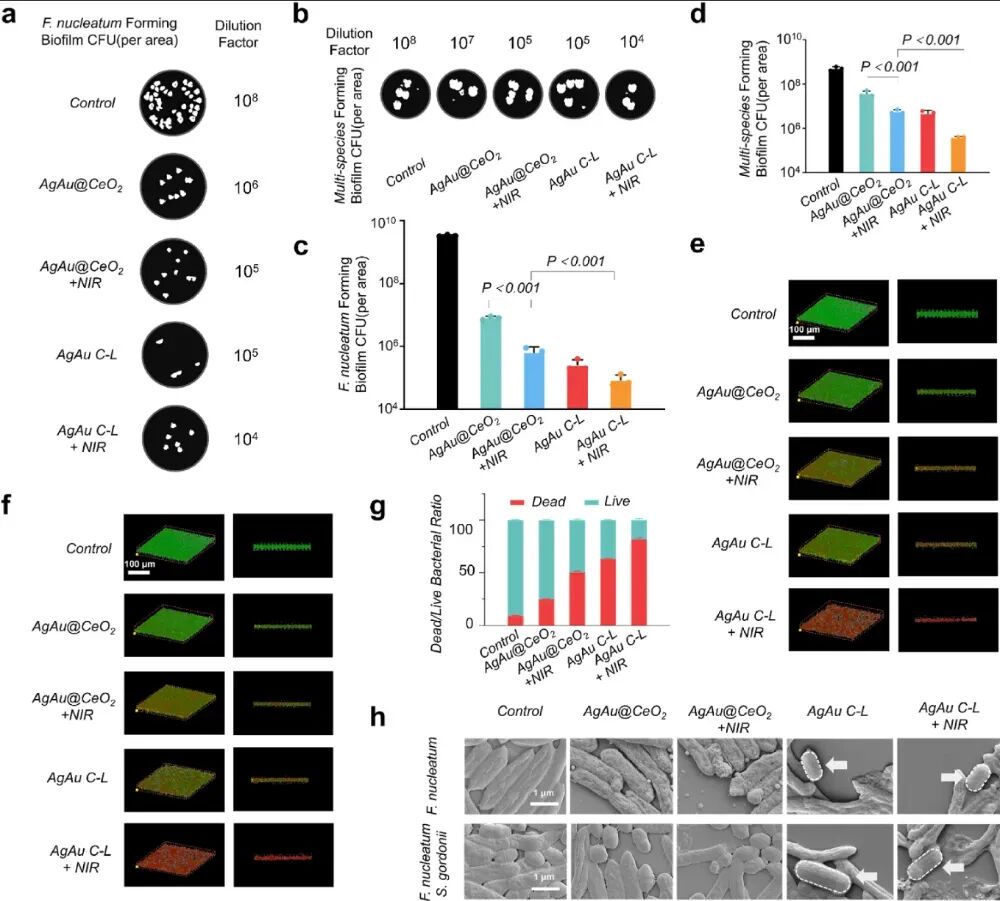
图 2 | 不同材料处理下的细菌状态:AgAu C-L + NIR 组实现最高的杀菌率,生物膜被显著破坏
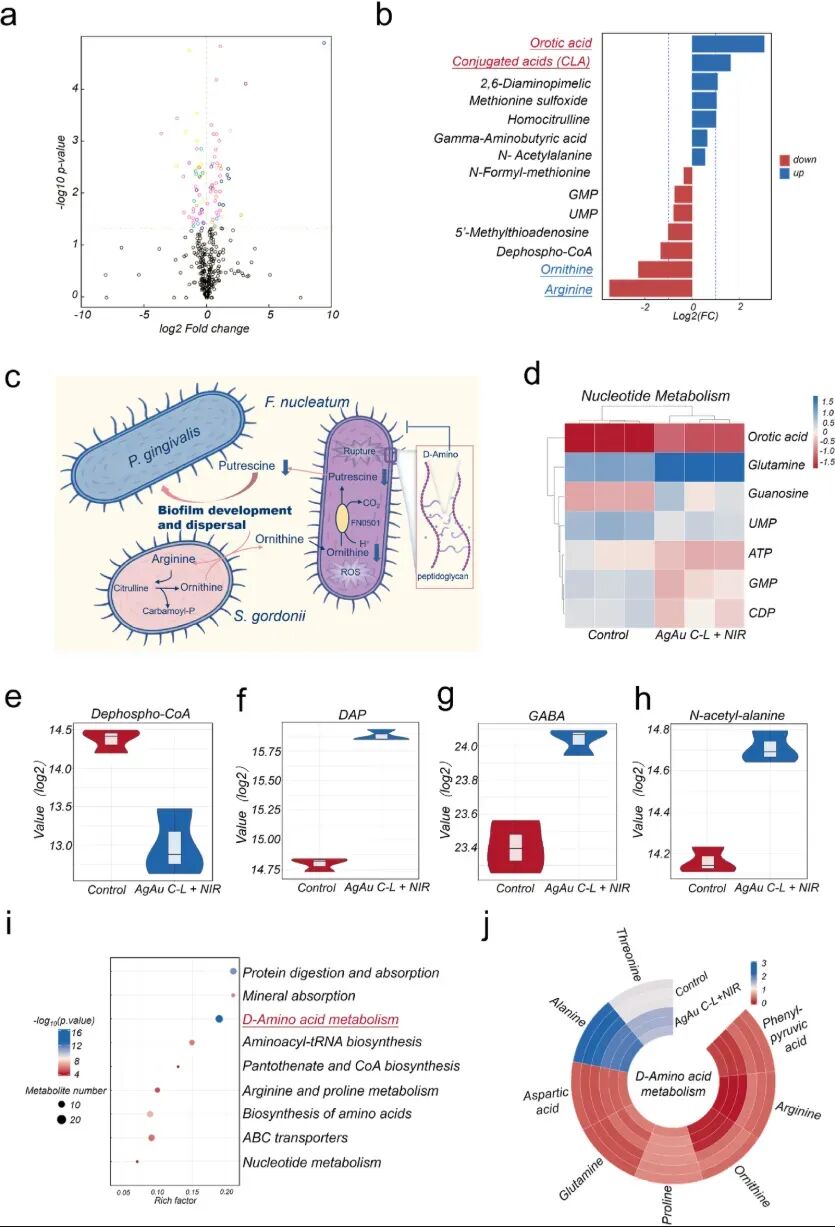
图 3 | 代谢组学揭示AgAu C-L + NIR的作用机制:处理后F. nucleatum的关键代谢物显著改变(a-b),涉及核苷酸代谢、氨基酸代谢等多条通路(d, i, j);特别是精氨酸-鸟氨酸-腐胺通路被破坏(c),导致生物膜形成受阻。差异代谢物如Dephospho-CoA、DAP、GABA和N-乙酰丙氨酸的变化进一步证实了这一机制(e-h)。
动物实验证明疗效
在牙周炎大鼠模型中,AgAu C-L + 近红外光治疗展现了显著疗效:
细菌负荷减少:致病菌数量下降近3个数量级;
炎症缓解:牙龈红肿大幅改善,免疫因子水平恢复正常;
骨组织保护:显著抑制牙槽骨吸收,组织修复接近健康水平。
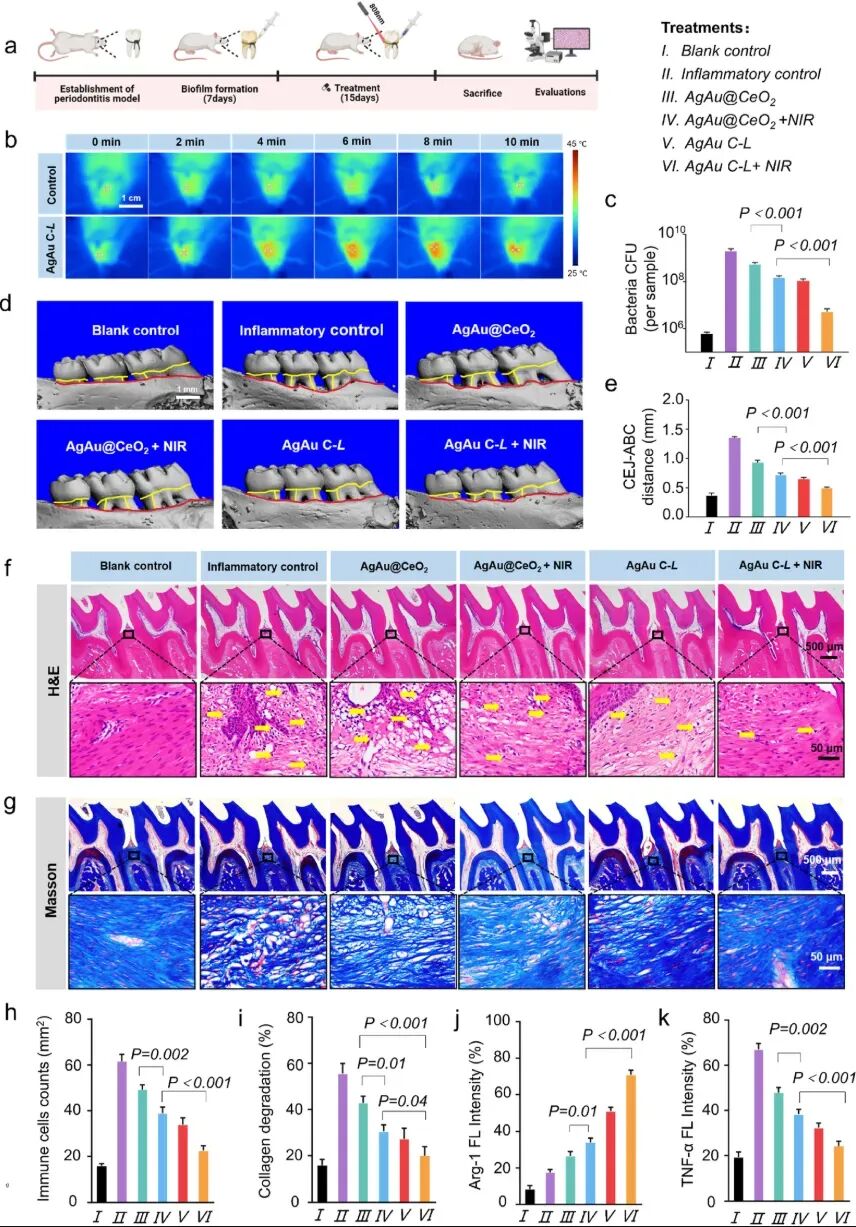
图 4 | 大鼠牙周炎模型治疗效果:AgAu C-L + NIR 组表现出最佳的抗菌和骨组织保护效果
总结与展望
AgAu C-L技术不仅解决了纳米酶在生理环境中“活不起来”的难题,还结合益生菌实现了“微环境自调控”,为精准口腔医学带来新思路。未来,这一平台有望推广至更多感染性疾病的治疗,开辟纳米酶临床应用的新篇章。
原文链接:
https://www.sciencedirect.com/unsupported_browser


