急性髓系白血病免疫治疗的现状、挑战、新兴策略与未来方向
时间:2025-09-26 12:10:37 热度:37.1℃ 作者:网络
免疫治疗在急性髓系白血病(AML)中的临床疗效仍然受到早期复发和治疗相关毒性的显著限制。华中科技大学同济医学院附属同济医院隗佳教授及山西白求恩医院王涛教授等近日于《Chinese Journal of Cancer Research》发表综述,探讨了基于抗体和细胞的AML免疫治疗的最新进展,重点关注已确立的靶点(CD33、CD123和CLL1)以及新兴靶点(包括CD7、CD70、CD38和FLT3),讨论的治疗方式包括免疫偶联物、双特异性T细胞衔接器和嵌合抗原受体T(CAR-T)细胞。此外还总结了当前阻碍AML免疫治疗成功的主要挑战,并提出了提高其疗效的策略,包括联合疗法、CAR结构的优化、CAR-T细胞的功能增强、新靶点的识别以及下一代细胞疗法的开发。总之,这些方法旨在为改善AML的免疫治疗效果提供新的见解。

引言
急性髓系白血病(AML)是一种高度侵袭性的血液恶性肿瘤,预后不良。发病率约为每10万人4.3例,诊断时的中位年龄为68岁。尽管有治疗选择,但五年总生存率仍不足30%。AML的特点是显著的遗传异质性,超过97%的病例存在体细胞突变。常见的驱动基因突变,如核仁磷酸蛋白(NPM1)、Fms样酪氨酸激酶3配体(FLT3)和肿瘤蛋白53(TP53),有助于骨髓内髓系祖细胞的克隆性扩增和分化受损,这种分子复杂性是该疾病侵袭性临床行为和治疗反应变异性的基础。大约40%–60%的患者对标准化疗难治,超过一半的病例会复发,复发患者长期生存率低于10%。
目前来说,AML治疗主要依赖于强化化疗和异基因造血干细胞移植(HSCT)。尽管靶向药物(如BCL2、FLT3和IDH1/2抑制剂)为某些患者亚群带来了新的希望,但约75%的患者最终会复发,10%–40%表现出原发性或获得性耐药。此外,当前的治疗方案在老年人(占AML病例的大多数)中通常耐受性差。对于复发或难治性(R/R)AML患者,仍缺乏有效的挽救治疗,凸显出对新型治疗策略的迫切需求。
包括基于抗体的方法 [例如,单克隆抗体、抗体-药物偶联物(ADCs)和双特异性T细胞衔接器(BITEs)] 和基于细胞的疗法(如CAR-T细胞)在内的免疫治疗已经彻底改变了血液恶性肿瘤的治疗格局。然而它们在AML中的临床应用仍然受到疗效欠佳和显著安全性问题的限制。这些限制主要归因于AML细胞与正常造血干细胞(HSCs)之间抗原表达的显著重叠、白血病细胞的显著异质性以及骨髓微环境的免疫抑制特性。
本综述对AML的当代免疫治疗靶点进行了全面分析,评估了基于抗体和细胞的治疗策略的最新进展,并重点介绍了应对现有挑战的新兴研究驱动解决方案。这些见解旨在为开发更安全、更有效的AML免疫治疗方法提供信息。
基于抗体的治疗
目前正在研究广泛的AML免疫治疗靶点,其中CD33、CD123和C型凝集素样分子-1(CLL1,也为CLEC12A)是研究最广泛的抗原(图1)。
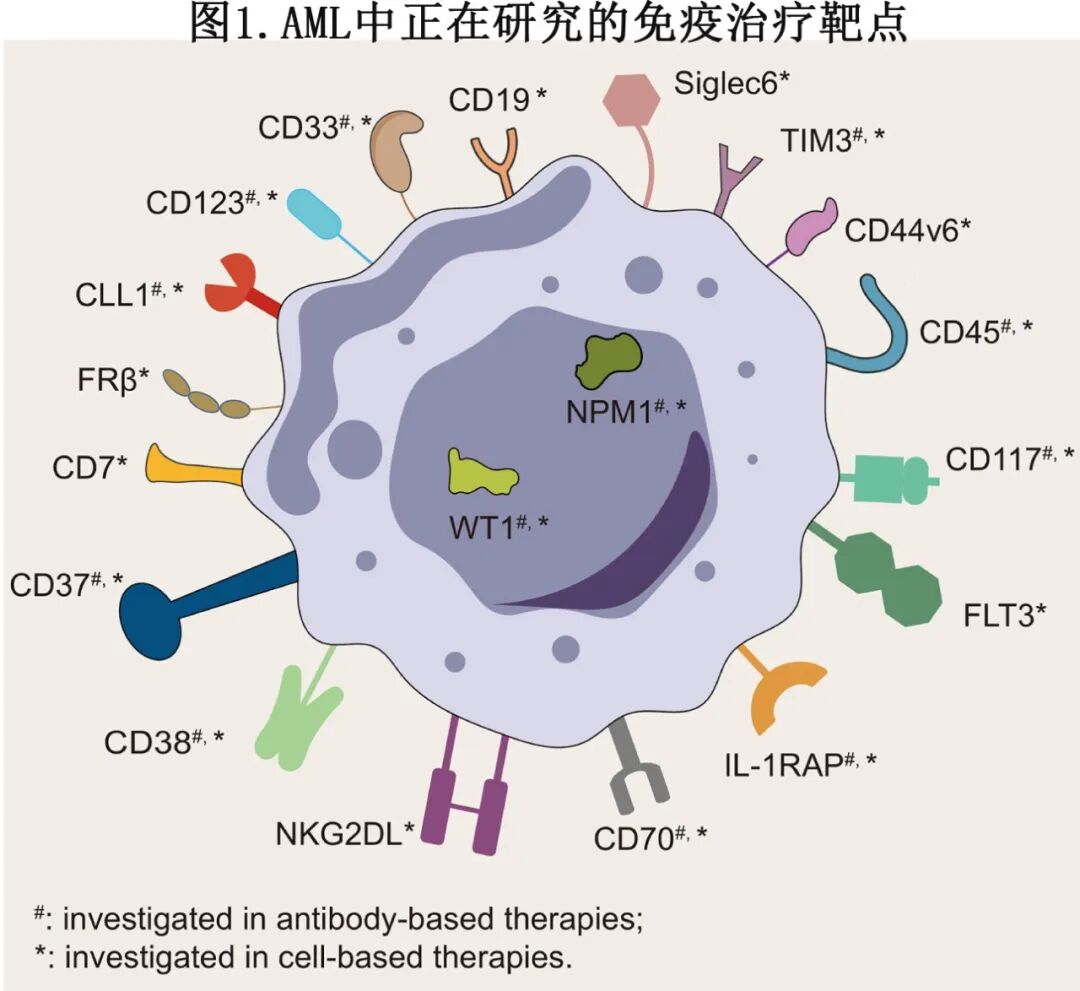
CD33在超过90%的AML原始细胞以及正常髓系细胞和造血干祖细胞(HSPCs)中表达。Gemtuzumab ozogamicin(GO)是一种由抗CD33单克隆抗体与细胞毒性药物卡奇霉素连接组成的抗体-药物偶联物,已获批用于治疗R/R AML(表1)。在首次复发的患者中,GO显示出约33%的复合完全缓解(CRc)率 [定义为完全缓解(CR)或血细胞计数不完全恢复的完全缓解(CRi)],并且可以安全地与标准诱导化疗联合使用。值得注意的是,它在具有良好细胞遗传学的患者中也获得显著的生存获益。其他靶向CD33的开发中的其他ADC包括Lintuzumab-Ac225,该药与CLAG-M方案联合用于R/R AML时显示出良好的耐受性,达到57%的CRc率。
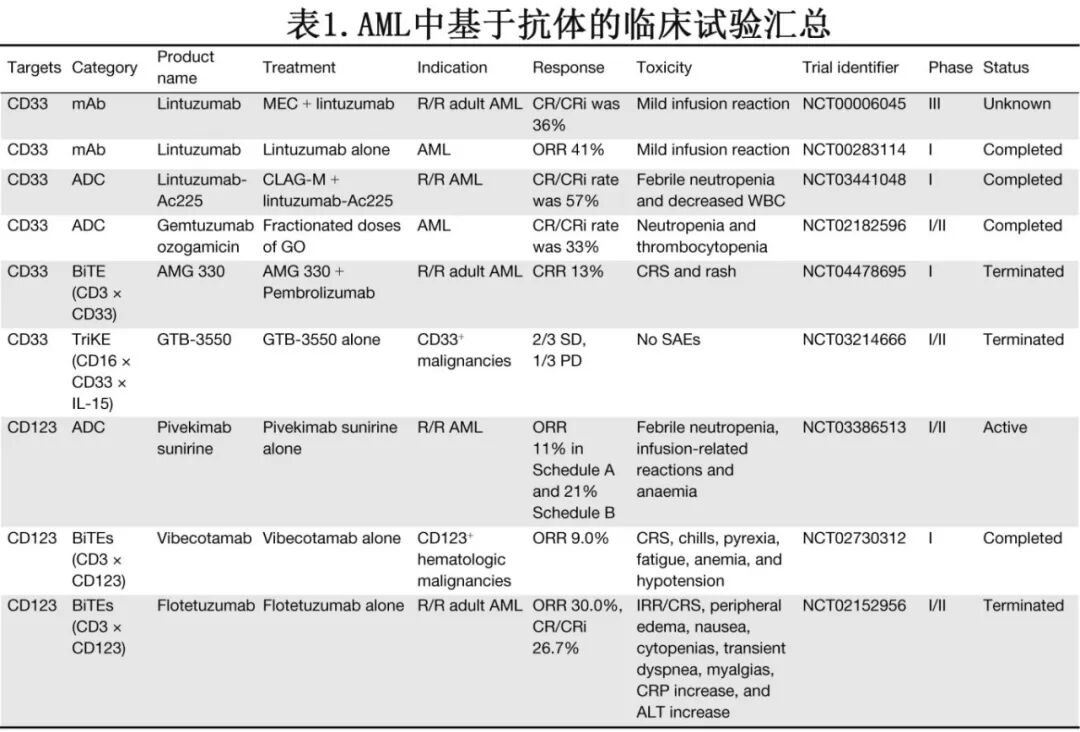
尽管CD123和CLL1在AML细胞上的表达水平通常低于CD33,但它们在正常HSPCs上的表达极少。然而CD123也在内皮细胞上表达,并且在母细胞性浆细胞样树突状细胞肿瘤(BPDCN,一种罕见且侵袭性的白血病亚型)中显著上调。这些独特的表达谱显著影响靶向这些抗原的免疫治疗的安全性。Pivekimab sunirine(IMGN632)是一种靶向CD123的ADC,在BPDCN中显示出特别有前景的疗效,在R/R AML中也显示出令人鼓舞的单药活性。与化疗的联合方案正在研究中;然而已有治疗相关不良事件的报道,如发热性中性粒细胞减少。
双特异性抗体可以通过重新激活患者的免疫监视系统来发挥抗肿瘤作用。几种靶向AML的双特异性抗体目前正在开发中,包括AMG 330(CD3 × CD33)、Vibecotamab(CD3 × CD123)、Flotetuzumab(CD3 × CD123)和MCLA-117(CD3 × CLL1)。这些药物已显示出不同程度的临床疗效,尽管其有效性常常受到半衰期短和毒性高等挑战的阻碍。此外,靶向自然杀伤(NK)细胞的三特异性抗体正在研究中。诸如SAR443579(CD123 × NKp46 × CD16)和GTB-3550 TriKE(CD16 × CD33 × IL-15)等药物在促进NK细胞活化和增殖方面显示出前景,早期研究表明其在高危骨髓增生异常综合征(MDS)和R/R AML中具有潜在的安全性和有效性。
基于细胞的治疗
已确立的靶点
在一项早期临床试验(NCT03126864)中,三名R/R AML患者接受自体CD33 CAR-T细胞治疗。未观察到临床反应,所有患者都经历了严重不良事件,包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)、肿瘤溶解综合征和肝功能障碍(表2)。为了提高安全性,Jacob Appelbaum等开发了一种雷帕霉素调控的CD33 CAR-T系统,并启动了一项临床试验(NCT05105152)。这些药物诱导型CAR-T细胞表现出与常规CAR-T细胞相当的抗肿瘤活性和药代动力学特征,同时允许在停用雷帕霉素时实现可逆失活,从而增强了安全性。
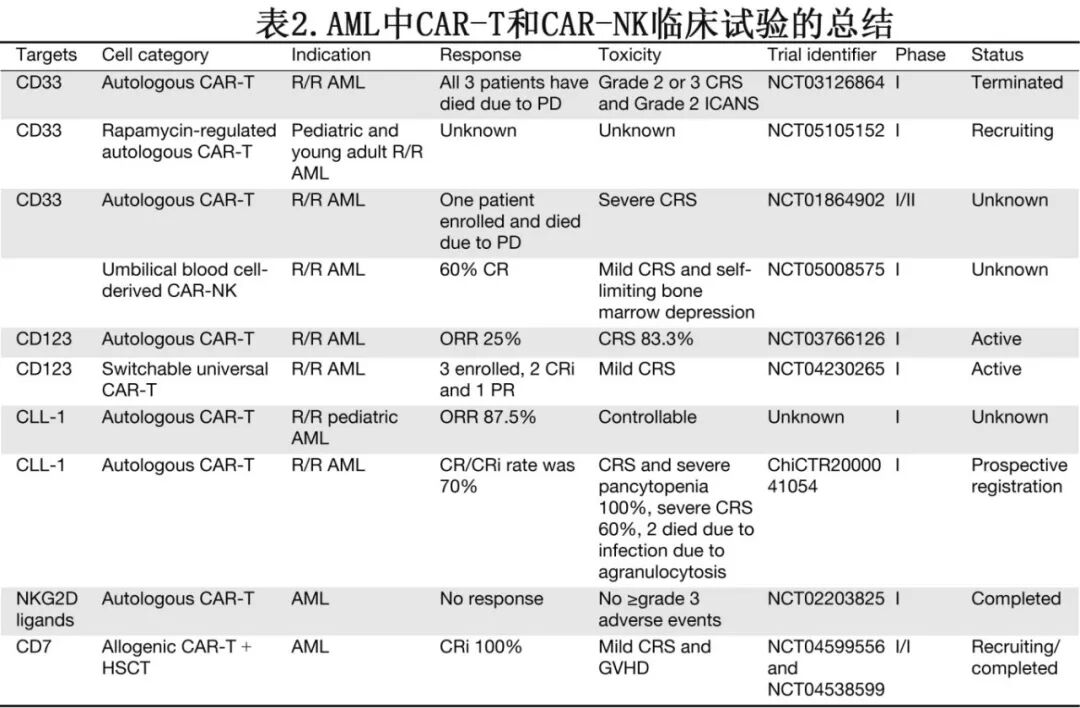
CD123 CAR-T细胞疗法在AML和BPDCN中均显示出初步疗效,但安全性问题仍然是一个重要的限制因素。在一项纳入12名R/R AML成年患者的首次人体临床试验(NCT03766126)中,三名患者实现临床缓解;但发生了两起治疗相关死亡事件,并且83.3%的受试者报告了CRS。与CD19 CAR-T细胞疗法相比,CD123 CAR-T细胞可能通过不同的机制失效。血清中细胞因子如白细胞介素-3(IL-3)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)和FLT3配体水平的升高与髓系白血病细胞存活率增加、治疗耐药性以及T细胞耗竭的促进有关。
靶向CLL1的CAR-T细胞疗法已显示出令人鼓舞的早期结果。在一项I/II期试验中,八名R/R AML儿科患者中有七名获得缓解,未报告≥3级CRS病例。在成年患者中,CR或CRi率达到70%。然而,60%的病例发生了高级别CRS,所有患者都出现了严重的全血细胞减少,两名患者因长期粒细胞缺乏继发感染而死亡。此外,CLL1 CAR-T细胞疗法在髓外疾病患者和仅有骨髓浸润患者中显示出相当的总生存期、无进展生存期和缓解持续时间。
鉴于AML显著的抗原异质性,正在探索靶向CD33、CD123和CLL1的组合策略,以减轻抗原逃逸的风险。然而,这些多抗原方法也可能增加累积毒性的风险,需要谨慎考虑疗效与安全性之间的平衡。
新兴靶点
约30%的AML病例中表达CD7。在一项临床研究(NCT04938115)中,使用基于纳米抗体的、自然选择的CD7 CAR-T细胞进行治疗。入组的10名患者中,有7名(70%)达到CR。然而有两名患者死于非复发相关原因,三名未接受桥接移植的患者在90天内复。为了增强治疗的持久性和降低毒性,Hu等人提出了一种“一体化(“all-in-one)”策略,序贯CD7 CAR-T细胞治疗与HSCT。该方法旨在避免药物清髓或移植物抗宿主病(GVHD)预防的需要,同时巩固抗白血病疗效并恢复因CAR-T相关毒性而受损的造血功能。
异常的CD19膜表达是伴有t(8;21)的AML的一个显著特征,与稳定的染色质状态和异常的PAX5活性有关。在这一亚群中,CD19 CAR-T细胞疗法可能提供治疗获益。Danylesko等人进行了一项临床研究(NCT04257175),在六名具有异常CD19表达的R/R AML患者中使用CD19 CAR-T细胞。四名患者达到CR,而两名患者出现疾病进展(PD)。Yin等人也报告了一项前瞻性试验(NCT03896854)的结果,该试验中所有10名入组患者均达到CR,其中6名达到分子学可测量残留病(MRD)阴性状态,中位总生存期(OS)和无白血病生存期分别为11.6个月和3.8个月(40)。这些发现表明CD19 CAR-T细胞在该AML亚型中具有潜在疗效。
CD70在正常组织中表达极低,但在AML细胞中上调。尚无关于CD70 CAR-T细胞疗法在AML中的临床试验数据发表。临床前研究表明,使用CD70的天然配体CD27设计的CAR-T细胞显示出增强的增殖能力和强大的抗肿瘤活性,且对HSCs无毒性。然而真实世界数据表明,原发性AML原始细胞上的CD70表达具有异质性,可能会限制治疗效果。在某些临床前模型中,CD70 CAR-T细胞的表现低于预期。
CD38在各种血液恶性肿瘤中广泛表达,并在超过50%的AML病例中存在。一项临床试验(NCT04351022)表明,靶向CD38的CAR-T细胞疗法可以诱导异基因HSCT后复发患者达到CR,且毒性可控。然而,尽管有初始反应,约一半患者在六个月内复发。
FLT3是一种在正常HSPCs和AML原始细胞上表达的跨膜受体,约25%-30%的新发AML患者携带FLT3突变,特别是FLT3内部串联重复(FLT3-ITD),且与不良预后相关。Jetani等人开发了FLT3 CAR-T细胞,该细胞对野生型和FLT3-ITD突变的AML细胞均表现出强大的细胞毒性。然而,相关的造血毒性需要通过HSCT进行后续挽救。为了提高安全性,Sommer等人设计了具有“关闭开关(off-switch)”机制的FLT3 CAR-T细胞。在临床前模型中,CAR-T细胞的清除允许造血恢复,而不影响抗白血病疗效。尽管在临床前研究中显示出前景,但由于缺乏大规模临床试验,这些靶点的安全性和有效性在人体中仍未得到证实。进一步的研究对于验证其临床适用性至关重要。
疗效的障碍
尽管已经确定了多个有前景的靶点,但免疫治疗在AML中的临床疗效仍然欠佳。即使在CD33、CD123和CLL1等特征明确的靶点中,复发和治疗相关毒性仍然是重大的临床障碍。这些挑战主要源于肿瘤异质性、免疫抑制微环境以及许多免疫治疗方法固有的on-target, off-tumor毒性。
肿瘤异质性
AML肿瘤细胞在基因组、转录组和表观遗传水平上表现出显著的异质性,导致治疗反应不一,并为免疫治疗靶点的选择带来重大挑战。依赖单一抗原的免疫治疗特别容易受到抗原逃逸的影响,因为某些亚克隆可能在治疗压力下迅速扩增,导致疾病复发。尽管二代测序(NGS)的进展促进了AML中关键驱动突变和潜在治疗靶点的识别,但精确识别并同时靶向个体患者中的主要致病克隆仍是关键挑战。解决这个问题需要开发多组学和多靶点的精准策略,以设计适合个体患者独特疾病特征的免疫疗法。
免疫抑制性微环境
AML中的骨髓微环境通过多种机制建立起强大的免疫抑制屏障,显著限制了免疫治疗的疗效。化疗和疾病本身都会减少免疫细胞的数量并损害其功能,显著削弱关键效应群体(包括T细胞和NK细胞)的抗肿瘤活性。肿瘤细胞及其微环境分泌丰富的免疫抑制因子,如转化生长因子-β(TGF-β)、白细胞介素-10(IL-10)、精氨酸酶II和吲哚胺2,3-双加氧酶(IDO),进一步加剧了这一挑战。这些因子不仅抑制CAR-T细胞的增殖和细胞毒功能,还促进免疫抑制细胞亚群(包括调节性T细胞[Tregs]和髓源性抑制细胞[MDSCs])的扩增,从而进一步削弱免疫治疗效果。
此外,AML微环境的物理成分(包括缺氧、酸中毒和异常的骨髓基质结构)也有助于免疫抑制。在缺氧条件下,AML细胞上调缺氧诱导因子1-α(HIF-1α)信号通路,增加乳酸的产生并导致局部酸性微环境的形成。这种酸中毒损害T细胞功能并破坏CAR-T细胞的代谢适应力,最终降低其持久性和细胞毒性潜力。
On-target off-tumor毒性
严重毒性是AML免疫治疗应用中的重大安全问题。经典靶点如CD33、CD123和CLL1在白血病细胞上高表达,但在不同程度上也存在于正常髓系祖细胞和某些非造血组织中。这种抗原重叠是靶向肿瘤外毒性的基础,可能导致显著的不良反应,包括骨髓抑制、中性粒细胞减少、贫血和血小板减少。这些毒性损害造血恢复,并增加感染和出血的风险。在严重且不可逆的造血损伤情况下,即使是支持治疗或HSCT也可能无法恢复稳态,从而严重损害患者的生活质量和生存结局。
改善策略
为了克服与AML免疫治疗相关的挑战,研究人员提出了一系列战略性方法。这些方法包括联合治疗方案、CAR设计的工程学进展、CAR-T细胞的功能增强、新靶点抗原的识别以及下一代细胞疗法的开发。
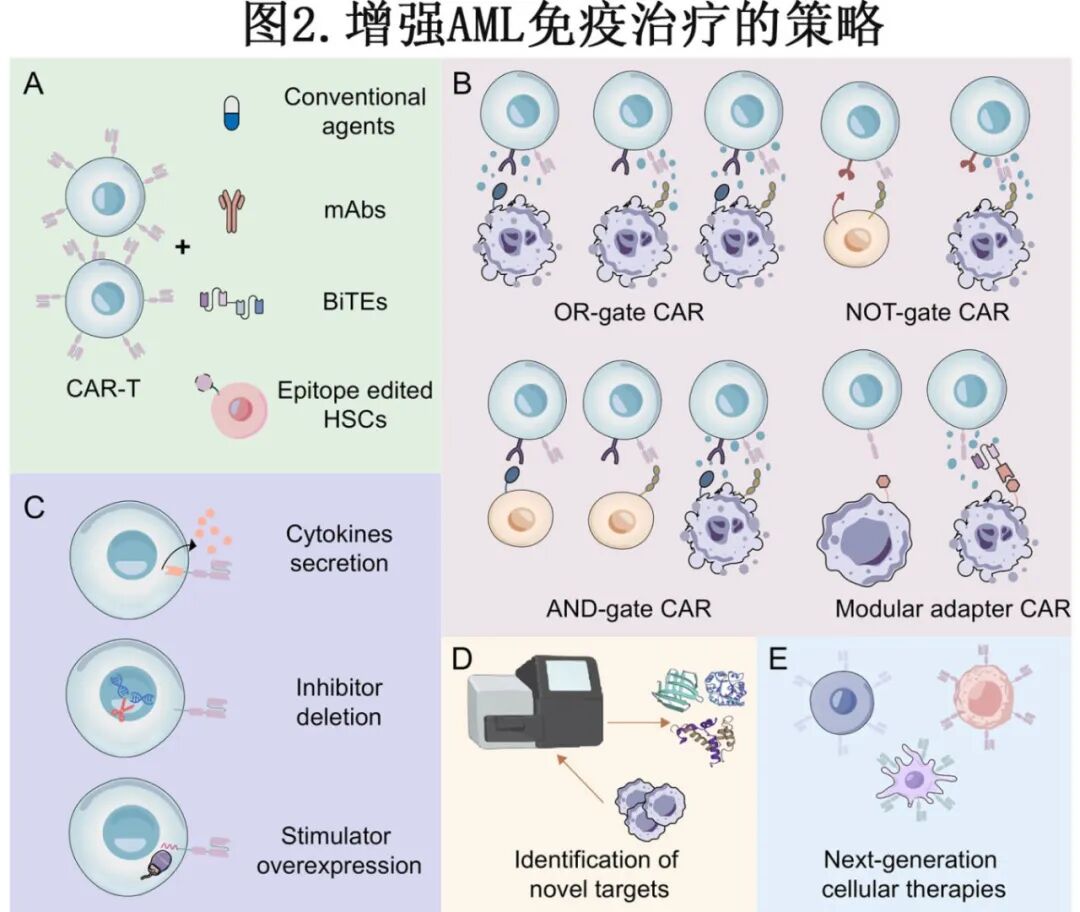
联合疗法
常规治疗方式可能增强免疫治疗的疗效和安全性(图2A)。某些化疗药物不仅能清除白血病原始细胞,还能上调肿瘤抗原或减轻CAR-T细胞耗竭,从而间接增强抗体或CAR-T介导的细胞毒性。表观遗传调节剂如地西他滨和西达本胺已被证明可上调AML细胞上的CD70表达。与之类似,FLT3抑制剂Crenolanib可增强FLT3表达,从而提高白血病细胞对FLT3靶向CAR-T治疗的敏感性。这些药物可能通过调节抗原可用性来增强CAR-T细胞的识别和抗肿瘤功效。
AML中的代谢重编程和改变的细胞代谢有助于形成免疫抑制微环境,损害CAR-T细胞的存活和功能,因此针对这些通路中特定代谢物或关键酶的代谢疗法具有增强CAR-T细胞功效的潜力。缺氧是AML微环境的一个标志,它促进蛋白质错误折叠,并与疾病进展和CAR-T治疗耐药密切相关。目前正在研究几种靶向缺氧相关信号通路的药物,它们是改善CAR-T细胞在AML中活性的有希望的候选者。
将免疫检查点抑制剂(ICIs)与CAR-T疗法相结合,在对抗免疫抑制微环境和增强CAR-T细胞功能方面也显示出潜力。临床前和早期临床研究表明,CD47阻断可增强巨噬细胞介导的AML细胞清除并促进抗原呈递,可能与其他免疫治疗策略产生协同作用。值得注意的是,Magrolimab(一种抗CD47抗体)已作为单药或联合方案在AML中进行评估;然而其有效性和安全性仍有待完全确定。
另一个关键的免疫调节通路涉及T细胞免疫球蛋白和粘蛋白结构域包含蛋白3(TIM-3),这是一种在AML原始细胞和各种免疫细胞亚群(包括T细胞和树突状细胞)上表达的抑制性受体。在AML中,TIM-3有助于白血病干细胞的维持和免疫逃逸,其高表达与不良预后相关。阻断TIM-3可能能够直接靶向白血病细胞并重振耗竭的T细胞,从而增强抗肿瘤免疫。Sabatolimab是一种针对TIM-3的单克隆抗体,目前正在与去甲基化药物联合用于AML和MDS患者的临床研究中,早期数据表明其具有可接受的安全性和潜在疗效。将ICIs与CAR-T细胞疗法相结合,代表着克服治疗耐药性和拓宽AML治疗选择的一种有前景的方法。
此外,将CAR-T疗法与抗体疗法相结合可能会扩大肿瘤靶标范围。Silva等人最近开发了工程化分泌抗CD33/抗CD3双特异性抗体的CD70 CAR-T细胞,从而解决了AML中的抗原异质性。与之类似,能够分泌抗CD33双特异性抗体的IL10R CAR-T细胞已显示出增强的靶向效力以及清除AML原始细胞和白血病干细胞的潜力。
HSCT仍然是巩固CAR-T诱导的缓解和减轻造血毒性的有效策略。为了保护HSCs免受CAR-T细胞的靶向肿瘤外效应,HSCs的表位编辑已成为一种有前景的方法。例如,HSCs上CD123的表位修饰已被证明可以赋予对CD123 CAR-T介导的细胞毒性的抵抗力,同时保留正常造血功能。类似的编辑策略已应用于CD45,促进了通用的、与免疫治疗兼容的造血系统的开发。然而这种表位编辑策略通常是靶点特异性的,可能无法在所有CAR结构中普遍适用。
优化CAR设计
CAR结构的工程学进展有可能增强肿瘤特异性并减少off-target毒性(图2B)。通过OR逻辑门控靶向多个AML抗原的串联或双顺反子CARs拓宽了抗原识别,从而降低了抗原逃逸的可能性。与之相反,AND门和NOT门控的CAR结构提高了白血病原始细胞与正常细胞之间的区分能力。AND门控CARs需要同时识别两个不同的抗原,每个抗原贡献一个独立的激活信号组成部分,以启动完全的T细胞毒性。在NOT门控系统中,仅表达肿瘤相关抗原的肿瘤细胞触发激活信号,而共表达第二个抗原的正常细胞优先传递抑制信号,从而防止脱肿瘤毒性。使用HLA-DR或CS1等配体的抑制性CARs(iCARs)已展示出概念验证活性;然而,用于AML的最佳抗原组合仍在研究中。
模块化适配器CAR系统采用可溶性适配器将CAR-T细胞与肿瘤靶标桥接起来,实现精确的剂量控制和快速清除,从而防止强直信号传导和T细胞耗竭。使用适配器交换或组合还允许动态调整以应对抗原异质性并最大限度地减少免疫逃逸。
增强CAR-T细胞功能
通过自分泌细胞因子支持或消除内在抑制通路来“武装”CAR-T细胞已得以广泛探索(图2C)。在临床前模型中,细胞因子如IL-2、IL-15、IL-21和IL-33已被共表达以增强CAR-T细胞的持久性和抗肿瘤功效。最近,IL-18武装的CD19 CAR-T细胞在对先前的CD19 CAR-T治疗复发或难治的淋巴瘤患者中实现81%的总缓解率,显示出与常规CAR-T细胞相当的安全性。出乎意料的是,传统上被认为是免疫抑制的IL-10,当以自分泌方式表达时,也被证明可以增强CAR-T细胞功能。
靶向基因编辑已经识别出几个可以改善CAR-T细胞性能的调节因子(图2C)。这些基因通常影响T细胞分化、代谢,或作为TCR信号传导的调节因子,相关例子包括ATF3、CH25H、Cbl-b、Regnase-1以及参与保持CD8+ T细胞干性的表观遗传因子。然而,需要在AML中进行特定背景的验证,并且删除肿瘤抑制基因(例如TET2)可能带来继发性恶性肿瘤的风险。此外,Zuo等人报道,在临床前模型和I期试验中,C-JUN过表达恢复了CD33 CAR-T细胞在AML中的功能,但还需要在更大的队列和更长的随访期中进行验证。
开发新靶点
新免疫治疗靶点的识别持续为AML治疗提供有希望的机会(图2D)。多组学测序的进展,加上大数据集的积累和共享,促进了系统性靶点发现。人工智能(AI)在这方面也已成为一个强大工具。Perna等人使用个性化算法整合蛋白质组学和转录组学数据集,以识别潜在的AML靶点,并提出了组合靶向策略以解决肿瘤异质性,同时最大限度地减少脱肿瘤效应。四个候选靶点(ADGRE2、CCR1、CD70和LILRB2)在后续研究中得到验证和进一步开发。Gottschlich等人利用单细胞转录组图谱将CSF1R和CD86识别为新的AML靶点;相应的CAR-T结构在临床前研究中显示出优于CD33 CAR-T细胞的特异性。
AML中的体细胞突变经常产生新抗原,这些新抗原是具有重要治疗潜力的肿瘤特异性标志物。尽管大多数新抗原是细胞内的,但它们可以通过基于T细胞受体(TCR)的疗法有效靶向。针对肾母细胞瘤1(WT1)的TCR-T疗法在R/R AML中的临床试验已显示出令人鼓舞的安全性和有效性,特别是在预防HSCT后复发方面。值得注意的是,一些细胞内蛋白,如NPM1,以前被认为无法通过免疫治疗靶向,现已在AML原始细胞和白血病干细胞的表面检测到,但在造血干细胞上未检测到。这种选择性的膜定位表明此类抗原可能代表AML安全有效的免疫治疗靶点。正在研究的其他靶点(如CD37、Siglec-6和整合素β2)在临床前研究中显示出前景,但有待临床验证。
下一代细胞疗法
细胞疗法的发展为减轻AML中与CAR-T细胞治疗相关的造血毒性提供了有希望的解决方案(图2E),其中CAR-NK细胞已成为一个具有良好安全性特征的潜在通用细胞治疗平台。临床试验已证明靶向CD19的异基因CAR-NK细胞在B细胞恶性肿瘤中的安全性和有效性。值得注意的是,与其他血液恶性肿瘤相比,AML细胞本质上对NK细胞介导的细胞毒性敏感。在一项I期试验中,Ciurea等人报告,在单倍体相合NK细胞输注后,伴或不伴血细胞计数恢复的复发或难治性AML患者的CR率为58.3%。
目前大多数靶向AML的CAR-NK疗法集中于有限数量的抗原,如CD123、CD33和NKG2D的配体。在最近的一项临床研究中,接受CD33 CAR-NK治疗的10名患者中有9名达到CR或CRi,其中6名患者达到MRD阴性状态。值得注意的是,骨髓抑制通过支持治疗自发缓解,表明毒性可控。临床前模型也表明,与CAR-T细胞相比,靶向CD123的CAR-NK细胞具有更优的安全性特征,具有可控的造血干细胞毒性和最小的内皮损伤。NK细胞固有的生物学特性,包括低GVHD风险和良好的安全性特征,使CAR-NK疗法成为AML治疗的一个有前景的替代方案。尽管如此,这种方法仍面临关键挑战,包括体内持久性有限、转导效率低以及大规模制造和标准化的困难,解决这些障碍对于充分发挥CAR-NK细胞的治疗潜力至关重要。
除了CAR-NK细胞,其他新兴的细胞平台,如CAR-巨噬细胞(CAR-M)和CAR-γδ T细胞,也在血液恶性肿瘤中正获得越来越多的关注。CAR-M具有固有的吞噬能力和抗原呈递功能,并且能够重塑肿瘤微环境。临床前研究表明,CAR-M可以有效清除肿瘤细胞并重编程免疫抑制性微环境。同样,CARγδT细胞提供主要组织相容性复合体 (MHC) 非依赖性肿瘤识别以及 CAR 介导的特异性。由于同种异体反应性极小,这些细胞表现出强效细胞毒性和良好的安全性特征。尽管目前 AML 的临床数据有限,但这些新型细胞疗法为扩大针对这种疾病的免疫治疗武库带来了相当大的希望。
结论
免疫治疗在AML中显示出巨大的潜力,但临床疗效仍然受到早期复发和治疗相关毒性的限制,这些挑战主要源于AML的显著异质性、免疫抑制微环境以及许多免疫治疗靶点与正常造血细胞之间的抗原重叠。为了克服这些障碍,正在探索各种策略,包括联合疗法、CAR设计的优化、CAR-T细胞的功能增强、新靶点的识别以及下一代细胞疗法的开发。这些创新方法旨在提高疗效、减少毒性并扩大符合条件的患者群体。随着研究的进展,这些努力有望为AML患者带来更安全、更有效的免疫治疗选择。
参考文献
Lin H, Wang T, Wei J. Strategic innovations: Tackling challenges of immunotherapy in acute myeloid leukemia. Chin J Cancer Res 2025;37(4):490-504. doi: 10.21147/j.issn.1000-9604.2025.04.02


