综述:DLBCL的抗CD19治疗顺序——从机制到临床决策
时间:2025-09-26 12:09:22 热度:37.1℃ 作者:网络
单克隆抗体(如坦昔妥单抗)、抗体药物偶联物(如loncastuximab tesirine)以及CAR-T疗法(如axi-cel、tisa-cel、liso-cel和瑞基奥仑赛等)等CD19 靶向治疗显著改善了复发性/难治性弥漫性大 B 细胞淋巴瘤 (R/R DLBCL) 的结局,双特异性抗体和三特异性抗体(通常称为BiTEs)在临床实践中的重要性也日益增加。
然而,CD19靶向治疗在治疗过程中的最佳定位尚不明确。关键试验常排除之前接受过其他CD19靶向治疗的患者,且缺乏标准化的方法来评估CD19的表达水平和持续性。此外,越来越多的证据表明,抗原丢失、选择性剪接、表位掩蔽和免疫逃逸等耐药机制可能对不同药物类别产生不同的疗效影响。
理解CD19表达和调节背后的分子机制对于优化CD19靶向治疗的临床应用至关重要,尤其是抗原密度、表位可及性和耐药机制的见解为治疗决策提供了关键基础。《International Journal of Molecular Sciences》近日发表综述,将机制知识与临床证据相结合,探讨了生物学变异性如何指导坦昔妥单抗、loncastuximab、CAR-T细胞疗法以及包括CAR-NK细胞和BiTEs在内的新兴平台的治疗顺序,旨在全面分析CD19生物学及其在DLBCL中的治疗价值,特别关注耐药机制、既往CD19靶向治疗的影响以及序贯治疗的临床可行性。此外还讨论了超越T细胞平台的治疗策略演变,包括CAR-NK细胞和三特异性抗体,并提出了未来研究和临床整合的方向。

CD19 作为治疗靶点
CD19 是免疫球蛋白超家族的一种跨膜糖蛋白,在B细胞发育的几乎整个过程中都有表达,从早期前B细胞阶段一直到成熟的记忆B细胞。其表达仅在终末分化为浆细胞时才会丧失。功能上,CD19 作为共受体,可增强B细胞受体(BCR)信号传导,降低抗原刺激的阈值,并参与调节B细胞的激活和存活。然而,与其他潜在靶点不同,CD19 并非DLBCL中的致癌驱动因子,其作用主要是一种谱系特异性标志物,而非功能性依赖(图1)。
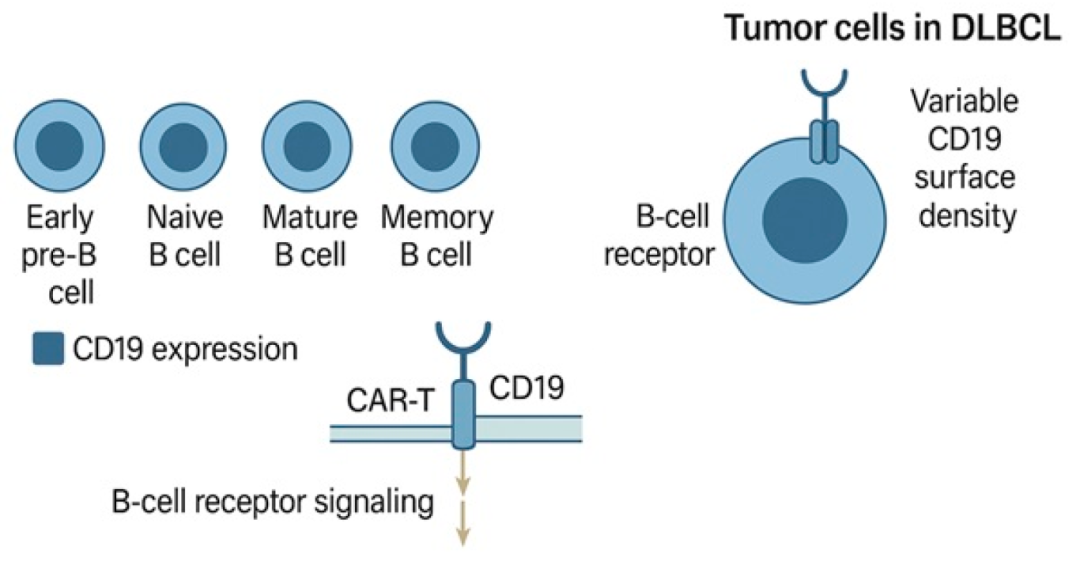
图1.CD19生物学及其在 DLBCL 中的治疗意义。CD19作为 B 细胞信号转导的辅助受体,在大多数 B 细胞恶性肿瘤中得以保留,使其成为理想的免疫治疗靶点
这种独特的生物学特性使CD19成为极具吸引力的免疫治疗靶点,并具有以下几个关键优势。首先,CD19 表达在绝大多数B细胞恶性肿瘤中得以保留,包括几乎所有的DLBCL诊断病例。其次,由于CD19在造血干细胞和非B细胞谱系中不表达,因此最大限度地降低了off-tumor毒性的风险。第三,尽管CD19的内化特性较为有限,但仍足以通过抗体药物偶联物(ADC)递送细胞毒性有效载荷。
然而,CD19的存在本身并不能保证治疗效果。越来越多的证据表明,肿瘤细胞表面表达的CD19抗原密度(即每个肿瘤细胞表面的CD19分子数量)可能会影响靶向CD19的药物活性,尤其是CAR-T细胞。临床前模型显示,靶抗原密度与CAR-T介导的细胞毒性之间存在相关性,其中CD19-CD28ζ构建体对低密度靶点的敏感性高于基于CD19–4-1BBζ的产品。
在临床实践中,通常使用免疫组织化学(IHC)或流式细胞术检测CD19的表达。IHC在福尔马林固定石蜡包埋的组织上具有广泛的适用性,但其动态范围有限,且可能存在观察者间的差异。流式细胞术可对低丰度抗原进行定量评估和检测,但仅限于外周血或骨髓穿刺液等液体样本。这两种技术均未经过前瞻性验证,无法基于CD19抗原密度阈值指导治疗决策。
此外,CD19的表达并非一成不变,可能会随着治疗过程的推进而发生变化。治疗后表达的变化可能源于多种机制,包括基因突变(例如外显子2–4中的突变)、导致截短异构体的替代mRNA剪接、转录下调,甚至是由于抗体结合导致的表位掩蔽。这些变化可能是永久性的,也可能是暂时性的,并且可能因所使用的特定CD19靶向药物、暴露的持续时间以及治疗间隔的不同而有所差异。
值得注意的是,新兴的临床数据表明,CD19在某些治疗(尤其是单克隆抗体如坦昔妥单抗)暴露后可能仍可检测到,但其密度降低或构象可及性发生改变。这一发现对于序贯CD19靶向治疗的可行性具有关键意义,因为这种治疗越来越需要精确、及时且功能相关的抗原状态评估。
不同的CD19靶向治疗对抗原表达产生不同的影响,这对后续治疗策略具有重要意义。坦昔妥单抗主要与表位掩蔽相关,而不会显著内化,从而保留CD19未来靶向的可能性。相比之下,loncastuximab tesirine通过其细胞毒性有效载荷诱导CD19的内化和降解。而CAR-T细胞疗法则依赖于强大的CD19表达来激活,更常与因基因突变、替代剪接或转录下调导致的抗原丢失相关。这些机制差异影响了序贯CD19靶向治疗的可行性和时机。表1提供了这些效应的比较概览,总结了主要CD19靶向平台的作用机制、临床疗效以及重新靶向的潜在影响。
CD19靶向治疗在R/R DLBCL中的应用
随着针对CD19的特异性药物的引入,复发/难治性DLBCL(R/R DLBCL)的治疗格局发生了范式转变(表2)。这些疗法虽然以共同的抗原靶点为纽带,但在作用机制、临床适应证、安全性特征以及后续治疗顺序的影响方面存在显著差异。目前,该领域主要由三大类疗法主导:单克隆抗体、ADC以及自体CAR-T细胞疗法。
坦昔妥单抗联合来那度胺
坦昔妥单抗是一种人源化、Fc增强型抗CD19单克隆抗体,设计用于增强抗体依赖性细胞毒性(ADCC)和吞噬作用。它与来那度胺的联合疗法基于II期L-MIND试验获得了加速批准,该试验纳入不适合移植且接受过≤2种既往治疗线的R/R DLBCL患者。联合治疗显示出57.5%的客观缓解率(ORR),其中完全缓解(CR)率为40%,更新的分析显示中位缓解持续时间超过43个月。
L-MIND试验的亚组分析确定了在接受坦昔妥单抗联合来那度胺治疗后预后改善的特定临床特征。非大包块病变、低国际预后指数(IPI)评分以及免疫功能(尤其是NK细胞活性)保留的患者显示出更高的缓解率和更长的缓解持续时间。此外,既往治疗线数≤2且一般状态良好(ECOG 0–1)的患者更可能从这种联合治疗中获益。这些发现支持在复发/难治性DLBCL的生物和临床有利亚群中使用坦昔妥单抗。
坦昔妥单抗与来那度胺之间的治疗协同作用源于后者(来那度胺)的免疫调节作用,包括增强NK细胞介导的细胞毒性。值得注意的是,坦昔妥单抗不会诱导CD19的快速内化,从而保留抗原可用性,为潜在的后续CD19靶向治疗创造条件。
然而,真实世界证据表明,缓解的持久性存在一定的异质性,特别是在具有高危细胞遗传学特征或大包块病变的患者中。此外,来那度胺的免疫学效应可能在经过多重预治疗或免疫功能低下的患者中被削弱,从而可能限制其在后续治疗中的疗效。
Loncastuximab Tesirine
Loncastuximab tesirine是一种ADC,由人源化抗CD19抗体通过可被蛋白酶切割的连接子与吡咯并苯二氮卓二聚体毒素(PBD)连接而成。其获批依据是II期LOTIS-2试验,该试验显示其在经过多重预治疗的患者队列(中位既往治疗次数为3次)中具有48.3%的ORR和24.1%的CR率。
在LOTIS-2试验中,loncastuximab tesirine在不同患者亚组中的疗效有所差异。既往治疗线数较少(≤3次)、无显著肝脏合并症以及肿瘤负荷较低的患者实现了更高的客观缓解率。此外,那些骨髓功能保留且血小板计数充足的患者对治疗的耐受性更好,并经历了更少的剂量限制性毒性。这些观察结果表明,loncastuximab可能特别适合具有中等风险疾病且既往接受细胞毒性药物治疗有限的患者。
与坦昔妥单抗不同,loncastuximab通过抗体-毒素复合物的内化以及随后的DNA交联发挥直接的细胞毒性作用。CD19内化在药效学上的需求可能影响其在CD19表达或表位可及性不同的肿瘤中的疗效。
Loncastuximab的毒性特征包括血小板减少症、水肿和肝酶升高,可能限制其在虚弱或合并症患者中的使用。重要的是,其在CAR-T治疗后的使用目前是允许的,尽管关于序贯治疗的真实世界数据仍然有限。
靶向CD19的CAR-T细胞疗法
靶向CD19的CAR-T细胞疗法包括axi-cel、tisa-cel、liso-cel和瑞基奥仑赛等,已经改变了适合患者的R/R DLBCL的治疗方式。这些自体细胞产品在共刺激域、生产平台和毒性特征上有所不同,但都依赖于强大的CD19表达来有效靶向。在ZUMA-7试验中,axi-cel(CD28共刺激)在二线治疗中显示出比标准治疗更优越的无进展生存期(PFS),但也带来了更高的细胞因子释放综合征(CRS)和神经毒性的风险。tisa-cel(4-1BB共刺激)具有更良好的毒性特征,但扩增动力学较慢,可能影响侵袭性疾病患者的疗效。liso-cel结合4-1BB共刺激和明确定义的CD4/CD8+细胞组成,在三线和二线治疗中均显示出良好的疗效和耐受性。虽然CD19在基线时几乎普遍表达,但在CAR-T治疗后复发的患者中观察到抗原调变或丢失。此外,生产时间、物流复杂性以及淋巴细胞清除化疗的需求限制了某些临床背景下的可及性和可行性。
总的来说,这些药物为靶向CD19提供了互补的方法,每种方法都有其独特的优点和局限性。它们在治疗线中的扩展使用需要仔细理解交叉耐药机制、给药时机以及对序贯CD19再靶向的潜在影响。
CD19表达的动态变化
尽管CD19在初治DLBCL中几乎普遍表达,但其表达并非一成不变。越来越多的证据表明,在疾病过程中,特别是受到免疫治疗剂的选择压力时,CD19的表面可用性可能会发生变化。因此,理解CD19表达的分子和表型动态变化对于指导治疗顺序和预测耐药机制至关重要(图2)。
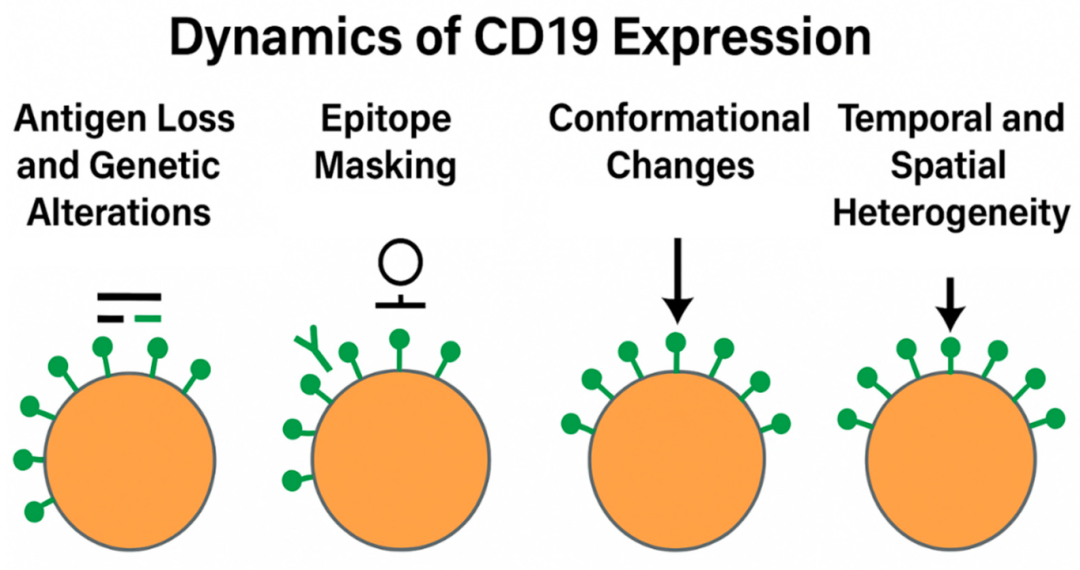
图2.CD19表达的动力学。CD19调节可通过基因突变、表位掩蔽和转录变化发生,影响序贯治疗的可行性
抗原丢失和遗传改变
抗原逃逸是CD19靶向治疗耐药的主要机制,该现象包括CD19表达的定量和定性变化,例如:
-
l 遗传突变:CD19基因中的插入、缺失和点突变,特别是影响编码CAR结构的scFv结合区的外显子2。
-
l 选择性剪接事件:生成缺乏细胞外表位的截短异构体,最初在儿童急性淋巴细胞白血病中报道,最近在高级别B细胞淋巴瘤中也有观察。
-
l 转录下调或表观遗传沉默:如启动子高甲基化,尽管后者在DLBCL中似乎不太常见。
重要的是,这些改变可能使恶性细胞对CD19靶向的免疫效应细胞(包括CAR-T细胞和单克隆抗体)“隐形”。
新兴的临床前研究探讨了逆转CD19下调和恢复治疗压力后抗原表达的策略。表观遗传调控(如使用DNA去甲基化剂)显示出重新激活沉默的CD19转录的潜力。细胞因子刺激(特别是白细胞介素-15(IL-15))可能增强CD19的表面表达和免疫识别。此外,包括CRISPR/Cas9方法在内的基因编辑技术正在探索中,以纠正CD19突变或恢复功能异构体。尽管这些干预措施仍处于实验阶段,但它们为克服耐药性和扩大复发/难治性B细胞恶性肿瘤中CD19再靶向的可行性提供了有希望的途径。
表位掩蔽和构象变化
在某些情况下,CD19在转录和蛋白水平得以保留,但由于以下原因在功能上变得不可接近:
-
l 表位掩蔽:先前治疗用的抗体占据了后续药物所需的关键结合位点(例如,坦昔妥单抗治疗后可能妨碍CAR-T结合);
-
l 抗体结合引起的立体位阻或受体内化;
-
l 糖基化模式改变:这可以调节抗原结构,削弱免疫识别。
这些机制可能导致CD19评估出现假阴性结果,从而低估序贯靶向治疗的可行性。
时间和空间异质性
CD19表达的动态变化还受到以下因素的影响:
-
l 时间变异:抗原调变是暂时的,在充分的清洗期后可能恢复;
-
l 空间异质性:亚克隆群体表现出不同的CD19密度或异构体组成。
这种异质性凸显了单一时点评估的局限性,支持使用流式细胞术、免疫组织化学(IHC)或转录组分析进行连续监测,以指导治疗决策。
对序贯治疗的影响
临床研究表明,CD19在CD19靶向治疗后的复发时经常得以保留,但其密度和可及性可能有所改变。例如,Duell等表明,坦昔妥单抗治疗后复发的患者通过IHC和mRNA分析仍可检测到CD19,从而支持在解决表位掩蔽的前提下后续进行CD19靶向治疗(包括CAR-T疗法)的合理性。
与之,CAR-T细胞疗法(尤其是axi-cel)后出现的CD19阴性复发与有害的CD19突变或完全抗原丢失有关,可能限制进一步CD19靶向治疗的效用。
CD19的动态特性既带来挑战,也带来机遇:尽管它使治疗计划复杂化,但也表明耐药性可能是情境依赖且可逆的,允许在适当条件下合理地重新靶向同一靶点。
CD19靶向治疗的序贯使用
随着不同的CD19靶向免疫治疗药物日益增多,人们开始关注是否可以对同一抗原进行序贯靶向,以及在何种生物学和临床情况下可能有效。尽管历史上对CD19抗原丢失或掩蔽的担忧使得人们在重用该靶点时持谨慎态度,但临床前模型和真实世界数据开始支持更细致的观点。
序贯CD19靶向治疗的可行性与先前治疗后CD19表达的持续性密切相关。现有数据表明,CD19在暴露于坦昔妥单抗等单克隆抗体后经常得以保留,尽管其密度降低或表位可及性发生改变。例如,Duell等表明,坦昔妥单抗治疗后复发的患者通过IHC和mRNA分析仍可检测到CD19,从而支持后续进行CD19靶向治疗(包括CAR-T细胞)的合理性。
相反,CAR-T治疗后更常观察到CD19丢失,尤其是axi-cel,其机制包括遗传突变、选择性剪接或转录沉默。Epperla等报告称,CAR-T后CD19阴性复发与对进一步CD19靶向药物的反应不佳有关。
尽管这些发现强调了在重新挑战CD19靶点前重新评估抗原状态的重要性,但需要指出的是,比较CD19+与CD19−患者结果的大规模前瞻性数据仍然有限。未来研究应优先按抗原状态进行分层,以更好地确定序贯CD19治疗的疗效。
临床前和真实世界证据
临床前研究表明,CD19抗原在暴露于某些抗CD19药物后可能持续存在,尤其是单克隆抗体。在小鼠模型中,坦昔妥单抗序贯CD19 CAR-T细胞治疗(在确定的洗脱期后)仍保留CAR-T的扩增和细胞毒性,并与比同时使用更弱的CRS相关。这些发现表明,先前抗CD19暴露的免疫影响可能通过时间、剂量和作用机制进行调节。
真实世界数据虽然仍然有限,但与这些观察结果一致。Duell等报告称,坦昔妥单抗治疗后复发的患者通过IHC和mRNA分析仍可检测到CD19表达,表明表位掩蔽而非完全抗原丢失。
CAR-T后CD19再靶向
CAR-T细胞失败后重新使用CD19靶向治疗更具争议性。在LOTIS-2试验中,先前接受CAR-T治疗的患者接受loncastuximab tesirine治疗后,ORR约为36%,表明在某些病例中仍保留敏感性。值得注意的是,这些结果可能反映出CD19表达的保留以及不依赖T细胞功能的其他细胞毒性机制。
同样,轶事报告和回顾性分析记录了CAR-T后对坦昔妥单抗为基础方案的反应,尽管在出现CD19阴性复发或严重免疫耗竭的患者中疗效降低。这些发现强化了在重新挑战CD19靶点前使用流式细胞术、IHC和分子分析等多模态技术重新评估抗原状态的必要性。
表位可及性和洗脱期的作用
序贯CD19靶向治疗中一个关键但常被低估的因素为表位可用性。坦昔妥单抗和大多数CAR构建体结合CD19的重叠细胞外结构域;如果在时间上接近给药,残留抗体结合可能在立体上妨碍CAR-T细胞识别。因此,基于体外和临床数据,建议至少进行2–3周的清洗期,以允许先前结合抗体的解离和功能CD19表位的恢复。
这一表位解蔽概念对临床实践具有直接影响。在坦昔妥单抗或loncastuximab治疗后短期内进展的患者中,如果不允许表位恢复,早期重新靶向CAR-T或双特异性抗体可能效果较差。相反,CD19靶向治疗之间的延长间隔可能增加成功重新靶向的可能性。
T细胞以外的其他方法
CD19 CAR-NK细胞
CAR修饰的自然杀伤(CAR-NK)细胞代表着一类新型细胞免疫疗法,在理论和实践上均较CAR-T细胞具有若干优势。不同于自体CAR-T产品,CAR-NK疗法可源自异体来源,包括脐带血、外周血或诱导多能干细胞(iPSCs),并能以外来现货型产品形式生产,从而克服了因患者个体化生产所致的延迟问题。
从免疫学角度来看,CAR-NK细胞具有以下特点:
-
l 较低的CRS(细胞因子释放综合征)和ICANS(免疫效应细胞相关神经毒性综合征)风险;
-
l 即使在CAR未被激活的情况下,也具有固有的细胞毒性,能够通过自然杀伤细胞受体识别CD19低表达或CD19阴性靶标;
-
l 发生移植物抗宿主病(GVHD)的风险极小,可用于既往接受过多线治疗或免疫功能低下的患者群体。
在一项具有里程碑意义的I期临床试验中,将脐带血来源的抗CD19 CAR-NK细胞用于治疗淋巴样恶性肿瘤患者,结果显示其安全性良好,且初步疗效令人鼓舞,未出现CRS或神经毒性。近期,早期试验开始探索iPSC来源的CAR-NK结构(如FT596)在侵袭性B细胞淋巴瘤中的应用,初步数据确认了其可行性及早期临床活性。
尽管前景广阔,但CAR-NK平台仍处于研究阶段,其耐久性、可扩展性及与CAR-T疗法相比的临床疗效有待在随机试验中得到验证。
靶向CD19的双特异性及三特异性抗体
靶向CD19的双特异性T细胞衔接抗体(BiTEs)和三特异性抗体是免疫疗法的又一前沿领域,它们提供了外来即用、非细胞介导的策略,可将免疫效应细胞重新定向至恶性B细胞(图3)。
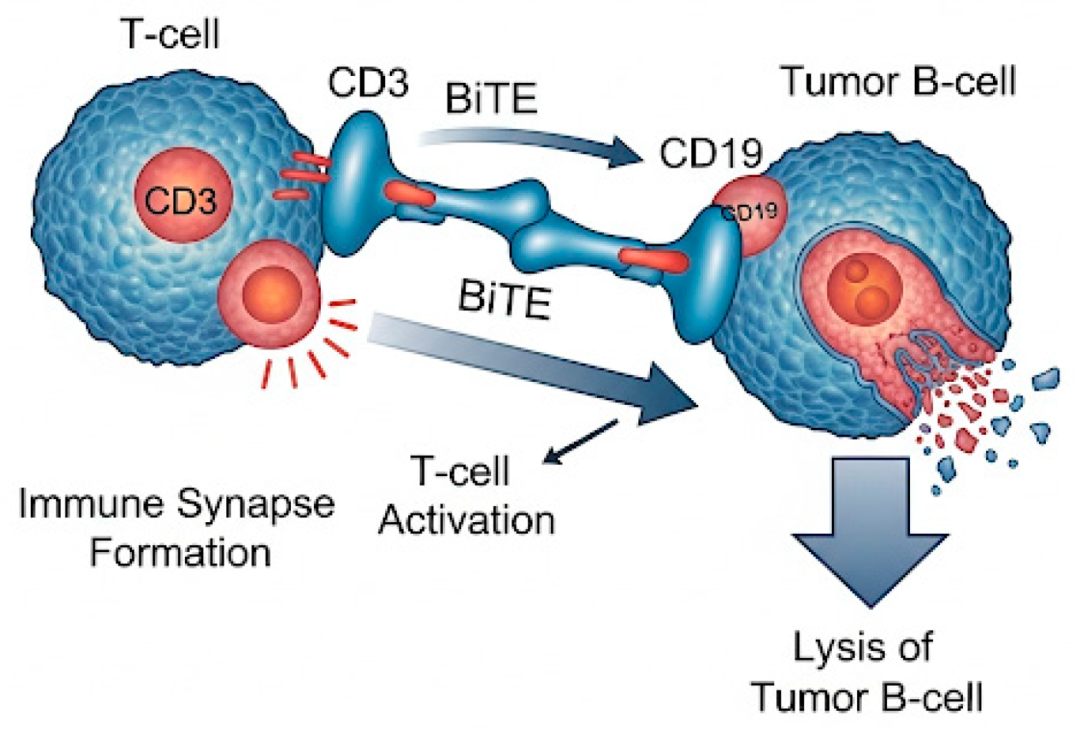
图3.CD19 BiTE(双特异性 T 细胞衔接器)的作用机制。该图说明了 CD19 BiTE 介导弥漫性大 B 细胞淋巴瘤 (DLBCL) 肿瘤细胞杀伤的免疫学机制。BiTE 分子同时与 T 细胞表面的 CD3 和恶性 B 细胞表面的 CD19 结合,促进免疫突触形成和 T 细胞活化,最终导致肿瘤细胞裂解。CD19 表达的动力学。CD19 调节可通过基因突变、表位掩蔽和转录变化发生,影响序贯治疗的可行性。
双特异性抗体能同时结合T细胞上的CD3和B细胞上的CD19,促进T细胞激活、免疫突触形成及靶细胞溶解。与CAR-T细胞不同,这些药物不依赖患者自身的淋巴细胞,适合快速给药,包括在门诊环境中使用。
近期的发展促成了三特异性抗体的构建,这些抗体能够结合多个肿瘤相关抗原(例如CD19和CD20)和/或共刺激受体(例如CD28或CD2),增强细胞毒性效力,并可能减少抗原逃逸。这些新一代分子旨在:
-
l 通过多抗原靶向降低免疫逃逸风险;
-
l 促进更强大和持续的T细胞激活;
-
l 在既往CAR-T治疗失败或存在抗原异质性的情况下维持治疗活性。
尽管临床数据尚处于早期阶段,但双特异性和三特异性抗体有望在T细胞疗法不可行、禁忌或失败的治疗模式中发挥重要作用。尤其是CAR-NK细胞和多特异性抗体等替代性CD19靶向策略,为扩大治疗可及性、降低毒性以及克服T细胞平台固有的耐药机制提供了有希望的途径。它们能否融入未来的治疗算法将取决于成熟的临床证据、后勤可行性和基于生物标志物的患者选择。
随着CD19靶向的双特异性和三特异性抗体在临床环境中的应用日益增加,将其整合到治疗算法中需要仔细考虑。这些药物提供外来即用的可及性、快速免疫激活和多抗原靶向能力,使它们在不适合细胞疗法或CAR-T治疗后复发的患者中尤为有价值。未来的研究应探索它们与其他CD19靶向方式的最佳序贯治疗方案,而预测性生物标志物可能有助于指导其在特定患者亚群中的应用。
结论与未来展望
CD19靶向免疫治疗药物的出现重新定义了R/R DLBCL的治疗格局,为选择有限的患者提供了长期缓解的新机会。然而,可用药物的不断增加以及耐药性、抗原动态变化和免疫功能障碍引入的复杂性凸显了在治疗选择和序贯治疗中采用更具个性化的生物学指导方法的需求。为此,未来的治疗算法必须整合能够纳入多层面临床和生物学数据的预测模型,包括:
-
l CD19抗原状态:包括表达水平、异构体完整性和表位可及性;
-
l 肿瘤微环境(TME)特征:如免疫抑制性浸润和细胞因子谱;
-
l 治疗史:尤其是既往CD19靶向药物的暴露及其免疫学后果;
-
l 宿主相关因素:包括免疫功能和细胞疗法的适用性。
这一策略的核心是对CD19进行动态评估,这需要整合超越基线IHC的现代诊断平台。例如,连续流式细胞术、RNA测序和数字空间分析等技术可以提供高分辨率、实时的抗原持续性和免疫微环境洞察,支持实时治疗决策。
最终,开发能够整合分子分析、免疫特征、影像学表现和现实治疗轨迹的AI驱动预测平台,有望优化治疗序贯方案。前瞻性、基于生物标志物的试验和现实世界注册研究应致力于验证这些工具,并指导其临床应用。随着我们对CD19动态变化的理解不断深入,R/R DLBCL治疗的未来不仅在于靶向正确的抗原,而是在正确的时间、正确的背景下使用正确的平台进行靶向治疗。
参考文献
Laddaga, F.E.; Della Mura, M.; Sorino, J.; Caruso, A.; Martinotti, S.; Ingravallo, G.; Gaudio, F. Sequencing Anti-CD19 Therapies in Diffuse Large B-Cell Lymphoma: From Mechanistic Insights to Clinical Strategies. Int. J. Mol. Sci. 2025, 26, 8662. https://doi.org/10.3390/ijms26178662


